葡萄糖是维持动物生命和保证生产所必需的营养物质之一。葡萄糖一方面可为细胞新陈代谢提供能源,另一方面其代谢中间产物还可作为蛋白质和脂肪合成的底物,只有保证葡萄糖充足供应,动物机体的各项机能才能正常运行。在葡萄糖的代谢方面,反刍动物与单胃动物的差异很大,对于泌乳动物而言,葡萄糖的代谢直接影响了乳汁的品质与产量。泌乳动物需要大量葡萄糖,研究发现高产奶牛乳腺每天需要2 kg葡萄糖,这些葡萄糖占奶牛总代谢葡萄糖的60%~85%[1]。在乳腺中,葡萄糖是合成乳糖的前体物质,而乳糖在调节乳腺渗透压中起重要作用,其合成量与合成效率是影响乳产量的主要因素[2]。有研究表明,奶牛主要依靠乳腺上皮细胞(BMECs)膜上的葡萄糖转运载体(GLUT)对葡萄糖进行吸收[3]。前人研究指出,葡萄糖转运载体1(GLUT1)可能在乳腺葡萄糖摄取中起主要作用[4]。葡萄糖转运载体8(GLUT8)和葡萄糖转运载体12(GLUT12)是新发现的转运载体,表达量仅次于GLUT1[5]。在泌乳奶牛乳腺中糖代谢还与乳蛋白合成密切相关。增加奶牛过瘤胃葡萄糖供应量可提高乳蛋白产量[1]。Appuhamy等[6]研究表明,外源添加葡萄糖可提高BMECs乳蛋白合成率。Zhang等[7]研究了葡萄糖应激对BMECs酪蛋白合成的影响,结果表明培养基中葡萄糖浓度从17.5 mmol/L下降到2.5 mmol/L时,β-酪蛋白和κ-酪蛋白mRNA和蛋白表达量显著下调。哺乳动物雷帕霉素靶蛋白(mTOR)是一种存在于哺乳动物胞浆中的蛋白,可以感受各种营养因素、生长因子、胰岛素、氨基酸、环境因素等信号[8]。mTOR与其他蛋白结合能形成2种不同的蛋白复合物(mTORC1和mTORC2),这2种蛋白复合物分别调节不同的细胞信号传导过程[9]。mTORC1可以作为营养、能量和氧化还原反应的感应器,其主要作用是调节蛋白质合成。目前,关于葡萄糖对奶牛泌乳生理学的研究多集中于葡萄糖的平衡供应以及淀粉过瘤胃保护等方面,但在探究葡萄糖对BMECs乳成分合成作用的分子机制尚不明确,并且相关研究大多在二维培养的条件下开展。与二维模式相比,三维模式能够模拟细胞在体内生长的状态。有研究将BMECs采用三维培养模式培养在流动的凝胶中,发现三维培养的细胞能形成类腺泡状结构[10]。而乳汁中的酪蛋白、β-乳球蛋白、α-乳清蛋白等均由乳腺腺泡内的分泌细胞合成。本课题组推测葡萄糖能促进BMECs的增殖并通过mTOR通路影响酪蛋白合成相关基因的表达,因此,本试验拟通过添加不同浓度葡萄糖,研究其对BMECs增殖、葡萄糖摄取和酪蛋白合成相关基因表达的影响,旨在为三维培养条件下深入研究葡萄糖对BMECs乳蛋白合成的生物学机制筛选适宜的剂量,为调控乳成分的合成提供科学依据。
1 材料与方法 1.1 试验材料DMEM/F12(12491-015)、DMEM无糖培养基(11966-025)和葡萄糖(A2494001)均购自Gibco公司;氢化可的松(H0135)、表皮生长因子(E4127)、催乳素(L6529)、胶原酶Ⅱ(17101-015)、青—链霉素(15140-122)和胰蛋白酶/乙二胺四乙酸(EDTA,25200054)均购自Sigma公司;四甲基偶氮唑盐(MTT,298-93-1)和二甲基亚砜(DMSO,0231)购自AMRESCO公司;胰岛素转铁蛋白溶液(ITS,41400045)、胎牛血清(FBS,SH30084.03)和磷酸盐缓冲液(PBS,SH30256.01)购自Hyclone公司;总RNA提取试剂盒RNA isoplus、反转录PCR试剂盒Prime scriptTM RT reagent kit和实时荧光定量PCR(RT-qPCR)试剂盒均购自TaKaRa公司;葡萄糖试剂检测盒(葡萄糖氧化酶法)(F0061-1)购自南京建成生物工程研究所;75 cm2(瓶底面积)细胞培养瓶(430720)购自Corning公司。
1.2 试验设计采用单因子完全随机试验设计。采集健康、处于泌乳期的荷斯坦奶牛乳腺组织进行BMECs培养,经分离纯化后,收集第2代的BMECs,以8×105个/孔的密度接种在75 cm2的细胞培养瓶中,置于37 ℃、5% CO2浓度的恒温培养箱中培养,每天观察细胞的生长形态,待细胞生长至80%汇合时,先用无血清、无激素的DMEM无糖培养基饥饿处理细胞24 h,然后更换添加了不同浓度葡萄糖[0(对照)、5、10、20 mmol/L]的诱导培养基继续培养12 h(葡萄糖的添加浓度参照陈璐[11]及孙晓旭[12]的研究结果设置),每组3个重复(每个组3瓶细胞,1瓶细胞为1个重复)。培养结束后收集细胞,通过噻唑蓝(MTT)比色法检测细胞活力[13];使用试剂盒检测BMECs培养液中葡萄糖的含量[14];采用RT-qPCR法检测葡萄糖转运载体及酪蛋白合成相关基因的表达[13]。
1.3 试验方法 1.3.1 BMECs的分离与纯化选取健康的、处于泌乳高峰期的荷斯坦奶牛进行试验,剪取含有丰富腺泡的乳腺组织约50 g。利用Ⅱ型胶原酶消化法得到原代BMECs。将原代BMECs置于37 ℃、5% CO2浓度的恒温培养箱中培养,细胞生长至80%汇合时,利用成纤维上皮细胞和BMECs对胰蛋白酶的敏感度不同来纯化BMECs并传代。
1.3.2 BMECs活力测定收集第2代细胞,以1×104个/孔的密度将细胞悬浮液接种于96孔细胞培养板,每孔200 μL,放入37 ℃、5% CO2浓度的恒温培养箱中培养。待细胞生长至80%汇合时进行饥饿处理12 h,然后换成含不同浓度葡萄糖[0(对照)、5、10、20 mmol/L]的诱导培养基继续培养24 h,每组6个重复(每组6个孔,1个孔为1个重复)。在培养结束前4 h向各培养孔加入MTT(5 mg/mL)20 μL;4 h后弃去上清液,加入DMSO 100 μL/孔,振荡10 min。最后用全自动酶标仪检测各孔在490 nm波长下的吸光度(OD)值。细胞相对增殖率(RGR)计算公式如下:
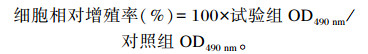
|
细胞培养结束后,收集培养瓶中的细胞培养液,用葡萄糖测定试剂盒检测培养液中的葡萄糖含量,用分光光度计检测340 nm波长下的OD值,并计算BMECs中葡萄糖相对摄取率,其计算公式如下:
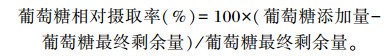
|
将第2代BMECs悬浮液接种于75 cm2培养瓶中,每瓶10 mL含有8×105个细胞,然后置于7 ℃、5% CO2浓度的恒温培养箱中培养,当细胞生长至80%汇合时,饥饿处理12 h,更换添加不同浓度葡萄糖[0(对照)、5、10、20 mmol/L]的诱导培养基继续培养24 h,每组设3个重复。培养结束后收集细胞,根据试剂盒说明书提取细胞总RNA,用分光光度计测定提取的总RNA浓度及OD260 nm/OD280 nm,最后按照反转录试剂盒说明进行PCR反转录。本试验以β-肌动蛋白(ACTB)、真核翻译启始因子3亚基K(eIF3K)和泛素表达转录因子(UXT)为内参基因,检测GLUT1、GLUT8、GLUT12和酪蛋白合成相关基因αs1-酪蛋白(CSN1S1)和κ-酪蛋白(CSN3)及酪蛋白合成相关转录调控因子mTOR、真核翻译启始因子4E结合蛋白(4EBP1)、真核翻译启始因子4E(eIF4E)、核糖体p70s6激酶(S6K1)的基因表达。采用2-△△Ct法对RT-PCR试验结果进行相对定量分析。引物序列及参数见表 1。
|
|
表 1 引物序列及参数 Table 1 Primer sequences and parameters |
试验数据用Excel 2010进行计算和整理,利用SAS 9.0软件的ANOVA程序进行单因素方差分析,采用Duncan氏法进行多重比较,以P < 0.05作为差异显著性判断标准。
2 结果 2.1 添加不同浓度葡萄糖对BMECs增殖的影响由表 2可知,与对照组相比,添加葡萄糖促进了BMECs的增殖,其中,20 mmol/L组BMECs的相对增殖率显著高于对照组和5 mmol/L组(P < 0.05),但与10 mmol/L组差异不显著(P>0.05)。
|
|
表 2 添加不同浓度葡萄糖对BMECs相对增殖率的影响 Table 2 Effects of adding different concentrations of glucose on relative growth rate in BMECs |
由表 3可知,各试验组BMECs葡萄糖相对摄取率均显著高于对照组(P < 0.05);5 mmol/L组相对摄取率高于20 mmol/L组但差异不显著(P>0.05);10 mmol/L组相对摄取率显著高于20 mmol/L组(P < 0.05)。
|
|
表 3 添加不同浓度葡萄糖对BMECs葡萄糖相对摄取率的影响 Table 3 Effects of adding different concentrations of glucose on relative uptake rate in BMECs |
由表 4可知,添加葡萄糖可不同程度地上调BMECs的GLUT1、GLUT8和GLUT12的基因表达量。5、10和20 mmol/L组GLUT1和GLUT12的基因表达量显著高于对照组(P < 0.05);20 mmol/L组GLUT1和GLUT12的基因表达量显著高于5 mmol/L组和对照组(P < 0.05),但与10 mmol/L组差异不显著(P>0.05)。10和20 mmol/L组GLUT8的基因表达量显著高于对照组和5 mmol/L组(P < 0.05);20 mmol/L组GLUT8的基因表达量显著高于对照组和5、10 mmol/L组(P < 0.05)。
|
|
表 4 添加不同浓度葡萄糖对BMECs葡萄糖转运载体相关基因表达量的影响 Table 4 Effects of adding different concentrations of glucose on expression of glucose transporter synthesis-related genes in BMECs |
由表 5可知,葡萄糖添加组CSN3、mTOR、eIF4E和S6K1的基因表达量显著高于对照组(P < 0.05),但是5和20 mmol/L组4EBP1的基因表达量显著低于对照组(P < 0.05)。10 mmol/L组CSN1S1的基因表达量显著高于对照组、5和20 mmol/L组(P < 0.05),5和20 mmol/L组CSN1S1的基因表达量有高于对照组的趋势,但统计分析差异不显著(P>0.05)。
|
|
表 5 添加不同浓度葡萄糖对BMECs酪蛋白合成相关基因表达量的影响 Table 5 Effects of adding different concentrations of glucose on expression of casein synthesis-related genes in BMECs |
奶牛的产奶性能与BMECs的增殖和活力有着密不可分的关系,养分的供应很大程度影响了BMECs的增殖。葡萄糖是维持动物生命和保证生产所必需的营养物质之一。对于泌乳动物来说,葡萄糖是合成乳汁的主要前体物质,其作用更加重要。前人研究表明,在无糖培养条件下,细胞活力逐渐下降,48 h后,大部分细胞死亡,部分细胞凋亡[15]。有研究表明,增加葡萄糖的供应量可以提高BMECs的活力,可能是因为葡萄糖代谢的中间产物如葡萄糖-6-磷酸、还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)等可以增加细胞的存活率[12]。王芳[16]研究了葡萄糖浓度对BMECs活力的影响,结果表明高浓度组(17.5 mmol/L)对BMECs活力的影响显著高于低糖组(2.5 mmol/L)。本试验结果表明,葡萄糖能显著促进细胞增殖,并且随着葡萄糖浓度的增大,增殖作用加强。葡萄糖被哺乳期BMECs摄取用于乳糖的合成并通过糖酵解途径提供能量。葡萄糖是合成乳糖的主要前体物,它通过维持牛奶的渗透压来控制牛奶的产量。Lin等[17]的研究结果表明,乳腺中葡萄糖的摄取在产奶量中起着关键的作用。孙晓旭[12]在研究中发现,增加葡萄糖的供应量,可显著提高BMECs葡萄糖摄取量。本研究表明,随着葡萄糖浓度增加,BMECs的葡萄糖相对摄取率逐渐增加,且当葡萄糖添加浓度为10~20 mmol/L时,细胞相对增殖率显著高于对照组。葡萄糖摄取进入BMECs是一个多步骤的复杂过程,主要包括2步:第1步是葡萄糖的快速摄取,主要是将葡萄糖跨膜转运,摄入细胞内;第2步是摄取进入胞内的糖在细胞内2个不同的糖腔里慢速交换吸收。泌乳奶牛乳腺对葡萄糖的摄取主要依靠BMECs的葡萄糖转运载体,有研究表明,奶牛主要依靠BMECs膜上的葡萄糖转运载体对葡萄糖进行吸收[3]。Zhao[18]发现葡萄糖诱导BMECs中GLUT1 mRNA和蛋白质表达量显著增加,但不影响GLUT4、GLUT8和GLUT12 mRNA表达量。本研究表明,随着葡萄糖浓度的增加,GLUT1、GLUT8和GLUT12基因表达量均增加。这可能是由于葡萄糖在细胞培养体系中作为营养和能量底物不断被消耗,培养时间的不同及葡萄糖供应量不同从而引起了乳腺细胞的代偿反应[19],使得葡萄糖转运载体基因表达量不同。在鸡和小鼠胸腺细胞上的试验结果表明,增加葡萄糖的供应可提高GLUT1基因表达量[20-21]。GLUT8和GLUT12是近年来新发现的转运载体,在泌乳奶牛乳腺中的表达量仅次于GLUT1[4]。Lin等[17]研究指出,12 mmol/L葡萄糖浓度是诱导BMECs生长和乳糖合成的最佳浓度,并且奶牛乳腺也不同程度地表达GLUT3、GLUT4、GLUT5、GLUT8、GLUT12。本试验结果表明,增加葡萄糖的供应可提高GLUT1、GLUT8和GLUT12基因表达量;且随着葡萄糖浓度的增加,BMECs对葡萄糖摄取量逐渐增大,同时葡萄糖转运载体GLUT1、GLUT8和GLUT12的基因表达量逐渐升高。由此推测,GLUT1是奶牛乳腺中受葡萄糖诱导的主要葡萄糖转运蛋白载体,用于乳糖合成的主要葡萄糖转运蛋白,GLUT8和GLUT12也参与BMECs葡萄糖的摄取,其表达水平受葡萄糖浓度的影响,高浓度的葡萄糖能促进葡萄糖转运载体GLUT1、GLUT8和GLUT12的基因表达量。
3.2 添加不同浓度葡萄糖对BMECs酪蛋白合成相关基因表达量的影响牛乳蛋白质的含量大约为3.0%。在整个泌乳期,乳腺分泌的蛋白质是全身蛋白质合成总量的43%,其中乳蛋白占90%,乳蛋白几乎含有生命体所需要的所有必需氨基酸,是衡量奶品质的重要指标之一。乳蛋白的80%是酪蛋白(αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白及κ-酪蛋白),其余是乳清蛋白。Zhang等[7]研究了葡萄糖应激对BMECs酪蛋白合成的影响,结果表明葡萄糖浓度从17.5 mmol/L下降到2.5 mmol/L时,β-酪蛋白和κ-酪蛋白mRNA和蛋白表达量显著下调。哺乳动物泌乳期需要大量的能量。对机体而言,蛋白质合成和周转是除了离子转运外最耗能的过程[22]。研究表明,从妊娠期到泌乳期,反刍动物的乳腺由于乳蛋白的合成对能量的需求增加了5倍以上,主要用于mRNA的翻译过程[23]。葡萄糖是机体能量的主要来源,可以为组织器官的新陈代谢提供能量。增加乳腺葡萄糖摄取量不仅可以为乳蛋白的合成提供大量的ATP,而且能够节约生糖氨基酸,使更多的氨基酸作为前体物用于乳蛋白合成。葡萄糖等能量物质主要通过腺苷酸活化蛋白激酶/哺乳动物雷帕霉素靶蛋白(AMPK/mTOR)信号通路调节乳蛋白的合成[24]。mTOR作为mTORC1和mTORC2的核心成分,在基因转录和蛋白合成中发挥着重要的作用。在细胞内调控细胞的生长、增殖与分化以及乳中蛋白质合成。mTORC1信号通路参与细胞生长、增殖[25]、自噬、凋亡过程,还对脂代谢、糖代谢有一定的调节作用。目前可以确定4EBP1和S6K1是mTORC1的直接下游效应器。活化的mTORC1能引起4EBP1磷酸化,释放eIF4E并与eIF4G结合形成复合体,该复合体随后与mRNA的5’端结合,并招募解旋酶eIF4A及其辅因子eIF4B[26]。S6K1是mTORC1的正向调节信号,当S6K1被激活后可与SKAR支架蛋白结合。外显子连接复合物(EJC)可以募集SKAR支架蛋白,一旦S6K1与EJC结合,这些mRNA区域的翻译就会增加,从而促进蛋白质合成[27]。王珊珊[28]以BMECs为模型,添加了不同浓度的葡萄糖后发现葡萄糖的浓度对mTOR、Raptor、4EBP1和S6K1的磷酸化水平有显著的影响。体外BMECs培养试验也发现,磷酸化的AMPK可以抑制mTOR的活性,降低4EBP1、S6K1的磷酸化,减少乳蛋白合成[29]。本试验结果显示,在BMECs中葡萄糖添加浓度为10~20 mmol/L时能促进CSN1S1、CSN3、4EBP1、S6K1和eIF4E的基因表达,并且10 mmol/L组mTOR的基因表达量显著上调。因此,本研究中BMECs可能通过葡萄糖转运载体摄取葡萄糖,葡萄糖摄取量增加激活AMPK/mTOR通路,使下游基因4EBP1和S6K1发生磷酸化,4EBP1的磷酸化释放了真核生物翻译启始因子eIF4E,而后与eIF4G结合形成含帽子结构的翻译启始复合物,启动mRNA的翻译过程,从而促进了BMECs中CSN1S1和CSN3的合成。
目前关于反刍动物调控反刍动物乳腺基因表达的研究较少,而本研究发现葡萄糖酪蛋白合成相关基因随葡萄糖添加浓度呈现先上升后降低的趋势,这可能是因为在体外培养细胞时葡萄糖是一个不断消耗的过程,葡萄糖是主要的能源物质,而酪蛋白合成需要消耗能量,因此在能量缺乏时引起酪蛋白合成相关基因表达的代偿效应[21];其次,有研究表明葡萄糖参与调控乳蛋白合成相关基因的表达[7],葡萄糖进入细胞后经代谢产生的代谢产物如葡萄糖6-磷酸等,可能作为细胞内的信号分子通过复杂的信号传导途径影响基因表达[30];最后,增加底物浓度对酪蛋白合成的生物过程进行动态的负反馈作用,从而降低酪蛋白合成相关基因的表达,而其具体机制有待深入研究。
4 结论添加10~20 mmol/L的葡萄糖能促进细胞生长增殖;添加不同浓度的葡萄糖均能显著上调GLUT1、GLUT8和GLUT12的基因表达量,并呈现出剂量依赖效应;添加10 mmol/L葡萄糖能显著上调CSN1S1、CSN3、mTOR、4EBP1、S6K1和eIF4E的基因表达量。综上所述,添加10~20 mmol/L的葡萄糖对BMECs乳糖及酪蛋白的合成具有较好的促进作用。
| [1] |
RIGOUT S, LEMOSQUET S, VAN EYS J E, et al. Duodenal glucose increases glucose fluxes and lactose synthesis in grass silage-fed dairy cows[J]. Journal of Dairy Science, 2002, 85(3): 595-606. DOI:10.3168/jds.S0022-0302(02)74113-1 |
| [2] |
CANT J P, TROUT D R, QIAO F, et al. Milk synthetic response of the bovine mammary gland to an increase in the local concentration of arterial glucose[J]. Journal of Dairy Science, 2002, 85(3): 494-503. DOI:10.3168/jds.S0022-0302(02)74100-3 |
| [3] |
赵珂, 刘红云, 刘建新. 泌乳奶牛乳腺葡萄糖吸收、代谢及其调控研究进展[J]. 中国奶牛, 2009(8): 26-30. DOI:10.3969/j.issn.1004-4264.2009.08.011 |
| [4] |
ZHAO F Q, DIXON W T, KENNELLY J J. Localization and gene expression of glucose transporters in bovine mammary gland[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 1996, 115(1): 127-134. DOI:10.1016/0305-0491(96)00043-0 |
| [5] |
ZHAO F Q, KEATING A F. Expression and regulation of glucose transporters in the bovine mammary gland[J]. Journal of Dairy Science, 2007, 90(Suppl.1): E76-E86. |
| [6] |
APPUHAMY J A D R N, NAYANANJALIE W A, ENGLAND E M, et al. Effects of AMP-activated protein kinase (AMPK) signaling and essential amino acids on mammalian target of rapamycin (mTOR) signaling and protein synthesis rates in mammary cells[J]. Journal of Dairy Science, 2014, 97(1): 419-429. DOI:10.3168/jds.2013-7189 |
| [7] |
ZHANG M C, ZHAO S G, WANG S S, et al. D-glucose and amino acid deficiency inhibits casein synthesis through JAK2/STAT5 and AMPK/mTOR signaling pathways in mammary epithelial cells of dairy cows[J]. Journal of Dairy Science, 2018, 101(2): 1737-1746. DOI:10.3168/jds.2017-12926 |
| [8] |
BALL G F. Mechanistic target of rapamycin (mTOR):a mediator of social development[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(35): 9240-9242. DOI:10.1073/pnas.1711812114 |
| [9] |
KENNEDY B K, LAMMING D W. The mechanistic target of rapamycin:the grand conductor of metabolism and aging[J]. Cell Metabolism, 2016, 23(6): 990-1003. DOI:10.1016/j.cmet.2016.05.009 |
| [10] |
王秀美.二、三维培养模式对奶牛乳腺上皮细胞泌乳代谢相关基因的影响[D].博士学位论文.呼和浩特: 内蒙古农业大学.2013.
|
| [11] |
陈璐.赖氨酸与乙酸互作效应对奶牛乳腺上皮细胞内乳蛋白、乳脂肪和乳糖合成相关基因表达的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学.2017.
|
| [12] |
孙晓旭.葡萄糖对奶牛乳腺上皮细胞乳糖合成的影响[D].硕士学位论文.哈尔滨: 东北农业大学, 2013.
|
| [13] |
邢媛媛.二、三维培养模式下添加激素对奶牛乳腺上皮细胞乳脂肪和乳蛋白合成的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2017.
|
| [14] |
赵珂.奶牛乳腺上皮细胞葡萄糖摄取的调控及其对乳成分合成的影响研究[D].博士学位论文.杭州: 浙江大学, 2011.
|
| [15] |
刘炎, 蒋茂荣, 林社裕, 等. 缺糖损伤对PC12细胞的效应及对葡萄糖调节蛋白75的表达影响[J]. 中国交通医学杂志, 2004, 18(6): 625-627. DOI:10.3969/j.issn.1006-2440.2004.06.001 |
| [16] |
王芳.赖氨酸蛋氨酸配比模式和葡萄糖水平影响酪蛋白合成关键基因表达[D].硕士学位论文.北京: 中国农业科学院, 2015.
|
| [17] |
LIN Y, SUN X X, HOU X M, et al. Effects of glucose on lactose synthesis in mammary epithelial cells from dairy cow[J]. BMC Veterinary Research, 2016, 12: 81. DOI:10.1186/s12917-016-0704-x |
| [18] |
ZHAO F Q. Biology of glucose transport in the mammary gland[J]. Journal of Mammary Gland Biology and Neoplasia, 2014, 19(1): 3-17. DOI:10.1007/s10911-013-9310-8 |
| [19] |
HAMMERMAN P S, FOX C J, THOMPSON C B. Beginnings of a signal-transduction pathway for bioenergetic control of cell survival[J]. Trends in Biochemical Sciences, 2004, 29(11): 596-592. |
| [20] |
AULWURM U R, BRAND K A. Increased formation of reactive oxygen species due to glucose depletion in primary cultures of rat thymocytes inhibits proliferation[J]. European Journal of Biochemistry, 2000, 267(18): 5693-5698. DOI:10.1046/j.1432-1327.2000.01576.x |
| [21] |
HUMPHREY B D, RUDRAPPA S G. Increased glucose availability activates chicken thymocyte metabolism and survival[J]. The Journal of Nutrition, 2008, 138(6): 1153-1157. DOI:10.1093/jn/138.6.1153 |
| [22] |
OSORIO J S, LOHAKARE J, BIONAZ M. Biosynthesis of milk fat, protein, and lactose:roles of transcriptional and posttranscriptional regulation[J]. Physiological Genomics, 2016, 48(4): 231-256. DOI:10.1152/physiolgenomics.00016.2015 |
| [23] |
BIONAZ M, HURLEY W L, LOOR J J.Milk protein synthesis in the lactating mammary gland: insights from transcriptomics analyses[M]//HURLEY W L.Milk protein.New York: In Tech, 2012: 285-324.
|
| [24] |
HARDIE D G. The AMP-activated protein kinase pathway-new players upstream and downstream[J]. Journal of Cell Science, 2004, 117(23): 5479-5487. DOI:10.1242/jcs.01540 |
| [25] |
LIN T V, HSIEH L, KIMURA T, et al. Normalizing translation through 4E-BP prevents Mtor-driven cortical mislamination and ameliorates aberrant neuron integration[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(40): 11330-11335. DOI:10.1073/pnas.1605740113 |
| [26] |
KIM J, OKAMOTO H, HUANG Z J, et al. Amino acid transporter Slc38a5 controls glucagon receptor inhibition-induced pancreatic α cell hyperplasia in mice[J]. Cell Metabolism, 2017, 25(6): 1348-1361. DOI:10.1016/j.cmet.2017.05.006 |
| [27] |
张猛.mTORC1和mTORC2在人肝细胞氨基酸代谢关键酶表达中的调控作用[D].硕士学位论文.呼和浩特: 内蒙古大学, 2019.
|
| [28] |
王珊珊.葡萄糖和氨基酸应激对奶牛乳腺上皮细胞β-酪蛋白及信号通路相关蛋白磷酸化表达的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2016.
|
| [29] |
BURGOS S A, KIM J J, DAI M, et al. Energy depletion of bovine mammary epithelial cells activates AMPK and suppresses protein synthesis through inhibition of mTORC1 signaling[J]. Hormone and Metabolic Research, 2013, 45(3): 183-189. |
| [30] |
FUKUDA H, IRITANI N. Transcriptional regulation of leptin gene promoter in rat[J]. FEBS Letters, 1999, 455(1/2): 165-169. |




