反刍动物与单胃动物最大的区别在于瘤胃,反刍动物的瘤胃是一个供厌氧微生物繁殖的连续接种的发酵罐,70%的以上的营养物质在瘤胃内消化。瘤胃运动是反刍动物维持正常生理活动的必要保障,与瘤胃内微生物发酵息息相关。瘤胃内微生物发酵效率对饲粮的消化以及营养物质的合成有很大的影响,从而影响反刍动物的生长性能以及生理健康[1]。因此,通过瘤胃运动调控反刍动物营养代谢是研究反刍动物营养的关键。反刍活动是反刍动物最具特征性一种消化模式,它是由一系列网-瘤胃收缩活动来完成[2]。瘤胃运动方式为4个囊腔的收缩和舒张,瘤胃周期性运动分为瘤胃原发性收缩和瘤胃继发性收缩。当网胃第2次收缩至高峰时,瘤胃开始收缩,瘤胃的收缩先由瘤胃前庭开始,再沿着背囊由前向后扩张,到达后背盲囊,在背囊收缩期间腹囊属于舒张状态,后背盲囊收缩结束转到腹盲囊由后向前依次收缩,最后收缩终止于瘤胃前部[3]。这种起源于网胃两相收缩的收缩运动为瘤胃原发性收缩。在原发性收缩后,瘤胃有时候还可能发生一次单独的附加收缩,称为瘤胃继发性收缩,瘤胃继发性收缩仅涉及瘤胃部分区域,一般情况下收缩的部位是背侧冠状肌柱、背囊和后背盲囊,有时继发性收缩仅局限在背囊,在瘤胃出现继发性收缩时往往发生嗳气活动。正是由于瘤胃的周期性运动才让瘤胃内食糜按照一定规律反复运动,使得进入瘤胃内的饲料得到充分的发酵,以此来供应动物个体生长发育所需要的营养物质。瘤胃的运动主要受神经和体液调节,也受饲粮适口性、饲喂量、反刍活动、药物以及其他因素影响[4-7]。在实际生产中,研究者可以通过监测瘤胃运动频率和强度帮助诊断急、慢性疾病以及消化期生理异常情况[8],也可以通过测定瘤胃运动的各项指标来评定饲粮在瘤胃中发酵的效率,为反刍动物的健康养殖提供理论基础。
1 反刍动物瘤胃运动的机制瘤胃运动主要受神经-体液调节,神经调节中枢在延髓,高级中枢在大脑皮质,传出神经为迷走神经和交感神经。动物采食饲料后,饲料通过刺激口腔黏膜感受器、瘤胃内机械和压力感受器,产生一系列神经信号,神经信号通过传入神经传至神经中枢,然后通过传出神经将指令传送到瘤胃,引起瘤胃的规律性运动[9-11]。乙酰胆碱是胆碱能系统中的主要神经递质,它通过激活位于瘤胃神经系统平滑肌细胞或神经细胞上的受体发挥作用,引起瘤胃平滑肌层的收缩。当传出神经迷走神经兴奋时,瘤胃运动加强,当交感神经兴奋时,瘤胃运动减弱。由于反刍动物复胃系统存在反馈调节,其他胃部运动与瘤胃运动是相互协调的。当饲料刺激网胃感受器,不仅可使瘤-网胃收缩增强,还会促发反刍动作。皱胃被内容物充盈时,会通过反馈调节抑制瘤胃和网胃的运动,反之则会增强瘤胃的运动。瘤胃运动的神经调节过程如图 1所示。
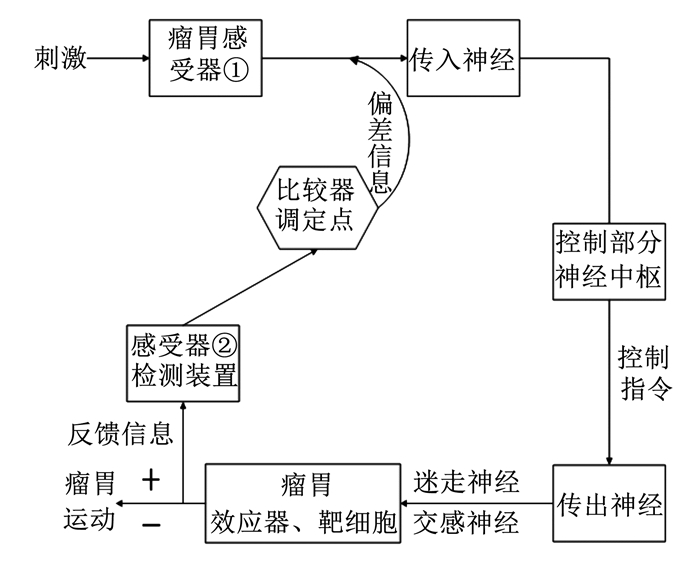
|
图 1 瘤胃运动的神经调节图 Fig. 1 Diagram of rumen movement-nervous regulation |
体液调节机体的各种生理机能及内环境的稳态已成为共识。机体通过激素及神经激素传递化学信息,使机体的组织细胞相互协调,以适应内外环境的变化,保证动物生命活动。下丘脑是内分泌活动的调节中枢,它通过对垂体分泌活动的调节,来控制其他内分泌腺的激素分泌。下丘脑-垂体轴通过反刍动物垂体释放激素及各种肽类物质,如胆囊收缩素、促性腺激素释放激素、促甲状腺激素释放激素、胰岛素等,经血液循环到达瘤胃,作用于瘤胃上的靶器官,以此来辅助调节瘤胃运动[12]。瘤胃运动的体液调节过程如图 2所示。
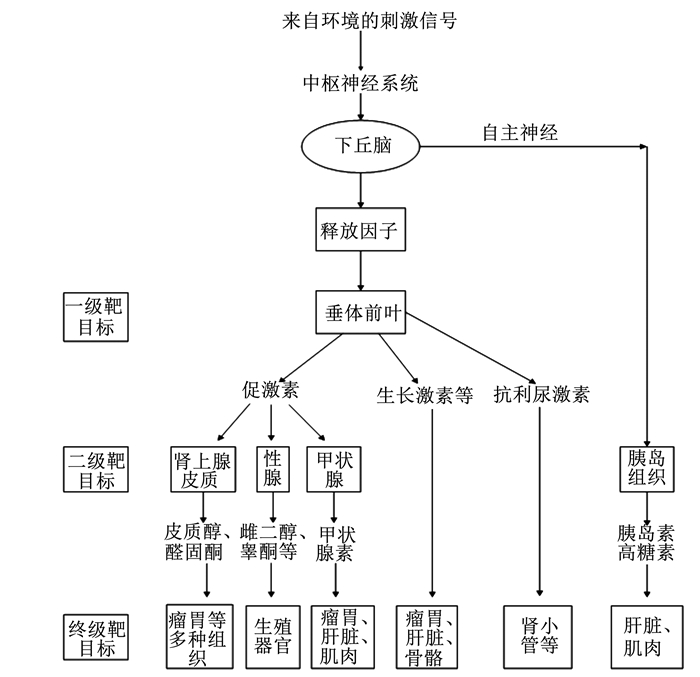
|
图 2 瘤胃运动的体液调节图 Fig. 2 Diagram of rumen movement-humoral regulation |
饲料的物理特性和化学成分是影响反刍动物瘤胃运动频率和强度的重要因素之一。研究表明,在利用荨麻干草替代苜蓿干草饲喂新疆细毛羊时,饲喂荨麻干草可使瘤胃蠕动的频率减慢[13],对反刍动物饲喂三叶草以及过高的大麦时也会抑制瘤胃运动[14-15],原因是饲料本身物理特性导致采食量降低,进而影响了瘤胃运动。也有研究表明面筋蛋白经瘤胃微生物降解产生的阿片肽类物质能加强瘤胃运动,显著促进活体瘤胃平滑肌收缩力加强、收缩持续时间延长以及收缩频率变慢[16],这是饲料本身含有的特殊化学成分被转化为促瘤胃动力分子的结果。饲料粉碎粒度在影响瘤胃运动上起着重要作用。饲料的粉碎粒度较大,颗粒较粗糙,会降低瘤胃乳头角质层厚度,有利于营养物质的吸收,同时提高瘤胃表层的血液流动,加强瘤胃运动的频率。如果饲料的粉碎粒度较小,瘤胃内的饲粮不能通过充分地摩擦来降低乳头角质层厚度,导致瘤胃乳头表面覆膜,不利于营养物质的吸收,同时降低瘤胃的运动频率和强度[17-18]。
2.1.2 饲粮精粗比饲粮的精粗比是保证饲粮营养平衡和科学饲养反刍动物的关键因素,大量研究表明,饲粮精粗比差异对反刍动物的采食量[19]、生产性能[20]和血浆激素指标[21]有很大的影响。此外,饲粮精粗比也是调控瘤胃内环境及瘤胃运动的重要因素[22]。饲粮中精饲料比例过高,瘤胃内微生物发酵加快,产生过量的挥发性脂肪酸,造成酸沉积,严重时导致瘤胃酸中毒,使瘤胃内环境紊乱,瘤胃运动停止;粗饲料比例过高,能量释放缓慢,造成瘤胃能量吸收降低,瘤胃内粗饲料容易凝集成团,严重时会转变为瘤胃积食、胀气等疾病,导致瘤胃生长和运动受阻,进而影响动物个体的生长性能和生理健康。
2.1.3 饲料添加剂在2020年全面禁止使用饲用抗生素的趋势下,新型饲料添加剂层出不穷。研究表明,在反刍动物饲粮中添加植物提取物[23-24]、中草药[25]、益生菌[26-27]、酶制剂[28]等对反刍动物的生长性能和瘤胃发酵都有一定的有益效果。由于各类型饲料添加剂所包含成分不同,其影响瘤胃运动的方式也有区别。研究表明生姜提取物以及薄荷精油可提高瘤胃平滑肌收缩频率,主要原因是生姜提取物和薄荷精油中存在胆碱、皂苷等促胃肠动力作用的成分[29-30]。大蒜氧化物可提高瘤胃收缩频率,减少收缩持续时间,增加瘤胃液稀释率和周转率,加强瘤胃排空能力[31],直接作用是刺激瘤胃平滑肌化学感受器加强兴奋活动,间接作用是通过神经反射性调节作用,增强下丘脑摄食中枢的兴奋活动,加强瘤胃运动以及瘤胃排空。
2.2 摄食对瘤胃运动的影响摄食行为与瘤胃运动有着密不可分的关系,摄食行为反映能量摄入与能量消耗的动态平衡。在下丘脑神经元网络和神经肽递质方面发现,瘤胃在运动过程中会向大脑发送关于身体能量平衡状况的信号循环肽,以便它可以相应地调整进食行为[32]。在能量缺乏时期,瘤胃向大脑发送缺乏信号,大脑神经元分泌神经肽Y和促肾上腺皮质激素相关肽,从而抑制促甲状腺激素和促肾上腺皮质激素的分泌,激活动物摄食行为,瘤胃运动加强;在能量过剩时期,下丘脑的弓状核分泌促黑素细胞刺激素、可卡因和调节苯丙胺的转录物,导致垂体分泌促甲状腺激素和促肾上腺皮质激素,减弱动物摄食行为,瘤胃运动减弱[33]。
2.3 激素对瘤胃运动的影响早在1951年,研究者就发现将山羊的脑皮层切除后注射肾上腺素,可引起瘤胃收缩[34],并认为瘤胃的不同部位有α和β受体分布[35];另有研究表明,在绵羊第三脑室注射内啡肽[36]以及静脉注射乙酸钠[37]均能显著抑制瘤胃运动。对绵羊十二指肠酸化与瘤胃运动关系的研究表明十二指肠灌注乳酸(pH=2.0)抑制瘤胃收缩幅度和频率,交叉循环和血液转移试验的观察表明双缩醛酸会释放出1种或多种激素,类似于胆囊收缩素,对胃肠运动有刺激作用,对瘤胃运动有抑制作用[38]。促胰液素对瘤胃运动影响的研究表明,促胰液素降低了瘤胃收缩频率和瘤胃描记波收缩幅度,延长了瘤胃收缩波间距,由此揭示缺乏胃窦的反刍动物瘤胃运动也能被促胰液素调节[39]。胰岛素、胰高血糖素和抗利尿激素等对瘤胃运动的调控作用仍然不清楚。
2.4 疾病和治疗对瘤胃运动的影响近年来反刍动物的集约化养殖逐步崛起,但是由于饲养经验不足和生长环境的突变,反刍动物的前胃疾病发病率较高。前胃原发性病变是由瘤胃壁收缩周期中断或菌群发酵过程中断引起的,继发性病变是由瘤胃收缩或发酵异常引起的,主要包括腺胃乏力、瘤胃嵌顿、瘤胃胀大和瘤胃酸中毒。在前胃疾病发生前后,瘤胃平滑肌细胞都能表现出一定的节律性运动和可测量的蠕动波,但是可测量蠕动波的强度存在差异且发生周期性变化,表明前胃疾病的发病伴有瘤胃机械运动障碍,动物瘤胃功能明显减弱[40-42]。当反刍动物患瘤胃亚急性酸中毒时,瘤胃内pH降低,丙酸和丁酸的含量增高,瘤胃运动受到抑制,其中丁酸对瘤胃运动的抑制作用最强,其次是乙酸、丙酸和乳酸[43-44]。
前胃疾病如瘤胃胀气、瘤胃迟缓、瘤胃酸中毒的临床症状大多数为瘤胃运动减慢,严重时瘤胃运动停止,最后导致死亡,治疗原则为消除瘤胃发酵气体、兴奋瘤胃蠕动和恢复瘤胃内环境稳态。研究表明甲氧氯普胺、莫沙必利等药物可增强牛的瘤胃动力,原因为乙酰胆碱与平滑肌上的毒蕈碱受体结合并诱导收缩,药物选择性地作用于5-羟色胺4(5-HT4)受体,增加瘤胃胆碱能神经末梢的乙酰胆碱释放量[45]。在兴奋瘤胃蠕动治疗过程中有以下几种方法可以促进瘤胃运动:1)腹泻疗法。可以一次性灌服液体石蜡油、菜籽油、硫酸镁和硫酸钠等刺激瘤胃收缩,加速瘤胃内容物排出。2)强心补液法。通过静脉注射安呐咖、氯化钠溶液和氯化钠葡萄糖等,皮下注射比赛可林,或者肌肉注射复合维生素B1来促进瘤胃运动。3)针刺疗法。针刺疗法在治疗反刍动物前胃疾病方面已经取得了明显的疗效。王林安等[46]研究表明,针刺交巢、百会穴组和左侧第5、6、7、8肋间穴组,瘤胃收缩波幅明显增高,而针刺脾俞穴后瘤胃收缩波幅则明显降低。
2.5 热应激对瘤胃运动的影响研究表明气候变化能对畜体产生影响,特别是环境高温导致的热应激,其可对反刍动物瘤胃结构造成负面影响,降低瘤胃蠕动和反刍[47]。热应激下,动物采食量减少[48-49],胃肠道中食糜的通过速度比在热中性环境时慢,饲料不能充分刺激瘤胃上皮,瘤胃上皮的血液流动受到抑制,从而降低瘤胃运动和反刍[50]。此外,热应激过程中动物脑垂体会通过减少生长激素的分泌来调节畜体的代谢,进而会影响瘤胃运动[51]。热应激下奶牛瘤胃内pH较低,这意味着在热应激期间较低的瘤胃内pH会抑制瘤胃运动[52]。在短期热应激期间,下丘脑-垂体-肾上腺皮质轴释放糖皮质激素,糖皮质激素通过能量动员的方式改善健康状况,并影响前胃运动等生理活动。
2.6 反刍动物生理阶段对瘤胃运动的影响反刍动物个体因自身遗传性状差异会导致瘤胃发育程度不同,间接影响着瘤胃运动的强度和频率。不同个体间的瘤胃会按照一定节律性、周期性运动,但在蠕动波峰和波形上会有一些小差异。在反刍动物不同的生长阶段瘤胃运动差异很大,在幼畜刚出生时,皱胃是反刍胃中最大的胃,随着日龄的增长和对植物性饲料采食量的逐渐增加,瘤胃才迅速发育,据研究发现,牛、羊幼畜在2~3周龄才出现短时间的反刍活动,表明了幼畜的瘤胃活动偏低,与成年个体瘤胃运动有较大差异[53]。反刍动物处于不同的生理阶段瘤胃运动也会有差异,当处于妊娠生理阶段时,通过神经调节或体液调节所生成的激素抑制瘤胃运动,短时间停止反刍活动[54-55]。
3 瘤胃运动的调控瘤胃运动在机体内主要受神经和体液共同调控,外部环境中最易受饲粮成分变化的影响,其次是疾病和环境因素。瘤胃运动与瘤胃发育及功能相辅相成,因此通过改变饲粮是最易实现的调控手段。
研究表明,玉米蛋白、小麦谷蛋白和大麦胶蛋白等降解的肽类产物中含有阿片样活性物质,被称为“外啡肽”[56-57]。反刍动物的中枢及瘤胃平滑肌上分布有大量阿片样受体细胞,阿片样活性物质能够与阿片受体结合,实现对瘤胃运动的调节[58]。有研究表明瘤胃运动也可以受粗饲料类型、粒度和摄入量的调节,饲喂禾本科饲料的绵羊瘤胃收缩频率高于饲喂谷壳和颗粒饲料的绵羊[59],饲喂新鲜苜蓿的绵羊瘤胃运动频率比饲喂苜蓿干草的绵羊更快[60-61]。在广泛的饲喂试验中得知,饲粮的类型、粒度以及饲喂方式都是调控瘤胃运动的重要因素。由于不同个体在调节瘤胃运动方面有所不同,不同个体间饲粮类型、粒度、饲喂时间和精粗比例需要更多的研究来确定。以下几方面是通过饲粮手段调控瘤胃运动的关键:1)配制饲粮时应注意饲料间的组合效应,平衡蛋白质能量比,碳水化合物中非纤维性碳水化合物与中性洗涤纤维的比例以及氮源必须要保持平衡状况。2)饲粮的阴阳离子差可对瘤胃运动进行调控,研究发现饲粮的阴阳离子差可通过影响机体的酸碱平衡影响反刍动物的自由采食量,进而对瘤胃进行营养调控[62]。3)饲粮中含硫化合物和矿物元素占比应合理。适当添加瘤胃调控剂如脲酶抑制剂、离子载体、活性酵母培养物等维持瘤胃内环境稳定,促使饲粮调控瘤胃运动达到更好的效果[63-64]。
在实际饲养中反刍动物出现采食量下降、瘤胃运动减慢情况时,首先检查动物饲料原料的安全,调整饲粮配方和饲喂方式[59],然后适当增加饲料的粉碎粒度以及在饲粮中添加促瘤胃动力药物来刺激瘤胃壁收缩,加强瘤胃运动[16, 51],最后增加动物的户外运动时间,加快瘤胃血液循环,促进瘤胃运动。
反刍动物在发生瘤胃胀气、瘤胃迟缓、瘤胃酸中毒等疾病时,多数伴有瘤胃机械运动障碍,严重时还会导致瘤胃运动停止。治疗的首要任务是紧急恢复瘤胃正常生理活动。通过灌服硫酸镁和硫酸钠加快瘤胃的收缩,肌肉注射比赛可林、维生素B1等促瘤胃动力药物来增强瘤胃运动。
为了更有效地对瘤胃运动进行调控,在生产中应根据季节调整反刍动物户外运动时间,提高动物免疫力,保持畜舍内卫生,注意防热、防寒,减少疾病和应激对瘤胃运动造成的影响。
4 小结瘤胃运动是一个复杂的过程,并且是按照一定规律运动的生理活动。由于瘤胃内附有多重感受器以及多种激素受体,机体外因素如饲料粉碎粒度、饲粮精粗比、疾病治疗和应激等最终都会转化为神经-体液调节方式对瘤胃运动产生影响。体外调控瘤胃运动最重要的方式是对饲粮进行调节,而目前对于饲粮营养物质消化率和瘤胃内微生物多样性因素对瘤胃运动规律和调控技术的研究还不够深入。因此,还需进一步开展试验来阐述瘤胃运动的影响因素和调控技术,通过研发瘤胃运动调控技术为反刍动物生理学提供理论参考,为畜牧业健康养殖提供科学方法。
| [1] |
SCHÄREN M, FRAHM J, KERSTEN S, et al. Interrelations between the rumen microbiota and production, behavioral, rumen fermentation, metabolic, and immunological attributes of dairy cows[J]. Journal of Dairy Science, 2018, 101(5): 4615-4637. |
| [2] |
HUFFMAN C F. Ruminant nutrition[J]. Annual Review of Biochemistry, 1953, 22: 399-422. |
| [3] |
刘敏雄. 反刍动物消化生理学[M]. 北京: 北京农业大学出版社, 1991: 18-24.
|
| [4] |
ROUSSEAU J P, FALEMPIN M. Neural control of the motility of the reticulo-rumen[J]. Reproduction, Nutrition, Development, 1985, 25(4B): 763-775. |
| [5] |
KANIA B F. Opioid inhibitory control of the ruminant stomach motility:functional importance of the hypothalamus[J]. Veterinary Medicine Series A, 1992, 39(1/2/3/4/5/6/7/8/9/10): 445-452. |
| [6] |
KARASU A, GENÇCELEP M. The effect of xylazine HCl used in repeated sedations for sheep on biochemical and clinical values[J]. Kafkas Universitesi Veteriner Fakultesi Dergisi, 2015, 21(6): 831-836. |
| [7] |
MCFARLANE Z D, BARBERO R P, NAVE R L G, et al. Effect of forage species and supplement type on rumen kinetics and serum metabolites in growing beef heifers grazing winter forage[J]. Journal of Animal Science, 2017, 95(12): 5301-5308. |
| [8] |
NAGY D W. Diagnostic approach to forestomach diseases[J]. Veterinary Clinics of North America:Food Animal Practice, 2017, 33(3): 441-450. |
| [9] |
RUCKEBUSCH Y, THIVEND P.Digestive physiology and metabolism in ruminants[M]. Dordrecht: Springer, 1980.
|
| [10] |
SEJRSEN K, HVELPLUND T, NIELSEN M O. Ruminant physiology:digestion, metabolism and impact of nutrition on gene expression, immunology and stress[M]. Wageningen: Academic Publishers, 2006: 345-346.
|
| [11] |
DEHORITY B A. Gastrointestinal tracts of herbivores, particularly the ruminant:anatomy, physiology and microbial digestion of plants[J]. Journal of Applied Animal Research, 2002, 21(2): 145-160. |
| [12] |
韩正康. 瘤胃代谢的神经内分泌调节[J]. 动物医学进展, 2006, 27(9): 9-13. |
| [13] |
许行浩, 侯宇, 赵树林, 等. 饲喂荨麻干草对羊胃肠动力的影响[J]. 新疆农业科学, 2019, 56(5): 964-971. |
| [14] |
PARSONS A R, NEUMANN A L, WHITEHAIR C K, et al. Isolated gut and rumen motility as affected by extracts from bloat producing forages[J]. Journal of Animal Science, 1955, 14(2): 403-411. |
| [15] |
MANN S O. Some effects on the rumen micro-organisms of overfeeding a high barley ration[J]. Journal of Applied Bacteriology, 1970, 33(2): 403-409. |
| [16] |
孙镇平, 袁海星, 金良, 等. 小麦面筋蛋白对山羊瘤胃运动的影响[J]. 畜牧兽医学报, 2006, 37(4): 348-351. |
| [17] |
TEIMOURI YANSARI A, VALIZADEH R, NASERIAN A, et al. Effects of alfalfa particle size and specific gravity on chewing activity, digestibility, and performance of holstein dairy cows[J]. Journal of Dairy Science, 2004, 87(11): 3912-3924. |
| [18] |
孔庆斌, 张晓明. 苜蓿干草切割长度对荷斯坦育成母牛采食与反刍行为和营养物质消化的影响[J]. 中国畜牧杂志, 2008, 44(19): 47-51. |
| [19] |
PAPI N, MOSTAFA-TEHRANI A, AMANLOU H, et al. Effects of dietary forage-to-concentrate ratios on performance and carcass characteristics of growing fat-tailed lambs[J]. Animal Feed Science and Technology, 2011, 163(2/3/4): 93-98. |
| [20] |
SHI H T, ZHANG J, LI S L, et al. Effects of a wide range of dietary forage-to-concentrate ratios on nutrient utilization and hepatic transcriptional profiles in limit-fed Holstein heifers[J]. BMC Genomics, 2018, 19: 148. |
| [21] |
THORP C L, WYLIE A R G, STEEN R W J, et al. Effects of incremental changes in forage:concentrate ratio on plasma hormone and metabolite concentrations and products of rumen fermentation in fattening beef steers[J]. Animal Science, 2000, 71(1): 93-109. |
| [22] |
HAN X F, LI B B, WANG X L, et al. Effect of dietary concentrate to forage ratios on ruminal bacterial and anaerobic fungal populations of cashmere goats[J]. Anaerobe, 2019, 59: 118-125. |
| [23] |
COSTA M, ALVES S P, CAPPUCCI A, et al. Effects of condensed and hydrolyzable tannins on rumen metabolism with emphasis on the biohydrogenation of unsaturated fatty acids[J]. Journal of Agricultural and Food Chemistry, 2018, 66(13): 3367-3377. |
| [24] |
ZHAN J S, LIU M M, WU C X, et al. Effects of alfalfa flavonoids extract on the microbial flora of dairy cow rumen[J]. Asian-Australasian Journal of Animal Sciences, 2017, 30(9): 1261-1269. |
| [25] |
LIANG X, JIN J, BI X, et al. Effects of Chinese herbal medicine and cold exposure on plasma glucose, leucine and energy metabolism in sheep[J]. Journal of Animal Physiology and Animal Nutrition, 2018, 102(2): e534-e541. |
| [26] |
KUMAGAI H, KUMAGAE S, MITANI K, et al. Effects of supplementary probiotics to two different diets on dry matter intake, daily gain, digestibility, ruminal pH, and fecal microbial populations and metabolites in ewes[J]. Animal Science Journal, 2004, 75(3): 219-224. |
| [27] |
SUPRATMAN H, RAMDANI D, KUSWARYAN S, et al. Application of probiotics and different size of sodium bicarbonate powders for feedlot sheep fattening[J]. AIP Conference Proceedings, 2018, 1927(1): 030045. |
| [28] |
赵连生, 王典, 王有月, 等. 饲粮中添加复合酶制剂对奶牛瘤胃发酵、营养物质表观消化率和生产性能的影响[J]. 动物营养学报, 2018, 30(10): 4172-4180. |
| [29] |
MAMAGHANI A, MAHAM M, DALIR-NAGHADEH B. Effects of ginger extract on smooth muscle activity of sheep reticulum and rumen[J]. Veterinary Research Forum:An International Quarterly Journal, 2013, 4(2): 91-97. |
| [30] |
JALILZADEH-AMIN G, MAHAM M, DALIR-NAGHADEH B, et al. Effects of Mentha longifolia essential oil on ruminal and abomasal longitudinal smooth muscle in sheep[J]. Journal of Essential Oil Research, 2012, 24(1): 61-69. |
| [31] |
柏冬星.大蒜氧化物对山羊瘤胃消化代谢及激素水平的影响[D].硕士学位论文.扬州: 扬州大学, 2010.
|
| [32] |
ROCHE J R, BLACHE D, KAY J K, et al. Neuroendocrine and physiological regulation of intake with particular reference to domesticated ruminant animals[J]. Nutrition Research Reviews, 2008, 21(2): 207-234. |
| [33] |
PULINA G, AVONDO M, MOLLE G, et al. Models for estimating feed intake in small ruminants[J]. Revista Brasileira de Zootecnia, 2013, 42(9): 675-690. |
| [34] |
COMLINE R S, TITCHEN D A. Reflex contraction of the oesophageal groove in young ruminants[J]. The Journal of Physiology, 1951, 115(2): 210-226. |
| [35] |
CLARY J J, MITCHELL J R, LITTLE C O, et al. Pancreatic amylase activity from ruminants fed different rations[J]. Canadian Journal of Physiology and Pharmacology, 1969, 47(2): 161. |
| [36] |
KANIA B F, DOMA N ' SKI E. Central adrenergic pathway participation in the inhibitory effects of endorphins on forestomach motility in sheep[J]. Small Ruminant Research, 1996, 19(3): 247-254. |
| [37] |
KANIA B F, MOTYL T, KULASEK G. Inhibitory action of intravenously administered ammonium acetate on the motility of the rumen in sheep[J]. Veterinary Quarterly, 1981, 3(3): 105-110. |
| [38] |
BRUCE L A, HUBER T L. Inhibitory effect of acid in the intestine on rumen motility in sheep[J]. Journal of Animal Science, 1973, 37(1): 164-168. |
| [39] |
崔思列. 促胰液素对山羊瘤胃运动调节效应的新发现[J]. 兽医科技信息, 1994(8): 14. |
| [40] |
WAN C Y, GONG D C, YANG F L. Effect of anterior stomach disease on rumen function of beef cattle[J]. Animal Husbandry and Feed Science, 2017, 9(5): 315-317. |
| [41] |
臧明实. 肉牛常见前胃疾病的临床症状和防治措施[J]. 现代畜牧科技, 2019(11): 76-77. |
| [42] |
陈莹. 前胃疾病在牛羊养殖中的鉴别诊断方法[J]. 吉林农业, 2019(20): 67. |
| [43] |
SHABANI E, CERONI V. Clinical findings dictated by subacute rumen acidosis (SARA) condition in cows for milk production[J]. Albanian Journal of Agricultural Science, 2013, 12(3): 327-331. |
| [44] |
CEBRAT E. Rumen motility in experimental acidosis of the rumen in sheep[J]. Acta Physiologica Polonica, 1979, 30(4): 533-541. |
| [45] |
ARAI S, HARITANI M, SAWADA H, et al. Effect of mosapride on ruminal motility in cattle[J]. Journal of Veterinary Medical Science, 2019, 81(7): 1017-1020. |
| [46] |
王林安, VELLE W. 针刺对牛网胃、瘤胃蠕动机能影响的试验观察[J]. 黑龙江畜牧兽医, 1990(8): 27-29. |
| [47] |
HIRAYAMA T, KATOH K, OBARA Y. Effects of heat exposure on nutrient digestibility, rumen contraction and hormone secretion in goats[J]. Animal Science Journal, 2004, 75(3): 237-243. |
| [48] |
NARDONE A, RONCHI B, LACETERA N, et al. Effects of climate changes on animal production and sustainability of livestock systems[J]. Livestock Science, 2010, 130(1/2/3): 57-69. |
| [49] |
SORIANI N, PANELLA G, CALAMARI L. Rumination time during the summer season and its relationships with metabolic conditions and milk production[J]. Journal of Dairy Science, 2013, 96(8): 5082-5094. |
| [50] |
SILANIKOVE N. Effects of water scarcity and hot environment on appetite and digestion in ruminants:a review[J]. Livestock Production Science, 1992, 30(3): 175-194. |
| [51] |
BEEDE D K, COLLIER R J. Potential nutritional strategies for intensively managed cattle during thermal stress[J]. Journal of Animal Science, 1986, 62(2): 543-554. |
| [52] |
MISHRA M, MARTZ F A, STANLEY R W, et al. Effect of diet and ambient temperature-humidity on ruminal pH, oxidation reduction potential, ammonia and lactic acid in lactating cows[J]. Journal of Animal Science, 1970, 30(6): 1023-1028. |
| [53] |
KOSTOV Y, ALEXANDROVA V. Appearance and dynamics of rumen motility in newborn calves[J]. Bulgarian Journal of Agricultural Science, 2010, 16(5): 665-668. |
| [54] |
MALAŠAUSKIENE D, TELEVIČ IUS M, JUOZAITIENE V, et al. Rumination time as an indicator of stress in the first thirty days after calving[J]. Polish Journal of Veterinary Sciences, 2019, 22(2): 363-368. |
| [55] |
CELLINI M, HUSSEIN H A, ELSAYED H K, et al. The association between metabolic profile indices, clinical parameters, and ultrasound measurement of backfat thickness during the periparturient period of dairy cows[J]. Comparative Clinical Pathology, 2019, 28(3): 711-723. |
| [56] |
孙镇平, 周业飞, 朱王飞, 等. 蛋白质过瘤胃保护增强植物外啡肽对山羊生长代谢的调节作用[J]. 畜牧兽医学报, 2004, 35(1): 6-9. |
| [57] |
ZIOUDROU C, STREATY R A, KLEE W A. Opioid peptides derived from food proteins.The exorphins[J]. The Journal of Biological Chemistry, 1979, 25(7): 2446-2449. |
| [58] |
王修启, 张兆敏, 阎祥洲, 等. 麦谷蛋白源外啡肽研究进展[J]. 食品与发酵工业, 2003, 29(10): 75-78, 89. |
| [59] |
WAGHORN G C, REID C S W. Rumen motility in sheep and cattle given different diets[J]. New Zealand Journal of Agricultural Research, 1983, 26(3): 289-295. |
| [60] |
MCLEAY L M, KOKICH D C, HOCKEY H U, et al. Motility of the reticulum and rumen of sheep given juice-extracted pasture[J]. British Journal of Nutrition, 1982, 47(1): 79-85. |
| [61] |
ULYATT M J, WAGHORN G C, JOHN A, et al. Effect of intake and feeding frequency on feeding behaviour and quantitative aspects of digestion in sheep fed chaffed lucerne hay[J]. The Journal of Agricultural Science, 1984, 102(3): 645-657. |
| [62] |
HERSOM M J, HANSEN G R, ARTHINGTON J D. Effect of dietary cation-anion difference on measures of acid-base physiology and performance in beef cattle[J]. Journal of Animal Science, 2010, 88(1): 374-382. |
| [63] |
陈沫, 臧长江, 陈晖, 等. 不同离子型表面活性剂对反刍动物瘤胃发酵调控的研究进展[J]. 中国畜牧兽医, 2018, 45(5): 1203-1210. |
| [64] |
郭永清, 赵宇飞, 张小宇. 酵母培养物对断奶犊牛生长性能及瘤胃发酵的影响[J]. 饲料研究, 2019, 42(11): 10-13. |




