2. 湖南家禽安全生产工程技术研究中心, 湖南畜禽安全生产协同创新中心, 长沙 410128
2. Hunan Engineering Research Center of Poultry Production Safety, Hunan Co-Innovation Center of Animal Production Safety, Changsha 410128, China
近年来,抗生素在畜禽生产中的滥用造成了许多不良影响,如导致各类致病菌的多重耐药性、环境污染、抗生素在动物体内大量残留等,甚至严重威胁人类的健康。开发抗生素替代产品成为了发展绿色畜牧业的重要方向。
植物精油作为主要的天然食品防腐剂和抑菌物质,在食品加工业中已广泛应用。百里香酚是百里香、牛至、冬香薄荷等植物精油的主要活性成分[1]。研究报道,百里香酚具有良好的抗氧化[2]、抗炎[3]、抑菌[4]、抗真菌[5]等特性。目前百里香酚已被欧盟委员会认定可作为食品中的调味剂,且被美国食品药品管理局认定为公认安全的食品添加剂。本文主要对百里香酚调控动物肠道菌群的可能机制及其在畜禽生产中替代抗生素的潜力进行了综述。
1 百里香酚的来源和结构百里香酚(5-甲基-2-异丙基酚)又名麝香草酚,是一种单萜酚类化合物,主要存在于从唇形科植物(如百里香、牛至、罗勒等)提取的精油中[6]。百里香酚的化学结构见图 1,其分子式为C10H14O,具有特殊的香味和良好的防腐性[7-8],作为无害的调味料和天然防腐剂在食品工业中广泛应用。目前,百里香酚的含量主要通过气相色谱法[9]、高效液相色谱法[10]等方法进行检测。
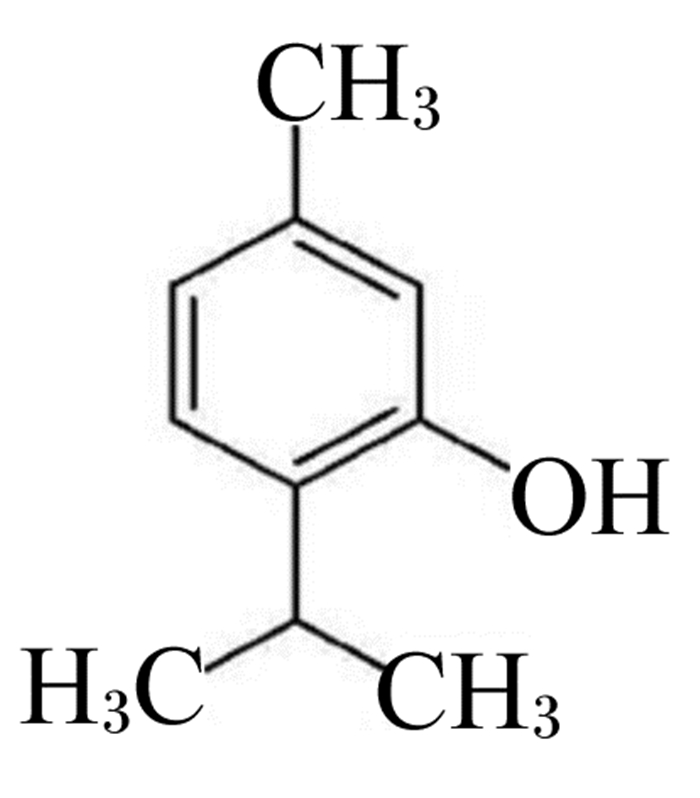
|
图 1 百里香酚的化学结构 Fig. 1 Chemical structure of thymol |
研究者们以各类动物为模型,检测了百里香酚对畜禽肠道菌群的改善作用(表 1)。研究表明,百里香酚能够有效降低有害菌数量,增加有益菌数量,其抗炎、抗氧化等功能也被认为与其调控肠道菌群的功能相关。
|
|
表 1 百里香酚对畜禽肠道菌群的改善作用 Table 1 Improve effects of thymol on intestinal flora of livestock and poultry |
动物肠道稳态的维持与其肠道菌群的稳定有着密切的联系,肠道内有害菌和有益菌数量及功能的平衡是保证动物肠道健康的关键。针对肠道内有害菌和有益菌的调控也是目前调控肠道健康的重要途经。目前,关于百里香酚对于肠道菌群的影响主要集中在其抑菌机制上,对于其调控动物肠道有益菌作用的研究较少,具体作用机制也有待进一步阐明。Cetin等[12]的研究表明,在饲粮中添加牛至精油(主要成分为百里香酚和香芹酚)能够显著提高肉鸡肠道乳酸菌丰度。Castañeda-Correa等[15]研究表明,百里香酚能够调节瘤胃微生物的活动,增加有益菌数量,减少甲烷产量,提高饲料利用率。但在Gutiérrez等[16]的研究中,百里香酚却被证实对于致病菌和有益菌都具有较强的抗菌活性。Moghrovyan等[17]的研究也表明,牛至精油能够抑制包括有益菌和其他微生物的生长。因此,关于百里香酚对于有益菌的调控机制仍有待进一步深入。
3 百里香酚的抑菌机制 3.1 破坏细菌细胞膜的结构细胞膜是细菌进行能量转换、物质运输、信息识别与传递和代谢调控等一系列生命活动必不可少的结构。百里香酚可以通过破坏细菌细胞膜从而发挥其抗菌作用。Zhou等[18]研究发现,百里香酚能够直接与细菌膜蛋白IolS结合,导致其活性增加,引起细胞内还原性辅酶Ⅱ(triphosphopyridine nucleotide,NADPH)的损耗进而增加细胞膜的通透性,造成细菌细胞的死亡。Pham等[19]的研究也表明,较高浓度的百里香酚能够通过降低某些脂肪酸的比例,破坏细胞膜结构来达到抗菌的效果。虽然百里香酚对细胞膜的抑菌机制研究结果比较单一,但是其同分异构体香芹酚在此方面已有不少研究进展。香芹酚与细胞膜的脂质双分子层相互作用,并存在脂肪酸链之间,导致膜结构的膨胀和不稳定甚至损坏[20-21]。Lesjak等[22]的研究中也提到香芹酚可以通过调节脂多糖的释放来分解革兰氏阴性菌的外膜。此外,其亲脂性结构也能与细胞膜的磷脂双层相互作用,增加细胞膜通透性,导致细胞内容物的渗漏,引起细菌死亡。由于化学结构和理化性质的相似性,百里香酚很可能也具有相似的作用机制。
3.2 影响细菌蛋白质的合成及功能蛋白质是菌体结构组成的重要成分,也是其发挥生理功能的基础。抑制细菌某些功能蛋白质的表达或破坏其结构,也是抑制菌体活性的一种重要手段。Hassannejad等[23]研究表明,百里香酚可以通过下调鲍曼不动杆菌的外模蛋白外膜蛋白A(outer membrane protein A,ompA)基因的表达,降低细菌黏附力以及毒力作用,从而达到抗菌的效果。Liu等[24]研究提出,百里香酚还具有抑制野生型大肠杆菌膜结合FIF0 ATP合成酶的作用,引起菌体内ATP合成量下降,从而达到抑菌的效果。β-半乳糖苷酶是广泛存在于微生物中的一种水解酶,Wang等[25]研究表明,百里香酚能够通过影响大肠杆菌中邻硝基苯-β-D-半乳糖苷底物的活性部位以及β-半乳糖苷酶的结构以抑制酶的活性,达到抑菌效果。百里香酚的同分异构体香芹酚也能通过影响蛋白质合成等相关途径行使抑菌功能。Upadhyay等[26]提到,香芹酚可以抑制空肠弯曲菌烟碱与烟碱型乙酰胆碱的结合,表明香芹酚能够通过与毒力蛋白受体结合来来发挥抗菌作用,此外香芹酚还能调节大肠杆菌O157 : H7和李斯特菌HSP60(GroEL)伴侣蛋白和其他蛋白的表达从而影响菌体内蛋白质的折叠,进而达到抗菌作用。
3.3 抑制毒力因子的表达细菌的多种分泌系统分泌的毒力因子以及毒力相关毒性蛋白是发挥其致病性的关键[27]。抑制细菌的毒力因子的表达,也是抑制菌体生长繁殖的重要手段。细菌Ⅲ型分泌系统所分泌的效应蛋白是部分革兰阴性菌操纵宿主细胞凋亡[28]与焦亡[29]的因素之一。张勇[30]研究发现,百里香酚能够抑制沙门氏菌Ⅲ型分泌系统主要毒力蛋白信号诱导增殖相关蛋白(SipA)的表达。百里香酚能够与SipA结合,使其构象发生变化进而被Lon蛋白酶降解。α-溶血素是细菌生长后期所分泌的一种外毒素,可在敏感细胞的细胞膜上形成中空的七聚圆柱体,形成孔道,破坏细胞膜完整性,最终导致细胞裂解。孙茂等[31]研究表明,百里香酚能够下调金色葡萄球菌的α-溶血素的表达,从而防止其引起的多种疾病。Upadhyaya等[32]的研究表明,百里香酚能够抑制肠炎沙门氏菌在家禽生殖道的活性以及毒力基因的表达,发挥其保护作用。
3.4 影响生物膜形成生物膜是细菌进行生命活动以及抵抗宿主防御机制至关重要的结构,主要由蛋白质、多糖、肽聚糖、磷脂等构成。胞外多糖是细菌生物膜维持其三维结构的主要成分,既是生物膜结构的基础,又是其功能的主要承担者[33-34],所以抑制或减少细菌胞外多糖的合成和分泌,是抑制生物膜形成的重要手段。靳盼盼等[35-36]研究表明,百里香酚可能通过影响食源阴沟肠杆菌热稳定的类核结构(heat-stable nucleoid-structural,HNS)→rcsA→wca(胞外多糖合成)基因簇这一级联调控途径,降低与生物膜形成相关的6个目的基因(生物膜黏附相关基因:sgB、csgE、csgF;胞外多糖合成相关基因:wcaA、wcaM、wza)的相对表达量来影响胞外多糖克拉酸的合成,从而降低生物膜内胞外多糖的含量,达到抑制细菌的泳动能力、降低生物膜厚度、导致其生物膜结构松散的效果。Wang等[37]研究表明,百里香酚可以通过限制胸膜肺炎放线杆菌聚谷氨酸(PGA)基因编码的生物膜基质的主要成分PGA多糖来损害其生物膜结构,进而达到抑菌效果。除此之外,百里香酚的同分异构体香芹酚还有抑制生物膜形成[38]或清除预先形成的生物膜[39]等功能。所以百里香酚在生物膜方面的抑制作用除了对各类基因的抑制外,可能还具有其他等待发现的新途径。
3.5 影响群体感应(quorum sensing,QS)细菌间的通信系统群体感应是细菌以菌体密度依赖的方式产生和检测信号分子从而调节细胞生理行为的途径[40]。群体感应可以调节毒性因子表达、生物膜形成、胞外蛋白酶产生、DNA转录、生物发光、色素的生成、质粒的转移和次生代谢物的产生等许多生理活动[41]。近年来的研究表明,许多植物提取物能够通过抑制菌体的群体感应来达到抑菌的效果。自体诱导分子-2(AI-2)是由群体感应基因表达产生的一种化学信号分子,也是群体感应中分布最广最普遍的信号分子,在协调细胞空间分布、聚集胞外多糖和建立生物膜三维结构等方面起着重要的作用,LuxS和pfs基因是AI-2合成过程中不可缺少的2种基因。Aram等[42]研究表明,百里香酚可以通过抑制肺炎球菌中LuxS和pfs基因的表达,从而导致生物膜的破坏,达到抑菌效果。在金色葡萄球菌中,群体感应系统由附属基因调节子(agr)基因座编码,agr基因座包含2类操纵子,其中一类包含agrBDCA,主要作用于RNAⅢ(一类由核苷酸构成的小RNA分子,是金色葡萄球菌agr群体感应调控系统的组成成分)转录本的生产,另一类驱动RNAⅢ的转录,被认为是agr位点的效应分子,hld基因是RNAⅢ的一类转录本。Sharifi等[43]研究表明,一定浓度的百里香酚能够显著抑制hld基因的表达,从而影响群体感应系统中agr基因座的编码,导致群体感应系统功能障碍,达到抑菌的效果,Aram等[42]研究也提出百里香酚能够通过抑制肺炎链球菌中群体感应相关基因LuxS和pfs的表达破坏生物膜,导致菌体死亡。
目前,百里香酚在群体感应中的研究并不多,但它的同分异构体香芹酚已被证实具有抑制群体感应的功效。Tapia-Podriguez等[44]的研究结果表明,香芹酚可以通过抑制铜绿假单胞菌中LasI的活性,同时降低lasR基因、生物膜和群集运动的表达,进而影响酰基高丝氨酸内酯(AHL)的产生来抑制铜绿假单胞菌的群体感应,达到抑制毒力因子的抗菌效果。Deryabin等[45]在研究中提出,香芹酚可能存在通过与LuxI型AHL合成酶或LuxR型AHL受体蛋白结合进而抑制群体感应的机制。由于百里香酚与香芹酚是同分异构体,理化性质以及生物学作用相似度较高,推测百里香酚可能在这些方面也有相似的功效。
3.6 影响宿主与微生物互作百里香酚除了能够直接或间接作用于菌体本身发挥抗菌作用,还能够通过增强宿主免疫间接调控肠道菌群。Kwon等[46]研究表明,百里香酚能下调受金色葡萄球菌感染的HaCaT角质形成细胞内促炎细胞因子[肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)]和趋化因子[白细胞介素-8(IL-8)、单核细胞趋化蛋白-1(MCP-1)]基因的表达,达到抗炎抑菌效果。Omonijo等[47]的研究表明,百里香酚可以通过抑制炎症状态下肠上皮细胞内活性氧(reactive oxygen species,ROS)的产生以及促炎细胞因子的表达来改善肠道屏障的功能,以达到抗炎的效果。除此之外,Wang等[48]研究表明,百里香酚还能够通过抑制Toll样受体4(Toll-like receptors 4,TLR4)介导的RhoA依赖性核转录因子-κB(NF-κB)信号传导途径来抑制脂多糖诱导的HMrSV5细胞炎症。Wang等[49]的研究也提到了相同的机制,增强屏障功能、防止肠道菌群紊乱也是百里香酚增强宿主抵抗力的机制之一。Wei等[11]的研究表明,一定浓度的百里香酚能够减弱断奶仔猪断奶引起的氧化应激和肠道屏障障碍,维持肠道菌群的稳定。
4 在畜禽生产中替代抗生素的应用随着饲料禁抗、养殖减抗、产品无抗时代的到来,天然植物提取物,特别是植物精油越来越受到行业的关注。百里香酚作为牛至油的主要功能成分,关于其在畜禽生产中的应用已有部分研究报道。
4.1 在猪生产中的应用目前,关于百里香酚在猪生产中的应用主要来源于牛至油产品,单独的百里香酚在猪饲粮中应用的报道较少。以往研究表明,仔猪饲粮添加牛至油可有效降低断奶仔猪腹泻,提高仔猪的平均日增重,降低料重比,但差异不显著[50]。Yang等[51]研究表明,百里香酚等植物精油和有机酸的混合物能够改善断奶仔猪的生长性能,增加了粪便中异戊酸的浓度,并调节了断奶仔猪的肠道菌群。百里香酚对猪源的金黄色葡萄球菌[52]以及猪肠道菌群中的多种致病菌(如大肠杆菌和沙门氏菌等)[53]都存在一定抑制作用。Connell等[54]的研究显示,百里香酚能够降低伤口细菌数量,促进伤口的愈合。此外,Varel[55]的研究表明,百里香酚能够抑制猪粪便的微生物发酵,减少废气和异味的排放,并减少粪便中的大肠杆菌菌群,从而降低对环境的污染。
4.2 在反刍动物生产中的应用Kazemi-Bonchenari等[56]研究表明,饲粮中添加百里香酚能够改善荷斯坦乳牛的增重和饲料转化率。Monteschio等[57]研究表明,饲粮中添加百里香酚能够增加Nellore雌性犊牛肌节长度,改善肉品质。Fratini等[58]研究表明,百里香酚能够抑制引起家畜乳腺炎的菌株如金黄色葡萄球菌、沃氏葡萄球菌、大肠杆菌等的活动,以抵抗病原菌的侵染,同时还能够提高奶牛的产奶量[50]。André等[59]研究表明,百里香酚能够抑制绵羊胃肠道线虫成虫的活力以及幼虫的发育,同时还能增强某些驱虫药的驱虫活性[60]。Ferreira等[61]研究表明,百里香酚能够抑制捻转血矛线虫(主要寄生在羊的胃肠道)虫卵的孵化、幼虫的发育以及活动。
4.3 在家禽生产中的应用Luna等[62]研究表明,百里香酚能够提高家禽的饲料转化率,可作为肉鸡生长的天然促进剂。Hafeez等[63]研究也发现,用添加百里香酚的饲粮进行饲喂能够提高肉鸡回肠的养分消化率,改善肉鸡的生长性能。Betancourt等[64]研究表明,百里香酚能够抑制艾美耳球虫活力,并且提高球菌感染情况下家禽的饲料转化率。Yin等[65]对家禽坏死性肠炎的研究表明,含25%的百里香酚和25%的香芹酚的精油能够抑制产气荚膜梭菌致病性,调节回肠微生物结构,抵抗致病菌的侵染。Nazar等[66]研究表明,百里香酚还具有缓解慢热性应激(chronic heat stress,CHS)对禽类内分泌、生化和免疫相关变量的有害影响的能力。Du等[67]研究表明,饲粮中添加一定量的百里香酚可以改善肉鸡肠道完整性,调节免疫反应,从而减轻肠道损伤。
5 小结效果显著、成分明确、无残留、无耐药性问题的绿色植物提取物是未来替代抗生素使用的重要成分。百里香酚作为一种天然植物活性成分,由于其良好的抑菌性能,富含百里香酚的牛至油产品也已在畜牧业中大量应用,具有替代抗生素的巨大潜力。但目前关于百里香酚、香芹酚和牛至粗提物在动物试验上应用效果比较以及协同作用效果还未有定论,有待进一步阐明。目前距离百里香酚真正用于生产实践还有一定距离,其提取工艺、作用效果、不同动物及疾病情况下的使用规范等均有待深入研究。然而,随着研究的不断深入和作用机制的进一步明确,百里香酚的应用前景将越来越广阔。
| [1] |
毕文慧, 马恒, 张东春, 等. 百里香酚-淀粉抑菌剂的制备及其对鲜切蔬菜微生物的控制[J]. 食品工业科技, 2019, 40(18): 1-7. |
| [2] |
GOLKAR P, TAGHIZADEH M, JALALI S A H. Determination of phenolic compounds, antioxidant and anticancer activity of Chrozophora tinctoria accessions collected from different regions of Iran[J]. Journal of Food Biochemistry, 2019, 43(11): e13036. |
| [3] |
COSTA M F, DURÇO A O, RABELO T K, et al. Effects of carvacrol, thymol and essential oils containing such monoterpenes on wound healing:a systematic review[J]. Journal of Pharmacy and Pharmacology, 2019, 71(2): 141-155. |
| [4] |
GUIMARÃES A C, MEIRELES L M, LEMOS M F, et al. Antibacterial activity of terpenes and terpenoids present in essential oils[J]. Molecules, 2019, 24(13): 2471. |
| [5] |
SCHLEMMER K B, JESUS F P K, TONDOLO J S M, et al. In vitro activity of carvacrol, cinnamaldehyde and thymol combined with antifungals against Malassezia pachydermatis[J]. Journal de Mycologie Médicale, 2019, 29(4): 375-377. |
| [6] |
MARCHESE A, ORHAN I E, DAGLIA M, et al. Antibacterial and antifungal activities of thymol:a brief review of the literature[J]. Food Chemistry, 2016, 210: 402-414. |
| [7] |
邵丹.百里香酚对LPS诱导的子宫内膜上皮细胞炎性反应的抗炎作用及机制[D].硕士学位论文.北京: 中国农业科学院, 2019.
|
| [8] |
邵丹, 宋朋杰, 闫宝琪, 等. 百里香酚对脂多糖诱导的子宫内膜上皮细胞炎性反应的抑制作用研究[J]. 畜牧兽医学报, 2019, 50(7): 1493-1499. |
| [9] |
罗成江, 周炜, 侯轩, 等. 气相色谱法测定香味剂中桉油精肉桂醛百里香酚及香芹酚的含量[J]. 中国兽医杂志, 2019, 55(2): 113-115. |
| [10] |
杨春香, 王易芬, 王婧, 等. 高效液相色谱法检测活性食品包装薄膜中的香芹酚和百里香酚[J]. 食品科学, 2018, 39(16): 317-320. |
| [11] |
WEI H K, XUE H X, ZHOU Z X, et al. A carvacrol-thymol blend decreased intestinal oxidative stress and influenced selected microbes without changing the messenger RNA levels of tight junction proteins in jejunal mucosa of weaning piglets[J]. Animal, 2017, 11(2): 193-201. |
| [12] |
CETIN E, YIBARR A, YESILBAG D, et al. The effect of volatile oil mixtures on the performance and ilio-caecal microflora of broiler chickens[J]. British Poultry Science, 2016, 57(6): 780-787. |
| [13] |
LILIANA B, RODRIGUEZ F, PHANDANOUVONG V, et al. Effect of origanum chemotypes on broiler intestinal bacteria[J]. Poultry Science, 2014, 93(10): 2526-2535. |
| [14] |
GIANNENAS I, PAPANEOPHYTOU C P, TSALIE E, et al. Dietary supplementation of benzoic acid and essential oil compounds affects buffering capacity of the feeds, performance of turkey poults and their antioxidant status, pH in the digestive tract, intestinal microbiota and morphology[J]. Asian-Australasian Journal of Animal Sciences, 2014, 27(2): 225-236. |
| [15] |
CASTAÑEDA-CORREA A, CORRAL-LUNA A, HUME M E, et al. Effects of thymol and carvacrol, alone or in combination, on fermentation and microbial diversity during in vitro culture of bovine rumen microbes[J]. Journal of Environmental Science and Health, Part B, 2019, 54(3): 170-175. |
| [16] |
GUTIÉRREZ S, MORÁN A, MARTÍNEZ-BLANCO H, et al. The usefulness of non-toxic plant metabolites in the control of bacterial proliferation[J]. Probiotics and Antimicrobial Proteins, 2017, 9(3): 323-333. |
| [17] |
MOGHROVYAN A, SAHAKYAN N, BABAYAN A, et al. Essential oil and ethanol extract of oregano (Origanum vulgare L.) from Armenian flora as a natural source of terpenes, flavonoids and other phytochemicals with antiradical, antioxidant, metal chelating, tyrosinase inhibitory and antibacterial activity[J]. Current Pharmaceutical Design, 2019, 25(16): 1809-1816. |
| [18] |
ZHOU W, WANG Z, MO H Z, et al. Thymol mediates bactericidal activity against Staphylococcus aureus by targeting an aldo-keto reductase and consequent depletion of NADPH[J]. Journal of Agricultural and Food Chemistry, 2019, 67(30): 8382-8392. |
| [19] |
PHAM Q, TOPGAARD D, SPARR E. Cyclic and linear monoterpenes in phospholipid membranes:phase behavior, bilayer structure, and molecular dynamics[J]. Langmuir, 2015, 31(40): 11067-11077. |
| [20] |
ANTONIA N, MARINO A, GINESTRA G, et al. Effects of adaptation to carvacrol on Staphylococcus aureus in the planktonic and biofilm phases[J]. Biofouling, 2017, 33(6): 470-480. |
| [21] |
BOUND D J, MURTHY P S, SRINIVAS P. 2, 3-Dideoxyglucosides of selected terpene phenols and alcohols as potent antifungal compounds[J]. Food Chemistry, 2016, 210: 371-380. |
| [22] |
LESJAK M, SIMIN N, ORCIC D, et al. Binary and tertiary mixtures of Satureja hortensis and Origanum vulgare essential oils as potent antimicrobial agents against Helicobacter pylori[J]. Phytotherapy Research, 2016, 30(3): 476-484. |
| [23] |
HASSANNEJAD N, BAHADOR A, RUDBARI N H, et al. In vivo antibacterial activity of Zataria multiflora Boiss extract and its components, carvacrol, and thymol, against colistin-resistant Acinetobacter baumannii in a pneumonic BALB/c mouse model[J]. Journal of Cellular Biochemistry, 2019, 120(11): 18640-18649. |
| [24] |
LIU M, AMINI A, AHMAD Z. Safranal and its analogs inhibit Escherichia coli ATP synthase and cell growth[J]. International Journal of Biological Macromolecules, 2017, 95: 145-152. |
| [25] |
WANG L H, WANG M S, ZHANG X A, et al. In vitro investigation of the inhibitory mechanism of β-galactosidase by cinnamaldehyde alone and in combination with carvacrol and thymol[J]. Biochimica et Biophysica Acta:General Subjects, 2016, 1861(1): 3189-3198. |
| [26] |
UPADHYAY A, ARSI K, WAGLE B R, et al. Trans-cinnamaldehyde, carvacrol, and eugenol reduce Campylobacter jejuni colonization factors and expression of virulence genes in vitro[J]. Frontiers in Microbiology, 2017, 8: 713. |
| [27] |
王明贵. 广泛耐药革兰阴性菌感染的实验诊断、抗菌治疗及医院感染控制:中国专家共识[J]. 中国感染与化疗杂志, 2017, 17(1): 82-93. |
| [28] |
WOOD S J, GOLDUFSKY J W, BELLO D, et al. Pseudomonas aeruginosa ExoT induces mitochondrial apoptosis in target host cells in a manner that depends on its GTPase-activating protein (GAP) domain activity[J]. Journal of Biological Chemistry, 2015, 290(48): 29063-29073. |
| [29] |
JEON J, KIM Y J, SHIN H, et al. T3SS effector ExoY reduces inflammasome-related responses by suppressing bacterial motility and delaying activation of NF-κB and caspase-1[J]. The FEBS Journal, 2017, 284(20): 3392-3403. |
| [30] |
张勇.百里香酚对沙门氏菌Ⅲ型分泌系统的抑制作用及机制[D].博士学位论文.长春: 吉林大学, 2018.
|
| [31] |
孙茂, 何学文, 邓嘉强, 等. 亚抑菌质量浓度的百里香酚对金黄色葡萄球菌α-溶血素表达的影响[J]. 云南农业大学学报(自然科学版), 2019, 34(3): 414-419. |
| [32] |
UPADHYAYA I, UPADHYAY A, KOLLANOOR-JOHNY A, et al. Effect of plant derived antimicrobials on Salmonella enteritidis adhesion to and invasion of primary chicken oviduct epithelial cells in vitro and virulence gene expression[J]. International Journal of Molecular Sciences, 2013, 14(5): 10608-10625. |
| [33] |
Nwodo U U, GREEN E, OKOH A. Bacterial exopolysaccharides:functionality and prospects[J]. International Journal of Molecular Sciences, 2012, 13(12): 14002-14015. |
| [34] |
BALES P M, RENKE E M, MAY S L, et al. Purification and characterization of biofilm-associated EPS exopolysaccharides from ESKAPE organisms and other pathogens[J]. PLoS One, 2013, 8(6): e67950. |
| [35] |
靳盼盼, 刘亚文, 刘旖旎, 等. 百里香酚对食源阴沟肠杆菌生物膜形成的抑制作用[J]. 食品工业科技, 2019, 40(22): 104-109. |
| [36] |
靳盼盼.香芹酚和百里香酚对两株食源性腐败菌生物膜的抑制作用研究[D].硕士学位论文.哈尔滨: 东北农业大学, 2019.
|
| [37] |
WANG L, ZHAO X Q, ZHU C L, et al. Thymol kills bacteria, reduces biofilm formation, and protects mice against a fatal infection of Actinobacillus pleuropneumoniae strain L20[J]. Veterinary Microbiology, 2017, 203: 202-210. |
| [38] |
SOKOLIK C G, BEN-SHABAT-BINYAMINI R, GEDANKEN A, et al. Proteinaceous microspheres as a delivery system for carvacrol and thymol in antibacterial applications[J]. Ultrasonics Sonochemistry, 2017, 41: 288-296. |
| [39] |
HUACHO P M M, HERRERO E R, VERSPECHT T, et al. Terpinen-4-ol and carvacrol affect multi-species biofilm composition[J]. Biofouling, 2019, 35(5): 561-572. |
| [40] |
BRACKMAN G, COENYE T. Quorum sensing inhibitors as anti-biofilm agents[J]. Current Pharmaceutical Biotechnology, 2015, 21(1): 5-11. |
| [41] |
萨仁高娃, 胡文忠, 冯可, 等. 植物精油及其成分对病原微生物的抗菌机理的研究进展[J]. 食品科学, 2019, 1-13. |
| [42] |
ARAM S, ALI A, ABDOLMAJID M. Streptococcus pneumoniae quorum sensing and biofilm formation are affected by Thymus daenensis, Satureja hortensis, and Origanum vulgare essential oils[J]. Acta Microbiologica et Immunologica Hungarica, 2018, 65(3): 345-359. |
| [43] |
SHARIFI A, MOHAMMADZADEH A, SALEHI Z T, et al. Antibacterial, antibiofilm and antiquorum sensing effects of Thymus daenensis and Satureja hortensis essential oils against Staphylococcus aureus isolates[J]. Journal of Applied Microbiology, 2018, 124(2): 379-388. |
| [44] |
TAPIA-PODRIGUEZ M R, BERNAL-MERCADO A T, GUTIERREZ-PACHECO M M, et al. Virulence of Pseudomonas aeruginosa exposed to carvacrol:alterations of the Quorum sensing at enzymatic and gene levels[J]. Journal of Cell Communication and Signaling, 2019, 13(4): 531-537. |
| [45] |
DERYABIN D, GALADZHIEVA A, KOSYAN D, et al. Plant-derived inhibitors of AHL-mediated quorum sensing in bacteria:modes of action[J]. International Journal of Molecular Sciences, 2019, 20(22): 5588. |
| [46] |
KWON H I, JEONG N H, JUN S H, et al. Thymol attenuates the worsening of atopic dermatitis induced by Staphylococcus aureus membrane vesicles[J]. International Immunopharmacology, 2018, 59: 301-309. |
| [47] |
OMONIJO F A, LIU S X, HUI Q R, et al. Thymol improves barrier function and attenuates inflammatory responses in porcine intestinal epithelial cells during lipopolysaccharide (LPS)-induced inflammation[J]. Journal of Agricultral Food Chemistry, 2019, 67(2): 615-624. |
| [48] |
WANG Q L, CHENG F J, XU Y, et al. Thymol alleviates lipopolysaccharide-stimulated inflammatory response via downregulation of RhoA-mediated NF-κB signalling pathway in human peritoneal mesothelial cells[J]. European Journal of Pharmacology, 2018, 833: 210-220. |
| [49] |
WANG H C, JIANG K F, YIN N N, et al. Thymol mitigates lipopolysaccharide-induced endometritis by regulating the TLR4-and ROS-mediated NF-κB signaling pathways[J]. Oncotarget, 2017, 8(12): 20042-20055. |
| [50] |
梁建勇, 李晓康, 焦婷, 等. 牛至精油在畜禽生产中的研究进展[J]. 中国饲料, 2017(9): 22-25. |
| [51] |
YANG C M, ZHANG L L, GAO G T, et al. Effects of dietary supplementation with essential oils and organic acids on the growth performance, immune system, faecal volatile fatty acids, and microflora community in weaned piglets[J]. Journal of Animal Science, 2019, 97(1): 133-143. |
| [52] |
LOFA A, VELASCO V, GERDING M, et al. Antibiotic-resistant Staphylococcus aureus strains of swine origin:molecular typing and susceptibility to oregano (Origanum vulgare L.) essential oil and maqui (Aristotelia chilensis (Molina) Stuntz) extract[J]. Journal of Applied Microbiology, 2019, 127(4): 1048-1056. |
| [53] |
GÓMEZ-GARCÍA M, SOL C, DE NOVA P J G, et al. Antimicrobial activity of a selection of organic acids, their salts and essential oils against swine enteropathogenic bacteria[J]. Porcine Health Management, 2019, 5: 32. |
| [54] |
CONNELL S, LI J M, DURKES A, et al. Application of hyperosmotic nanoemulsions in wound healing:partial thickness injury model in swine[J]. Advances in Wound Care, 2017, 6(5): 153-165. |
| [55] |
VAREL V H. carvacrol and thymol reduce swine waste odor and pathogens:stability of oils[J]. Current Microbiology, 2002, 44(1): 38-43. |
| [56] |
KAZEMI-BONCHENARI M, FALAHATI R, POORHAMDOLLAH M, et al. Essential oils improved weight gain, growth and feed efficiency of young dairy calves fed 18 or 20% crude protein starter diets[J]. Journal of Animal Physiology and Animal Nutrition, 2018, 102(3): 652-661. |
| [57] |
MONTESCHIO J O, VARGAS-JUNIOR F M, ALMEIDA F L A, et al. The effect of encapsulated active principles (eugenol, thymol and vanillin) and clove and rosemary essential oils on the structure, collagen content, chemical composition and fatty acid profile of Nellore heifers muscle[J]. Meat Science, 2019, 155: 27-35. |
| [58] |
FRATINI F, CASELLA S, LEONARDI M, et al. Antibacterial activity of essential oils, their blends and mixtures of their main constituents against some strains supporting livestock mastitis[J]. Fitoterapia, 2014, 96: 1-7. |
| [59] |
ANDRÉ W P P, CAVALCANTE G S, RIBEIRO W L C, et al. anthelmintic effect of thymol and thymol acetate on sheep gastrointestinal nematodes and their toxicity in mice[J]. Revista Brasileira de Parasitologia Veterinária, 2017, 26(3): 323-330. |
| [60] |
MIRÓ V, LIFSCHITZ A, VIVIANI P, et al. In vitro inhibition of the hepatic S-oxygenation of the anthelmintic albendazole by the natural monoterpene thymol in sheep[J]. Xenobiotica, 2019, 50(4): 408-414. |
| [61] |
FERREIRA L E, BENINCASA B I, FACHIN A L, et al. Thymus vulgaris L.essential oil and its main component thymol:anthelmintic effects against Haemonchus contortus from sheep[J]. Veterinary Parasitology, 2016, 228: 70-76. |
| [62] |
LUNA A, TARIFA M F, FERNANDEZ M E, et al. Thymol, alpha tocopherol, and ascorbyl palmitate supplementation as growth enhancers for broiler chickens[J]. Poultry Science, 2018, 98(2): 1012-1016. |
| [63] |
HAFEEZ A, MÄNNER K, SCHIEDER C, et al. Effect of supplementation of phytogenic feed additives (powdered vs.encapsulated) on performance and nutrient digestibility in broiler chickens[J]. Poultry Science, 2016, 95(3): 622-629. |
| [64] |
BETANCOURT L, HUME M, RODRÍGUEZ F, et al. Effects of Colombian oregano essential oil (Lippia origanoides Kunth) and Eimeria species on broiler production and cecal microbiota[J]. Poultry Science, 2019, 98(10): 4777-4786. |
| [65] |
YIN D F, DU E C, YUAN J M, et al. Supplemental thymol and carvacrol increases ileum Lactobacillus population and reduces effect of necrotic enteritis caused by Clostridium perfringes in chickens[J]. Scientific Reports, 2017, 7: 7334. |
| [66] |
NAZAR F N, VIDELA E A, MARIN R H. Thymol supplementation effects on adrenocortical, immune and biochemical variables recovery in Japanese quail after exposure to chronic heat stress[J]. Animal, 2019, 13(2): 318-325. |
| [67] |
DU E C, WANG W W, GAN L P, et al. Effects of thymol and carvacrol supplementation on intestinal integrity and immune responses of broiler chickens challenged with Clostridium perfringens[J]. Journal of Animal Science and Biotechnology, 2016, 7: 19. |




