2. 农业部养猪科学重点实验室, 重庆 402460
2. Key Laboratory of Pig Industry Sciences, Ministry of Agriculture, Chongqing 402460, China
仔猪早期断奶时极易出现仔猪断奶应激综合征[1],主要表现为生长缓慢、免疫力低下、腹泻或绝食等[2],成为严重影响现代养猪生产效率的一个难题。抗生素对减轻仔猪早期断奶应激综合征、促进断奶仔猪生长[3]具有正面效应,但抗生素的大量应用伴随抗生素残留、细菌耐药性、环境污染等负面效应,我国已颁布了相应文件禁止在饲料中使用抗生素。因此,寻求安全、有效的抗生素替代品成为目前研究的热点。
甘露寡糖(mannan oligosaccharides,MOS)是一种典型的功能性寡糖[4-5],能够改善断奶仔猪肠道微生态平衡,提高宿主肠黏膜免疫力,且有益于肠道健康和生产性能的提高[6]。Zhao等[7]在断奶仔猪饲粮中添加0.1%的甘露寡糖,对断奶仔猪的生长性能和养分消化率有积极作用,并降低了腹泻评分。邵莲花等[8]在断奶仔猪饲粮中分别添加0.05%和0.10%的甘露寡糖,均有效改善了仔猪生长性能,显著抑制了大肠杆菌增殖,促进了双歧杆菌增殖。研究发现,益生菌能通过影响肠道微生物平衡和挥发性脂肪酸含量,改善断奶仔猪肠道健康水平[9-10],具有缓解断奶应激的潜力,并且复合的菌株或菌种比单一菌株更有效[11]。Wang等[12]在断奶仔猪饲粮中添加6×109 CFU/kg丁酸梭菌和1×1010 CFU/kg粪肠球菌,可促进断奶仔猪生长,保护肠绒毛形态,提高结肠内容物挥发性脂肪酸含量,并优化结肠内容物菌群结构。Rolfe[13]认为甘露寡糖和益生菌可以联合使用,甘露寡糖可以促进益生菌的生长。黄俊文等[14]在断奶仔猪饲粮中添加0.10%的甘露寡糖和0.05%的纳豆芽孢杆菌,断奶仔猪粪便中细菌数量在不同时期有不同程度的降低,但细菌种类增多。Vente-Spreeuwenberg等[15]认为甘露寡糖或益生菌可以影响肠道菌群。但目前却缺乏复合益生菌和甘露寡糖联合使用对断奶仔猪肠道菌群结构影响的相关报道。因此,本研究拟以甘露寡糖和复合益生菌为材料,研究两者对断奶仔猪生长性能及肠道形态结构、挥发性脂肪酸含量和菌群结构的影响,为两者在生产实践中的应用提供理论参考。
1 材料与方法 1.1 试验材料甘露寡糖,含量≥35%;复合益生菌,含枯草芽孢杆菌(≥1.0×109 CFU/g)、酿酒酵母(≥5.0×108 CFU/g)、丁酸梭菌(≥1.0×109 CFU/g)和解淀粉芽孢杆菌(≥1.0×108 CFU/g)。
1.2 试验设计选择144头体重(8.50±0.11) kg、28~30日龄的“杜×长×大”断奶仔猪,按体重基本一致原则随机分成4组,每组6个重复,每个重复6头猪。Ⅰ组为对照组,饲喂基础饲粮;Ⅱ组为甘露寡糖组,饲喂基础饲粮+0.1%甘露寡糖;Ⅲ组为复合益生菌组,饲喂基础饲粮+0.1%复合益生菌;Ⅳ组为甘露寡糖和复合益生菌合用组,饲喂基础饲粮+0.1%甘露寡糖+0.1%复合益生菌。试验在重庆市畜牧科学院营养工程试验基地进行。预试期5 d,正试期28 d。
1.3 饲养管理试验严格按照猪场常规试验管理进行,并按要求进行预防接种、驱虫,分别在09:00和17:00对各组仔猪进行拌料饲喂。
1.4 检测指标 1.4.1 生长性能测定于正试验的第1天和第28天早晨空腹称重禁食12 h的仔猪,用于计算平均日增重。称重前结算饲粮消耗,根据饲粮投喂量计算平均日采食量。根据平均日增重和平均日采食量计算料重比。每天观察记录所有试验仔猪的腹泻情况。每头仔猪腹泻1天记为1个腹泻头次,试验结束后计算各组的腹泻率。

|
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
在试验第28天,从每个重复中选取1头接近平均体重且健康状况良好的仔猪进行屠宰,剪取仔猪空肠、回肠中段各3 cm肠段,固定于4%甲醛溶液中,备用。
在无菌条件下,取盲肠和结肠内容物,一部分-80 ℃冻存,用于肠道微生物多样性检测;一部分-20 ℃冻存,用于挥发性脂肪酸含量检测。
1.4.3 肠道黏膜形态结构测定取出固定的肠道组织,常规石蜡切片制作,采用显微镜在线测量软件,测量空肠、回肠隐窝深度和绒毛高度,并计算绒毛高度/隐窝深度(VH/CD)。
1.4.4 盲肠和结肠菌群多样性分析将样品送至北京百迈克生物技术公司,使用高通量测序技术对结肠内容物进行16S rRNA基因测序,分析断奶仔猪盲肠和结肠菌群结构。
1.4.5 挥发性脂肪酸含量测定准确称取1 g肠道内容物,加入1 mL超纯水,混匀。15 000 r/min离心15min,取上清,按体积比9 : 1比例添加25%偏磷酸(上清液/偏磷酸),冰水浴3 h。采用GC-2010气相色谱仪测定乙酸、丙酸、丁酸和戊酸含量。
1.5 数据处理及统计分析试验数据经Excel 2016软件处理后,采用SPSS 25.0软件进行单因素方差分析(one-way ANOVA)和Duncan氏法多重比较检验,P < 0.05为差异显著,0.05≤P≤0.10为有趋势。
2 结果 2.1 甘露寡糖和复合益生菌对断奶仔猪生长性能的影响由表 2可知,与Ⅰ组相比,Ⅱ组平均日采食量显著提高(P < 0.05),平均日增重提高,但差异不显著(P>0.05),料重比有降低趋势(P=0.06);Ⅲ组平均日采食量显著降低(P < 0.05),平均日增重降低,但差异不显著(P>0.05);Ⅳ组平均日采食量显著提高(P < 0.05),平均日增重增加,但差异不显著(P>0.05),料重比有降低趋势(P=0.06),腹泻率显著降低(P < 0.05)。
|
|
表 2 甘露寡糖和复合益生菌对断奶仔猪生长性能的影响 Table 2 Effects of MOS and compound probiotic on growth performance of weaned piglets |
由表 3可知,与Ⅰ组相比,Ⅱ、Ⅲ、Ⅳ组空肠和回肠绒毛高度、隐窝深度和绒毛高度/隐窝深度均无显著差异(P>0.05)。
|
|
表 3 甘露寡糖和复合益生菌对断奶仔猪肠道形态结构的影响 Table 3 Effects of MOS and compound probiotic on intestinal morphology of weaned piglets |
由表 4可知,与Ⅰ组相比,Ⅲ和Ⅳ组盲肠内容物中丁酸含量分别提高了22.92%和75.69%(P=0.10),总挥发性脂肪酸含量分别提高了13.28%和24.44%,呈升高趋势(P=0.10);各组盲肠内容物中乙酸、丙酸和戊酸含量无显著差异(P>0.05)。与Ⅰ组相比,Ⅲ和Ⅳ组结肠内容物中丁酸含量分别显著提高了59.67%和60.84%(P < 0.05);总挥发性脂肪酸含量分别提高了44.27%和32.22%,呈升高趋势(P=0.06);各组结肠内容物中乙酸、丙酸和戊酸含量无显著差异(P>0.05)。
|
|
表 4 甘露寡糖和复合益生菌对断奶仔猪肠道挥发性脂肪酸含量的影响(湿重基础) Table 4 Effects of MOS and compound probiotic on intestinal VFA contents of weaned piglets (wet weight basis) |
使用QIIME软件,对操作分类单元(OTUs)丰度矩阵中每个样本的序列按97%的相似度在不同深度下随机抽样,以每个深度下抽取的序列数及其对应的OTUs数量分别计算反映菌群丰富度的Chao1、ACE指数及兼顾菌群均匀性的Shannon和Simpson指数。由表 5可知,与Ⅰ组相比,Ⅱ组盲肠内容物的Shannon指数显著降低(P < 0.05),Simpson指数显著升高(P < 0.05);Ⅲ和Ⅳ组盲肠内容物的Shannon和Simpson指数无显著差异(P < 0.05)。各组间结肠内容物的α多样性指数均无显著差异(P>0.05)。
|
|
表 5 甘露寡糖和复合益生菌对断奶仔猪后肠α多样性指数的影响 Table 5 Effects of MOS and compound probiotic on hindgut α diversity indexes of weaned piglets |
根据物种注释结果,分别选取了在门水平相对丰度排名前10和在属水平相对丰度排名前15的物种进行分析。由图 1可知,在门水平上,断奶仔猪盲肠的主要优势菌群包括厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、软壁菌门(Tenericutes)。在属水平上,主要优势菌群包括乳杆菌属(Lactobacillus)、梭状芽孢杆菌属(Clostridium_sensu_stricto_1)、罕见小球菌属(Subdoligranulum)、毛螺菌属(Lachnospira)、罗斯氏菌属(Roseburia)。
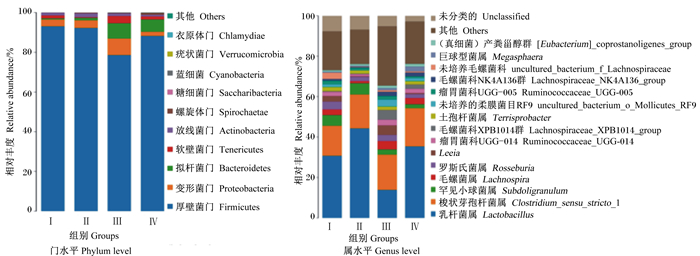
|
图 1 甘露寡糖和复合益生菌对断奶仔猪盲肠菌群结构的影响 Fig. 1 Effects of MOS and compound probiotics on cecal microbial structure of weaned piglets |
根据物种注释结果,分别选取了在门水平相对丰度排名前10和在属水平相对丰度排名前15的物种进行分析。由图 2可知,在门水平上,断奶仔猪结肠的主要优势菌群包括厚壁菌门、拟杆菌门、软壁菌门、变形菌门。在属水平上,主要优势菌群包括乳杆菌属、不可培养拟杆菌目S24-7群(uncultured_bacterium_f_Bacteroidales_S24-7_group)、梭状芽孢杆菌属、罗斯氏菌属。
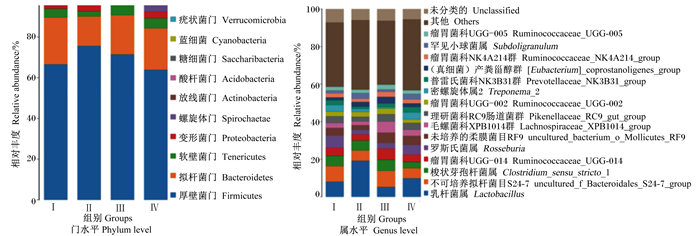
|
图 2 甘露寡糖和复合益生菌对断奶仔猪结肠菌群结构的影响 Fig. 2 Effects of MOS and compound probiotics on colonic microbial structure of weaned piglets |
在本试验中,饲粮中添加0.1%甘露寡糖显著提高了断奶仔猪平均日采食量,提高了平均日增重;与Zhao等[7]在基础饲粮中添加0.1%甘露寡糖改善断奶仔猪生长性能结果相似。甘露寡糖不能被胃和小肠消化吸收,能够为肠道中的乳酸杆菌和双歧杆菌等有益菌提供发酵底物,有利于益生菌的生长[16-17],改善肠道微生态,提高自身免疫力,减轻腹泻对断奶仔猪的影响。而在本试验中,饲粮中添加0.1%复合益生菌降低了断奶仔猪平均日采食量和平均日增重;与Lu等[18]在断奶仔猪中添加粪肠球菌、枯草芽孢杆菌、酿酒酵母(EBS)或者干酪乳杆菌(EBL)均显著提高断奶仔猪生长性能并降低腹泻率不同。可能与本试验断奶仔猪腹泻率较高有关,由于长时间运输过程中,保暖较差,断奶仔猪生长环境改变,产生应激,引起腹泻,而腹泻不利于益生菌在肠道中的快速定植和作用。饲粮中同时添加0.1%甘露寡糖和0.1%复合益生菌显著提高了断奶仔猪平均日采食量,显著降低了腹泻率。甘露寡糖可以促进益生菌的生长,加快外来添加菌的定植,提高益生菌在肠道中的竞争优势和占位,有效抑制致病菌和条件致病菌的过度生长,改善肠道微生态,降低仔猪腹泻率。
3.2 甘露寡糖和复合益生菌对断奶仔猪肠道形态的影响肠绒毛能极大地扩大营养物质的吸收面积,较高的绒毛高度/隐窝深度有利于营养物质的吸收[19],而绒毛变短,腺窝变深会减少营养物质的吸收,降低动物的生长性能。在本研究中,饲粮中添加0.1%的甘露寡糖对断奶仔猪肠道形态无显著影响,与李玉欣等[20]在断奶仔猪饲粮中添加0.1%的甘露寡糖显著增加断奶仔猪空肠绒毛长度和绒毛高度/隐窝深度结果不同。可能是本试验所用甘露寡糖在0.1%的添加水平下,其有效浓度不够对肠道形态产生显著影响。王莹[21]认为甘露寡糖对肠道的影响必须有一定的浓度,如果添加水平不足,则起不到改善效果。Xu等[22]发现在基础饲粮中添加不同浓度的壳聚糖,随着壳聚糖添加浓度升高,断奶仔猪肠道形态的改善效果呈先升高后降低的趋势。饲粮中添加0.1%复合益生菌对断奶仔猪肠道形态也无显著影响,可能与饲粮中有益菌的活菌数不够有关,在本试验中,每千克饲粮中各有益菌的有效浓度在1×108 CFU左右,而前人[12]在每千克饲粮中有益菌的添加浓度达到了1×109 CFU/g。Wang等[12]在断奶仔猪每千克饲粮中添加6×109 CFU丁酸梭菌和1×1010 CFU粪肠球菌显著增加了空肠绒毛长度、绒毛高度/隐窝深度,降低了隐窝深度。在本试验中,甘露寡糖和复合益生菌合用也未对断奶仔猪肠道形态有改善作用。
3.3 甘露寡糖和复合益生菌对断奶仔猪肠道微菌群结构的影响正常情况下,断奶仔猪肠道内各菌群相互依存、相互拮抗,以维持肠道的动态平衡。但断奶等外界环境应激容易破坏肠道动态平衡,导致肠道微生物菌群之间比例失调,极易造成腹泻等情况。在本研究中,饲粮中添加0.1%甘露寡糖提高了盲肠内容物菌群多样性,改善了菌群的均匀度,但对结肠内容物的菌群α多样性指数无显著影响。盲肠作为单胃动物的主要微生物发酵场所,甘露寡糖促进了双歧杆菌、乳酸杆菌和粪杆菌等肠道有益菌增殖,抑制了有害菌增殖,加快盲肠菌群结构的稳定。而复合益生菌与甘露寡糖合用对盲肠和结肠内容物的菌群α多样性指数无显著影响,可能是由于胃肠道的复杂性,使得动物个体面对饲粮改变时,出现了个别不同的应答[23]。
在本试验中,在门水平上,盲肠和结肠内容物的主要优势菌群包括厚壁菌门、变形杆菌门、拟杆菌门、软壁菌门;与对照组相比,饲粮中添加0.1%复合益生菌使盲肠变形菌门和拟杆菌门相对丰度呈升高趋势。厚壁菌门和拟杆菌门具有降解多糖和促进机体能量吸收的作用[24],在断奶仔猪肠道中起着至关重要的作用;而变形菌门是一种条件致病菌,能够反映微生态失调或不稳定的肠道微生物菌群结构,数量较少时,表现为良性,但在某些肠道环境下,它们会成为可引发炎症的肠道微生物[25]。在属水平上,盲肠内容物的主要优势菌群为乳杆菌属、梭状芽胞杆菌属、罕见小球菌属、毛螺菌属等;结肠内容物的主要优势菌群为乳酸菌属、不可培养拟杆菌目S24-7群、梭状芽孢杆菌属等。饲粮中添加0.1%甘露寡糖提高了断奶仔猪盲肠和结肠内容物中乳杆菌属的相对丰度;饲粮中添加0.1%复合益生菌提高了盲肠内容物中毛螺菌属的相对丰度;饲粮中同时添加0.1%甘露寡糖和0.1%复合益生菌提高了盲肠内容物中乳杆菌属的相对丰度。乳酸菌可通过自身及生长代谢产生抗菌物质,抑制腐败、致病菌等有害菌的繁殖,对于改善肠道微生物菌群结构具有重要作用[26]。毛螺菌属可以发酵多种碳水化合物,影响肠道碳水化合物的消化代谢,对于肠道挥发性脂肪酸的产生有重要作用。
3.4 甘露寡糖和复合益生菌对断奶仔猪肠道挥发性脂肪酸含量的影响猪的微生物发酵主要发生在盲肠、结肠,产生多种挥发性脂肪酸,主要包括甲酸、乙酸、丙酸和丁酸[27],可以发挥抑菌效应,增强肠道营养物质的吸收[28],对猪的肠道健康有重要作用。在本试验中,与对照组相比,饲粮中添加0.1%的甘露寡糖后盲肠和结肠挥发性脂肪酸含量略有升高,与贺琴[29]在断奶仔猪基础饲粮中添加酵母壁多糖显著提高仔猪结肠挥发性脂肪酸含量的结果相似。挥发性脂肪酸的产生与碳水化合代谢菌株有密切关系,而在本试验中,饲粮中添加0.1%甘露寡糖的断奶仔猪的盲肠和结肠内容物中,与碳水化合物发酵代谢相关的菌株如毛螺菌科的相对丰度虽略有提高,但并未对挥发性脂肪酸含量产生显著影响。饲粮中添加0.1%复合益生菌显著提高了盲肠和结肠内容物丁酸含量,提高了总挥发性脂肪酸含量,与Wang等[12]在断奶仔猪每千克饲粮中添加6×109 CFU丁酸梭菌和1×1010 CFU粪肠球菌显著增加仔猪结肠中挥发性脂肪酸含量的结果相似。这可能与本试验中使用的是含丁酸梭菌的复合益生菌有关,丁酸梭菌在畜禽肠道内能够产生乙酸、丁酸及乳酸等小分子代谢物[30-31],并且添加复合益生菌后,断奶仔猪盲肠和结肠中毛螺菌科的相对丰度大幅度提高,促进了肠道中碳水化合物的代谢。甘露寡糖和复合益生菌的合用也表现出与添加益生菌相似的效果。
4 结论① 饲粮中添加0.1%甘露寡糖改善了断奶仔猪平均日采食量及后肠菌群结构;饲粮中添加0.1%复合益生菌对后肠挥发性脂肪酸特别是丁酸含量的提高有正面影响。
② 饲粮中同时添加0.1%甘露寡糖和0.1%复合益生菌对提高断奶仔猪平均日采食量、降低腹泻率、提高后肠挥发性脂肪酸含量、改善后肠菌群结构均有正面影响。
| [1] |
WIJTTEN P J A, VAN DER MEULEN J, VERSTEGEN M W A. Intestinal barrier function and absorption in pigs after weaning:a review[J]. British Journal of Nutrition, 2011, 105(7): 967-981. |
| [2] |
伍淳操, 王建华. 乳酸菌和甘露寡糖对断奶仔猪生长及血清生化指标的影响[J]. 江苏农业学报, 2011, 27(1): 94-99. |
| [3] |
萨仁娜, 张琪, 谷春涛, 等. 微生物饲料添加剂对肉仔鸡大肠杆菌抑制及血液生化指标的影响[J]. 饲料研究, 2006(3): 4-8. |
| [4] |
PATEL S, GOYAL A. Functional oligosaccharides:production, properties and applications[J]. World Journal of Microbiology and Biotechnology, 2011, 27(5): 1119-1128. |
| [5] |
SONG S K, BECK B R, KIM D, et al. Prebiotics as immunostimulants in aquaculture:a review[J]. Fish & Shellfish Immunology, 2014, 40(1): 40-48. |
| [6] |
SAEED M, AHMAD F, ARAIN M A, et al. Use of mannan-oligosaccharides (MOS) as a feed additive in poultry nutrition[J]. Journal of World's Poultry Research, 2017, 7(3): 94-103. |
| [7] |
ZHAO P Y, JUNG J H, KIM I H. Effect of mannan oligosaccharides and fructan on growth performance, nutrient digestibility, blood profile, and diarrhea score in weanling pigs[J]. Journal of Animal Science, 2012, 90(3): 833-839. |
| [8] |
邵莲花, 刘桂林. 甘露寡糖在猪饲料中的应用[J]. 山西农业, 2005(7): 47-48. |
| [9] |
GAGGÌA F, MATTARELLI P, BIAVATI B. Probiotics and prebiotics in animal feeding for safe food production[J]. International Journal of Food Microbiology, 2010, 141(Suppl.1): S15-S28. |
| [10] |
HU S L, WANG L, JIANG Z Y. Dietary Additive probiotics modulation of the intestinal microbiota[J]. Protein & Peptide Letters, 2017, 24(5): 382-387. |
| [11] |
SANDERS M E, VELD J H I. Bringing a probiotic-containing functional food to the market:microbiological, product, regulatory and labeling issues[J]. Antonie Van Leeuwenhoek, 1999, 76(1/2/3/4): 293-315. |
| [12] |
WANG K L, CAO G T, ZHANG H R, et al. Effects of Clostridium butyricum and Enterococcus faecalis on growth performance, immune function, intestinal morphology, volatile fatty acids, and intestinal flora in a piglet model[J]. Food & Function, 2019, 10(12): 7844-7854. DOI:10.1039/C9FO01650C |
| [13] |
ROLFE R D. The role of probiotic cultures in the control of gastrointestinal health[J]. Journal of Nutrition, 2000, 130(Suppl.): 396S-402S. |
| [14] |
黄俊文, 冯定远, 林映才.DGGE法研究甘露寡糖、益生菌与抗生素对仔猪肠道微生态的影响[C]//中国畜牧兽医学会动物营养学分会——第九届学术研讨会论文集.中国畜牧兽医学会动物营养学分会: 中国畜牧兽医学会动物营养分会, 2004: 110.
|
| [15] |
VENTE-SPREEUWENBERG M A M, BEYNEN A C.Diet-mediated modulation of small Intestinal integrity in weaned piglets[C]//PLUSKE J R, LE DIVIDICH J, VERSTEGEN M W A.Weaning the pig-concepts and consequences.The Netherlands: Wageningen Academic Publishers, 2003: 145-198.
|
| [16] |
JAHANIAN R, ASHNAGAR M. Effect of dietary supplementation of mannan-oligosaccharides on performance, blood metabolites, ileal nutrient digestibility, and gut microflora in Escherichia coli-challenged laying hens[J]. Poultry Science, 2015, 94(9): 2165-2172. |
| [17] |
FLICKINGER E A, WOLF B W, GARLEB K A, et al. Glucose-based oligosaccharides exhibit different in vitro fermentation patterns and affect in vivo apparent nutrient digestibility and microbial populations in dogs[J]. The Journal of Nutrition, 2000, 130(5): 1267-1273. DOI:10.1038/sj.ijo.0801233 |
| [18] |
LU X H, ZHANG M, ZHAO L, et al. Growth performance and post-weaning diarrhea in piglets fed a diet supplemented with probiotic complexes[J]. J Microbiol Biotechnol, 2018, 28(11): 1791-1799. |
| [19] |
PLUSKE J R, HAMPSON D J, WILLIAMS I H. Factors influencing the structure and function of the small intestine in the weaned pig:a review[J]. Livestock Production Science, 1997, 51(1/2/3): 215-236. DOI:10.1016/S0301-6226(97)00057-2 |
| [20] |
李玉欣, 张立梅, 韩丹丹, 等. 毕赤酵母甘露寡糖对断奶仔猪生产性能肠道绒毛和细胞因子的影响[J]. 中国兽医杂志, 2015, 51(11): 33-35. |
| [21] |
王莹. 甘露寡糖在仔猪体内的生理功能及其应用[J]. 广东畜牧兽医科技, 2006, 31(5): 25-27. |
| [22] |
XU Y Q, SHI B L, YAN S M, et al. Effects of chitosan on body weight gain, growth hormone and intestinal morphology in weaned pigs[J]. Asian-Australasian Journal of Animal Sciences, 2013, 26(10): 1484-1489. |
| [23] |
IGE B A. Probiotics use in intensive fish farming[J]. African Journal of Microbiology Research, 2013, 7(22): 2701-2711. |
| [24] |
姬玉娇, 祝倩, 耿梅梅, 等. 高、低营养水平饲粮对环江香猪结肠菌群结构及代谢物的影响[J]. 微生物学通报, 2016, 43(7): 1650-1659. |
| [25] |
SHIN N R, WHON T W, BAE J. Proteobacteria:microbial signature of dysbiosis in gut microbiota[J]. Trends in Biotechnology, 2015, 33(9): 496-503. |
| [26] |
廖波, 王薇薇, 王永伟, 等. 饲用乳酸菌在畜禽养殖上的应用研究进展[J]. 中国饲料, 2019(19): 13-18. |
| [27] |
苏勇, 姚文, 黄瑞华, 等. 芽孢乳杆菌S1对断奶前后仔猪肠道乳酸菌、大肠杆菌和挥发性脂肪酸含量变化的影响[J]. 福建农林大学学报(自然科学版), 2006, 35(1): 73-76. |
| [28] |
HÖGBERG A, LINDBERG J E. The effect of level and type of cereal non-starch polysaccharides on the performance, nutrient utilization and gut environment of pigs around weaning[J]. Animal Feed Science and Technology, 2006, 127(3/4): 200-219. |
| [29] |
贺琴.酵母壁多糖对断奶仔猪生长性能、肠道微生物和机体免疫的影响[D].硕士学位论文.南昌: 江西农业大学, 2017: 19-21.
|
| [30] |
KANAUCHI O, MITSUYAMA K, ARAKI Y, et al. Modification of intestinal flora in the treatment of inflammatory bowel disease[J]. Current Pharmaceutical Design, 2003, 9(4): 333-346. |
| [31] |
PECK M W. Biology and genomic analysis of Clostridium botulinum[J]. Advances in Microbial Physiology, 2009, 55: 183-265, 320. |




