2. 山东农业大学动物科技学院, 泰安 271018
2. College of Animal Science and Technology, Shandong Agricultural University, Tai'an 271018, China
众所周知,养好奶牛重在养好瘤胃,发育良好的瘤胃是奶牛高产的基础。犊牛是瘤胃生长发育的重要时期,犊牛瘤胃随着饲粮的摄入和外界环境微生物的进入,瘤胃内会形成相对稳定的微生物区系,如细菌、真菌、原虫等,它们可分解饲粮中淀粉、蛋白质、糖类等营养物质[1]。瘤胃中大量厌氧微生物可降解发酵饲料生成挥发性脂肪酸和氨态氮,为反刍动物供应能量和蛋白质,促进机体发育[2]。Shanks等[3]研究发现,犊牛瘤胃内有很多蛋白质水解菌和乳酸杆菌,通过采食饲粮,犊牛瘤胃内微生物种类和数量会逐步接近成年牛。另有研究发现,瘤胃菌群受年龄和饲粮的影响[4-5]。新生犊牛消化道基本处于微生物空白状态,在此期间添加益生菌会从起点帮助消化系统建立优势微生态区系,健康的瘤胃微生物又会进一步促进瘤胃的发育。
研究发现,微生态制剂对动物的生长发育及消化代谢作用在幼龄阶段效果较为显著,它可以调节瘤胃pH和促进犊牛瘤胃发育。益生菌进入动物体胃肠道中可以产生过氧化氢、乙酸和丙酸,使胃肠道内pH降低,挥发性脂肪酸产量增加,从而提高瘤胃功能[6]。符运勤等[7]研究发现,给1~8周龄犊牛添加地衣芽孢杆菌在不同程度上提高了犊牛的体躯指数、平均日采食量和平均日增重,同时应用聚合酶链反应-变性梯度凝胶电泳(PCR-DGGE)技术对其瘤胃液进行分析表明,添加益生菌组犊牛瘤胃微生物的多样性显著提高,改善了瘤胃微生物区系。张海涛[8]研究表明,断奶后犊牛饲喂纳豆枯草芽孢杆菌可提高犊牛的体增重和饲料利用率,可显著增加犊牛瘤胃表皮微生物数量和种类,提高瘤胃微生物多样性。Kawakami等[9]研究发现,饲喂含乳酸菌和酵母菌的代乳粉能显著增加黑白花奶牛的平均日增重、饲料转化率,减少粪便评分,促进生长和腹泻。董晓丽[10]在哺乳期犊牛代乳品中添加益生菌可增加平均日增重,有改善犊牛生长性能的趋势;在断奶犊牛饲粮中添加益生菌,能够改善断奶前期犊牛的饲料转化率,并影响断奶后犊牛的瘤胃微生物区系。瘤胃微生物中细菌种类多而复杂,与营养物质的消化代谢紧密相关[5],因此,分析瘤胃菌群结构和多样性变化对研究不同因素的作用机理有重要意义。前人的研究主要集中于微生态制剂对犊牛生长性能及瘤胃菌群的影响,而本研究将低聚果糖和微生态制剂组合饲喂哺乳期犊牛,监测对其生长性能的影响,并利用高通量测序技术研究对其瘤胃内容物细菌菌群的丰度和多样性及结构的影响,探索低聚果糖和微生态制剂组合对生长性能和瘤胃菌群的影响是否优于单独使用微生态制剂,为拓宽微生态制剂在哺乳期犊牛的应用提供数据支撑。
1 材料与方法 1.1 试验材料植物乳杆菌,活菌数≥1×109 CFU/g;枯草芽孢杆菌,活菌数≥2×1010 CFU/g;低聚果糖,纯度≥95%。
1.2 试验设计试验于2019年3月18日至2019年5月15日在青岛某规模化牧场进行。选取健康荷斯坦母犊牛21头,按照胎次[(1.9±0.8)胎]、体重[(40.5±0.9) kg]、日龄[(5.0±1.2)日龄]相近原则,随机分成3组,每组7头,单栏饲养。C组为空白对照组,犊牛饲喂基础饲粮;ZK组为植物乳酸杆菌+枯草芽孢杆菌组,每日每头犊牛饲喂5 g植物乳杆菌+5 g枯草芽孢杆菌;ZKT组为植物乳杆菌+枯草芽孢杆菌+低聚果糖组,每日每头犊牛饲喂5 g植物乳杆菌+5 g枯草芽孢杆菌+5 g低聚果糖;ZK组和ZKT组均在常规饲喂基础饲粮1 h后将相应的复合微生态制剂溶解在温水中,用奶瓶灌入。预试期7 d,正试期50 d。
1.3 试验饲粮和饲养管理试验犊牛饲喂于犊牛岛,恒温酸化奶每日饲喂3次(05:00、13:00、19:30),饲喂量随着日龄变化,7~14日龄犊牛每次2.6 L,14~30日龄犊牛每次3.2 L,30~45日龄犊牛每次3.8 L,46~60日龄犊牛每次2.0 L。犊牛自由采食基础饲粮,其组成及营养水平见表 1,自由饮水,试验期间不使用任何抗生素。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
所有试验牛于7 d预试期后空腹测定初始体重,正试期50 d后测定终末体重,计算每头牛平均日增重。每天饲粮添加量减去每天剩余量即为日采食量,计算平均日采食量。
1.5 瘤胃液的采集与处理正试期50 d后,于晨饲后2 h,每组随机采集4头牛瘤胃液。使用自制的瘤胃导管通过口腔采集犊牛瘤胃液,采集时前面约20 mL弃掉,继续采集约50 mL置于离心管内,4层纱布过滤并分装至10 mL离心管中,冰块封住迅速转入-80 ℃冰箱保存,以备送检。
1.6 样本测序 1.6.1 样品DNA提取和PCR扩增十六烷基三甲基溴化铵(CTAB)法提取瘤胃液DNA,然后琼脂糖凝胶电泳检测DNA浓度与纯度。取50 ng DNA于200 μL Eppendorf管内,用灭菌纯净水稀释样品至1 ng/μL。用带条形码(barcode)的特异引物,以稀释后的DNA为模板,根据测序区域的选择,进行PCR扩增。引物对应区域:16S V4区引物(515F和806R)。为确保扩增效率和准确性,使用New England Biolabs公司Phusion High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶。
1.6.2 PCR产物的混样和纯化用2%琼脂糖凝胶进行PCR产物检测;依据PCR产物浓度进行等量混样,充分混匀后使用1×TAE浓度2%的琼脂糖胶电泳将PCR产物纯化,剪切并回收目的条带。使用Thermo Scientific公司Gene JET胶回收试剂盒回收纯化产物。
1.6.3 样品测序将样品送至北京诺禾致源生物信息科技有限公司采用illumina Miseq平台进行测序。
1.7 统计分析试验数据用Excel 2010进行整理,然后用SAS 9.1.3统计软件的ANOVA过程进行单因素方差分析,差异显著用Duncan氏多重比较法检验,P < 0.05作为差异显著的标准。试验结果用平均值和均方根误差(R-MSE)表示。
2 结果与分析 2.1 复合微生态制剂对哺乳期犊牛生长性能的影响如表 2所示,ZK组和ZKT组的平均日增重和平均日采食量高于C组,但差异不显著(P>0.05)。
|
|
表 2 复合微生态制剂对哺乳期犊牛生长性能的影响 Table 2 Effects of compound microecologics on growth performance of suckling calves |
Alpha多样性分析是对单个样本的物种多样性的分析。本研究主要在操作分类单元(OTU)稀释曲线、韦恩(Venn)图和Alpha多样性分析指数3个层面进行展示。
通过对Reads剪切过滤,平均每样品测得80 030条Reads,经过质控平均得到75 052条有效数据,质控有效率达93.87%。由图 1可知,稀释曲线随着测序深度的不断增加逐渐上升,并趋于平缓,说明测序深度较为合理。以97%的一致性将序列聚类成为OTU,3个组共得到663个OTU,3组共有291个OTU,3组之间差异OTU中C组有40个,ZKT组有37个,ZK组有132个(图 2),说明3组物种多样性有差异。
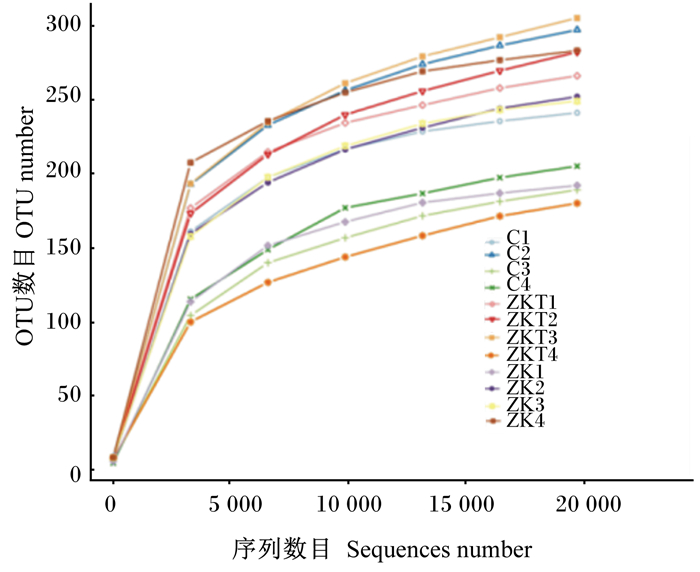
|
C1、C2、C3、C4分别为空白对照组的4个样品;ZK1、ZK2、ZK3、ZK4分别为植物乳酸杆菌+枯草芽孢杆菌组的4个样品;ZKT1、ZKT2、ZKT3和ZKT4分别为植物乳酸杆菌+枯草芽孢杆菌+低聚果糖组的4个样品。下图同。 C1, C2, C3 and C4 were 4 samples of blank control group, respectively; ZK1, ZK2, ZK3 and ZK4 were 4 samples of Lactobacillus plantarum+Bacillus subtilis group, respectively; ZKT1, ZKT2, ZKT3 and ZKT4 were 4 samples of Lactobacillus plantarum+Bacillus subtilis+fructoses oligosaccharide group, respectively. The same as below. 图 1 OTU稀释曲线 Fig. 1 OTU dilution curve |
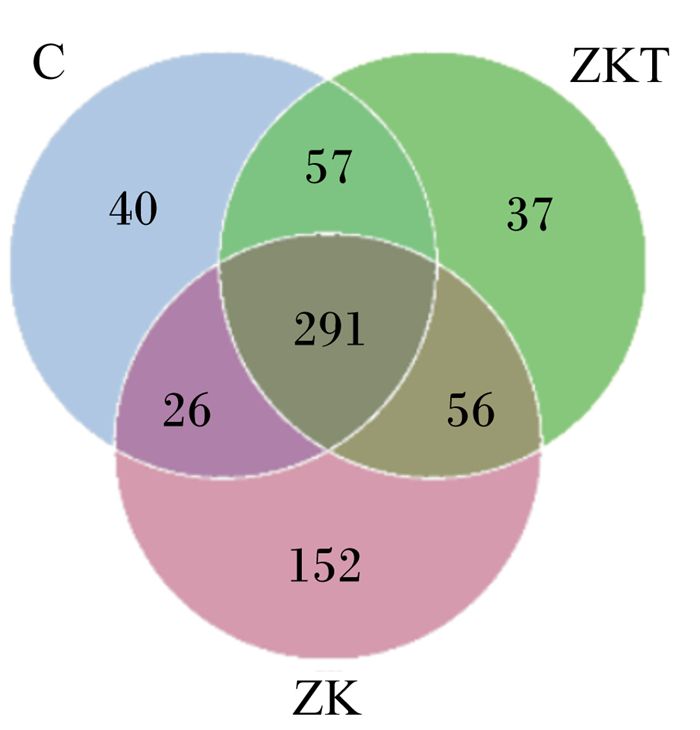
|
ZK:植物乳酸杆菌+枯草芽孢杆菌组Lactobacillus plantarum+Bacillus subtilis group;ZKT:植物乳杆菌+枯草芽孢杆菌+低聚果糖组Lactobacillus plantarum+Bacillus subtilis+fructoses oligosaccharide group;C:空白对照组blank control group。下图同The same as below。 图 2 韦恩图 Fig. 2 Venn diagram |
如表 3所示,Alpha多样性分析表明,各组之间可见物种数量、Chao1指数、ACE指数、Shannon指数及Simpson指数无显著差异(P>0.05),说明复合微生态制剂对断奶前犊牛瘤胃细菌菌群丰富度和多样性影响不显著;3组样品的覆盖率均在99%以上,表明样品中未被检测到的序列可能性较低。
|
|
表 3 复合微生态制剂对断奶前犊牛瘤胃内容物细菌菌群丰富度和多样性的影响 Table 3 Effects of compound microecologics on bacterial colony richness and diversity in rumen contents of calves before weaning |
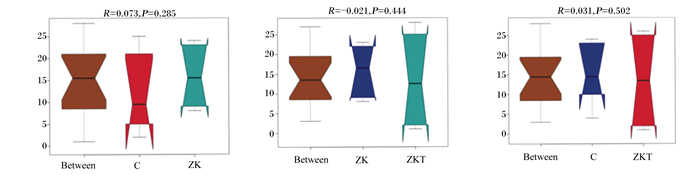
Beta多样性分析是用来比较样品在组间物种多样性方面存在的差异大小。样本距离越接近,表示物种组成结构越相似,群落结构相似度高的样本倾向于聚集在一起,群落差异大的样本则会远远分开。由图 3可以看出,本研究基于非加权距离主成分分析(PCoA),主成分2(PC2)贡献率为17.2%,主成分1(PC1)贡献率为31.67%,ZKT组聚类最好,C组与ZK组相对分散,说明组间群落结构差异较大。由图 4可以看出,以非加权距离矩阵做UPGMA聚类分析,并将聚类结果与各样本在门水平上的物种相对丰度整合展示,聚类树不能将C组有效区分,ZK组聚类较好,ZKT组聚类最好,说明复合微生态制剂的添加影响瘤胃内容物细菌菌落组成。由图 5可以看出,Anosim分析表明本试验ZK组、ZKT组与C组差异显著(R=0.073、R=0.031),而ZK组与ZKT组差异不显著(R=-0.021),说明分组有意义。
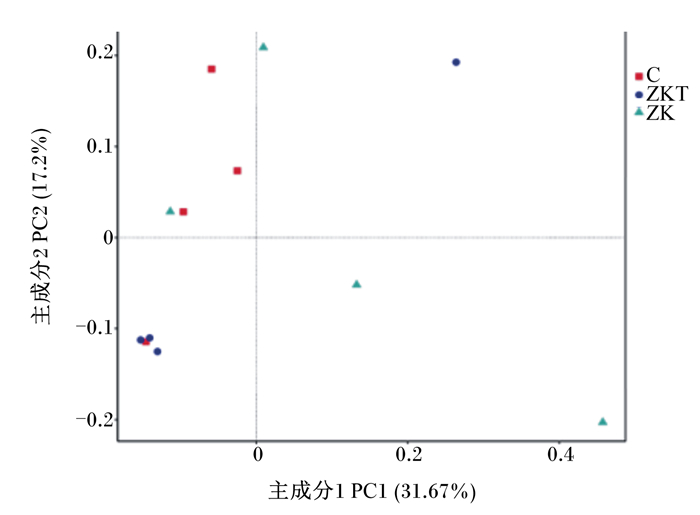
|
图 3 基于非加权距离PCoA Fig. 3 PCoA based on unweighted unifrac distance |
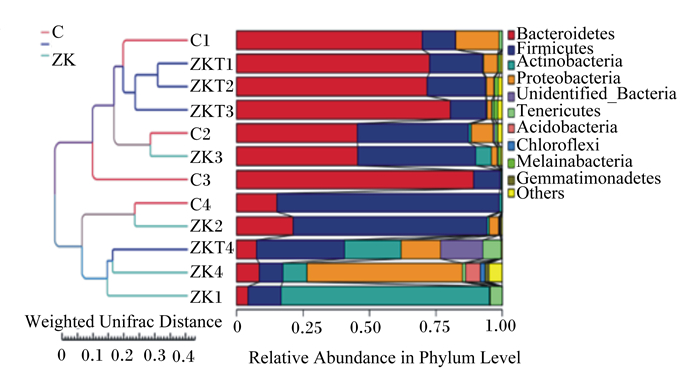
|
Unweighted Unifrac Distance:非加权距离;Relative Abundance in Phylum Level:门水平相对丰度;Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Actinobacteria:放线菌门;Proteobacteria:变形菌门;Unidentified_Bacteria:未鉴定菌门;Tenericutes:无壁菌门;Acidobacteria:酸杆菌门;Chloroflexi:绿弯菌门;Melainabacteria:黑水仙菌菌门;Gemmatimonadetes:芽单胞菌门;Others:其他。 图 4 UPGMA聚类树 Fig. 4 UPGMA cluster tree |
|
纵坐标:样本间距离的秩;横坐标:Between为2组之间的结果,其他2个为各自组内的结果。1>R>0表示组间差异显著;-1<R<0说明组间差异不显著。 Ordinate: the rank of the distance between samples; abscissa: Between was the result between two groups, and the other two are the results within each group. 1 > R > 0 mean significant difference between groups; -1 < R < 0 mean no significant difference between groups. 图 5 组间差异Anosim分析 Fig. 5 Anosim analysis between groups |
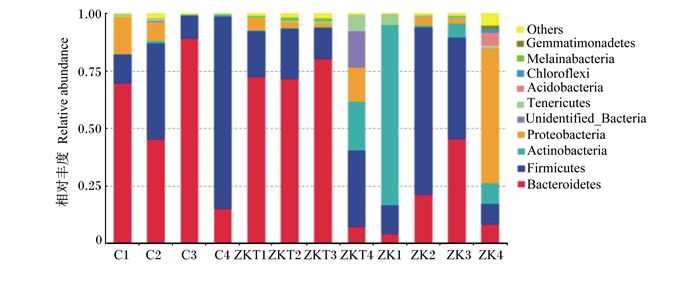
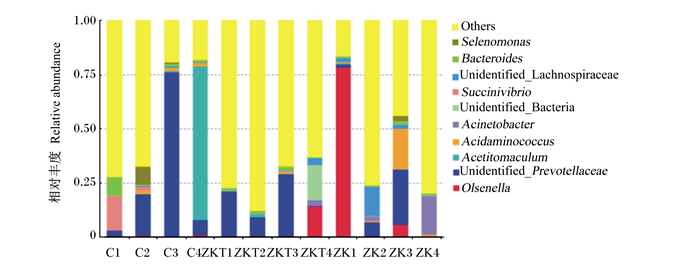
通过与数据库Silva132比对,进行物种注释,本研究共获得2个界、28个门、39个纲、64个目、105个科、187个属、110个种。犊牛瘤胃内容物中优势菌门为拟杆菌门、厚壁菌门、放线菌门、变形菌门等(图 6)。C组拟杆菌门和厚壁菌门相对丰度占91%以上,ZKT组占80%,而ZK组仅占54%;ZK组放线菌门相对丰度高于C组23%,高于ZKT组18%;ZKT组黑水仙菌菌门相对丰度高于C组和ZKT组。犊牛瘤胃液中优势菌属为欧陆森氏菌属、未鉴定普雷沃氏菌科、醋香肠菌属和氨基酸微球菌属等(图 7)。
|
Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Actinobacteria:放线菌门;Proteobacteria:变形菌门;Unidentified_Bacteria:未鉴定菌门;Tenericutes:无壁菌门;Acidobacteria:酸杆菌门;Chloroflexi:绿弯菌门;Melainabacteria:黑水仙菌菌门;Gemmatimonadetes:芽单胞菌门;Others:其他。图 8同The same as Fig. 8。 图 6 不同组的微生物结构(门水平) Fig. 6 Microbial structure in different groups (phylum level) |
|
Olsenella:欧陆森氏菌属;Unidentified_Prevotellaceae:未鉴定普雷沃氏菌科;Acetitomaculum:聚乙酸菌属;Acidaminococcus:氨基酸微球菌属;Acinetobacter:不动杆菌属;Unidentified_Bacteria未鉴定细菌;Succinivibrio:琥珀酸菌属;Unidentified_Lachnospiraceae:未鉴定毛螺菌科;Bacteroides:拟杆菌属;Selenomonas:月形单胞菌属。图 8同The same as Fig. 8。 图 7 不同组的微生物结构(属水平) Fig. 7 Microbial structure in different groups (genus level) |
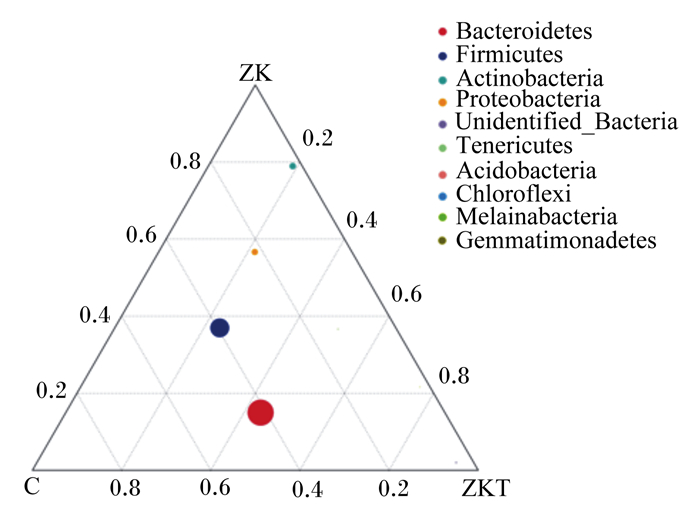
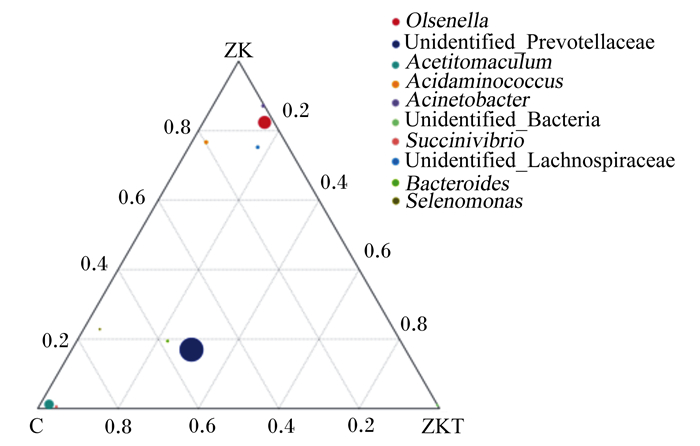
为了寻找3组样本之间优势物种的差异,选取3组样本在各分类水平上平均丰度排名前10的物种,生成三元相图(ternaryplot),以展示3组样本在不同分类水平上优势物种的差异(图 8、图 9)。ZKT组和C组拟杆菌门有优势,ZK组和C组厚壁菌门有优势,而ZK组放线菌门有优势;C组未鉴定普雷沃氏菌科有优势,ZK组欧陆森氏菌属有优势。
|
图 8 3组样本之间优势物种的差异(门水平) Fig. 8 Differences of dominant species among three groups of samples (phylum level) |
|
图 9 3组样本之间优势物种的差异(属水平) Fig. 9 Differences of dominant species among three groups of samples (genus level) |
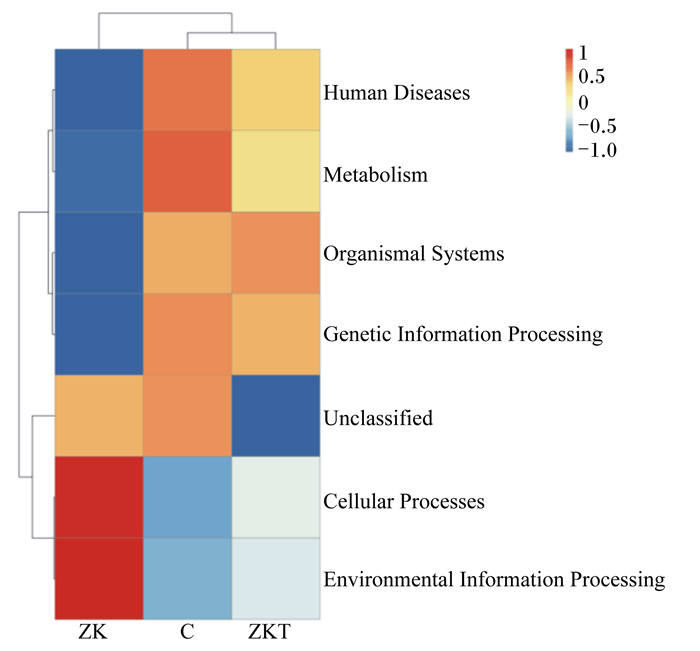
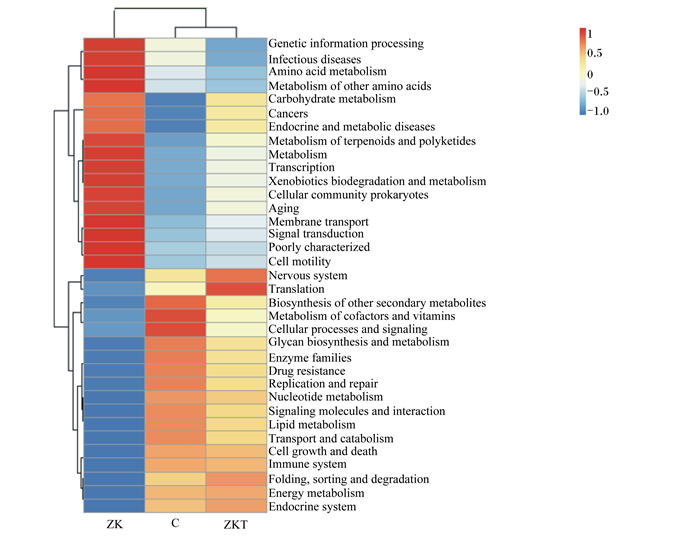
本试验共获得7类生物代谢通路功能分析一级功能层(图 10):人类疾病、新陈代谢、遗传信息处理、生物体系统、未鉴定功能、细胞过程和环境信息处理。ZK组的基因表达丰度在细胞过程、环境信息处理和未鉴定功能3个一级功能层较C组增高,C组在人类疾病、遗传信息处理、新陈代谢方面功能较高,而在细胞过程、环境信息处理2个一级功能层较ZK组低,ZKT组功能预测介于其他2组之间。进一步对预测基因二级功能层进行分析,发现其由遗传信息处理、感染性疾病、氨基酸代谢等35个子功能组成(图 11),对其基因表达丰度进行分析,发现ZK组在遗传信息处理、感染性疾病、氨基酸代谢、其他氨基酸代谢、碳水化合物代谢5个子功能比ZKT组、C组升高,ZKT组在神经系统疾病和转录子功能上较高。
|
Human Diseases:人类疾病;Metabolism:新陈代谢;Organismal Systems:有机系统;Genetic Information Processing:遗传信息处理;Unclassified:未分类;Cellular Processes:细胞代谢;Environmental Information Processing:环境信息处理。 图 10 Tax4Fun功能注释聚类热图(一级功能层) Fig. 10 Tax4Fun functional annotation cluster heat map (level 1 functional layer) |
|
Genetic information processing:遗传信息处理;Infectious diseases:感染性疾病;Amino acid metabolism:氨基酸代谢;Metabolism of other amino acids:其他氨基酸代谢;Carbohydrate metabolism:碳水化合物代谢;Cancers:癌症;Endocrine and metabolic diseases:内分泌和代谢疾病;Metabolism of terpenoids and polyketides:萜类化合物代谢;Metabolism:新陈代谢;Transcription:转录;Xenobiotics biodegradation and metabolism:异源物质的生物降解和代谢;Cellular community prokaryotes:原核生物翻译;Aging:凋亡;Membrane transport:细胞膜转运;Transduction:转导;Cell motility:细胞移动;Nervous system:神经系统;Translation:翻译;Biosynthesis of other secondary metabolites:次生产物代谢的生物合成;Metabolism of cofactors and vitamins维生素和酶代谢:Cellular processes and signaling;细胞信号传递与流程:Glycan biosynthesis and metabolism多糖合成与代谢;Enzyme families:酶家族;Drug resistance:耐药;Replication and repair:复制与修补;Nucleotide metabolism:核苷酸代谢;Signaling molecules and interaction:信号分子互作;Lipid metabolism:类脂代谢;Transport and catabolism:转运和分解;Cell growth and death:细胞生长和死亡;Immune system:免疫系统;Folding, sorting and degradation:折叠排序与降级;Energy metabolism:能量代谢;Endocrine system:内分泌系统。 图 11 Tax4Fun功能注释聚类热图(二级功能层) Fig. 11 Tax4Fun functional annotation cluster heat map (level 2 functional layer) |
在我国,犊牛从出生至断奶需要45~60 d时间,这段时间内,犊牛通过初乳及与自然环境的接触,瘤胃与肠道能及时获得益生菌的定植,使消化道正常发育。对早期瘤胃微生物的调控可在一定程度上减少犊牛多发的腹泻甚至死亡等问题[11]。瘤胃微生物最易受饲粮成分变化的影响,微生物的定殖与瘤胃发育相互促进。Bayatkouhsar等[12]给初生犊牛饲喂乳酸杆菌后,犊牛的平均日采食量和平均日增重都有增加趋势;Riddell等[13]研究也表明,饲喂益生菌的犊牛平均日增重、饲料转化率、平均日采食量均高于未饲喂益生菌的犊牛。而聂炼[14]研究表明,给3~4月龄断奶西门塔尔牛饲粮中添加不同益生菌对犊牛平均日增重、平均日采食量、料重比没有影响。本研究中,复合微生态制剂的添加对生长性能影响也不显著,ZK组与ZKT组之间差异也不显著。这与前人研究给断奶前后犊牛添加益生元可以一定程度上改善犊牛生长性能的结果[15-16]一致。不同试验结果的差异可能与添加益生菌的种类、数量、配比、添加方式以及牛场不同的管理水平有关。
3.2 复合微生态制剂对断奶前犊牛瘤胃内容物细菌菌群的影响 3.2.1 复合微生态制剂对断奶前犊牛瘤胃内容物细菌菌群丰富度和多样性的影响60日龄左右的犊牛已经通过母体、初乳、饲料、环境等多方面接触到了大量细菌,从而形成了瘤胃细菌的多样性。李文茜[17]给50日龄荷斯坦公犊牛添加丁酸梭菌能够促进犊牛及育成牛的生长发育,改善机体抗氧化、免疫功能,调控瘤胃微生态系统。而本试验中复合微生态制剂的添加未能显著改变瘤胃细菌菌群的丰富度和多样性。研究发现,给3~4月龄断奶西门塔尔牛饲粮中添加不同益生菌对粪便和瘤胃微生物组成影响不显著,但可以显著提高犊牛免疫[14],这与本试验结果一致。
以非加权距离矩阵做UPGMA聚类分析,聚类树不能将C组有效区分,ZK组聚类较好,ZKT组聚类最好。这与董晓丽[10]应用PCR-DGGE的分析表明饲喂相同益生菌的犊牛瘤胃微生物区系相似性很高、聚类分析能够聚合在一起的结果相吻合,这也说明添加微生态制剂可起到影响瘤胃微生物区系的作用。
3.2.2 复合微生态制剂对断奶前犊牛瘤胃内容物细菌菌群结构的影响使用益生菌(以乳酸菌和双歧杆菌为主)不仅能直接调节瘤胃发酵参数,而且有助于其他有益菌的生长[15]。早期瘤胃微生物是在各方面的影响下发育的,也正是这些影响,才使早期瘤胃微生物区系最终发育成对饲粮及环境适应、对宿主有利而且较为稳定的状态。Rey等[4]研究发现,拟杆菌门在犊牛3日龄成为占比最高的菌门,在83日龄前最高时甚至占到62.1%。本研究中,犊牛瘤胃中主要细菌及相对丰富度为厚壁菌门36.96%、拟杆菌门54.93%、变形菌门6.22%。而在成年反刍动物瘤胃中主要细菌及相对丰富度为厚壁菌门56%、拟杆菌门31%、变形菌门4%[18-19]。拟杆菌门的主要作用是对非纤维物质的降解,厚壁菌门则主要是对纤维类物质的降解[20],随着犊牛的成长,饲粮由牛奶和精料补充料逐步转变为全混合日粮,随之瘤胃内拟杆菌门逐渐减少而厚壁菌门逐渐增多,这正是瘤胃通过调整微生物区系来适应饲粮的表现。
本研究发现,ZKT组黑水仙菌菌门相对丰度高于C组和ZK组。黑水仙菌菌门属于一种蓝藻细菌,蓝藻是地球上非常重要的一类微生物,可独立地获得有氧呼吸复合体。李晓斌等[21]在研究L-瓜氨酸对小鼠体重及肠道菌群多样性的影响中指出,L-瓜氨酸可提高肠道中黑水仙菌菌门相对丰度。黑水仙菌菌门是胃肠道有益菌,具体功能未查到相关资料,有待于进一步研究。本研究中黑水仙菌菌门相对丰度的增加估计和低聚果糖的添加有关。植物乳酸菌、枯草芽孢杆菌、低聚果糖混合饲喂犊牛后,乳酸菌在胃肠道内定植有利于充分消化利用犊牛食入的牛奶,且可分解乳糖产生大量细菌素、乳酸等物质,有效抑制沙门氏菌和金黄色葡萄球菌等致病菌,为犊牛的健康生长提供有力保障;枯草芽孢杆菌在增殖中可产生枯草菌素、短杆菌肽等活性物质,这些活性物质对致病菌或内源性感染的条件致病菌有明显的抑制作用;低聚果糖可选择性地被植物乳酸杆菌利用,进而产生维生素和有益有机酸等,可抑制有害菌如大肠杆菌、梭菌等的增殖,减少肠道内腐败性代谢产物生成;枯草芽孢杆菌的快速增殖可迅速消耗环境中的游离氧,造成胃肠道低氧,促进有益厌氧菌如植物乳酸菌的生长,并产生乳酸等有机酸类,降低胃肠道pH,间接抑制其他致病菌生长,从而在三者的协同作用下改变了ZKT组犊牛的微生态区系。
3.3 复合微生态制剂对Tax4Fun功能预测的影响益生菌能够刺激瘤胃中蛋白质分解菌产生硫化物分解酶、氨基转化酶,降低肠道中吲哚和胺等有害物质,使寄生在粪便中的益生菌活菌继续发酵,减少粪便对环境的污染。功能预测显示,ZK组在细胞过程、环境信息处理和未鉴定功能3个一级功能层基因表达丰度增加,人类疾病、新陈代谢、遗传信息处理、生物体系统基因表达丰度降低,说明通过调节瘤胃微生物区系可改善瘤胃对饲料的利用效率和降低代谢副产物的排放,从而减少养殖对环境的污染,提高反刍动物养殖整体经济效益。进一步对预测基因二级功能层进行分析发现,ZK组在遗传信息处理、感染性疾病、氨基酸代谢、其他氨基酸代谢、碳水化合物代谢5个子功能预测基因表达丰度升高。ZK组的氨基酸微球菌属相对丰度占5.156%,ZKT组占0.240%,而C组仅占0.133%。氨基酸微球菌属参与发酵代谢,是氨基酸特别是谷氨酸的主要能源,可固定碳氧化物且可进行发酵反应。这与ZK组氨基酸代谢基因表达丰度增高相一致。最近有研究通过高通量测序技术对同父异母的犊牛瘤胃微生物测序得出,瘤胃微生物在亲子代之间可能具有传递性[22]。这一结果证明早期瘤胃微生物除了与母体接触及初乳摄取获得外,还有可能在胎儿时期就直接从母体内获得。ZK组在遗传信息处理功能上基因表达丰度增加,是否可通过添加益生菌来有助于遗传选育有待于研究。
4 结论复合微生态制剂对哺乳期犊牛生长性能及瘤胃细菌菌群丰富度和多样性均无显著影响;而ZKT组哺乳期犊牛断奶前的瘤胃微生态区系明显改变,ZK组在Tax4Fun功能预测上要好于ZKT组。
| [1] |
WELKIE D G, STEVENSO D M, WEIMER P J. PARISA analysis of ruminal bacterial community dynamics in lactating dairy cows during the feeding cycle[J]. Anaerobe, 2010, 16(2): 94-100. DOI:10.1016/j.anaerobe.2009.07.002 |
| [2] |
JAMI E, ISRAEL A, KOTSER A, et al. Exploring the bovine rumen bacterial community from birth to adulthood[J]. The ISME Journal, 2013, 7(6): 1069-1079. DOI:10.1038/ismej.2013.2 |
| [3] |
SHANKS O C, KELTY A, ARCHIBEQUE S, et al. Community structures of fecal bacteria in cattle from different animal feeding operations[J]. Applied and Environmental Microbiology, 2011, 77(9): 2992-3001. DOI:10.1128/AEM.02988-10 |
| [4] |
REY M, ENJALBERT F, COMBES S, et al. Establishment of ruminal bacterial community in dairy calves from birth to weaning is sequential[J]. Journal of Applied Microbiology, 2014, 116(2): 245-257. DOI:10.1111/jam.12405 |
| [5] |
MULLINS C R, MAMEDOVA L K, CARPENTER A J, et al. Analysis of rumen microbial populations in lactating dairy cattle fed diets varying in carbohydrate profiles and Saccharomyces cerevisiae fermentation product[J]. Journal of Dairy Science, 2013, 96(9): 5872-5881. DOI:10.3168/jds.2013-6775 |
| [6] |
ABD EL-TAWAB M M, YOUSSEF I M, BAKR H A, et al. Role of probiotics in nutrition and health of small ruminants[J]. Polish Journal of Veterinary Sciences, 2016, 19(4): 893-906. DOI:10.1515/pjvs-2016-0114 |
| [7] |
符运勤, 刁其玉, 屠焰, 等. 不同组合益生菌对0~8周龄犊牛生长性能及血清生化指标的影响[J]. 动物营养学报, 2012, 24(4): 753-761. |
| [8] |
张海涛.纳豆枯草芽孢杆菌对犊牛生长发育以及瘤胃组织形态学发育的影响[D].硕士学位论文.北京: 中国农业科学院, 2009. http://cdmd.cnki.com.cn/Article/CDMD-82101-2009152316.htm
|
| [9] |
KAWAKAMI S I, YAMADA T, NAKANISHI N, et al. Feeding of lactic acid bacteria and yeast affects fecal flora of holstein calves[J]. Journal of Animal and Veterinary Advances, 2012, 10(3): 269-271. |
| [10] |
董晓丽.益生菌的筛选鉴定及其对断奶仔猪、犊牛生长和消化道微生物的影响[D].博士学位论文.北京: 中国农业科学院, 2013. http://cdmd.cnki.com.cn/Article/CDMD-82101-1013357018.htm
|
| [11] |
FODITSCH C, VAN VLECK PEREIRAR, GANDA E K, et al. Oral administration of Faecalibacterium prausnitzii decreased the incidence of severe diarrhea and related mortality rate and increased weight gain in preweaned dairy heifers[J]. PLoS One, 2015, 10(12). |
| [12] |
BAYATKOUHSAR J, TAHMASEBI A M, NASERIAN A A, et al. Effects of supplementation of lactic acid bacteria on growth performance, blood metabolites and fecal coliform and lactobacilli of young dairy calves[J]. Animal Feed Science and Technology, 2013, 186(1/2): 1-11. |
| [13] |
RIDDELL J B, GALLEGOS A J, HARMON D L, et al. Addition of a Bacillus based probiotic to the diet of preruminant calves:infuence on growth, health, and blood parameters[J]. Journal of Applied Research in Veterinary Medicine, 2008(1): 78-85. |
| [14] |
聂炼.WB800N-CC31工程菌和屎肠球菌及其复合菌对犊牛生长性能及肠道菌群的影响[D].硕士学位论文.大庆: 黑龙江八一农垦大学, 2019. http://cdmd.cnki.com.cn/Article/CDMD-10223-1019107350.htm
|
| [15] |
UYENO Y, SHIGEMORI S, SHIMOSATO T. Effect of probiotics/prebiotics on cattle health and productivity[J]. Microbes and Environments, 2015, 30(2): 126-132. DOI:10.1264/jsme2.ME14176 |
| [16] |
KIDO K, TEJIMA S, NAGAYAMA H, et al. Effects of supplementation with cellooligosaccharides on growth performance of weaned calves on pasture[J]. Animal Science Journal, 2016, 87(5): 661-665. DOI:10.1111/asj.12469 |
| [17] |
李文茜.丁酸梭菌对犊牛及育成牛生长性能、血液指标和瘤胃发酵的影响[D].硕士学位论文.哈尔滨: 东北农业大学, 2019. http://cdmd.cnki.com.cn/Article/CDMD-10224-1019180161.htm
|
| [18] |
DIAS J, MARCONDES M I, DE SOUZA S M, et al. Bacterial community dynamics across the gastrointestinal tracts of dairy calves during preweaning development[J]. Applied and Environmental Microbiology, 2018, 84(9): e02675-17. DOI:10.1128/AEM.02675-17 |
| [19] |
CHAUCHEYRAS-DURAND F, OSSA F. Review:the rumen microbiome:composition, abundance, diversity, and new investigative tools[J]. Professional Animal Scientist, 2014, 30(1): 1-12. DOI:10.15232/S1080-7446(15)30076-0 |
| [20] |
WANG L Z, XU Q, KONG F L, et al. Exploring the goat rumen microbiome from seven days to two years[J]. PLoS One, 2016, 11(5): e0154354. DOI:10.1371/journal.pone.0154354 |
| [21] |
李晓斌, 赵国栋, 邱昊日, 等. L-瓜氨酸对小鼠体重及肠道菌群多样性的影响[J]. 动物营养学报, 2019, 31(9): 4235-4241. |
| [22] |
SASSON G, BEN-SHABAT S K, SEROUSSI E, et al. Heritable bovine rumen bacteria are phylogenetically related and correlated with the cow's capacity to harvest energy from its feed[J]. mBio, 2017, 8(4): e00703-17. DOI:10.1128/mBio.00703-17 |




