2. 舟山市水产研究所, 舟山 316000
2. Zhoushan Fisheries Research Institute, Zhoushan 316000, China
替代水产饲料中鱼粉的研究始于20世纪70年代中期[1],迄今仍然是水产动物营养和饲料研究的热点。随着饲料配方技术水平的提高,鱼类饲料中的鱼粉水平不断被降低[2],但利用植物性蛋白质原料完全替代肉食性鱼类饲料中的鱼粉仍是一个难题。通常情况下,通过添加植物性蛋白质原料将饲料鱼粉水平降低到一定程度后,鱼类生长速度随鱼粉替代水平增加而逐渐减慢。例如,通过添加豆粕将饲料鱼粉水平降低至21%导致花鲈(Lateolabrax japonicus)生长速度显著变慢[3];通过添加棉粕将饲料鱼粉水平降低至34%导致大菱鲆(Scophthalmus maximus)生长率降低[4]。一般认为,植物性蛋白质原料中蛋白质消化率低、氨基酸不平衡(缺乏部分必需氨基酸或功能性氨基酸)、存在抗营养因子等是限制其替代饲料鱼粉水平的重要因素[5],但涉及上述多种因素所产生的限制作用及其交互影响的定量分析尚未见报道。此外,植物性蛋白质原料中牛磺酸和硒的含量均低于鱼粉[6-7],因此,利用植物性蛋白质原料替代鱼粉往往导致饲料中牛磺酸和硒含量减少。牛磺酸是动物体内广泛分布的一种β-氨基酸,具有抗氧化及调节机体免疫、渗透压和神经活动等多种生理功能[8]。硒与半胱氨酸结合所形成的硒代半胱氨酸参与合成各种硒蛋白,包括与动物生长密切相关的硒蛋白W、碘甲腺原氨酸脱碘酶(iodothyronine deiodinase,Dio)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和硫氧蛋白还原酶(thioredoxin reductase,TR)等[9-12]。鉴于牛磺酸和硒的重要生理功能,推测牛磺酸和硒缺乏有可能是限制利用植物性蛋白质原料大量替代饲料鱼粉的重要因素。当利用大豆浓缩蛋白替代饲料鱼粉时,在饲料中适度添加牛磺酸可改善细点牙鲷(Dentex dentex)[13]、加利福尼亚湾石首鱼(Totoaba macdonaldi)[14]和虹鳟(Oncorhynchus mykiss)[15]的生长性能;当利用豆粕或发酵豆粕替代饲料鱼粉时,在饲料中适度添加硒可改善卵形鲳鲹(Trachinotus ovatus)[5]和尖吻鲈(Lates calcarifer)[16-17]的生长性能。
条纹锯鮨(Centropristis striata)俗称美洲黑石斑,原产于美洲,2002年被引进我国进行人工养殖,在山东、浙江等省沿海地区已形成一定的养殖规模。有关条纹锯鮨营养需求及其对不同饲料蛋白质源的利用能力方面已有一些研究报道。Alam等[18]指出,通过添加豆粕可将条纹锯鮨饲料鱼粉水平降低至16%;而Anderson等[19]指出利用脱酚棉籽蛋白粉可完全替代条纹锯鮨饲料中的鱼粉。此外,张清雯等[20]报道摄食含0.62~0.92 mg/kg硒的饲料可改善条纹锯鮨生长性能和机体的抗氧化能力。尽管有关条纹锯鮨饲料牛磺酸和硒的需求量尚未见报道,但根据对其他鱼类的研究结果,推测同时添加牛磺酸和硒可能有益于提高利用棉籽浓缩蛋白(cottonseed protein concentrate,CPC)替代条纹锯鮨饲料中鱼粉的水平。因此,本试验旨在研究添加牛磺酸和硒酵母对利用棉籽浓缩蛋白替代条纹锯鮨饲料鱼粉的影响,以期为完善条纹锯鮨饲料配方技术提供科学依据。
1 材料与方法 1.1 试验动物、饲料原料和试验饲料条纹锯鮨购自舟山市普陀区优辰水产养殖专业合作社,试验前用活水船运至舟山市水产研究所朱家尖试验基地,并暂养在一套室内流水养殖试验系统中。该养殖试验系统由36个直径68.5 cm、高73.0 cm、容积200 L的聚乙烯水槽组成,水源为经过沉淀、砂滤的海水。暂养期间,每天09:00和15:00投喂鱼粉水平为35%的试验饲料。
试验所用棉籽浓缩蛋白、牛磺酸、硒酵母均为公司产品。其他饲料原料,如鱼粉(产地新西兰)、鸡肉粉(产地美国)、豆粕、面粉和蛋白质混合物等购自浙江科盛饲料股份有限公司。主要饲料原料营养水平见表 1。
|
|
表 1 主要饲料原料营养水平(风干基础) Table 1 Nutrient levels of main feed ingredients (air-dry basis) |
对照(PC)饲料粗蛋白质水平为43%,粗脂肪水平为11%,鱼粉水平为35%。采用2×2试验设计,设2个饲料鱼粉替代水平(H:利用棉籽浓缩蛋白替代PC饲料中鱼粉的60%;L:利用棉籽浓缩蛋白替代PC饲料中鱼粉的80%)和2个牛磺酸与硒酵母的添加水平(ST:添加牛磺酸与硒酵母的混合物;N:不添加牛磺酸与硒酵母的混合物)。4个试验饲料分别简写为HST、LST、HN和LN饲料。牛磺酸和硒酵母的混合物中含825 g/kg的牛磺酸和280 mg/kg的硒。所有试验饲料粗蛋白质和粗脂肪水平相同,分别为43%和11%。
将饲料原料粉碎并过80目筛。根据饲料配方逐一称重各种原料,依次用手搅拌混合均匀,最后加入鱼油并用手搓匀。将手工混合均匀的原料转入饲料搅拌机,加入适量水并混合10 min。用SLP-450型单螺杆饲料膨化机(中国水产科学研究院渔业机械仪器研究所)挤压出直径为3 mm、长度为8 mm的饲料颗粒。待饲料在室温(25 ℃)下风干后,将其装入塑料袋,密封、保存在冰箱(-20 ℃)中。试验饲料组成及营养水平见表 2。
|
|
表 2 试验饲料组成及营养水平(风干基础) Table 2 Composition and nutrient levels of experimental diets (air-dry basis) |
试验开始前7 d,从暂养水槽中挑选出450尾个体大小相近的鱼,驯养在15个试验水槽中(容积为200 L,每个水槽内放养30尾鱼),驯养期间每天09:00和15:00按饱食量投喂PC饲料。试验开始前24 h,将驯养的鱼停食,然后将所有鱼集中在2个水槽中。每次随机捕捞24尾鱼,群体称重后依次放入15个试验水槽,每个饲料处理(PC、HST、LST、HN和LN饲料)设3个重复。试验鱼初始体重为(29.5±0.5) g (n=15)。从剩余的驯养鱼中随机挑选3组鱼(每组15尾),测量其体长、体重和肝脏重,并将所取的鱼样本保存在-20 ℃下用于分析鱼体初始组成。
养殖试验时间为10周,试验期间每天09:00和15:00按饱食量投喂试验饲料。每天17:00(投喂饲料2 h后)用虹吸的方法清除水槽底部沉积的粪便。每天24 h连续流水(流速为0.03 L/s),用表面温度计和HOBO Pendant UA-002-64水温记录仪(Onset,美国)测定试验水槽内水温(水温记录仪每隔30 min测量并记录1次水温数据)。每周用IS/Mill-E盐度计(AS ONE Corporation,日本)测量盐度。试验期间水槽内平均水温为(21.5±2.5) ℃(17.0~28.9℃),平均盐度为(24±2)‰(21‰~27‰)。
1.3 样品采集试验结束时,将各试验水槽中的鱼停食24 h,然后依次用丁香酚(浓度为80 mg/L)麻醉、捕捞并成批称重。从每个水槽中随机取3尾鱼,测量其体长、体重和肝脏重,然后保存在-20 ℃下作为分析鱼体组成的样品。从投喂PC、LST和LN饲料的水槽内各捕捞3尾个体大小相近的鱼(每个水槽捕捞1尾,共9尾鱼),用经1%肝素钠润洗的1 mL注射器从尾静脉处抽血并转入1.5 mL离心管中,离心(4 ℃、3 000 r/min)15 min后将血浆转入2 mL冻存管并迅速保存在液氮中。取血后测量鱼体长和体重,解剖取出肝脏,转入1.5 mL离心管并迅速保存在液氮中。血浆和肝脏样品运回实验室后-80 ℃保存待测。
1.4 饲料原料、试验饲料和鱼体组成分析将试验鱼样品在室温下解冻、称重,在高压灭菌锅中蒸煮(120 ℃)20 mim后匀浆、烘干(105 ℃)、称重、粉碎(过80目筛)。根据AOAC(1995)[21]方法分别测定饲料原料、试验饲料和鱼体的水分、粗蛋白质、粗脂肪、粗灰分和磷含量。其中,粗蛋白质含量用FOSS-8400全自动凯氏定氮仪(FOSS,瑞典)测定,粗脂肪含量用SZF-06A脂肪抽提仪(上海新嘉电子有限公司)测定。此外,用EA-3000 CHNS元素分析仪(Euro Vector,意大利)测定样品碳含量,用Parr-6200氧弹量热仪(Parr,美国)测定样品总能。
1.5 血浆和肝脏中抗氧化酶活性以及脂质过氧化产物的测定将血浆样品在4 ℃下化冻,分别用试剂盒方法测定超氧化物歧化酶(superoxide dismutase,SOD)、GPx和过氧化氢酶(catalase,CAT)活性以及丙二醛(malondialdehyde,MDA)含量。所用SOD、GPx、CAT和MDA试剂盒购自南京建成生物工程研究所。将肝脏样品化冻,按1 : 4(质量体积比)的比例加入0.86%的生理盐水后在冰水浴中匀浆(转速500 r/min),将匀浆液离心(4 ℃、12 000 r/min)5 min,取上清液。用考马斯亮蓝法测定上清液蛋白质含量[22],用上述试剂盒方法分别测定肝脏中的SOD、GPx和CAT活性以及MDA含量。
1.6 数据计算与统计分析摄食率(FI)、增重(WG)、饲料系数(FCR)、营养物质或能量储积效率[氮储积效率(NRE)、磷储积效率(PRE)、碳储积效率(CRE)、能量氮储积效率(ERE)]、肥满度(CF)、肝体比(HSI)和废物排放量[氮废物排放量(NW)、磷废物排放量(PW)、碳废物排放量(CW)]按下列公式计算:
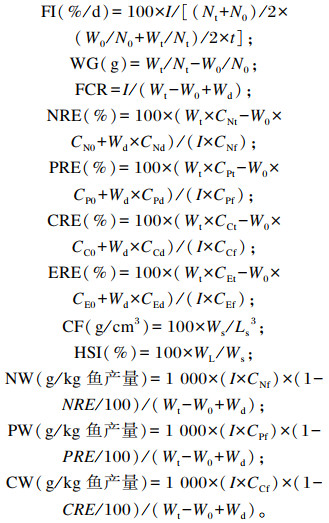
|
式中:I为试验期间每个水槽内投喂的饲料质量(g);W0和Wt分别为试验开始和结束时试验鱼体重(g);N0和Nt分别为试验开始和结束时每个水槽内试验鱼尾数;t为养殖试验时间(d);Wd为每个水槽内死鱼的质量(g);CN0、CNt和CNd分别为试验开始和结束时鱼体的粗蛋白质含量以及死鱼的鱼体粗蛋白质含量(%);CP0、CPt和CPd分别为试验开始和结束时鱼体的磷含量以及死鱼的鱼体磷含量(%);CC0、CCt和CCd分别为试验开始和结束时鱼体碳含量以及死鱼的鱼体碳含量(%);CE0、CEt和CEd分别为试验开始和结束时鱼体总能以及死鱼的鱼体总能(%);CNf、CPf、CCf以及CEf分别为饲料粗蛋白质、磷、碳和总能含量(%);Ws、Ls和WL分别为试验结束时所取鱼样品的体质量(g)、体长(cm)和肝脏质量(g)。
采用双因素方差分析检验饲料鱼粉替代水平、牛磺酸和硒酵母添加水平以及二者间的交互作用对试验鱼成活率、FI、WG、FCR、NRE、PRE、CRE、ERE、CF、HSI、NW、PW、CW和鱼体组成(水分、粗蛋白质、粗脂肪、粗灰分、碳、磷含量和总能)的影响。为了确定棉籽浓缩蛋白可替代的饲料鱼粉水平,采用单因素方差分析和Duncan氏多重比较法检验摄食PC、HST、LST、HN和LN饲料的鱼之间上述指标的差异以及摄食PC、LST和LN饲料的鱼之间血浆和肝脏抗氧化酶(SOD、GPx和CAT)活性以及MDA含量的差异。表示为百分数的数据(成活率、FI、NRE、PRE、CRE、ERE、HSI和鱼体组成等)在进行方差分析前先进行反正弦变换。依据生长速度(WG)、饲料蛋白质利用效率(NRE)、饲料成本(FCR)和养殖污染(NW)综合评价摄食不同饲料(PC、HST、LST、HN、LN饲料)时的养殖效益。双因素和单因素方差分析、Duncan氏多重比较和聚类分析利用SPSS 20.0软件完成,数据表示为平均值±标准差,P < 0.05为差异显著。
2 结果 2.1 条纹锯鮨的成活率、摄食率、生长和饲料利用效率从表 3可见,添加牛磺酸和硒酵母可显著影响成活率和NRE(P < 0.05),饲料鱼粉替代水平与添加牛磺酸和硒酵母的交互作用可显著影响FCR(P < 0.05)。饲料鱼粉替代水平、添加牛磺酸和硒酵母以及二者间的交互作用对FI、FBW、WG、PRE、CRE和ERE均无显著影响(P>0.05)。摄食PC、HST、LST、HN和LN饲料的鱼之间在FI、FBW、WG、FCR、NRE、PRE、CRE和ERE方面均无显著差异(P>0.05),但摄食HST和LST饲料的鱼成活率显著高于摄食PC和LN饲料的鱼(P < 0.05)。
|
|
表 3 条纹锯鮨的成活率、摄食率、生长和饲料利用效率 Table 3 Survival rate, feed intake, growth and feed utilization efficiency of Centropristis striata (n=3) |
从表 4可见,添加牛磺酸和硒酵母可显著影响粗灰分和磷含量(P < 0.05),饲料鱼粉替代水平与添加牛磺酸和硒酵母的交互作用可显著影响HSI(P < 0.05)。饲料鱼粉替代水平、添加牛磺酸和硒酵母以及二者间的交互作用对CF及鱼体水分、粗蛋白质、粗脂肪、碳含量和总能均无显著影响(P>0.05)。摄食PC、HST、LST、HN和LN饲料的鱼之间在CF、HSI及鱼体水分、粗蛋白质、粗脂肪、碳含量和总能方面均无显著差异(P>0.05),但摄食PC、HST和LST饲料的鱼粗灰分和磷含量显著低于摄食HN和LN饲料的鱼(P < 0.05)。
|
|
表 4 条纹锯鮨CF、HSI和鱼体成分组成 Table 4 Condition factor, hepatosomatic index and body composition of Centropristis striata |
从表 5可见,添加牛磺酸和硒酵母可显著影响NW(P < 0.05)。饲料鱼粉替代水平、添加牛磺酸和硒酵母以及二者间的交互作用对PW和CW无显著影响(P>0.05)。摄食PC、HST、LST、HN和LN饲料的鱼之间在NW、PW和CW方面无显著差异(P>0.05)。
|
|
表 5 条纹锯鮨养殖的氮、磷、碳废物排放量 Table 5 Wastes of nitrogen, phosphorus and carbon of Centropristis striata |
从图 1可见,根据WG、FCR、NRE和养殖氮废物排放量进行聚类分析结果表明,摄食PC饲料与摄食LST饲料时养殖效益接近,与摄食HST、HN和LN饲料时存在明显差异。

|
图 1 摄食试验饲料时条纹锯鮨的养殖效益 Fig. 1 Farming benefits of Centropristis striata fed test diets |
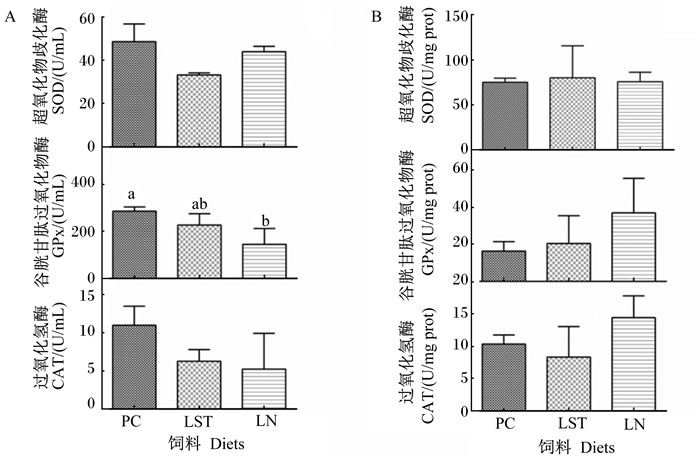
从图 2可见,摄食PC、LST和LN饲料的鱼之间血浆GPx活性存在显著差异(P < 0.05)。摄食PC饲料的鱼血浆GPx活性显著高于摄食LN饲料的鱼(P < 0.05),但血浆SOD和CAT活性无显著差异(P>0.05)。摄食PC、LST和LN饲料的鱼肝脏SOD、GPx和CAT活性无显著差异(P>0.05)。
|
A:血浆plasma;B:肝脏liver。 数据柱标相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。 Value columns with the same small letter or no letter mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 2 条纹锯鮨的血浆和肝脏中抗氧化酶活性 Fig. 2 Activities of antioxidative enzymes in plasma and liver of Centropristis striata |
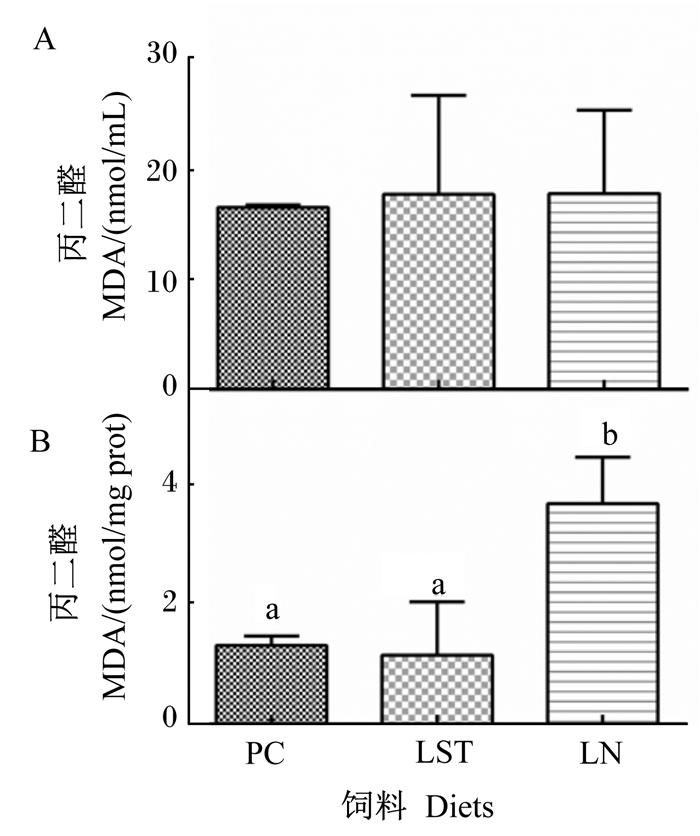
从图 3可见,摄食PC、LST和LN饲料的鱼之间血浆MDA含量无显著差异(P>0.05),但肝脏MDA含量存在显著差异(P < 0.05)。摄食PC和LST饲料的鱼肝脏MDA含量显著低于摄食LN饲料的鱼(P < 0.05)。
|
A:血浆plasma;B:肝脏liver。 图 3 条纹锯鮨的血浆和肝脏中丙二醛含量 Fig. 3 Content of MDA in plasma and liver of Centropristis striata |
本试验中,饲料鱼粉替代水平、添加牛磺酸和硒酵母以及二者间的交互作用对条纹锯鮨的FI、WG、PRE、CRE和ERE均无显著影响;摄食PC饲料的鱼与摄食HST、LST、HN和LN饲料的鱼之间在FI、WG、FCR、NRE、PRE、CRE和ERE等方面均无显著差异。这些结果表明通过添加棉籽浓缩蛋白将饲料鱼粉水平从35%降低到7%不会对条纹锯鮨摄食、生长和食物利用效率产生显著的负面影响,而添加牛磺酸和硒酵母不会显著增加利用棉籽浓缩蛋白替代条纹锯鮨饲料鱼粉的水平。值得指出的是,双因素方差分析表明添加牛磺酸和硒酵母可显著影响NRE。然而,尽管摄食HST饲料的鱼WG、NRE和ERE略高于摄食HN饲料的鱼,摄食LST饲料的鱼WG、NRE和ERE略高于摄食LN饲料的鱼,单因素方差分析表明摄食HST、LST、HN和LN饲料的鱼之间WG、NRE和ERE差异不显著。鉴于方差分析结果受重复间数据离散程度的影响较大,综合上述结果初步认为饲料中添加牛磺酸和硒酵母可一定程度上增加条纹锯鮨生长速度和饲料蛋白质利用效率。Wu等[23]报道,在饲料中添加牛磺酸可增加利用大豆浓缩蛋白替代卵形鲳鲹饲料鱼粉的水平;Wang等[5]报道,在饲料中添加硒酵母可增加利用豆粕替代卵形鲳鲹饲料鱼粉的水平。与上述研究结果相比,本试验中同时添加牛磺酸和硒酵母增加利用棉籽浓缩蛋白替代条纹锯鮨饲料鱼粉水平的作用不显著,表明牛磺酸和硒对鱼类的生理功能可能因种类而异。此外,有关牛磺酸和硒对鱼类生长和食物利用是否存在交互影响尚未确定,因此在鱼类饲料中同时添加牛磺酸和硒酵母与单独添加牛磺酸或硒酵母的效果孰优孰劣还有待进一步的试验检验。
Sullivan等[24]报道,条纹锯鮨的致死温度上限为33.6 ℃。本试验中,驯养阶段水温一度高达31.8 ℃,驯养阶段水温过高可能是导致试验鱼成活率(80%~94%)较低的重要原因。摄食HST和LST饲料的鱼成活率显著高于摄食HN和LN饲料的鱼,表明在相同饲料鱼粉替代水平下添加牛磺酸和硒酵母有益于提高条纹锯鮨的成活率;摄食HST饲料的鱼成活率与摄食LST饲料的鱼无显著差异,而摄食HN饲料的鱼成活率与摄食LN饲料的鱼无显著差异,表明利用棉籽浓缩蛋白替代饲料鱼粉不会导致条纹锯鮨死亡率增加。研究表明,添加5 g/kg的牛磺酸可显著提高军曹鱼(Rachycentron canadum)摄食低鱼粉水平饲料(利用酵母蛋白作为鱼粉替代物)时的成活率[25];添加30~60 g/kg的牛磺酸可显著提高鰤鱼(Seriola quinqueradiata)摄食无鱼粉饲料(利用豆粕作为鱼粉替代物)时的成活率[26]。然而,添加硒不会显著影响摄食低鱼粉水平饲料时卵形鲳鲹(利用豆粕作为鱼粉替代物)[5]和尖吻鲈(利用发酵豆粕作为鱼粉替代物)[17]的成活率。根据本试验和上述研究结果,推测添加牛磺酸可能是改善条纹锯鮨成活率的主要原因。
3.2 添加牛磺酸和硒酵母对条纹锯鮨养殖效益的影响研究表明,在饲料中添加5 g/kg牛磺酸或1 g/kg硒酵母可提高卵形鲳鲹的NRE,同时有助于降低摄食低鱼粉水平饲料(利用大豆浓缩蛋白或豆粕替代鱼粉)时的NW[5, 23]。本试验中,添加牛磺酸和硒酵母可显著影响条纹锯鮨的NRE和NW;摄食HST饲料的鱼NRE略高于摄食HN饲料的鱼,同时摄食LST饲料的鱼NRE略高于摄食LN饲料的鱼;摄食LST饲料的鱼NW和CW略低于摄食LN饲料的鱼。这些结果与添加牛磺酸或硒可提高卵形鲳鲹的NRE,同时有助于降低摄食低鱼粉水平饲料的鱼的NW的观点[5, 23]一致。有关在饲料中添加牛磺酸或硒对鱼类养殖CW影响的研究尚未见报道,本试验发现,条纹锯鮨养殖产生的CW远多于NW和PW,利用棉籽浓缩蛋白替代鱼粉以及在饲料中添加牛磺酸和硒酵母不会显著影响CW。
鱼类养殖效益可体现在生长、FCR、NRE以及环境影响等多个方面[27-28]。基于上述指标的一维(单一指标)评价表明饲料中添加牛磺酸和硒酵母对改善条纹锯鮨养殖效益的作用往往不一致。Zhang等[29]建议在一维评价的基础上进行多维综合评价,以避免不同维度的评价结果不一致或相互矛盾。本试验中,基于生长速度(WG)、饲料蛋白质利用效率(NRE)、饲料成本(FCR)和养殖氮污染(NW)进行聚类分析的结果表明,摄食PC和LST饲料时的养殖效益接近,而摄食HST和HN饲料时的养殖效益接近,摄食LST饲料时的养殖效益明显有别于摄食HST、HN和LN饲料时,这进一步证实了添加牛磺酸和硒酵母有益于改善摄食低鱼粉水平饲料时条纹锯鮨的养殖效益。
3.3 添加牛磺酸和硒酵母影响条纹锯鮨生长和饲料利用的机理研究表明,在饲料中添加牛磺酸可改善细点牙鲷[13]、加利福尼亚湾石首鱼[14]和虹鳟[15]的生长;在饲料中添加有机硒可促进虹鳟[9]、尖吻鲈[16-17]、军曹鱼[30]和大西洋鲷(Sparus aurata)[31]的生长。Zhang等[32]报道,在饲料中添加1 g/kg牛磺酸可显著提高青鱼(Mylopharyngodon piceus)的消化酶活性。Wang等[9]报道,虹鳟生长与硒蛋白W表达密切相关;Khan等[10]报道,硒蛋白Dio可将甲状腺激素(T4)转化为三碘甲腺原氨酸(T3),进而调节动物生长。与鱼粉相比,植物性蛋白质原料中牛磺酸和硒含量较低[6-7],故利用植物性蛋白质原料大量替代鱼粉往往导致饲料牛磺酸和硒含量降低。动物血浆中硒蛋白GPx活性与硒营养状态密切相关[33]。本试验中,摄食PC、LST和LN饲料的牛磺酸和硒含量随鱼粉替代水平增加而减少,摄食PC、LST和LN饲料的鱼血浆GPx活性亦逐渐降低,表明在饲料中添加牛磺酸和硒酵母能够改善摄食低鱼粉饲料时条纹锯鮨的硒营养状态,由此推测硒可能是限制棉籽浓缩蛋白替代饲料鱼粉的原因之一。
动物代谢过程中所产生的活性氧自由基(ROS)如不能被及时清除可导致脂质(如ω-3和ω-6脂肪酸)氧化,产生MDA等脂质氧化产物,严重时可引起细胞凋亡[34]。SOD、GPx和CAT是细胞内重要的抗氧化酶[35],其中GPx能够通过谷胱甘肽途径将过氧化氢(H2O2)还原为水和氧气[36]。研究表明,在饲料中添加牛磺酸可显著提高青鱼摄食低鱼粉水平饲料(利用豆粕替代鱼粉)时血清SOD和GPx活性,降低MDA含量[32];在饲料中添加牛磺酸可显著降低加利福尼亚湾石首鱼摄食低鱼粉水平饲料(利用大豆浓缩蛋白替代鱼粉)时肝脏MDA含量[37];在饲料中添加硒酵母可显著提高尖吻鲈摄食低鱼粉水平饲料(利用豆粕或发酵豆粕替代鱼粉)时血清GPx活性[16-17]。本试验中,摄食PC和LST饲料的鱼肝脏MDA含量显著低于摄食LN饲料的鱼,表明在饲料中添加牛磺酸和硒酵母可减轻条纹锯鮨肝脏的氧化损伤。
4 结论在饲料中添加牛磺酸和硒酵母未显著增加利用棉籽浓缩蛋白替代条纹锯鮨饲料鱼粉的水平,但在一定程度上有益于提高条纹锯鮨养殖成活率和养殖效益。
| [1] |
EL SAYED M A F. Alternative dietary protein sources for farmed tilapia, Oreochromis spp[J]. Aquaculture, 1999, 179(1/2/3/4): 149-168. |
| [2] |
FAO.State of world fisheries and aquaculture[R].Rome: Food and Agriculture Organization, 2018: 0-228.
|
| [3] |
LI Y, AI Q H, MAI K S, et al. Effects of the partial substitution of dietary fish meal by two types of soybean meals on the growth performance of juvenile Japanese seabass, Lateolabrax japonicus (Cuvier 1828)[J]. Aquaculture Research, 2012, 43(3): 458-466. DOI:10.1111/j.1365-2109.2011.02849.x |
| [4] |
BIAN F, ZHOU H, HE G, et al. Effects of replacing fishmeal with different cottonseed meals on growth, feed utilization, haematological indexes, intestinal and liver morphology of juvenile turbot (Scophthalmus maximus L.)[J]. Aquaculture Nutrition, 2017, 23(6): 1429-1439. DOI:10.1111/anu.12518 |
| [5] |
WANG Y, MA X Z, WANG F, et al. Supplementations of poultry by-product meal and selenium yeast increase fish meal replacement by soybean meal in golden pompano (Trachinotus ovatus) diet[J]. Aquaculture Research, 2017, 48(4): 1904-1914. DOI:10.1111/are.13028 |
| [6] |
SALZE G P, DAVIS D A. Taurine:a critical nutrient for future fish feeds[J]. Aquaculture, 2015, 437: 215-229. DOI:10.1016/j.aquaculture.2014.12.006 |
| [7] |
王丽赛, 张丽阳, 马雪莲, 等. 我国畜禽饲料资源中微量元素硒含量分布的调查[J]. 中国农业科学, 2019, 52(11): 2011-2020. DOI:10.3864/j.issn.0578-1752.2019.11.016 |
| [8] |
KIM C K, CHA Y N. Taurine chloramine produced from taurine under inflammation provides anti-inflammatory and cytoprotective effects[J]. Amino Acids, 2014, 46(1): 89-100. DOI:10.1007/s00726-013-1545-6 |
| [9] |
WANG L, ZHANG X Z, WU L, et al. Expression of selenoprotein genes in muscle is crucial for the growth of rainbow trout (Oncorhynchus mykiss) fed diets supplemented with selenium yeast[J]. Aquaculture, 2018, 492: 82-90. DOI:10.1016/j.aquaculture.2018.03.054 |
| [10] |
KHAN K U, ZUBERI A, JOÃO B K F, et al. An overview of the ongoing insights in selenium research and its role in fish nutrition and fish health[J]. Fish Physiology and Biochemistry, 2017, 43(6): 1689-1705. DOI:10.1007/s10695-017-0402-z |
| [11] |
LEI X G, CHENG W H, MCCLUNG J P. Metabolic regulation and function of glutathione peroxidase-1[J]. Annual Review of Nutrition, 2007, 27(1): 41-61. DOI:10.1146/annurev.nutr.27.061406.093716 |
| [12] |
ARNÉR E S J, HOLMGREN A. Physiological functions of thioredoxin and thioredoxin reductase[J]. European Journal of Biochemistry, 2000, 267(20): 6102-6109. DOI:10.1046/j.1432-1327.2000.01701.x |
| [13] |
CHATZIFOTIS S, POLEMITOU I, DIVANACH P, et al. Effect of dietary taurine supplementation on growth performance and bile salt activated lipase activity of common dentex, Dentex dentex, fed a fish meal/soy protein concentrate-based diet[J]. Aquaculture, 2008, 275(1/2/3/4): 201-208. |
| [14] |
LÓPEZ L M, FLORES-IBARRA M, BAÑUELOS-VARGAS I, et al. Effect of fishmeal replacement by soy protein concentrate with taurine supplementation on growth performance, hematological and biochemical status, and liver histology of totoaba juveniles (Totoaba macdonaldi)[J]. Fish Physiology and Biochemistry, 2015, 41(4): 921-936. |
| [15] |
GAYLORD T G, TEAGUE A M, BARROWS F T. Taurine supplementation of all-plant protein diets for rainbow trout (Oncorhynchus mykiss)[J]. Journal of the World Aquaculture Society, 2006, 37(4): 509-517. DOI:10.1111/j.1749-7345.2006.00064.x |
| [16] |
ILHAM I, SIDDIK M A B, FOTEDAR R. Effects of organic selenium supplementation on growth, accumulation, haematology and histopathology of juvenile barramundi (Lates calcarifer) fed high soybean meal diets[J]. Biological Trace Element Research, 2016, 174(2): 436-447. DOI:10.1007/s12011-016-0708-1 |
| [17] |
ILHAM I, FOTEDAR R. Growth, enzymatic glutathione peroxidase activity and biochemical status of juvenile barramundi (Lates calcarifer) fed dietary fermented soybean meal and organic selenium[J]. Fish Physiology and Biochemistry, 2017, 43(3): 775-790. |
| [18] |
ALAM M S, WATANABE W O, SULLIVAN K B, et al. Replacement of menhaden fish meal protein by solvent-extracted soybean meal protein in the diet of juvenile black sea bass supplemented with or without squid meal, krill meal, methionine, and lysine[J]. North American Journal of Aquaculture, 2012, 74(2): 251-265. DOI:10.1080/15222055.2012.678567 |
| [19] |
ANDERSON A D, ALAM M S, WATANABE W O, et al. Full replacement of menhaden fish meal protein by low-gossypol cottonseed flour protein in the diet of juvenile black sea bass Centropristis striata[J]. Aquaculture, 2016, 464: 618-628. DOI:10.1016/j.aquaculture.2016.08.006 |
| [20] |
张清雯, 陈超, 邵彦翔, 等. 硒代蛋氨酸对条纹锯生长性能、组织硒含量、抗氧化能力及血清生化指标的影响[J]. 动物营养学报, 2018, 30(11): 475-485. |
| [21] |
AOAC.Official methods of analysis[S].16th edn.Washington D.C.: Association of Official Analytical Chemists, 1995.
|
| [22] |
BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. |
| [23] |
WU Y, HAN H, QIN J, et al. Replacement of fishmeal by soy protein concentrate with taurine supplementation in diets for golden pompano (Trachinotus ovatus)[J]. Aquaculture Nutrition, 2015, 21(2): 214-222. |
| [24] |
SULLIVAN M L, TOMASSO J R. Limiting and optimal temperatures for the northern Atlantic population of black sea bass[J]. North American Journal of Aquaculture, 2010, 72(3): 258-260. DOI:10.1577/A09-046.1 |
| [25] |
LUNGER A N, MCLEAN E, GAYLORD T G, et al. Taurine supplementation to alternative dietary proteins used in fish meal replacement enhances growth of juvenile cobia (Rachycentron canadum)[J]. Aquaculture, 2007, 271(1/2/3/4): 401-410. |
| [26] |
TAKAGI S, MURATA H, GOTO T, et al. Hemolytic suppression roles of taurine in yellowtail Seriola quinqueradiata fed non-fishmeal diet based on soybean protein[J]. Fisheries Science, 2006, 72(3): 546-555. DOI:10.1111/j.1444-2906.2006.01183.x |
| [27] |
WANG Y, KONG L, LI C, et al. The potential of land animal protein ingredients to replace fish meal in diets for cuneate drum, Nibea miichthioides, is affected by dietary protein level[J]. Aquaculture Nutrition, 2010, 16(1): 37-43. |
| [28] |
WANG Y, WANG F, JI W X, et al. Optimizing dietary protein sources for Japanese sea bass (Lateolabrax japonicus) with an emphasis on using poultry by-product meal to substitute fish meal[J]. Aquaculture Research, 2015, 46(4): 874-883. DOI:10.1111/are.12242 |
| [29] |
ZHANG Y Q, WU Y B, JIANG D L, et al. Gamma-irradiated soybean meal replaced more fish meal in the diets of Japanese seabass (Lateolabrax japonicus)[J]. Animal Feed Science and Technology, 2014, 197: 155-163. DOI:10.1016/j.anifeedsci.2014.08.002 |
| [30] |
PHAM H D, SIDDIK M A B, FOTEDAR R, et al. Total bioavailable organic selenium in fishmeal-based diet influences growth and physiology of juvenile cobia Rachycentron canadum (Linnaeus, 1766)[J]. Biological Trace Element Research, 2019, 190(2): 541-549. DOI:10.1007/s12011-018-1565-x |
| [31] |
MECHLAOUI M, DOMINGUEZ D, ROBAINA L, et al. Effects of different dietary selenium sources on growth performance, liver and muscle composition, antioxidant status, stress response and expression of related genes in gilthead seabream (Sparus aurata)[J]. Aquaculture, 2019, 507: 251-259. DOI:10.1016/j.aquaculture.2019.04.037 |
| [32] |
ZHANG J Z, HU Y, AI Q H, et al. Effect of dietary taurine supplementation on growth performance, digestive enzyme activities and antioxidant status of juvenile black carp (Mylopharyngodon piceus) fed with low fish meal diet[J]. Aquaculture Research, 2018, 49(9): 3187-3195. DOI:10.1111/are.13783 |
| [33] |
BALLIHAUT G, KILPATRICK L E, KILPATRICK E L, et al. Multiple forms of selenoprotein P in a candidate human plasma standard reference material[J]. Metallomics, 2012, 4(6): 533-538. DOI:10.1039/c2mt20059g |
| [34] |
AYALA A, MUÑOZ M F, ARGVELLES S. Lipid peroxidation:production, metabolism, and signaling mechanisms of malondialdehyde and 4-hydroxy-2-nonenal[J]. Oxidative Medicine and Cellular Longevity, 2014, 2014: 360438. |
| [35] |
SIES H. Oxidative stress:a concept in redox biology and medicine[J]. Redox Biology, 2015, 4: 180-183. DOI:10.1016/j.redox.2015.01.002 |
| [36] |
RAHAL A, KUMAR A, SINGH V, et al. Oxidative stress, prooxidants, and antioxidants:the interplay[J]. Biomed Research International, 2014, 2014: 761264. |
| [37] |
BAÑUELOS-VARGAS I, LÓPEZ L M, PÉREZ-JIMÉNEZ A, et al. Effect of fishmeal replacement by soy protein concentrate with taurine supplementation on hepatic intermediary metabolism and antioxidant status of totoaba juveniles (Totoaba macdonaldi)[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2014, 170: 18-25. DOI:10.1016/j.cbpb.2014.01.003 |




