2. 吉林农业大学, 长春 130118
2. Jilin Agricultural University, Changchun 130118, China
犬科动物可追溯到渐新世和中新世,是现存最古老的、分布最广泛的食肉动物群之一,其中属于毛皮动物的狐类以及作为宠物饲养的犬类是目前最具有经济意义的犬科动物[1]。由于犬科动物经济价值的提升,益生菌制剂在犬科动物疾病治疗和预防保健中的应用越来越广泛[2],但对于犬科动物原籍菌的研究和应用仍较少。从动物自身分离得到的原籍菌能更好地适应同种类动物的胃肠道环境,从而能更好地发挥其益生特性,取得最大化的治疗和保健效果[3]。
约氏乳杆菌(Lactobacillus johnsonii)分类于乳杆菌属(Lactobacillus)[4]。研究表明,约氏乳杆菌具有良好的益生作用,能够促进仔猪的生长并降低仔猪腹泻[5-6];防治家禽坏死性肠炎,改善肉鸡的生长性能,减少肉鸡体内病原菌的定植[7-10];还可以预防老龄小鼠因蛋白质能量失衡导致的免疫机能障碍,提高小鼠小肠上皮细胞抗原受体的基因表达以及预防肥胖小鼠非酒精性脂肪性肝病[11-13]。欧盟于2010年对约氏乳杆菌进行了安全资格认定(QPS),并批准其在饲料和食品中使用[14]。
本试验通过对1株新分离蓝狐源约氏乳杆菌ZJBF004的产酸能力、对低pH和高胆盐环境的耐受性、对12种常用抗生素的敏感性、对致病菌抑制能力和黏附蓝狐小肠上皮原代细胞能力、抗氧化性及安全性的综合评价,初步判定其益生潜能,为后期该菌株在畜牧生产中的应用及复合微生态制剂菌种多样性的开发奠定基础,为开发犬科动物益生菌制剂、丰富犬科动物饲用微生物数据库提供备选菌株。
1 材料与方法 1.1 试验材料 1.1.1 分离材料分离材料样品采集于吉林省某饲养基地冬毛期健康蓝狐的肠道内容物。
1.1.2 菌株和细胞试验用菌株包括大肠杆菌(ATCC 25922)、金黄色葡萄球菌(ATCC 25923)、鼠伤寒沙门氏菌(ATCC 14028),试验用细胞为蓝狐小肠上皮原代细胞株,均为本实验室保存材料。
1.2 试验方法 1.2.1 菌株的分离无菌采集蓝狐肠道内容物1 g,使用磷酸盐缓冲液(PBS)进行连续倍比稀释后取10-4、10-5、10-6稀释液100 μL分别涂布于固体乳酸细菌培养基(MRS)[15],37 ℃培养过夜,挑取单菌落在MRS平板上划线分离纯化,重复纯化3次后转接至MRS斜面培养,保存备用,选取其中1株菌株命名为ZJBF004,进行下一步鉴定及研究。
1.2.2 菌株ZJBF004的鉴定 1.2.2.1 16S rRNA基因序列分析按照细菌基因组提取试剂盒说明书进行操作,提取细菌的总DNA,利用16S rRNA基因的通用引物进行PCR扩增[16]。PCR反应体系为50 μL:菌株ZJBF004总DNA 2 μL,LA Taq酶1 μL,10×LA Taq Buffer 5 μL,上、下游引物各1 μL,脱氧核糖核苷三磷酸(dNTP)2 μL,加ddH2O至总体积50 μL。PCR扩增程序:95 ℃预变性2 min;94 ℃变性20 s,60 ℃退火20 s,72 ℃延伸40 s,共30个循环;最后72 ℃延伸1 min。PCR扩增产物经1%琼脂糖凝胶电泳鉴定后,使用凝胶回收试剂盒纯化后由生工生物工程(上海)股份有限公司进行测序,测序结果通过NCBI数据库(http://www.ncbi.nlm.nih.gov)线上Blast选取相似程度较大的序列对16S rRNA基因进行比对,并利用Mega 7.0软件应用最大邻近(neighuor-joining, NJ)算法分别构建系统发育树,以确定分离菌株的进化关系。
通用引物序列为27F(5’-GAGCGGATAACAATTTCACACAGG-3’)、1492R(5’-CGCCAGGGTTTTCCCAGTCACGAC-3’)。
1.2.2.2 生理生化鉴定参照《乳酸细菌分类鉴定及实验方法》[4]进行乳酸菌生理生化特性鉴定,将初步分离得到的菌株接种到液体MRS中培养至对数期,对菌株的明胶试验、V-P试验、甲基红(MR)试验、糖发酵试验等生化特性使用细菌微量生化反应鉴定管进行初步鉴定[17]。
1.2.3 菌株ZJBF004的体外益生特性 1.2.3.1 菌株ZJBF004的生长曲线及产酸性能测定取活化培养24 h后的分离菌种液以2.0%的接种量接种于MRS中,37 ℃恒温厌氧培养24 h,设置对照组为未接菌种液的液体培养基。分别于0、1、2、3、4、5、6、8、10、12、14、24 h取样测定培养液600 nm处吸光度(OD600)值,分别于0、2、4、6、8、10、12、14、24 h取样测定培养液pH。以时间为横坐标,以培养液的pH和OD600值为纵坐标,绘制其生长曲线和产酸曲线。
1.2.3.2 菌株ZJBF004不同温度的生长曲线取活化培养24 h后的分离菌种液以2.0%的接种量接种于MRS中,分别于20、37和55 ℃恒温厌氧培养。分别于0、1、2、3、4、5、6、8、10、12、14、24、36、48 h测定其OD600值,每组3个平行。测定完成后取3组平行试验结果计算平均值,根据计算结果绘制生长曲线。
1.2.3.3 菌株ZJBF004对酸度的耐受性取活化培养24 h后的分离菌种液以2.0%的接种量接种于初始pH分别为1.0、2.0、3.0、4.0、5.0、6.0、7.0的MRS中,37 ℃恒温厌氧培养。分别于0、6、12、24 h测定其OD600值,每组3个平行。测定完成后取3组平行试验结果计算平均值,根据计算结果绘制曲线。
1.2.3.4 菌株ZJBF004对人工胃液和人工肠液的耐受性人工胃液和人工肠液的配制方法参考2010年版《中国药典》[18]。
取活化培养24 h后的分离菌种液,于4 ℃、8 000 r/min离心10 min后弃去上清液,加入等体积的生理盐水重悬。配制好的人工胃液和人工肠液经0.2 μm无菌滤膜过滤处理后各取10 mL,分别加入重悬后的菌悬液1 mL,37 ℃恒温厌氧培养。分别于0和3 h时取100 μL培养液梯度稀释后涂布,进行活菌平板计数,测定菌株对人工胃肠液的耐受性,取0 h组活菌计数结果作为对照。
1.2.3.5 菌株ZJBF004对胆盐的耐受性取活化培养24 h后的分离菌种液200 μL加入胆盐浓度为3 g/L的MRS中,37 ℃恒温厌氧培养。分别于0和6 h时取100 μL培养液梯度稀释后涂布,进行活菌平板计数,测定菌株对胆盐的耐受性,取0 h组活菌计数结果作为对照计算存活率。
1.2.3.6 菌株ZJBF004的表面疏水性测定采用细菌碳烃化合物黏着法(bacterium adhesion to hydrocarbons, BATH)[19],通过乳酸菌对碳烃化合物的亲和力来反映菌株表面的疏水性能。取活化培养24 h后的分离菌种液用PBS洗涤3次后调节菌液OD600值为0.25±0.05(A0)备用,取3 mL上述菌液与等体积二甲苯混合,涡旋振荡3 min,在37 ℃下孵育1 h,吸取水相,测量OD600值(At)。重复3次试验,取平均值。疏水率(CSH)计算公式如下:
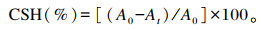
|
式中:At为t时刻的吸光度;A0为0时刻的吸光度。
1.2.3.7 菌株ZJBF004的自凝聚性测定取活化培养24 h后的分离菌种液,于4 ℃、8 000 r/min离心10 min,取沉淀,用PBS洗涤3次后加入2倍体积的PBS重悬备用,取2 mL上述菌液,涡旋振荡10 s,测量OD600值(A0)。37 ℃静置2 h,小心吸取上清液,测量OD600值(At)。重复3次试验,取平均值。自凝聚率计算公式如下[20]:
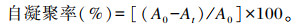
|
式中:At为t时刻的吸光度;A0为0时刻的吸光度。
1.2.3.8 菌株ZJBF004对细胞的黏附能力测定参考李正华[21]的试验方法,将蓝狐小肠上皮原代细胞复苏后按常规传代方法培养,培养液为含15%胎牛血清的杜氏改良Eagle培养基(DMEM),置37 ℃、5% CO2培养箱中培养,每48 h换液1次。将培养好的细胞经胰酶消化后,加培养基吹打均匀制成细胞悬液(5×104 CFU/mL),均匀铺在已放置玻璃爬片的24孔板中,培养至致密单层后弃去培养液,用PBS清洗3次后每孔加入1 mL活化培养24 h后的分离菌种液(菌液浓度调节为1×108 CFU/mL)和1 mL细胞培养液,37 ℃厌氧培养2 h。吸出孔内的混合液体,用PBS漂洗3次后每孔加入适量的多聚甲醛固定30 min。吸出孔内的多聚甲醛,用PBS漂洗3次后进行革兰氏染色,显微镜下每孔随机计数30个视野,每个视野选择单个分布的细胞,通过计数黏附在30个细胞上的菌体个数,来判断黏附能力的大小。
1.2.3.9 菌株ZJBF004的抑菌能力研究菌株的抑菌性能采用牛津杯琼脂扩散法进行测定。取活化培养24 h后的分离菌种液,于4 ℃、8 000 r/min离心10 min取上清液备用,分别取200 μL大肠杆菌、沙门氏菌和金黄色葡萄球菌新鲜菌液均匀涂布于LB固体培养基上。待菌液吸收完全后,在每个平板上成品字形放置3个牛津杯,每个牛津杯内加入200 μL上清液,平板于37 ℃恒温培养箱正置放置培养,24 h后观察是否有抑菌圈形成,并精确量取抑菌圈直径。
1.2.3.10 菌株ZJBF004对常见抗生素的敏感性抗生素敏感性采用纸片扩散法进行测定[22]。取活化培养24 h后的分离菌种液200 μL均匀涂布于MRS固体培养基上,采用纸片扩散法测定菌株对青霉素(10 U/片)、头孢孟多(30 μg/片)、四环素(30 μg/片)、阿奇霉素(15 μg/片)、环丙沙星(5 μg/片)、万古霉素(30 μg/片)、氯霉素(30 μg/片)、克林霉素(2 μg/片)、庆大霉素(10 μg/片)、甲氧苄啶(5 μg/片)、甲硝唑(5 μg/片)以及磷霉(200 μg/片)共12种抗生素的耐药性。
1.2.3.11 菌株ZJBF004的自由基清除测定参照文献[23]对菌株的1, 1-二苯基-2-三硝基苯肼(DPPH)清除能力进行测定。取活化培养24 h后的分离菌种液,于4 ℃、8 000 r/min离心10 min,将沉淀用PBS洗涤3次后,加入等体积的生理盐水重悬备用。取2 mL样品加入2 mL 0.2 mmol/L DPPH的无水乙醇溶液,充分混匀,放置于37 ℃恒温培养箱中避光反应30 min,8 000 r/min离心10 min,取上清液,于517 nm处测定吸光度。设置等体积的生理盐水作为对照组,同时以等体积的生理盐水和无水乙醇的混合液作为空白调零。DPPH自由基清除率的计算公式如下:

|
式中:A样品为待测样品的吸光度;A对照为生理盐水的吸光度;A空白为生理盐水和无水乙醇混合液的吸光度。
1.3 数据分析结果以“平均值士标准差”表示,数据通过SAS 9.4中配对t检验和析因设计方差分析进行分析,P < 0.01为差异极显著。
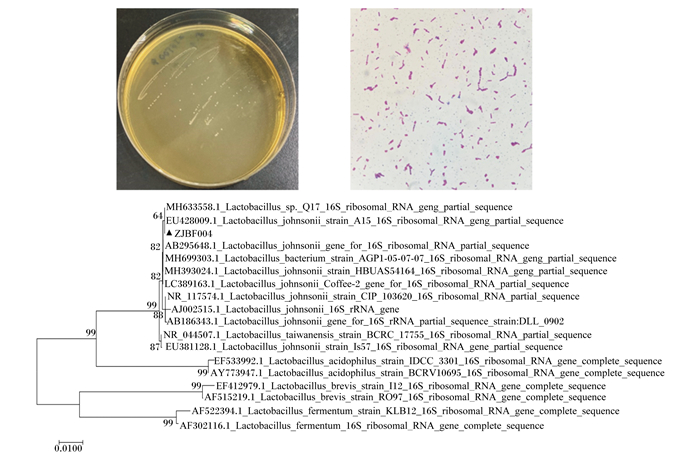
2 结果与分析 2.1 菌株ZJBF004的分离与鉴定从蓝狐肠道内容物中成功分离到4株乳酸菌,对其中命名为ZJBF004的菌株进行后续研究。如图 1所示,菌株ZJBF004菌落在MRS上呈现为扁平、圆形、表面光滑、边缘不整齐,近似透明状;菌株ZJBF004呈革兰氏染色反应阳性,形态长短不一,两端呈圆形,单个或成对存在,无芽孢。利用细菌16S rRNA基因通用引物27F和1492R对菌株ZJBF004进行PCR扩增和测序后,通过NCBI数据库线上Blast功能寻找与菌株ZJBF004 16S rRNA基因序列相似度较大的多个序列,通过Clustal W方法进行序列同源性分析,结果表明菌株ZJBF004的16S rRNA基因序列与约氏乳杆菌A15株(登录号:EU428009)和Q1-7株(登录号:MH633558)的16S rRNA基因序列同源性最高,达到100%。使用最大临近法(NJ法)对18株约氏乳杆菌的16S rRNA基因进行系统进化树分析,结果显示,菌株ZJBF004的16S rRNA基因序列与约氏乳杆菌A15株和Q1-7株同源,形成一个进化分支。
|
图 1 菌株ZJBF004的菌落、菌体形态(1 000×)及系统进化树 Fig. 1 Colony, cell morphology (1 000×) and phylogenetic tree of strain ZJBF004 |
菌株ZJBF004的生理生化特性如表 1所示,菌株ZJBF004能发酵葡萄糖、果糖、半乳糖等单糖,纤维二糖、麦芽糖、蔗糖、乳糖等二糖产酸。葡萄糖产气试验、过氧化氢酶试验、吲哚试验、V-P试验、MR试验等均为阴性,明胶液化试验、七叶苷水解试验、淀粉水解试验呈阳性,说明菌株ZJBF004具有蛋白酶及淀粉酶活性。初步鉴定菌株ZJBF004为约氏乳杆菌。
|
|
表 1 菌株ZJBF004的生理生化特性 Table 1 Physiological and biochemical characteristics of strain ZJBF004 |
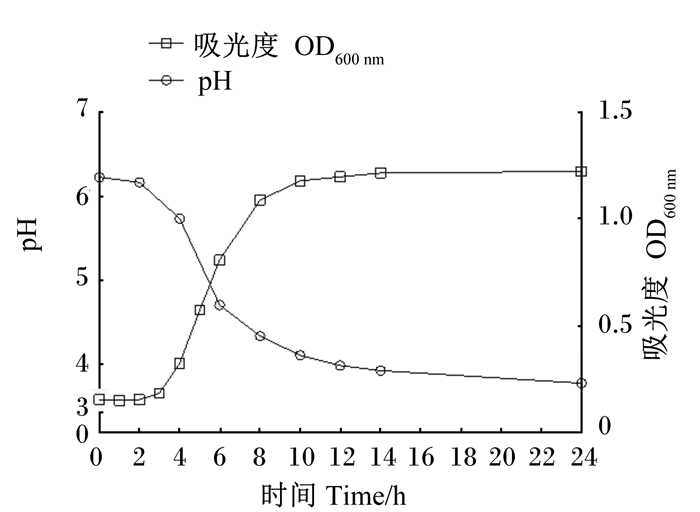
如图 2所示,菌株ZJBF004在接种后2 h内生长缓慢,2 h后迅速进入对数生长期,10 h后生长速度变缓,14 h时到达最大生长量。菌株ZJBF004在接种后2 h内pH下降缓慢,从6.22下降至6.16,2~10 h内,菌液pH从6.16快速下降至4.10;10 h后菌液pH变化趋于平缓,基本稳定在3.77左右。综上所述,菌株ZJBF004可以在14 h内达到最大生长量和较低的pH。
|
图 2 菌株ZJBF004生长曲线和产酸曲线 Fig. 2 Curves of growth and acid producing of strain ZJBF004 |
如图 3所示,当菌株ZJBF004在37 ℃培养时,在0~2 h生长缓慢,处于生长延滞区,2 h后进入对数生长期,10 h后达到生长稳定期,此时菌株活菌数量达到峰值;菌株在20 ℃培养时生长完全被抑制;在55 ℃培养时延滞期很短,为1 h,1 h时后进入指数生长期,4 h后生长渐缓,随后停止生长。通过比较可以得出,菌株ZJBF004对温度敏感,在37 ℃培养条件下能较为迅速的进入对数生长期并持续生长,而在较低或较高温度条件下培养时,菌株ZJBF004生长受到限制,因此在生产和应用的过程中应该避免不适宜的温度。
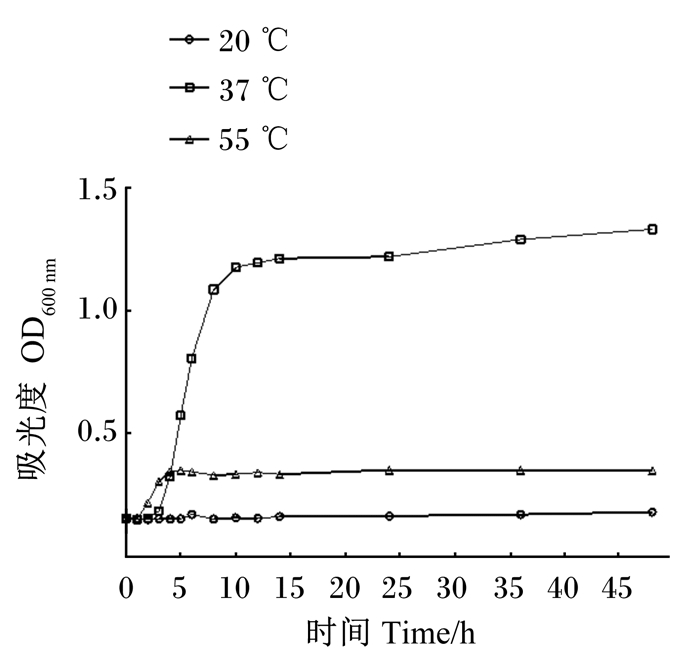
|
图 3 菌株ZJBF004的温度生长曲线 Fig. 3 Temperature growth curve of strain ZJBF004 |
如图 4所示,当培养基pH=7.0时,菌株ZJBF004生长迅速,能在短时间内获得菌体数量的大幅度增加。当培养基pH=4.0时,菌株ZJBF004的生长速度和菌体数量明显较pH=5.0~7.0时低。当培养基pH=1.0~3.0时,菌株ZJBF004的生长完全被抑制,到24 h后也未出现生长。通过比较可以得出,菌株在pH=3.0的环境中生长状态明显受到抑制,对pH=4.0的酸性环境也有一定的耐受性,菌株在pH≥5.0的环境中生长状态为最佳。
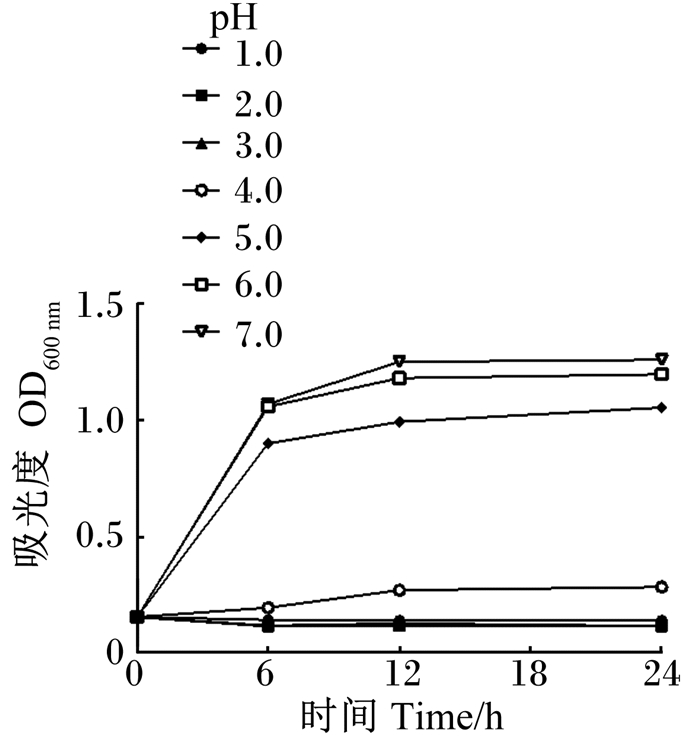
|
图 4 菌株ZJBF004在不同pH培养基中的生长曲线 Fig. 4 Growth curve of strain ZJBF004 in culture with different pH |
由表 2可知,接种于人工胃液3 h后菌株ZJBF004的存活率为(95.39±0.41)%,活菌数约为7.39×107 CFU/mL;接种于人工肠液3 h后菌株ZJBF004的存活率为(92.80±0.15)%,活菌数约为3.02×107 CFU/mL,说明菌株ZJBF004对人工胃肠液有较好的耐受性。
|
|
表 2 菌株ZJBF004在人工胃肠液中的存活率 Table 2 Survival rate of strain ZJBF004 in artificial gastrointestinal juice |
由表 3可知,菌株ZJBF004在含有3 g/L胆盐条件下的培养基中耐受6 h后,菌株的存活率为(75.81±0.43)%,活菌数约为1.375×105 CFU/mL,说明菌株ZJBF004对胆盐具有较好的耐受性。
|
|
表 3 菌株ZJBF004在牛磺胆酸钠溶液中的存活率 Table 3 Survival rate of strain ZJBF004 in sodium taurocholate solution |
细菌根据表面疏水性定义标准,一般设定CSH>50%为高度疏水,CSH介于20%和50%为中度疏水,CSH < 20%为非疏水[19]。自凝聚能力一般分为:低(16%~35%)、中等(35%~50%)和高(50%以上)3类。结果表明,菌株ZJBF004的表面CSH为(48.74±5.98)%,具有中度疏水性,但是自凝聚性能较低,低于16%的最低界定值。
2.4.6 菌株ZJBF004对肠上皮细胞的黏附能力体内益生菌发挥益生作用的前提是能定植于肠道内且增殖达到一定的数量。试验选取蓝狐小肠上皮原代细胞作为体外模型,与菌株ZJBF004共培养2 h后,经染色后于显微镜下观察计数(图 5),经计算菌株ZJBF004对蓝狐肠上皮细胞的黏附率为(18.67±3.12)个/细胞。
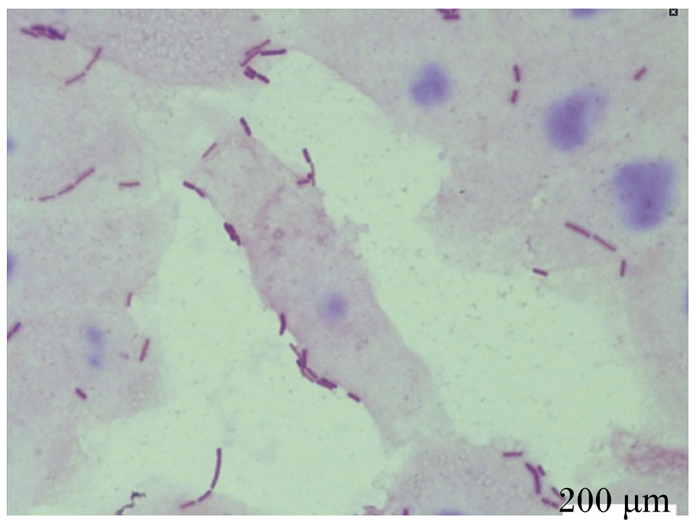
|
图 5 菌株ZJBF004黏附细胞图 Fig. 5 Adherence of strain ZJBF004 to cells (1 000×) |
本研究对菌株ZJBF004的发酵上清液对常见大肠杆菌、沙门氏菌等病原菌的抑制性进行了测定。如表 4所示,菌株ZJBF004的发酵上清液对大肠杆菌、沙门氏菌、金黄色葡萄球菌均有较好的抑制作用,对金黄色葡萄球菌的抑菌活性最强,抑菌圈直径为(24.17±0.93) mm;对沙门氏菌和大肠杆菌的抑菌圈直径分别为(16.58±0.86) mm和(11.63±1.55) mm。
|
|
表 4 菌株ZJBF004发酵上清液对常见病原菌的抑制性 Table 4 Inhibitory of fermentation broth of strain ZJBF004 on common pathogenic bacteria |
如表 5所示,菌株ZJBF004对各种常见抗生素的敏感性不同。对头孢孟多敏感性强,抑菌圈直径大于27 mm;其次是青霉素,抑菌圈直径大于23 mm;对氯霉素中度敏感,抑菌圈直径大于18 mm;对四环素、万古霉素敏感性较弱,抑菌圈直径为8~13 mm;而对阿奇霉素、环丙沙星、克林霉素、庆大霉素、甲氧苄啶、甲硝唑和磷霉素则不敏感。
|
|
表 5 菌株ZJBF004对常用抗生素的敏感性 Table 5 Sensitivity of strain ZJBF004 to common antibiotics |
菌株ZJBF004的DPPH自由基清除率为28.50%。
3 讨论 3.1 菌株ZJBF004的鉴定结果乳酸菌因具有增强机体免疫、维持肠道内菌群平衡、促进营养物质的吸收进而提高动物生产性能等多种益生特性,经常作为一种抗生素替代物用于预防和治疗肠道感染,同时也被用作畜牧业和伴侣动物的生长促进剂[24-25]。有研究表明,同源益生菌对环境的适应性更强、能快速定植并发挥作用[26]。本研究从健康蓝狐肠道内容物中分离得到优势菌株ZJBF004,其菌落菌体形态特征、16S rRNA基因序列分析、革兰氏染色反应、部分生理生化特征以及糖发酵试验结果均与约氏乳杆菌的特征相符。
3.2 菌株ZJBF004的胃肠道定植能力益生菌能否顺利通过胃肠道成功定植并发挥益生作用与菌株对低pH环境、胃蛋白酶、胰蛋白酶及胆盐的耐受能力有关。而菌株的表面疏水性是判断细菌与肠道表皮细胞相互吸附能力的重要指标之一,菌株的自凝聚性能又能影响细菌生物膜的形成,因此表面疏水性和自凝聚性作常被用于间接地评估益生菌的肠道定植能力[27-28]。菌株ZJBF004在低pH环境、人工模拟胃肠道环境及胆盐环境中均具有较强的耐受性,综合自凝聚率、表面疏水性及细胞黏附试验结果可以发现菌株ZJBF004具有良好的胃肠道定植能力,说明菌株ZJBF004具有在动物体内存活的潜力。
3.3 菌株ZJBF004的抑菌能力乳酸菌在其生长繁殖的过程中能产生大量的乳酸及细菌素[29],这些代谢产物往往对病原菌具有一定的抑制作用,而抑菌活性也被认为是益生菌竞争性杀死或抑制肠道内病原菌的一个重要的指标,因此筛选抑菌活性强的乳酸菌也一直是乳酸菌研究的热点。马妙莲等[30]在1株具有广谱抑菌活性的戊糖片球菌的发酵上清液中发现含有乳酸、乙酸、琥珀酸、柠檬酸、棕榈酸、油酸、硬脂酸和亚油酸等多种抑菌成分。Fayol-Messaoudi等[31]研究发现,约氏乳杆菌能显著抑制鼠伤寒沙门氏菌活性。孙晓雯等[32]研究发现约氏乳杆菌对大肠杆菌K88、K99均有抑制作用。本研究发现,菌株ZJBF004的发酵上清液对常见的病原菌大肠杆菌、沙门氏菌和金黄色葡萄球菌的生长有不同程度的抑制作用,在动物体内定植后能有效抑制动物机体胃肠道内的有害菌株,从而减少部分胃肠道疾病的发生,但该菌株具体的抑菌机制还需进一步研究。
3.4 菌株ZJBF004的抗生素敏感性近年来,对乳酸菌的耐药性进行的研究越来越多,有研究发现,乳酸菌具有耐药性能避免在使用抗生素治疗疾病时被一同杀灭,但乳酸菌在含有抗生素环境中生长,易发生遗传转移,导致这些耐药性基因在动物体内被转移到其他致病微生物上[33-34]。Coman等[35]从犬粪便中筛选出1株具有胃肠道定制能力的罗伊氏乳杆菌AI菌株,对克林霉素十分敏感。还有学者从猫和狗的粪便筛选出了对氨苄西林和万古霉素都耐受的粪肠球菌[36]。益生菌在应用过程中可能出现宿主由于生病或预防目的使用抗生素的情况,致使其生长被抑制,很难发挥好的益生效果,因此,了解菌株对高温和常用抗生素的敏感性,对于指导其正确使用和更好地发挥其益生作用具有重要意义。本研究通过耐药性试验发现,菌株ZJBF004对青霉素、头孢孟多、四环素、万古霉素和氯霉素5种抗生素敏感,对阿奇霉素、环丙沙星、克林霉素、庆大霉素、甲氧苄啶、甲硝唑和磷霉素7种抗生素则均不敏感,这12种抗生素分属于12种不同类别。研究结果表明菌株ZJBF004在动物胃肠道内定植成功后不容易被后续服用的药物杀死,从而能更长久地在动物机体内发挥益生作用,但对于菌株ZJBF004对不同抗生素敏感性差异机理正在进一步研究。
3.5 菌株ZJBF004的抗氧化性研究表明,乳酸菌能清除肠道内的活性氧分子,保持氧化和抗氧化的平衡,从而减轻重金属等对机体的氧化损伤[37]。夏爽等[38]从犬的粪便中分离到1株粪肠球菌22005,该菌株发酵上清液及细胞提取物的DPPH清除率分别为43.3%和46.68%。陈佩等[39]对约氏乳杆菌CCFM134的抗氧化性能进行了研究,发现该菌株完整细胞及细胞提取物的DPPH清除率分别为10.23%和3.89%。本研究发现,菌株ZJBF004完整细胞的DPPH自由基清除率为28.50%,抗氧化性能良好,因此菌株ZJBF004是一种十分有潜力的天然的抗氧化物。
4 结论本研究利用MRS分离到1株产酸能力较强的约氏乳杆菌菌株ZJBF004,其生长性能良好,对高温、酸性及人工模拟的胃肠道内环境都具有一定的耐受性,对肠上皮细胞具有较好的黏附能力,同时对多种不同类别类抗生素不敏感,因此在动物机体内易于定植和存活;同时,其对几种常见的病原菌都具有一定的抑制能力,还具有一定的抗氧化能力,具有在动物机体内能发挥益生作用的潜力,故可作为犬科动物益生菌制剂的备选菌株。
| [1] |
居龙和. 人类最忠实的伴侣动物——家犬[J]. 生物学通报, 2006, 41(1): 15-16. DOI:10.3969/j.issn.0006-3193.2006.01.007 |
| [2] |
任普军.犬源益生菌的筛选及其对犬细菌性腹泻的治疗试验[D].硕士学位论文.雅安: 四川农业大学, 2007.
|
| [3] |
全海志.犬源乳酸菌的分离鉴定及生化特性研究[D].硕士学位论文.延吉: 延边大学, 2003.
|
| [4] |
凌代文. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 6-16.
|
| [5] |
马志勇.约氏乳酸杆菌JJB3和纳米硒对断奶仔猪生产性能、肠道菌群结构及多样性的影响[D].硕士学位论文.成都: 四川农业大学, 2008.
|
| [6] |
XIN J G, ZENG D, WANG H S, et al. Probiotic Lactobacillus johnsonii BS15 promotes growth performance, intestinal immunity, and gut microbiota in piglets[J]. Probiotics and Antimicrobial Proteins, 2019(1): 1-10. |
| [7] |
GEIER M S, MIKKELSEN L L, TOROK V A, et al. Comparison of alternatives to in-feed antimicrobials for the prevention of clinical necrotic enteritis[J]. Journal of Applied Microbiology, 2010, 109(4): 1329-1338. DOI:10.1111/j.1365-2672.2010.04758.x |
| [8] |
LIU C Q, ZHU Q, CHANG J, et al. Effects of Lactobacillus casei and Enterococcus faecalis on growth performance, immune function and gut microbiota of suckling piglets[J]. Archives of Animal Nutrition, 2017, 71(2): 120-133. DOI:10.1080/1745039X.2017.1283824 |
| [9] |
LA RAGIONE R M, NARBAD A, GASSON M J, et al. In vivo characterization of Lactobacillus johnsonii FI9785 for use as a defined competitive exclusion agent against bacterial pathogens in poultry[J]. Letters in Applied Microbiology, 2010, 38(3): 197-205. |
| [10] |
VAN COILLIE E, GORIS J, CLEENWERCK I, et al. Identification of Lactobacilli isolated from the cloaca and vagina of laying hens and characterization for potential use as probiotics to control Salmonella enteritidis[J]. Journal of Applied Microbiology, 2007, 102(4): 1095-1106. |
| [11] |
KABURAGI T, YAMANO T, FUKUSHIMA Y, et al. Effect of Lactobacillus johnsonii La1 on immune function and serum albumin in aged and malnourished aged mice[J]. Nutrition, 2007, 23(4): 342-350. DOI:10.1016/j.nut.2007.02.001 |
| [12] |
KINGMA S D K, LI N, SUN F, et al. Lactobacillus johnsonii N6.2 stimulates the innate immune response through toll-like receptor 9 in Caco-2 cells and increases intestinal crypt paneth cell number in biobreeding diabetes-prone rats[J]. Journal of Nutrition, 2011, 141(6): 1023-1028. DOI:10.3945/jn.110.135517 |
| [13] |
XIN J G, ZENG D, WANG H S, et al. Preventing non-alcoholic fatty liver disease through Lactobacillus johnsonii BS15 by attenuating inflammation and mitochondrial injury and improving gut environment in obese mice[J]. Applied Microbiology and Biotechnology, 2014, 98(15): 6817-6829. DOI:10.1007/s00253-014-5752-1 |
| [14] |
NIKOSKELAINEN S, SALMINEN S, BYLUND G, et al. Characterization of the properties of human-and dairy-derived probiotics for prevention of infectious diseases in fish[J]. Applied and Environmental Microbiology, 2001, 67(6): 2430-2435. DOI:10.1128/AEM.67.6.2430-2435.2001 |
| [15] |
杜连祥, 路福平. 微生物学实验技术[M]. 北京: 中国轻工业出版社, 2008: 349-355.
|
| [16] |
袁林, 吴清平, 吴克刚, 等. 广谱抑菌物质产生菌GX-21的筛选及鉴定[J]. 现代食品科技, 2014, 30(12): 68-73, 60. |
| [17] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 北京科学出版社, 2001: 289-294.
|
| [18] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2010.
|
| [19] |
POWTHONG P, SUNTORNTHI P. Isolation, identification and analysis of probiotic properties of lactic acid bacteria from selective various traditional Thai fermented food and kefir[J]. Pakistan Journal of Nutrition, 1997, 14(2): 67-74. |
| [20] |
ANGMO K, KUMARI A, SAVITRI, et al. Probiotic characterization of lactic acid bacteria isolated from fermented foods and beverage of Ladakh[J]. LWT-Food Science and Technology, 2015, 66: 428-435. |
| [21] |
李正华.罗伊氏乳杆菌生物学特性及功能性发酵乳的研究[D].硕士学位论文.无锡: 江南大学, 2008.
|
| [22] |
李平兰, 潘伟好, 吕艳妮, 等. 微生态制剂中常用乳酸菌对抗生素的药敏性研究[J]. 中国农业大学学报, 2004, 9(1): 15-20. |
| [23] |
SHIMADA K, FUJIKAWA K, YAHARA K, et al. Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J]. Journal of Agricultural and Food Chemistry, 1992, 40(6): 945-948. DOI:10.1021/jf00018a005 |
| [24] |
罗佳, 金锋. 肠道菌群影响宿主行为的研究进展[J]. 科学通报, 2014, 59(22): 2169-2190. |
| [25] |
尹胜利, 杜鉴, 徐晨. 乳酸菌的研究现状及其应用[J]. 食品科技, 2012, 37(9): 25-29. |
| [26] |
TIMMERMAN H M, VELDMAN A, VAN DER ELSEN E, et al. Mortality and growth performance of broilers given drinking water supplemented with chicken-specific probiotics[J]. Poultry Science, 2006, 85(8): 1383-1388. DOI:10.1093/ps/85.8.1383 |
| [27] |
ABUSHELAIBI A, AL-MAHADIN S, EL-TARABILY K, et al. Characterization of potential probiotic lactic acid bacteria isolated from camel milk[J]. LWT-Food Science and Technology, 2017, 79: 316-325. DOI:10.1016/j.lwt.2017.01.041 |
| [28] |
SHEKH S L, DAVE J M, VYAS B R M. Characterization of Lactobacillus plantarum strains for functionality, safety and γ-amino butyric acid production[J]. LWT-Food Science and Technology, 2016, 74: 234-241. DOI:10.1016/j.lwt.2016.07.052 |
| [29] |
李东霞, 庞会利, 王雁萍, 等. 高抗菌活性乳酸菌的筛选及菌种鉴定[J]. 饲料工业, 2013, 34(19): 13-17. |
| [30] |
马妙莲, 赵静, 陈晓琳, 等. 具有广谱抑菌活性乳酸菌的筛选及抑菌物质分析[J]. 食品科学, 2012, 33(1): 162-165. |
| [31] |
FAYOL-MESSAOUDI D, BERGER C N, COCONNIER-POLTER M H, et al. pH-, lactic acid-, and non-lactic acid-dependent activities of probiotic Lactobacilli against Salmonella enterica Serovar typhimurium[J]. Applied and Environmental Microbiology, 2005, 71(10): 6008-6013. DOI:10.1128/AEM.71.10.6008-6013.2005 |
| [32] |
孙晓雯, 刘庆, 闫轶洁, 等. 一株新饲用乳杆菌的分离鉴定及益生性研究[J]. 中国畜牧兽医, 2011, 38(9): 30-33. |
| [33] |
HOJSAK I, SHAMIR R. Safety of probiotics[J]. World Review of Nutrition and Dietetics, 2013, 107(11): 161-170. |
| [34] |
PRADHAN D, MALLAPPA R H, GROVER S. Comprehensive approaches for assessing the safety of probiotic bacteria[J]. Food Control, 2020, 108: 106872. DOI:10.1016/j.foodcont.2019.106872 |
| [35] |
COMAN M M, VERDENELLI M C, CECCHINI C, et al. Probiotic characterization of Lactobacillus isolates from canine faeces[J]. Journal of Applied Microbiology, 2019(1): 1245-1256. |
| [36] |
ÖZKAN A, ERHAN T E K. Isolation of ampicillin and vancomycin resistant Enterococcus faecium from dogs and cats[J]. Kafkas Universitesi Veteriner Fakultesi Dergisi, 2019, 25(2): 263-269. |
| [37] |
MOHAPATRA S, CHAKRABORTY T, PRUSTY A K, et al. Fenvalerate induced stress mitigation by dietary supplementation of multispecies probiotic mixture in a tropical freshwater fish, Labeo rohita (Hamilton)[J]. Pesticide Biochemistry and Physiology, 2012, 104(1): 28-37. DOI:10.1016/j.pestbp.2012.06.006 |
| [38] |
夏爽, 谷珊珊, 关乃瑜, 等. 动物肠道中具有益生特征的抗铅乳酸菌的分离与鉴定[J]. 中国兽医科学, 2015, 45(12): 1254-1259. |
| [39] |
陈佩, 党辉, 张秋香, 等. 1株具有潜在降糖作用的益生菌的筛选[J]. 中国食品学报, 2014, 14(11): 27-33. |




