2. 河南省动物疫病与公共卫生重点实验室, 洛阳 471000;
3. 河南省肉羊繁育工程技术研究中心, 洛阳 471000
2. Key Laboratory of Animal Disease and Public Health of Henan Province, Luoyang 471000, China;
3. Research Center of Breeding Engineering Technology for Meat Sheep of Henan Province, Luoyang 471000, China
随着人们饮食结构的改变,高热量、高脂肪食品的摄入量越来越大,而随之心脑血管疾病如高血压、高血脂、冠心病、脑中风、动脉粥样硬化等的发生也越来越严重。据统计,全世界每年死于该类疾病的人数高达1 500万,居各种死因之首[1-2]。研究表明心脑血管疾病与血清胆固醇水平有直接关系,因此,降低血清胆固醇水平可有效防止心血管疾病的发生[3-5]。前人的研究表明某些乳酸菌具有降解介质中胆固醇的能力,这可能与乳酸菌产生的胆盐水解酶(bile salt hydrolase, BSH, EC3.5.1.24)密切相关[6-7]。已报道的能产生BSH的乳酸菌有植物乳杆菌(Lactobacillus acidophilus)、发酵乳杆菌(Lactobacillus fermentum)、副干酪乳杆菌(Lactobacillus plantarum)和双歧杆菌(Bifidobacterium)等[7-10]。另外,在类杆菌、梭菌和肠球菌的代谢产物中也发现有BSH[11-13]。表面上看是某些乳酸菌可以降解介质中的胆固醇,但归根结底,BSH才是使胆固醇降解的最根本原因,所以分离纯化BSH是临床上最为需要的。而目前鲜见有关于BSH高效表达及其纯化方面的文献报道。本实验室前期分离鉴定了1株植物乳杆菌DPP8(GenBank登录号:KR824936;菌种保藏号:CCTCC M2016136)[14],并初步探明了该菌株具有降解胆固醇的功能。在此基础上,本试验利用PCR技术克隆植物乳杆菌DPP8 BSH基因,将其重组于表达载体pET32a(+)中,再转入大肠杆菌BL21(DE3)中进行高效表达,获得重组BSH,并探讨纯化的重组BSH的酶学性质,以期为进一步开发BSH酶制剂和研究其降胆固醇机理奠定基础。
1 材料与方法 1.1 材料与试剂 1.1.1 菌株与质粒植物乳杆菌DPP8,本实验室分离保存;大肠杆菌BL21(DE3)和质粒pET32a(+)均为本实验室保存材料。
1.1.2 培养基MRS液体培养基:蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,磷酸氢二钾2 g,乙酸钠5 g,柠檬酸二铵2 g,葡萄糖20 g,吐温-80 1 mL,七水硫酸镁0.58 g,四水硫酸锰0.25 g,琼脂粉15 g,水1 000 mL,调pH至6.2~6.4,0.11 MPa、121 ℃灭菌20 min。
LB液体培养基:胰化蛋白胨10 g,酵母提取物5 g,氯化钠5 g,1mol/L氢氧化钠溶液1 mL,琼脂15 g,调pH至7.2,0.11 MPa、121 ℃灭菌20 min。
LB固体培养基:在LB液体培养基中加入1.5%的琼脂。
1.1.3 生化试剂及工具酶IPTG、X-gal、Goldview、TaqDNA聚合酶、T4 DNA连接酶、EcoRⅠ、XhoⅠ、DL4500 DNA Marker、DL2000 DNA Marker、DL2000 Plus DNA Marker等均购自日本TaKaRa公司;细菌基因组提取试剂盒、质粒纯化试剂盒、琼脂糖凝胶回收试剂盒等均购自天根生化科技(北京)有限公司。
1.2 仪器与设备PCR仪、水平电泳槽、垂直电泳槽、凝胶成像系统为美国Bio-Rad公司产品;气浴振荡器为上海博迅实业有限公司产品;台式高速离心机为美国Sigma公司产品。
1.3 试验方法 1.3.1 引物设计根据GenBank中已登录的植物乳杆菌源BSH基因(登录号:MBUL90)序列,利用Primer Premier 6.0设计1对引物,BSH1:5’-CGGAATTCATGTGTACTGCCATAACT-3’(划线部分为EcoRⅠ位点),BSH2:5’-CGCTCGAGGTTAACTGCATAGTATTG-3’(划线部分为XhoⅠ位点),送至上海生物工程股份有限公司合成。
1.3.2 植物乳杆菌DPP8基因组DNA的提取将培养的植物乳杆菌DPP8按照天根生化科技(北京)有限公司生产的细菌基因组DNA提取试剂盒的方法提取其基因组DNA。
1.3.3 BSH基因的克隆以植物乳杆菌DPP8基因组DNA为模板,利用引物BSH1和BSH2进行PCR扩增,PCR反应体系(25 μL)为:10×PCR Buffer 2.0 μL,dNTP mixture 2.0 μL,Tks GflexTM DNA Polymerase 0.5 μL,BSH1、BSH2各0.5 μL,模板1 μL,加双蒸水(ddH2O)至25 μL。PCR扩增程序为:95 ℃ 5 min→95 ℃ 30 s,56 ℃ 45 s,72 ℃ 90 s,35个循环→72 ℃ 10 min→4 ℃保存。取4 μL PCR产物经1.0%的琼脂糖凝胶电泳检测。利用天根生化科技(北京)有限公司的琼脂糖凝胶DNA回收试剂盒进行PCR产物的回收,然后将扩增产物连接于pMD18-T,得到克隆质粒pMD18-BSH,将PCR法和酶切法鉴定正确的质粒送至生工生物工程(上海)股份有限公司进行测序。利用DNAstar 6.0软件包中的Meglign将所得BSH基因序列与已发表的相应基因序列进行同源性比较,采用Kimura2-parameter法计算遗传距离,用Neighbor-Joining法构建系统发育树,确定克隆出的是否是BSH基因。
1.3.4 重组表达载体的构建利用限制性内切酶EcoRⅠ和XhoⅠ分别对鉴定正确的克隆质粒pMD18-BSH与表达载体pET32a(+)进行双酶切,分别回收目的条带,16 ℃条件下经T4 DNA连接酶连接过夜,转化大肠杆菌JM109,在含100 μg/mL氨苄青霉素的LB固体培养基上筛选阳性菌株。用质粒提取试剂盒提取质粒,采用PCR法、双酶切法及测序技术进行鉴定,将鉴定正确的质粒命名为pET32a(+)-BSH。
1.3.5 重组质粒pET32a(+)-BSH的转化及阳性菌株筛选参照《分子克隆实验指南》[15]的方法,制备大肠杆菌BL21感受态细胞,将验证正确的重组表达载体pET32a(+)-BSH转化大肠杆菌BL21,取100 μL转化液涂于含氨苄青霉素(终浓度为100 μg/mL)的LB固体培养基中,37 ℃过夜培养,挑取单菌落,接种于LB液体培养基,37 ℃培养16 h,提取质粒DNA,参与PCR法和酶切法进行鉴定。将鉴定正确的重组菌株命名为BL21-BSH。
1.3.6 重组菌株BL21-BSH的诱导表达及纯化将鉴定正确的重组菌株BL21-BSH按1 : 100(体积比)转接入含氨苄青霉素(终浓度为100 μg/mL)的LB液体培养液中,培养至600 nm处吸光度(OD600 nm)=0.6~0.8时,加入异丙基硫代半乳糖苷(IPTG)至终浓度为0.1 mmol/L,37 ℃、180 r/min诱导培养10 h。取培养液,5 000 r/min离心10 min,弃上清,用200 μL柠檬酸-磷酸缓冲液(pH 7.0)洗涤细胞2次。加200 μL的柠檬酸-磷酸缓冲液,置于-20 ℃冰箱中,反复冻融3~4次后,在冰上用超声波破碎细胞后离心收集上清液,加入40 μL 5×上样缓冲液沸水浴10 min,然后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)检测。所得BSH参照文献[16],按照硫酸铵沉淀+DEAE-Sepharose Fast Flow离子交换层析方法进行纯化。
1.3.7 BSH活性测定标准曲线的绘制:取0.5 mmol/L的牛磺酸标准液,配制成5个不同浓度的工作液:0.083、0.167、0.250、0.333、0.417 mmol/L。不同浓度的牛磺酸工作液组成见表 2。不同浓度的牛磺酸工作液于570 nm测其吸光度,以牛磺酸浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
|
|
表 1 牛磺酸工作液配制 Table 1 Preparation of taurine working solution |
取纯化的酶液0.2 mL,分别加入下列试剂:0.3 mL 0.5 mol/L pH为6.0的磷酸缓冲液、0.1 mL 0.12 mmol/L的牛磺胆酸钠、0.3 mL 55 mmol/L的乙二胺四乙酸(EDTA)溶液、0.3 mL 0.01 mmol/L的巯基乙醇溶液、0.3 mL双蒸水,混合均匀后置于37 ℃恒温孵育30 min,然后立即加入1.5 mL 15%的三氯乙酸溶液终止反应;8 000 r/min离心15 min,取0.4 mL上清液,加入2 mL蒸馏水和1.8 mL茚三酮试剂,混合均匀,置于沸水浴中15 min,冰浴冷却至常温,于570 nm测其吸光度。BSH活性定义为每分钟每毫升酶液反应产生牛磺酸的毫摩尔数。
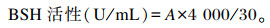
|
式中:A表示牛磺酸的毫摩尔数。
1.3.8 BSH的酶学性质分析 1.3.8.1 温度对BSH活性的影响按照1.3.7方法,将纯化的BSH液分别在22、25、28、31、34、37、40、43、46、49、52 ℃条件下测定其活性,以最高活性为100%,分析温度对BSH活性的影响。
将纯化的BSH液分别在20、25、30、35、40、45、50、55、60、65、70 ℃条件下处理1 h,按照1.3.7方法测定其活性,以不进行温度处理样品的BSH活性为100%,分析BSH的热稳定性。
1.3.8.2 pH对BSH活性的影响利用磷酸盐缓冲液和碳酸钠-碳酸氢钠缓冲液将纯化的BSH液的pH分别调至4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,在该酶的最适反应温度下,按照1.3.7方法测定BSH活性,以最高活性为100%,分析pH对BSH活性的影响。
利用磷酸盐缓冲液和碳酸钠-碳酸氢钠缓冲液将纯化的BSH液的pH分别调至3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,在该酶的最适反应温度下放置1 h后,按照1.3.7方法测定BSH活性,以最高活性为100%,分析BSH的pH稳定性。
1.3.8.3 金属离子对BSH活性的影响在BSH反应体系中,分别加入钠离子(Na+)、钾离子(K+)、镁离子(Mg2+)、二价铁离子(Fe2+)、铜离子(Cu2+)、锰离子(Mn2+)、锂离子(Li2+)、铝离子(Al3+)、三价铁离子(Fe3+)、锌离子(Zn2+)、钙离子(Ca2+)和钡离子(Ba2+),使其终浓度为1 mmol/L,在BSH最适反应温度和pH条件下反应60 min,按照1.3.7方法测定BSH活性,以不加金属离子样品(对照)的BSH活性为100%,分析不同金属离子对BSH活性的影响。
1.4 数据处理采用Excel 2010软件进行数据处理及图形绘制。
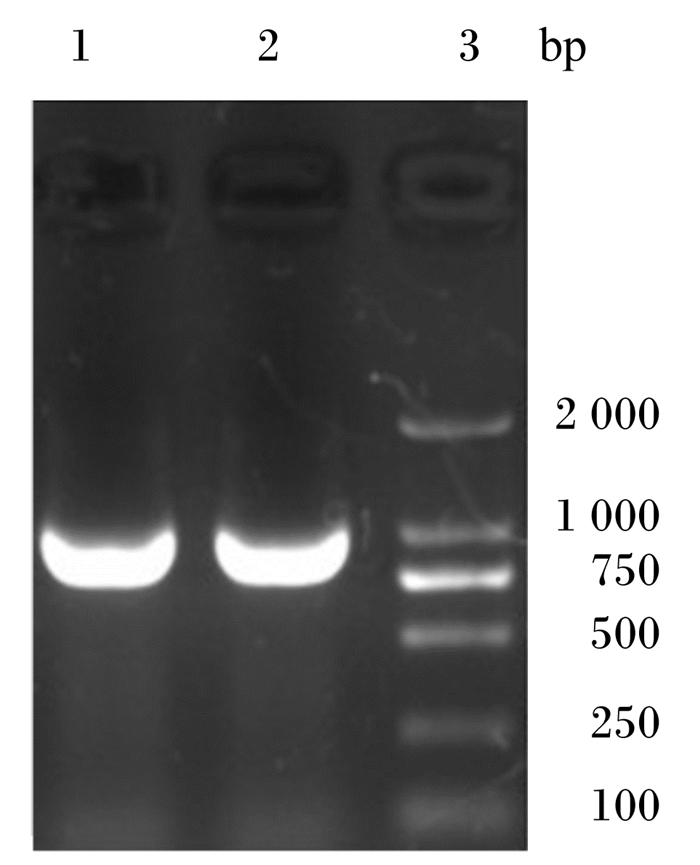
2 结果与分析 2.1 BSH基因PCR扩增结果以植物乳杆菌DPP8全基因组DNA为模板,经PCR扩增后,产物在1.0%的琼脂糖凝胶上电泳,如图 1所示,在约975 bp处有1条特异性条带,与预期大小相符。
|
泳道1、2:PCR扩增产物;泳道3:DL2000 DNA Marker。 Lanes 1 and 2: PCR amplification product; lane 3: DL2000 DNA Marker. 图 1 BSH基因PCR扩增结果 Fig. 1 PCR amplification result of BSH gene |
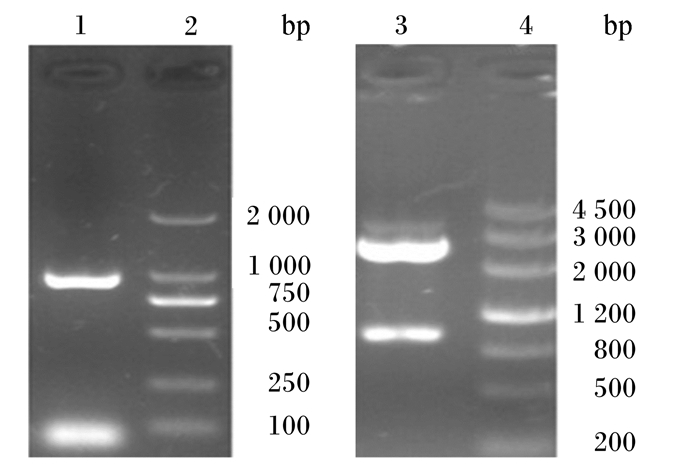
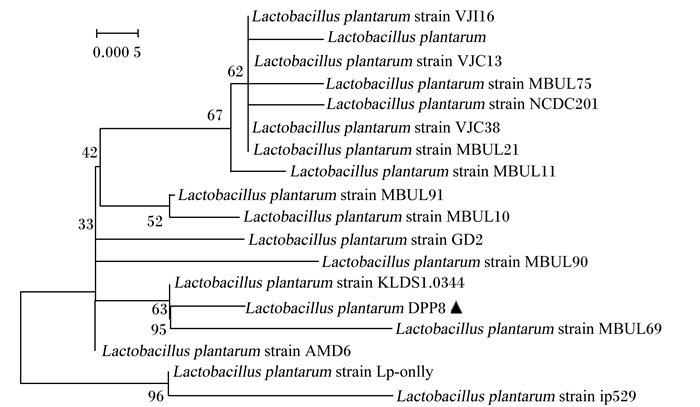
以pMD18-BSH质粒为模板,通过PCR扩增出1条约为975 bp的条带(图 2中泳道1),与目的基因大小相符;将质粒pMD18-BSH用EcoR Ⅰ和Xho Ⅰ双酶切后,在1.0%的琼脂糖凝胶上显示出2条条带(图 2中泳道3),大小分别约为975和2 692 bp,结果与目的基因大小相符,表明成功克隆了BSH基因。测序结果表明所克隆基因全长为975 bp,编码1条324个氨基酸的多肽,将其序列提交到GenBank,登录号为:KT343778。将该序列提交到GenBank上进行BLAST,选取同源性99%以上的序列,采用Mega 6.0软件进行系统进化树分析,结果如图 3所示。植物乳杆菌DPP8 BSH基因与其他植物乳杆菌源BSH基因具有较近的亲缘关系,尤其是与植物乳杆菌MBUL69,二者的BSH基因在同一分支中,说明亲缘关系较近,进一步验证了从植物乳杆菌DPP8中成功克隆出了BSH基因。
|
泳道1:PCR扩增产物;泳道2:DL2000 DNA Marker;泳道3:经EcoR Ⅰ和Xho Ⅰ双酶切后PCR扩增产物;泳道4:DL4500 DNA Marker。 Lane 1: PCR amplification product; lane 2:DL2000 DNA Marker; lane 3: PCR amplification product after being double digested by EcoR Ⅰ and Xho Ⅰ; lane 4: DL4500 DNA Marker. 图 2 质粒pMD18-BSH PCR扩增产物及酶切鉴定 Fig. 2 PCR amplification product and enzyme digestion identification of plasmid pMD18-BSH |
|
Lactobacillus plantarum:植物乳杆菌;strain:菌株。 图 3 基于Neighbor-Joining法构建植物乳杆菌DPP8 BSH基因序列系统进化树分析 Fig. 3 Phylogenetic tree analysis based on BSH gene sequence from Lactobacillus plantarum DPP8 by Neighbor-Joining method |
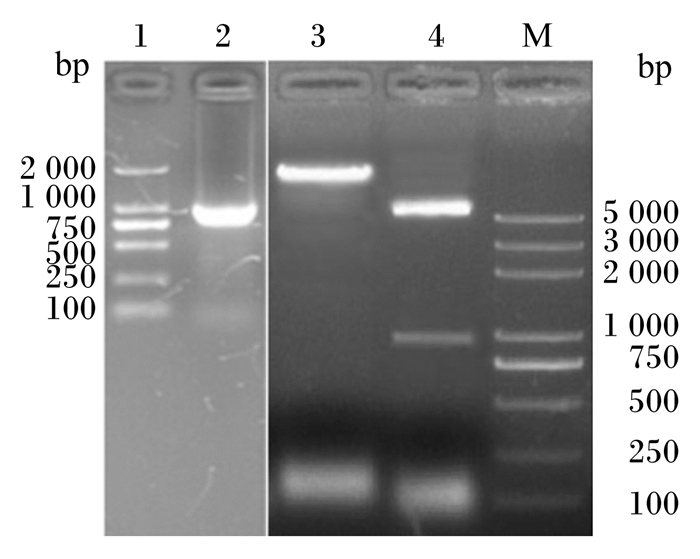
由图 4可知,重组质粒pET32a(+)-BSH经PCR扩增出1条975 bp的条带,与目的条带大小相符;经EcoRⅠ、XhoⅠ双酶切后分别得到2条大小分别约为5 900和975 bp的条带,经EcoRⅠ单酶切得到1条大小约为6 900 bp条带。上述结果说明BSH基因已插入表达载体pET32a(+)中。
|
泳道1:DL2000 DNA Marker;泳道2:PCR扩增产物;泳道3:经EcoRⅠ酶切后PCR扩增产物;泳道4:经XhoⅠ、EcoRⅠ双酶切后PCR扩增产物;泳道M:DL2000 plus DNA Marker。 Lane 1: DL2000 DNA Marker; lane 2: PCR amplification product; lane 3: amplification product after being digested by EcoR Ⅰ; lane 4: PCR amplification product after being double digested by EcoR Ⅰ and Xho Ⅰ; lane M: DL2000 plus DNA Marker. 图 4 重组质粒pET32a(+)-BSH PCR扩增产物及酶切鉴定 Fig. 4 PCR amplification product and enzyme digestion identification of recombinant plasmid pET32a(+)-BSH |
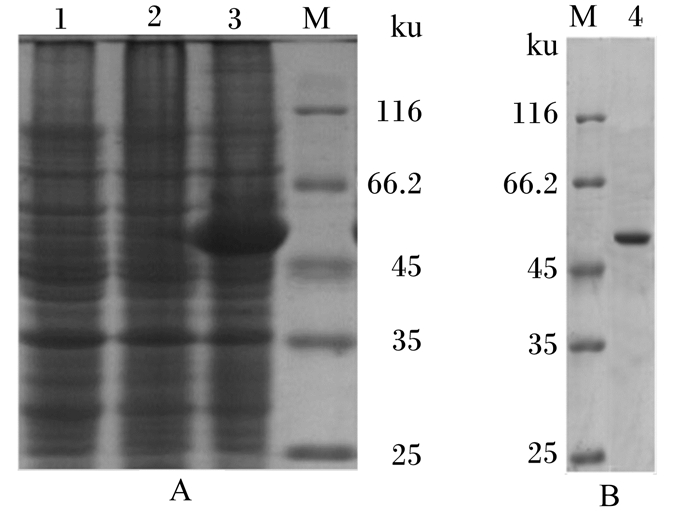
经IPTG诱导后的重组大肠杆菌进行SDS-PAGE,其结果见图 5-A。在图 5-A泳道3的56 ku处有1条较明显的蛋白条带,理论上BSH蛋白的大小应约为37.1 ku,但载体pET32a(+)上具有融合的标签蛋白,大小为18 ku,所以表达出的融合蛋白应为55~56 ku,与预期蛋白分子质量大小相符,而经诱导的pET32a(+)/BL21和未诱导的重pET32a(+)-BSH(BL21)在56 ku处均无此条带,说明BSH蛋白在大肠杆菌BL21中得到了表达。图 5-B为BSH蛋白经纯化后的SDS-PAGE条带。
|
泳道1:未经诱导的pET32a(+)-BSH(BL21);泳道2:经诱导的pET32a(+)(BL21);泳道3:经诱导的pET32a(+)-BSH(BL21);泳道4:纯化蛋白;泳道M:蛋白质Marker。 Lane 1: uninduced pET32a(+)-BSH(BL21); lane 2: induced pET32a(+)(BL21); lane 3: induced pET32a(+)-BSH(BL21); lane 4: purified protein; lane M: protein Marker. 图 5 重组蛋白的SDS-PAGE及纯化 Fig. 5 SDS-PAGE and purification of recombinant protein |
牛磺酸浓度测定标准曲线方程为Y=2.122X-0.012 1(R2=0.996 4),其中X代表牛磺酸含量,Y代表570 nm处吸光度。
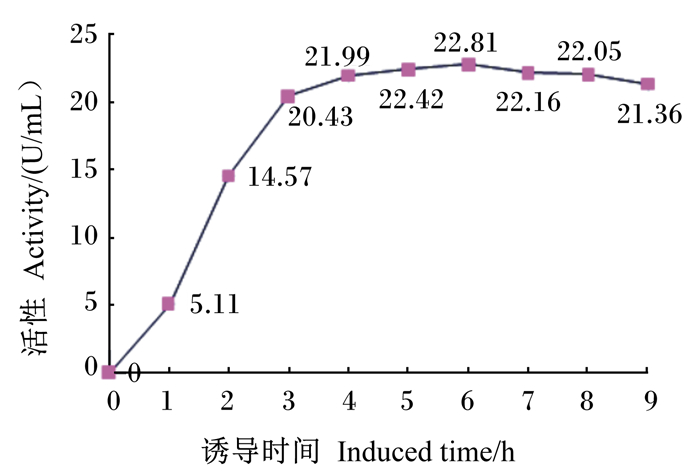
重组大肠杆菌经不同时间诱导,分别取不同诱导时间的大肠杆菌裂解液,采用牛磺酸标准液标定法进行BSH活性的测定,结果见图 6。重组菌株BL21/pET32a(+)-BSH在培养0~6 h时BSH活性不断升高,培养到6 h时BSH活性达到最大值22.81 U/mL,但在诱导4 h后活性已基本稳定,且超过6 h后随着诱导时间的延长活性还有下降的趋势。
|
图 6 不同诱导时间表达产物BSH活性 Fig. 6 BSH activity in expression products with different induced time |
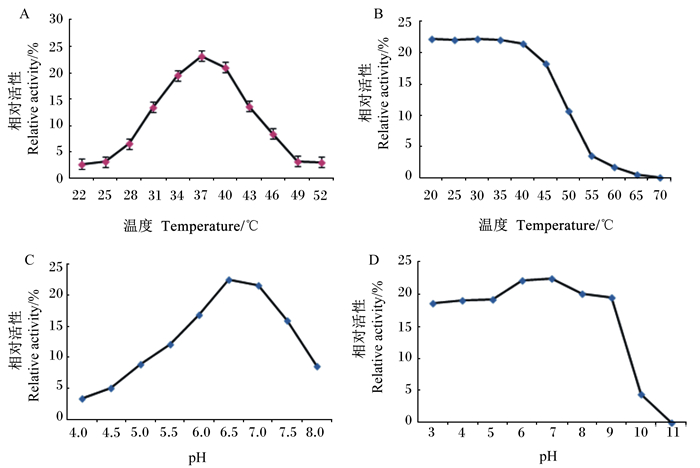
纯化的BSH在22~52 ℃温度下测得的BSH活性如图 7-A所示,可知BSH最适反应温度为37 ℃。将纯化的BSH经20~70 ℃保温处理1 h后,再测定其残余的BSH活性,检测其对热的稳定性,结果如图 7-B所示,该酶在40 ℃之前活性基本不变,40 ℃之后活性急骤下降,70 ℃时活性降为0,表明其对高温敏感。
|
A:温度对BSH活性的影响;B:温度对BSH稳定性的影响;C:pH对BSH活性的影响;D:pH对BSH稳定性的影响。 A: effects of temperature on BSH activity; B: effects of temperature on BSH stability; C: effects of pH on BSH activity; D: effects of pH on stability of BSH stability. 图 7 温度和pH对BSH活性及稳定性的影响 Fig. 7 Effects of temperature and pH on BSH activity and stability |
将纯化的BSH在不同pH条件下进行酶促反应,检测其BSH活性,结果如图 7-C所示,可以看出该酶酶促反应的最适pH为6.5。将纯化的BSH在pH 3.0~11.0条件下处理后,再检测其BSH活性,测定其对pH的稳定性,结果如图 7-D所示,可以看出BSH活性在pH 3.0~9.0时能保持在90%以上,在pH 9.0以后呈急骤下降趋势,表明该酶对高pH较敏感,而对低pH的适应性较强。
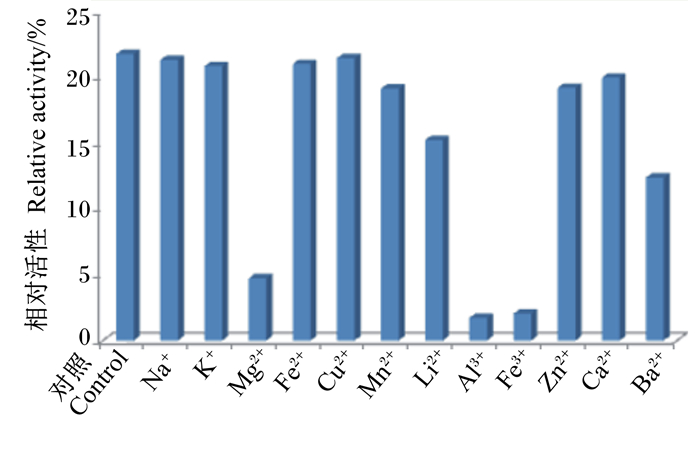
2.8 金属离子对BSH活性的影响金属离子对BSH活性的影响如图 8所示。在检测的金属离子范围内,各种金属离子对BSH活性均未呈现出较为明显的促进作用,其中Na+、K+、Fe2+、Cu2+、Mn2+、Zn2+、Ca2+对BSH活性无明显抑制作用,而Mg2+、Al3+、Fe3+对BSH活性的抑制作用较强,相对活性均在25%以下,Li2+、Ba2+对BSH活性也有一定的抑制作用。
|
图 8 金属离子对BSH活性的影响 Fig. 8 Effects of metal ions on BSH activity |
BSH是一种由微生物代谢产生的胞内酶,在基因组上诠释是由BSH基因编码的一种蛋白质,能够水解介质中结合态的牛胆酸盐和甘氨酸盐生成氨基酸和非结合态胆酸,非结合态胆酸能与胆固醇结合形成沉淀,随粪便排出体外,从而降低介质中胆固醇的含量[16-17];另外,由于胆酸是胆固醇合成的前体物,所以体内胆固醇的合成速度会受到影响,从而也能降低介质中胆固醇的含量[18-19]。因此,BSH是该类菌株降解胆固醇的必要条件之一,所以研究基于含BSH的降胆固醇菌株或BSH对于降低动物性食品中胆固醇含量,减少人们胆固醇摄取量,以降低心血管疾病的发病率,对保证人类健康具有极其重要的意义。
据目前的报道,BSH主要来自于乳酸菌,但这些菌株中的BSH仅仅是其自身众多代谢成分之一,往往存在表达量不高、实际应用效果不明显等情况。本课题组在前期分离筛选的菌株中,对培养基中胆固醇降解率最高可达35.93%,通过饲喂小鼠30 d后,高脂血症小鼠血清胆固醇含量比对照组降低27%[14],虽然比Gu等[20]研究的植物乳杆菌CGMCC8198对高脂血症小鼠血清胆固醇的降解率20%还要高,但还不能满足实际需要。若提高其降解效果,一是通过对原始菌株进行诱变,筛选BSH突变株;二是通过基因工程技术将BSH在高效表达系统中进行表达,然后将BSH直接开发成可食用的酶制剂或药物用于降低血清胆固醇含量,以预防心脑血管疾病。但是一般情况下,体外诱变使菌株中目标酶活性提高的水平很有限。本研究就是基于这一点,从植物乳杆菌DPP8基因组上克隆获得了BSH基因,并将其重组入大肠杆菌表达载体pET32a(+),且实现了在大肠杆菌BL21中的高效表达,表达量是原始菌株植物乳杆菌DPP8的近4倍[21]。该结果与任婧等[22]将植物乳杆菌ST-Ⅲ的4种BSH的编码序列(BSH1~4)分别在pET-28b(+)进行表达,所得4种BSH的活性分别为29.00、20.49、24.90、21.13 U/mL稍有差异。这可能是因为任婧等[22]使用的是BL21/pET-28b(+)表达系统,本研究使用的是BL21/pET32a(+),亦或有表达条件差异所引起的原因。
酶学性质研究发现所表达的BSH的最适反应pH为6.5、最适反应温度为37 ℃,这与王继超等[23]研究得出植物乳杆菌源纯化BSH的最适反应为pH 6.0、最适反应温度为37 ℃基本一致。而赵瑞香等[24]研究发现嗜酸乳杆菌源BSH的最适反应pH为6.0、最适反应温度为40 ℃,说明不同乳酸菌源BSH在酶学性质上会有一定的差异;同时,其研究显示Ca2+、Mn2+、Mg2+、Fe2+、Zn2+对BSH活性有促进作用,Cu2+、Ba2+对BSH活性有抑制作用,这与本研究结果差异较大,这可能是因为不同乳酸菌源BSH的分子结构不同,从而导致不同金属离子能够影响的活性基团存在差异。
以上结果表明了本试验成功获得了基于BSH的大肠杆菌高效表达系统,为进一步开发BSH酶制剂提供了可能,也为研究BSH的作用机制奠定了基础。
4 结论① 本试验成功克隆了植物乳杆菌DPP8 BSH基因,丰富了BSH基因库。通过基因工程技术将其重组入大肠杆菌高效表达系统BL21/pET32a(+),SDS-PAGE检测证明BSH在大肠杆菌中获得了高效表达,重组菌株经IPTG诱导6 h后BSH活性最高可达22.81 U/mL。
② 本试验重组大肠杆菌表达系统所表达的BSH的最适反应温度为37 ℃,最适反应pH为6.5,在40 ℃以下时具有较高的活性,pH在3.0~9.0时可保持90%以上的活性,Mg2+、Al3+、Fe3+对其活性具有较强的抑制作用。
| [1] |
MATTIUZZI C, SANCHIS-GOMAR F, LIPPI G. Worldwide burden of LDL cholesterol:implications in cardiovascular disease[J]. Nutrition, Metabolism & Cardiovascular Diseases, 2020, 30(2): 241-244. |
| [2] |
SALTIJERAL A, ESCOBAR C, DE ISLA L P, et al. Lifestyle and cardiovascular risk factors in Spanish, Portuguese and Latin-American cardiologists.PREDICA survey[J]. REC:CardioClinics, 2019, 54(1): 17-26. DOI:10.1016/j.rccl.2018.12.011 |
| [3] |
CHAMPAGNE C P, RAYMOND Y, GUERTIN N, et al. Growth of Lactobacillus reuteri NCIMB 30242 during yogurt fermentation and bile salt hydrolysis activity in the product[J]. Dairy Science & Technology, 2016, 96(2): 173-184. |
| [4] |
VAN SCHIE M C, JAINANDUNSING S, VAN LENNEP J E R. Monogenetic disorders of the cholesterol metabolism and premature cardiovascular disease[J]. European Journal of Pharmacology, 2017, 816: 146-153. DOI:10.1016/j.ejphar.2017.09.046 |
| [5] |
XU X Y, DEBORAH P, INGLIS S C, et al. Can regular long-term breakfast cereals consumption benefits lower cardiovascular diseases and diabetes risk?A longitudinal population-based study[J]. Annals of Epidemiology, 2019, 37: 43-50.e3. DOI:10.1016/j.annepidem.2019.07.004 |
| [6] |
GUO L D, WANG L Q, LIU F, et al. Effect of bile salt hydrolase-active Lactobacillus plantarum KLDS 1.0344 on cholesterol metabolism in rats fed a high-cholesterol diet[J]. Journal of Functional Foods, 2019, 61: 103497. DOI:10.1016/j.jff.2019.103497 |
| [7] |
NAMI Y, BAKHSHAYESH R V, MANAFI M, et al. Hypocholesterolaemic activity of a novel autochthonous potential probiotic Lactobacillus plantarum YS5 isolated from yogurt[J]. LWT, 2019, 111: 876-882. DOI:10.1016/j.lwt.2019.05.057 |
| [8] |
CAVALCANTE R G S, DE ALBUQUERQUE T M R, DE LUNA FREIRE M O, et al. The probiotic Lactobacillus fermentum 296 attenuates cardiometabolic disorders in high fat diet-treated rats[J]. Nutrition, Metabolism and Cardiovascular Diseases, 2019, 29(12): 1408-1417. DOI:10.1016/j.numecd.2019.08.003 |
| [9] |
BHAT B, BAJAJ B K. Hypocholesterolemic potential and bioactivity spectrum of an exopolysaccharide from a probiotic isolate Lactobacillus paracasei M7[J]. Bioactive Carbohydrates and Dietary Fibre, 2019, 19: 100191. DOI:10.1016/j.bcdf.2019.100191 |
| [10] |
BO T B, WEN J, ZHAO Y C, et al. Bifidobacterium pseudolongum reduces triglycerides by modulating gut microbiota in mice fed high-fat food[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2020, 198: 105602. DOI:10.1016/j.jsbmb.2020.105602 |
| [11] |
MORGAN A E, MOONEY K M, WILKINSON S J, et al. Cholesterol metabolism:a review of how ageing disrupts the biological mechanisms responsible for its regulation[J]. Ageing Research Reviews, 2016, 27: 108-124. DOI:10.1016/j.arr.2016.03.008 |
| [12] |
GERVASI T, HORN N, WEGMANN U, et al. Expression and delivery of an endolysin to combat Clostridium perfringens[J]. Applied Microbiology and Biotechnology, 2014, 98(6): 2495-2505. DOI:10.1007/s00253-013-5128-y |
| [13] |
ZHANG F, QIU L, XU X P, et al. Beneficial effects of probiotic cholesterol-lowering strain of Enterococcus faecium WEFA23 from infants on diet-induced metabolic syndrome in rats[J]. Journal of Dairy Science, 2017, 100(3): 1618-1628. DOI:10.3168/jds.2016-11870 |
| [14] |
丁盼盼, 丁轲, 余祖华, 等. 降胆固醇乳酸杆菌的筛选及对小鼠血清胆固醇的影响[J]. 食品科学, 2016, 37(15): 192-197. DOI:10.7506/spkx1002-6630-201615032 |
| [15] |
格林M R, 莎姆布鲁克J.分子克隆实验指南[M].3版.黄培堂, 译.北京: 科学出版社, 2013: 87-96.
|
| [16] |
BUSTOS A Y, DE VALDEZ G F, FADDA S, et al. New insights into bacterial bile resistance mechanisms:the role of bile salt hydrolase and its impact on human health[J]. Food Research International, 2018, 112: 250-262. DOI:10.1016/j.foodres.2018.06.035 |
| [17] |
LIONG M T, SHAH N P. Bile salt deconjugation ability, bile salt hydrolase activity and cholesterol co-precipitation ability of Lactobacilli strains[J]. International Dairy Journal, 2005, 15(4): 391-398. DOI:10.1016/j.idairyj.2004.08.007 |
| [18] |
ITO M, SHIMIZU K, HONDA H. Searching for high-binding peptides to bile acid for inhibition of intestinal cholesterol absorption using principal component analysis[J]. Journal of Bioscience and Bioengineering, 2019, 127(3): 366-371. DOI:10.1016/j.jbiosc.2018.08.006 |
| [19] |
APRO J, BECKMAN L, ANGELIN B, et al. Influence of dietary sugar on cholesterol and bile acid metabolism in the rat:marked reduction of hepatic Abcg5/8 expression following sucrose ingestion[J]. Biochemical and Biophysical Research Communications, 2015, 461(4): 592-597. DOI:10.1016/j.bbrc.2015.04.070 |
| [20] |
GU X C, LUO X G, WANG C X, et al. Cloning and analysis of bile salt hydrolase genes from Lactobacillus plantarum CGMCC No.8198[J]. Biotechnology Letters, 2014, 36(5): 975-983. DOI:10.1007/s10529-013-1434-9 |
| [21] |
丁盼盼.降解胆固醇乳酸杆菌的分离、功能鉴定及其基因的克隆与表达[D].硕士学位论文.洛阳: 河南科技大学, 2016: 17-18.
|
| [22] |
任婧, 姚晶. 植物乳杆菌ST-Ⅲ胆盐水解酶的表达及其酶活力分析[J]. 食品科学, 2012, 33(17): 165-168. |
| [23] |
王继超, 李秀凉.胆盐水解酶的分离纯化及酶学性质的研究[D].硕士学位论文.哈尔滨: 黑龙江大学, 2013.
|
| [24] |
赵瑞香, 李刚, 牛生洋, 等. 嗜酸乳杆菌胆盐水解酶的分离纯化及酶学性质[J]. 食品科学, 2014, 35(5): 165-168. |




