2. 佛蒙特大学, 伯灵顿 05405
2. The University of Vermont, Burlington 05405, USA
随着人们生活水平的提高和健康意识的增强,牛奶因含有丰富的优质蛋白质已经逐渐成为人们日常饮食的一部分。牛奶蛋白主要包括酪蛋白(casein)、乳清蛋白(α-lactalbumin,α-LA/LALBA)和乳球蛋白(β-LG,BLG)。酪蛋白是牛奶蛋白的主要成分,主要包括αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和κ-酪蛋白,其对应的编码基因分别是CSN1S1、CSN1S2、CSN2和CSN3。作为编码乳蛋白中最重要的蛋白质——酪蛋白的基因,已经成为了研究乳蛋白的靶点。研究表明,牛奶合成过程中需要能量、前体物和相关信号通路的参与,泌乳激素(如催乳素)在此过程中发挥着重要的调节作用。牛奶生产过程中,奶牛乳腺上皮细胞(MECs)需要从血液中摄取葡萄糖,此过程受葡萄糖转运子1(GLUT1)和葡萄糖转运子8(GLUT8)的调节[1]。研究表明,在妊娠晚期到泌乳早期,乳腺上皮细胞中GLUT1和GLUT8基因的表达会显著上调[2]。乳房炎是影响奶业生产的第一大疾病,它主要是由细菌侵入奶牛乳腺所致。当细菌通过奶牛乳头进入乳腺组织,细菌便会产生毒素、酶、细胞壁的成分[如脂多糖(LPS)]和炎症介质[如细胞因子白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)等[2-3]]。LPS是一种革兰氏阴性菌细胞壁的主要组成成分,又称内毒素。一方面,奶牛高精料饲粮引起的瘤胃内环境紊乱,进而导致瘤胃内源性微生物崩解而产生大量的LPS,这些LPS进一步随血流进入乳腺组织释放;另一方面,饲养环境中的外源性微生物可以通过奶牛乳头进入乳腺组织,在奶牛强大的免疫系统作用下,这些进入奶牛乳腺组织的病原微生物被大量杀死而释放LPS。不管是由于哪种形式,都能够引起一系列先天性免疫基因对革兰氏阴性菌感染的应答,即只要有LPS的释放,炎症介质就会吸引大量多形态中性粒细胞和吞噬细胞向感染部位移动,以清除异物,导致局部炎症,即乳腺炎。关于LPS对奶牛乳腺炎症反应应答机制的影响,主要有2种说法:一种是LPS-细胞因子-核转录因子-κB(NF-κB)-一氧化氮合酶(iNOS) 信号通路,另一种是LPS-细胞因子-p38丝裂原活化蛋白激酶(p38MAPK)-iNOS信号通路[4]。NF-κB被认为是免疫反应的核心介质[5]。NF-κB进入细胞核,反激活编码促炎细胞因子基因的表达。研究结果表明,由LPS诱导的大鼠乳腺上皮细胞(MMECs)炎症可导致多种细胞因子基因表达,包括TNF-α、白细胞介素-6(IL-6)和白细胞介素-1β(IL-1β)[6]。乳腺炎会造成暂时或永久性的乳腺组织损伤,减少乳腺上皮细胞的数量和活性,导致泌乳量的下降[4]。因为不管什么原因造成的乳腺炎,LPS都是造成奶牛乳腺损伤和降低乳品质的根本,所以需要对LPS影响酪蛋白合成的机制进行深入研究。本试验假设在乳腺上皮细胞中,LPS能通过增加葡萄糖消耗进而增加GLUT基因的表达,最终抑制酪蛋白基因的表达。在这个假设基础上,本试验以体外培养的HC11细胞为载体,探讨LPS对HC11细胞中主要酪蛋白基因(CSN1S1、CSN2、α-LA)、葡萄糖转运因子基因(GLUT1和GLUT8)和相关细胞因子基因(IL-6、IL-1β和TNF-α)表达的影响,旨在为奶牛养殖实践中奶牛乳腺炎的防治提供思路和依据。
1 材料与方法 1.1 细胞模型HC11细胞来自于妊娠中期BALB/c大鼠的细胞系,由美国佛蒙特大学赵凤启教授实验室提供。
1.2 试验设计采用单因素试验设计,共设置6个组,研究不同剂量的LPS对HC11细胞酪蛋白相关基因、葡萄糖转运因子和细胞因子基因表达的影响。试验设计方案见表 1。
|
|
表 1 试验设计表 Table 1 Test design table |
复苏后的HC11细胞以2×105个/孔等密度接种于6孔板,先用生长培养基DMEM/F12(10%胎牛血清,100 U/mL双抗,5 μg/mL胰岛素,10 ng/mL表皮生长因子,所有试剂均来自美国Gibco公司)培养至细胞80%贴壁后,从培养箱取出细胞,用磷酸盐缓冲液(PBS)清洗细胞3次,换用前激素诱导培养基PIM(用10%木炭处理的马血清替代10%胎牛血清)培养24 h后,再用PBS清洗细胞3次,再换用激素诱导培养基HIM(100 ng/mL地塞米松,5 μg/mL催乳素),按照试验设计将细胞分为对照组(0 ng/mL LPS)和试验组(分别添加100、500、1 000、5 000、25 000 ng/mL LPS),每组设3个重复,每个重复3个孔,继续培养3和24 h后收获细胞,用于测定各基因表达量。
总RNA的提取采用RNeasy Plus Kit (Qiagen)试剂盒并按说明书进行,RNA的转录采用SuperScriptTM Ⅲ Reverse Transcriptase (Invitrogen)试剂盒并按说明书进行,以甘油醛-3-磷酸脱氢酶(GAPDH)、β-肌动蛋白(β-actin)和次黄嘌呤磷酸核糖基转移酶(HPRT)为内参基因,采用SYBR green试剂盒并按说明书对各基因表达量进行分析,基因表达量用2-ΔΔCt法进行计算。基因引物信息见表 2。
|
|
表 2 基因引物信息 Table 2 Primer information of genes |
采用SAS 9.1中的单因素方差分析进行数据处理,并采用Tukey法进行多重比较。P < 0.05表示差异显著。
2 结果 2.1 LPS对大鼠乳腺上皮细胞酪蛋白基因表达的影响由图 1可见,与对照组相比,对于CSN1S1基因,LPS作用于奶牛乳腺上皮细胞较短时间(3 h)时,1 000~25 000 ng/mL的LPS显著增加了CSN1S1基因的表达量(P < 0.05);作用较长时间(24 h)时,所有剂量的LPS均显著增加了CSN1S1基因的表达量(P < 0.05)。与对照组相比,对于CSN2基因,不同剂量、不同作用时间的LPS均显著降低了CSN2基因的表达量(P < 0.05)。与对照组相比,对于α-LA基因,LPS作用时间较短(3 h)时,500~1 000 ng/mL的LPS显著增加了α-LA基因的表达量(P < 0.05);随着作用时间的延长(24 h),不同剂量的LPS均显著抑制了α-LA基因的表达(P < 0.05)。
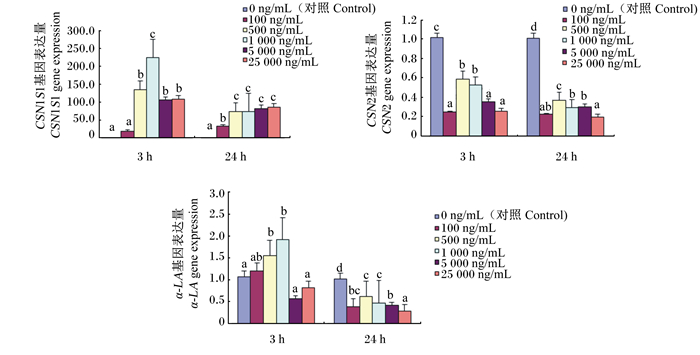
|
数据柱标注不同小写字母表示差异显著(P < 0.05)。下图同。 Value columns with different small letters mean significant difference (P < 0.05). The same as below. 图 1 LPS对HC11细胞中酪蛋白基因表达的影响 Fig. 1 Effects of LPS on casein gene expression in HC11 cells |
由图 2可见,从剂量效应来看,对于IL-6基因,与对照组相比,1 000 ng/mL的LPS作用于HC11细胞3 h时显著增加了IL-6基因的表达量(P < 0.05),但若持续作用24 h,则100~25 000 ng/mL的LPS显著增加IL-6基因的表达量(P < 0.05)。对于IL-1β基因,与对照组相比,大于500 ng/mL的LPS作用3 h时显著增加了IL-1β基因的表达量(P < 0.05),但若持续作用24 h,大于500 ng/mL的LPS作用3 h时显著增加了IL-1β基因表达量(P < 0.05)。对于TNF-α基因,与对照组相比,所有剂量的LPS,不论作用于HC11细胞3 h还是24 h,均显著增加了TNF-α基因的表达量(P < 0.05)。从时间效应来看,对于绝大多数LPS剂量添加组,3种细胞因子基因的表达量在LPS作用24 h时均高于3 h时。
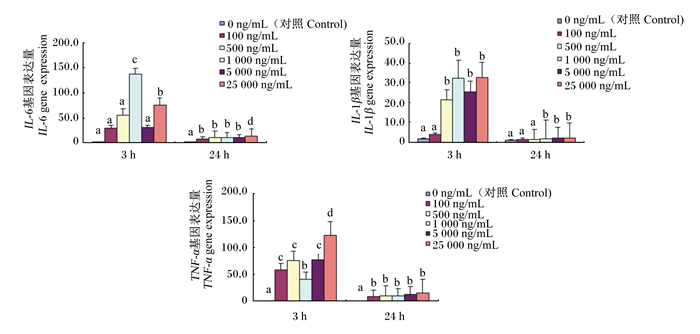
|
图 2 LPS对HC11细胞中细胞因子基因表达的影响 Fig. 2 Effects of LPS on cytokine gene expression in HC11 cells |
由图 3可见,大于5 000 ng/mL的LPS显著增加了作用3 h时GLUT1基因的表达量(P < 0.05);作用24 h时,500 ng/mL的LPS显著增加了GLUT1基因的表达量(P < 0.05),其他各组与对照组相比差异不显著(P>0.05)。与对照组相比,各个剂量的LPS均显著抑制了作用3 h时GLUT8基因的表达(P < 0.05),作用24h时,LPS对GLUT1和GLUT8基因表达量的影响差异均不显著(P>0.05)。
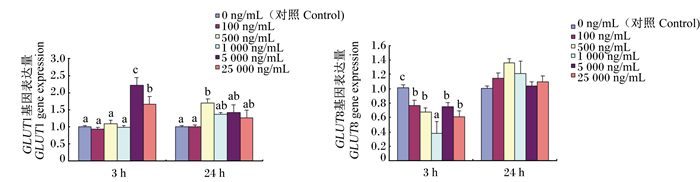
|
图 3 LPS对HC11细胞中葡萄糖转运因子基因表达的影响 Fig. 3 Effects of LPS on glucose transporter gene expression in HC11 cells |
据报道,世界上至少有1/3的奶牛患有乳腺炎,隐性乳腺炎的发病率甚至更高,每年造成的经济损失高达350亿美元,隐性乳腺炎在中国的发病率为40%~80%。乳腺炎被列为奶牛的四大主要疾病之一,但目前仍没有合适的防治方案。因此,建立体外大鼠模型,研究乳腺炎对奶牛产奶量的影响机制,以保证乳业的健康发展,提高奶牛的产奶量很有必要的。LPS是革兰氏阴性菌细胞膜的主要成分,也是一种毒素,会引起氧化损伤,被广泛用于建立炎症和细菌感染的动物模型。本试验采用不同剂量的LPS在HC11细胞系中建立乳腺炎模型,研究炎症对酪蛋白基因、葡萄糖转运因子和相关细胞因子等基因表达的影响。
3.1 LPS对大鼠乳腺上皮细胞酪蛋白基因表达的影响对于酪蛋白基因的研究,学者们一致认为,酪蛋白基因的高表达是乳中酪蛋白的合成和分泌的前提,同时酪蛋白的合成还受氨基酸、葡萄糖、小肽等蛋白质合成前体物供给量的影响,并受激素水平的调控。炎症状态下,由于能量等营养物质的重分配、乳腺组织的破坏等会引起酪蛋白合成的减少。本试验研究结果表明,不同剂量、不同作用时间的LPS作用于HC11细胞,均显著抑制了催乳素诱导的CSN2基因的表达,5 000 ng/mL的LPS作用于HC11细胞3 h时对催乳素诱导的α-LA基因的表达也有抑制作用。前人研究结果[7, 11-13]都证实了这一点,说明在LPS诱导的炎症状态下,小肽、氨基酸、脂肪酸等乳成分合成前体物大多被动员用于抗炎,而用于乳蛋白合成和泌乳的前体物相对减少,因此造成了酪蛋白基因表达量的下降。但是对于本试验得到的不管LPS作用于大鼠乳腺上皮细胞3 h还是24 h,均增加了CSN1S1基因的表达量,尤其是1 000 ng/mL的LPS作用3 h时,500 ng/mL以上的LPS作用24 h时均显著增加了CSN1S1基因的表达量的结果还不多见。Vordenbäumen等[14]研究发现,10 μg/mL CSN1S1作用24 h,可以使人单核细胞中CD14和CD64表达量平均上调2.5和1.9倍,作用24和48 h分别使吞噬活动增加1.4和1.9倍,抑制细胞外信号调节蛋白激酶1/2(ERK1/2)可抑制CSN1S1诱导的CD14表达量上调,而应激活化蛋白激酶(JNK)和p38蛋白(p38)抑制剂阻碍了CSN1S1诱导的促炎细胞因子IL-1β或IL-6的分泌,说明CSN1S1在体外诱导单核细胞向巨噬细胞样表型分化,推测CSN1S1的功能也可能超越了营养特性,还包括免疫调节作用。陈静波[15]、Ingham等[16]和Yamaji等[17]研究发现,用不同浓度的LPS刺激人单核细胞使CSN1S1的mRNA表达量显著增加,说明CSN1S1的合成受到某些蛋白的刺激可能会发生差异性表达;用低剂量的LPS能使乳腺细胞基因组甲基化水平升高,导致泌乳相关基因表达降低,而高剂量的LPS反而能使基因组甲基化水平和发生甲基化的基因数量降低。
陈晨等[18]研究表明,CSN1S1基因型为AB和BB型,κ-αs1-β-复合酪蛋白多态性与κ-酪蛋白和αs2-酪蛋白相对含量显著相关。Cieslak等[19]研究发现,CSN1S1中的1个基因型与马奶总蛋白含量有关。Wang等[20]在奶山羊的CSN1S1基因中只发现了1个新的11-bp indel,并发现该indel与繁殖性状显著相关,可以作为山羊产仔数的有效分子标记。
因此,对于本试验的结果,究竟是LPS诱导的炎症状态下CSN1S1基因型发生变化引起的CSN1S1基因表达量的增加?还是CSN1S1与CSN2基因之间具有一定的拮抗作用(炎症导致CSN2基因表达量显著下降,所以CSN1S1基因表达量显著增加)?还是像杨永强等[21]推测的CSN1S1基因上有信号转换器和转录激活剂5a或5b(STAT5a/b)、NF-κB和CCAAT/增强子结合蛋白(C/EBP)等不同的结合位点在不同情况下发挥不同的功能?结合本试验的结果,本研究观点更倾向于第3个原因,即健康状态下,CSN1S1基因上NF-κB和C/EBP的转录因子活性受阻,酪蛋白合成通路打开,有利于乳蛋白的合成和分泌;而炎症状态下STAT5a/b活性受阻,CSN1S1基因上NF-κB和C/EBP的转录因子激活,积极应答炎症反应,有利于乳腺从炎症状态恢复。因此,初步推测CSN1S1基因可能与炎症反应的免疫调节功能有关,并且CSN1S1与CSN2基因之间的拮抗作用也是由于CSN1S1基因的炎症应答免疫调节作用引起的,具体功能和作用机理还有待进一步研究。
3.2 LPS对大鼠乳腺上皮细胞相关细胞因子基因表达的影响本试验研究结果表明,所有剂量的LPS,不论作用于HC11细胞3 h还是24 h,均显著增加了TNF-α基因的表达量;1 000 ng/mL的LPS作用于HC11细胞3 h和500~25 000 ng/mL的LPS作用于HC11细胞24 h,均显著增加了IL-6基因的表达量;大于500 ng/mL的LPS作用于HC11细胞作有3 h时显著增加了IL-1β基因的表达量。从时间效应来看,对于绝大多数LPS剂量添加组,3种细胞因子基因在作用24 h时的表达量均高于3 h时的表达量。众所周知,TNF-α是由活化的单核巨噬细胞产生的一种细胞因子,具有广泛的生物学活性,具有调节机体免疫和介导机体炎症反应、组织损伤、休克等生理性和病理性反应双重作用,细菌和病毒入侵、LPS刺激等致炎因素均可以诱导机体表达过量TNF-α,引起动物机体发热、呼吸系统及心脏、肾脏等多脏器衰竭,严重时甚至引起死亡[22]。IL-1β又称淋巴细胞活化因子,也是由活化的单核巨噬细胞产生,在组织炎症状态下发挥着重要功能。IL-6主要由成纤维细胞、角质细胞、单核巨噬细胞及T淋巴细胞产生[22],它可以诱导B淋巴细胞和T淋巴细胞增殖分化,增强自然杀伤(NK)细胞和细胞毒性T淋巴(CTL)细胞的活性参与炎症反应[23-26]。有研究结果表明,不同浓度LPS刺激奶牛乳腺上皮细胞24 h后,细胞中IL-1β、IL-6和白细胞介素-8(IL-8)的mRNA相对表达水平随着LPS刺激浓度的增加而增加,说明IL-1β、IL-6在炎症反应中会被激活以起到抗炎作用[27],这和本试验研究结果一致,也与试验的推论基本一致。
3.3 LPS对大鼠乳腺上皮细胞葡萄糖转运因子基因表达的影响本试验研究结果表明,作用3 h时5 000 ng/mL的LPS显著增加了催乳素诱导的GLUT1基因的表达量,但所有剂量的LPS均显著抑制了GLUT8基因的表达。葡萄糖转运因子是一类调控细胞外葡萄糖进入细胞内的跨膜蛋白家族,参与糖代谢、炎性反应和免疫应答等过程。Villagrán等[28]研究表明,在妊娠和泌乳期,乳腺会增加能量的供应对满足上皮细胞的分化和乳成分的合成,作为牛奶中的主要碳水化合物,乳糖在乳腺上皮细胞的高尔基体中由葡萄糖和尿苷二磷酸半乳糖(UPD-半乳糖)的乳糖合成酶合成。GLUT1和GLUT8基因在乳腺发育过程中表达增加,泌乳时GLUT1基因表达量增加20倍,GLUT8蛋白表达量增加2倍。这也基本上验证了本试验结果。其原因可能是:一方面,LPS作用时间较短时(3 h),在各种细胞因子抗炎症作用下,GLUT1的葡萄糖转运能力在尽力发挥作用,但随着作用时间的延长,炎症反应更加明显,可用于乳成分合成的葡萄糖的量也在减少,因此GLUTs基因的表达量也随之降低;另一方面,从本文的研究结果可以推测,GLUT1和GLUT8之间可能有一定的比例关系存在,即当炎症较为严重时(LPS剂量越大,诱导炎症越明显;同样剂量LPS作用时间越长,炎症因子作用发挥越明显,炎症可能有所好转)GLUT1会发挥作用,而GLUT8暂时减少或停止表达,帮助葡萄糖向抗炎方向转运,而随着炎症因子作用的发挥,炎症反应有所缓解,此时GLUT1基因表达量有所减少,而GLUT8基因表达量有所增加,直到乳腺炎症康复,两者比例重新回到正常泌乳时的水平。在本试验结果中,作用3 h时,大于5 000 ng/mL LPS显著增加了GLUT1基因的表达量,其他剂量组均增加不显著;各个剂量的LPS均显著降低了GLUT8基因的表达量。作用24 h时,除500 ng/mL LPS显著增加了GLUT1基因的表达量外,其他各组间GLUT1和GLUT8基因的表达量差异均不显著,这和前面的推论一致。
HC11细胞是研究泌乳激素诱导牛奶基因表达的很好的模型。从本试验研究中所采用的LPS剂量来看,LPS明显诱导多种细胞因子的表达,包括白细胞介素和TNF-α,这与前人在乳腺上皮细胞中的很多研究结果[22, 27]一致。本试验中得到的新发现是,在乳腺上皮细胞中LPS显著抑制了CSN2和α-LA基因的表达,但却显著增加了CSN1S1基因的表达。在乳腺上皮细胞中LPS抑制牛奶蛋白基因表达和乳腺炎抑制牛奶产量是一致的,但是LPS显著增加CSN1S1基因表达量的原因尚不清楚。这可能表明CSN1S1基因在乳腺中具有免疫学功能。此外,本试验数据表明,细菌感染期间乳腺上皮细胞中葡萄糖摄取有增加的趋势,LPS导致HC11细胞中GLUT1基因表达量的增加就说明了这一点。
4 结论① LPS主要通过刺激炎症因子基因的表达而影响各酪蛋白基因的表达。在大鼠乳腺上皮细胞中,LPS能抑制CSN2基因的表达,却能增强CSN1S1基因的表达,随着作用时间的延长,还能降低α-LA基因的表达。
② LPS短时间(3 h)作用于乳腺上皮细胞可以增加GLUT1基因的表达量,却降低了GLUT8基因的表达量,说明GLUT1和GLUT8基因功能不同,在炎症状态下两者通过基因表达量的改变,相互协作,有利于能量的重分配,以维持奶牛乳腺健康。
③ LPS诱导的炎症状态可以诱发CSN1S1基因的高表达,这为CSN1S1基因的深入研究指明了新的方向,为通过基因调控预防和治疗乳腺炎提供了新的思路。
| [1] |
ZHAO F Q. Biology of glucose transport in the mammary gland[J]. Journal of Mammary Gland Biology and Neoplasia, 2014, 19(1): 3-17. DOI:10.1007/s10911-013-9310-8 |
| [2] |
SALMAN S, KHOL-PARISINI A, SCHAFFT H, et al. The role of dietary selenium in bovine mammary gland health and immune function[J]. Animal Health Research Reviews, 2009, 10(1): 21-34. |
| [3] |
MIAO J F, FA Y M, GU B B, et al. Taurine attenuates lipopolysaccharide-induced disfunction in mouse mammary epithelial cells[J]. Cytokine, 2012, 59(1): 35-40. |
| [4] |
LI D P, FU Y H, ZHANG W, et al. Salidroside attenuates inflammatory responses by suppressing nuclear factor-κB and mitogen activated protein kinases activation in lipopolysaccharide-induced mastitis in mice[J]. Inflammation Research, 2013, 62(1): 9-15. |
| [5] |
SKELLY D T, HENNESSY E, DANSEREAU M A, et al. A systematic analysis of the peripheral and CNS effects of systemic LPS, IL-1β, TNF-α and IL-6 challenges in C57BL/6 mice[J]. PLoS One, 2013, 8(7): e69123. DOI:10.1371/journal.pone.0069123 |
| [6] |
SHI H Y, GUO Y M, LIU Y, et al. The in vitro effect of lipopolysaccharide on proliferation, inflammatory factors and antioxidant enzyme activity in bovine mammary epithelial cells[J]. Animal Nutrition, 2016, 2(2): 99-104. |
| [7] |
KOBAYASHI K, OYAMA S, UEJYO T, et al. Underlying mechanisms involved in the decrease of milk secretion during Escherichia coli endotoxin induced mastitis in lactating mice[J]. Veterinary Research, 2013, 44: 119. |
| [8] |
AN H, XU H, YU Y, et al. Up-regulation of TLR9 gene expression by LPS in mouse macrophages via activation of NF-κB, ERK and p38 MAPK signal pathways[J]. Immunology Letters, 2002, 81(3): 165-169. |
| [9] |
AERNI-FLESSNER L, ABI-JAOUDE M, KOENIG A, et al. GLUT4, GLUT1, and GLUT8 are the dominant GLUT transcripts expressed in the murine left ventricle[J]. Cardiovascular Diabetology, 2012, 11: 63. |
| [10] |
DONAL T S, HENNESSY E, MARC-ANDRE D, et al. A systematic analysis of the peripheral and CNS effects of systemic LPS, IL-1β, TNF-α and IL-6 challenges in C57BL/6 mice[J]. PloS One, 2013, 8(7): .e69123. |
| [11] |
张花.添加脂肪酸和激素对奶牛乳腺上皮细胞乳蛋白和乳脂肪合成的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10129-1018881861.htm
|
| [12] |
田雯.功能性氨基酸(亮氨酸和精氨酸)对奶牛乳蛋白合成调控作用及机制的研究[D].博士学位论文.扬州: 扬州大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-11117-1017113770.htm
|
| [13] |
丁洛阳.精氨酸酶调控奶牛乳腺中酪蛋白合成的分子机制[D].硕士学位论文.扬州: 扬州大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-11117-1016284406.htm
|
| [14] |
VORDENBÄUMEN S, BRAUKMANN A, ALTENDORFER I, et al. Human casein alpha s1(CSN1S1) skews in vitro differentiation of monocytes towards macrophages[J]. BMC Immunology, 2013, 14: 46. |
| [15] |
陈静波.内毒素引起奶牛乳腺上皮细胞泌乳功能降低的表观遗传学机制研究[D].硕士学位论文.重庆: 西南大学, 2019.
|
| [16] |
INGHAM B, SMIALOWSKA A, KIRBY N M, et al. A structural comparison of casein micelles in cow, goat and sheep milk using X-ray scattering[J]. Soft Matter, 2018, 14(17): 3336-3343. |
| [17] |
YAMAJI D, KANG K, ROBINSON G W, et al. Sequential activation of genetic programs in mouse mammary epithelium during pregnancy depends on STAT5A/B concentration[J]. Nucleic Acids Research, 2013, 41(3): 1622-1636. |
| [18] |
陈晨, 赵烜影, 郭鸰, 等. 中国水牛乳蛋白基因型与酪蛋白胶束粒度的关联研究[J]. 中国畜牧杂志, 2020, 56(1): 70-76. |
| [19] |
CIESLAK J, WODAS L, BOROWSKA A, et al. 5'-flanking variants of equine casein genes (CSN1S1, CSN1S2, CSN2, CSN3) and their relationship with gene expression and milk composition[J]. Journal of Applied Genetics, 2018, 60(1): 71-78. |
| [20] |
WANG K, YAN H L, XU H, et al. A novel indel within goat casein alpha S1 gene is significantly associated with litter size[J]. Gene, 2018, 671: 161-169. |
| [21] |
杨永强, 龚俞, 焦仁刚, 等. 不同牛种CSN1S1基因启动子区SNP研究[J]. 基因组学与应用生物学, 2012, 31(6): 549-553. |
| [22] |
CEDERBAUM A I, LU Y K, WANG X D, et al.Synergistic toxic interactions between CYP2E1, LPS/TNFα, and JNK/p38 MAP kinase and their implications in alcohol-induced liver injury[M]//VASILIOU V, ZAKHARI S, SEITZ H, et al.Biological basis of alcohol-induced cancer.Cham: Springer, 2015, 815: 145-172.
|
| [23] |
ZIMMERMANN M, AGUILERA F B, CASTELLUCCI M, et al. Chromatin remodelling and autocrine TNF-α are required for optimal interleukin-6 expression in activated human neutrophils[J]. Nature Communications, 2015, 6: 6061. |
| [24] |
KIM M S, LEE W S, JEONG J, et al. Induction of metastatic potential by TrkB via activation of IL6/JAK2/STAT3 and PI3K/AKT signaling in breast cancer[J]. Oncotarget, 2015, 6(37): 40158-40171. |
| [25] |
SANSONE P, CECCARELLI C, BERISHAJ M, et al. Self-renewal of CD133hi cells by IL-6/Notch3 signalling regulates endocrine resistance in metastatic breast cancer[J]. Nature Communications, 2016, 7(1): 10442. |
| [26] |
WALCH-RVCKHEIM B, MAVROVA R, HENNING M, et al. Stromal fibroblasts induce CCL20 through IL-6/C/EBPβ to support the recruitment of Th17 cells during cervical cancer progression[J]. Cancer Research, 2015, 75(24): 5248-5259. |
| [27] |
张旭.LPS对奶牛乳腺上皮细胞乳脂合成功能和脂代谢相关分子的影响[D].硕士学位论文.大庆: 黑龙江八一农垦大学, 2018. https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&filename=1018011282.nh
|
| [28] |
VILLAGRÁN M, MUÑOZ M, INOSTROZA E, et al. GLUT1 and GLUT8 support lactose synthesis in Golgi of murine mammary epithelial cells[J]. Journal of Physiology and Biochemistry, 2019, 75(2): 209-215. DOI:10.1007/s13105-019-00679-3 |



