2. 四川省畜牧科学研究院, 动物遗传育种四川省重点实验室, 成都 610066
2. Animal Genetics and Breeding Key Laboratory of Sichuan Province, Animal Science Academy of Sichuan Province, Chengdu 610066, China
芽孢杆菌是一类较为常见的细菌,广泛分布于自然环境中,其产生的芽孢可在多种极端环境中生存,具有较强的耐受能力[1]。解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和短小芽孢杆菌(Bacillus pumilus)属于芽孢杆菌科芽孢杆菌属,2种芽孢杆菌均能分泌多种抗菌物质,具有对动物和环境无害、稳定性强、广谱抑菌等特点,常被作为生防菌进行研究和应用,并且具有开发为动物益生菌的潜力[2-4]。解淀粉芽孢杆菌可提高仔猪肠上皮细胞屏障和免疫功能,且起到与抗生素相似的作用[5]。短小芽孢杆菌具有与抗生素相似的降低断奶仔猪回肠大肠杆菌丰度的功能,且不会对生长性能、乳酸菌、健康指标等产生不利影响[6]。此外,短小芽孢杆菌还具有改善动物生长性能、提高机体免疫力等作用[7]。目前,关于解淀粉芽孢杆菌和短小芽孢杆菌在动物小肠肠道中的作用机制尚不清楚。小肠是食物消化与吸收的主要场所,小肠肠道菌群影响着动物的生长、代谢和免疫,对小肠肠道菌群的研究具有重要意义[8]。因此,本试验从川中黑山羊粪便中筛选出2株芽孢杆菌,通过探究不同浓度羊源芽孢杆菌对小鼠肠道生化指标和肠道菌群的影响,从而为其在黑山羊饲养研究中的应用提供科学资料。
1 材料与方法 1.1 试验材料 1.1.1 样品采集试验分别在成都、巴中、广元等地川中黑山羊养殖场采集30余份健康和腹泻黑山羊粪便样品,装入灭菌后的溶菌肉汤(LB)液态培养基中并带回实验室培养处理。
1.1.2 指示菌和试验动物大肠埃希氏菌(Escherichia coli)、霍氏肠杆菌(Enterobacter hormaechei)、路德维希肠杆菌(Enterobacter ludwigii)、阴沟肠杆菌(Enterobacter cloacae)、肺炎克雷伯氏菌(Klebsiella Pneumoniae)、尸毒梭菌(Clostridium cadaveris)、霍乱弧菌(Vibrio cholerae)、藤黄微球菌(Micrococcus luteus)、金黄色葡萄球菌(Staphylococcus aureus)保种于西南民族大学青藏高原动物遗传资源保护与利用重点实验室,分离源为川中黑山羊。
无特定病原体(SPF)级30日龄昆明(KM)小鼠,购自成都达硕实验动物有限公司,许可证号:SCXK(川)2015-030,体重为(15.0±2.8) g。
1.1.3 主要试剂1.1×T3 Super PCR Mix购自成都擎科梓熙生物技术有限公司,细菌基因组DNA提取试剂盒购于北京天根生化科技有限公司,细菌生化鉴定管购于杭州微生物试剂有限公司,总超氧化物歧化酶(T-SOD)测试盒(羟胺法)、碱性磷酸酶(AKP)测试盒(可见光比色法)、溶菌酶(LZM)测试盒(比浊法)购自南京建成生物工程研究所。
1.2 试验方法 1.2.1 抑菌菌株的筛选将30余份装有粪便样品的LB液态培养基置于180 r/min、37 ℃振荡培养箱中培养24 h,划线接种于LB固态培养基中,纯化得到单菌落。以分离得到的菌株作为测试菌,并与1.1.2中9种指示菌分别接种于LB液态培养基中培养24 h。采用细菌浊度仪测量指示菌浓度后将其调至1×107 CFU/mL,每个培养皿接种100 μL,每个牛津杯中加入测试菌200 μL,以灭菌的空白LB液态培养基做对照,于4 ℃放置3 h后37 ℃培养18 h测量抑菌圈,根据结果筛选出2株抑菌作用最好的菌株,分别命名为fsznc-06和fsznc-09。
1.2.2 分离菌株的鉴定采用革兰氏染色法对2株分离菌株进行染色。采用细菌生化鉴定管进行生化鉴定,鉴定标准参照《伯杰细菌鉴定手册》。根据细菌基因组DNA提取试剂盒说明书,提取细菌总DNA。采用16S rDNA通用引物(正向引物:5′-AGAGTTTGATCCTGGCTCAG-3′;反向引物:5′-CTACGGCTACCTTGTTACGA-3′),以提取的细菌DNA作为模板进行PCR扩增。PCR反应体系25 μL:1.1×T3 Super PCR Mix 22 μL,细菌DNA模板和上、下游引物各1 μL。PCR反应条件:98 ℃预变性2 min;98 ℃变性10 s,55 ℃退火10 s,72 ℃延伸30 s,共30个循环;72 ℃再延伸2 min。用1.0%琼脂糖凝胶电泳法检测DNA片段长度,凝胶成像系统拍照,将PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序,取得16S rDNA序列后提交至GenBank,并进行BLAST序列比对,用Mega 5.0软件构建系统进化树。
1.2.3 分离菌株抑菌活性成分分析取1.2.1中指示菌以及2株分离菌株接种于LB液态培养基中,37 ℃、180 r/min培养24 h,细菌浊度仪测量各菌株浊度。取5 mL 2株分离菌株菌液,4 ℃、7 830 r/min离心20 min得上清和沉淀。收集上清,经过0.22 μm滤膜过滤后装入灭菌的EP管中4 ℃冷藏备用。离心后的沉淀加入5 mL磷酸盐缓冲液(PBS)洗涤,再次离心的菌体沉淀,加入5 mL PBS后4 ℃冷藏备用。再分别取20 mL 2株分离株菌液,以上述相同的方法分别制备1管20 mL的菌悬液,放入细胞破碎仪中破碎10 min得细胞内容物,4 ℃冷藏备用。将指示菌倍比稀释到107 CFU/mL,涂布于LB固态培养基上,每个培养皿中插入4个牛津杯,分别加入200 μL的细菌发酵液、上清液、菌悬液和胞内液,置于4 ℃放置3 h,移入恒温培养箱37 ℃培养18 h后测量抑菌圈直径,每组3个重复。
1.2.4 小鼠急性毒性试验和饲养管理分别取菌株fsznc-06和fsznc-09菌液,4 ℃、5 000 r/min离心10 min,取菌体沉淀加入0.9%氯化钠溶液并分别配制成浓度为1×108、1×1010和1×1011 CFU/mL菌悬液。分别选取10只小鼠,灌胃法灌服1×1011 CFU/mL菌液,每只0.3 mL/d,连续灌服7 d,观察小鼠状态。选取60只健康的小鼠,随机分为5组,分别为菌株fsznc-06低剂量组(JD1组)、菌株fsznc-06高剂量组(JD2组)、菌株fsznc-09低剂量组(DX1组)、菌株fsznc-09高剂量组(DX2组)和对照组(DZ组),每组3个重复,每个重复4只。JD1和JD2组每2 d灌服1次1×108和1×1010 CFU/mL的菌株fsznc-06菌液,DX1和DX2组每2 d灌服1次1×108和1×1010 CFU/mL的菌株fsznc-09菌液,DZ组每2 d灌服1次0.9%氯化钠溶液,饲喂量均为0.3 mL/只。采用小鼠灌胃器饲喂菌液,按常规饲养程序饲养小鼠,试验饲养场地为西南民族大学武侯校区第二实验楼动物房,试验周期为28 d。
1.2.5 肠道生化指标检测取各组饲养28 d小鼠的空肠组织,剔除脂肪,用生理盐水冲洗肠道内容物,-80 ℃保存备用。按重量(g):体积(mL)=1:9的比例加入0.86%的生理盐水,在冰水浴条件下剪碎后匀浆,然后在4 ℃、3 000 r/min离心20 min,保留上清液,4 ℃保存备用。采用试剂盒分别检测小肠组织T-SOD、AKP和LZM活性。
1.2.6 肠道内容物采集和测序取各组饲养28 d小鼠空肠内容物,采用十六烷基三甲基溴化铵(CTAB)法提取各组样品DNA,对16S V3~V4区进行扩增和胶回收,用Thermofisher公司的Ion Plus Fragment Library Kit 48 rxns建库试剂盒和Ion S5TM XL进行文库构建与上机测序,由北京诺禾致源生物信息科技有限公司完成测序和信息分析。
1.3 数据统计和分析系统发育树用Mega 5.0软件构建,Adobe Photoshop 13.0处理。试验数据以平均值±标准差(mean±SD)表示,采用SPSS 26.0统计软件进行单因素方差分析和Duncan氏法多重比较。P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果和分析 2.1 分离菌株的筛选和鉴定从山羊粪便中共分离110株菌株,经筛选得到2株具有广谱抑菌作用且抑菌效果相对较好的菌株,分别命名为菌株fsznc-06和fsznc-09。菌株fsznc-06菌落呈圆形,菌落较大,表面褶皱,中间隆起,边缘呈锯齿状,颜色为乳白色,菌体较黏稠。菌株fsznc-09菌落呈较小的圆形,菌落表面圆润光滑,边缘较整齐,多数菌落中间可见圆圈,多数颜色为偏淡黄的乳白色。经染色镜鉴,菌株fsznc-06可见多数成对或单个的紫色或黑紫色杆菌菌体,极少链状排列,芽孢呈椭圆形。菌株fsznc-09可见多数紫色或紫黑色单个杆菌,芽孢数量较少。以上结果表明2菌株均为革兰氏阳性杆菌。菌株fsznc-06和fsznc-09的生理生化鉴定结果见表 1,菌株fsznc-06和fsznc-09的形态学和理化特性分别与《伯杰细菌鉴定手册》中关于解淀粉芽孢杆菌和短小芽孢杆菌的描述基本一致。
|
|
表 1 菌株fsznc-06和fsznc-09的生理生化鉴定结果 Table 1 Results of physiological and biochemical identification of bacterial strains fsznc-06 and fsznc-09 |
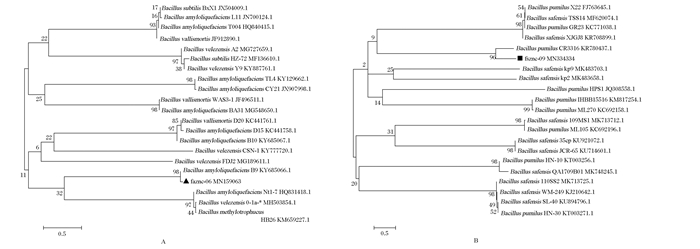
测序结果显示,菌株fsznc-06和fsznc-09的16S rDNA片段长度分别为1 453和1 430 bp。将16S rDNA基因序列提交到GenBank中获得的登录号分别为MN159063、MN334334。系统发育树结果表明,菌株fsznc-06的16S rDNA基因序列与解淀粉芽孢杆菌B9的16S rDNA基因序列置信度为98%(图 1-A),菌株fsznc-09的16S rDNA基因序列与短小芽孢杆菌CR33的16S rDNA基因序列置信度为96%(图 1-B),结合分离菌株形态学和理化特性,综合判定菌株fsznc-06为解淀粉芽孢杆菌,菌株fsznc-09为短小芽孢杆菌。
|
Bacillus subtilis:枯草芽孢杆菌;Bacillus amyloliquefaciens:解淀粉芽孢杆菌;Bacillus vallismortis:死谷芽孢杆菌;Bacillus celezensis:贝莱斯芽孢杆菌;Bacillus methylotrophucus:甲基营养型芽孢杆菌; Bacillus pumilus:短小芽孢杆菌;Bacillus safensis:沙福芽孢杆菌。 图 1 16S rDNA基因序列与菌株fsznc-06(A)和fsznc-09(B)的系统发育树 Fig. 1 16S rDNA gene sequence and phylogenetic tree of bacterial strains fsznc-06 (A) and fsznc-09 (B) |
由表 2可见,抑菌试验结果表明,上清液、菌悬液和胞内液抑菌圈直径均小于或等于发酵液。通过比较各成分抑菌圈直径发现,菌株fsznc-06和fsznc-09各成分抑菌效果顺序为发酵液>上清液>胞内液、菌悬液。因此,2菌株的发酵液抑菌效果相对最佳,主要抑菌物质可能存在于上清液,胞内液也具有一定的抑菌能力。
|
|
表 2 菌株fsznc-06和fsznc-09不同成分的抑菌圈直径 Table 2 Antibacterial circle diameter of different components of bacterial strains fsznc-06 and fsznc-09 |
灌服菌株fsznc-06和fsznc-09菌悬液的小鼠在饲养7 d内未见死亡情况,未见异常,解剖未见明显病变,表明菌株fsznc-06和fsznc-09对小鼠无致病性。
2.4 肠道生化指标由表 3可见,与DZ组相比,DX2组小肠组织T-SOD活性略有降低(P>0.05),其他各组小肠组织T-SOD活性均极显著提高(P < 0.01)。与DZ组相比,JD2组小肠组织AKP活性略有升高(P>0.05),其他各组小肠组织AKP活性均显著或极显著提高(P < 0.05或P < 0.01)。与DZ组相比,JD1和DX1组小肠组织LZM活性显著或极显著提高(P < 0.05或P < 0.01),JD2组小肠组织LZM活性略有提高(P>0.05),DX2组小肠组织LZM活性略有降低(P>0.05)。此外,JD1组与JD2组之间小肠组织T-SOD和AKP活性有显著或极显著差异(P < 0.05或P < 0.01),小肠组织LZM活性差异不显著(P>0.05);DX1组与DX2组之间小肠组织T-SOD和LZM活性有极显著差异(P < 0.01),小肠组织AKP活性差异不显著(P>0.05)。
|
|
表 3 小鼠小肠组织生化指标 Table 3 Biochemical indexes of small intestine tissue of mice |
对各样本测序结果的有效标签(effective tags)以97%的一致性进行操作分类单元(OTUs)聚类和物种注释,结果显示,JD1、JD2、DX1、DX2和DZ组OTUs数量分别为158、169、137、145和152个,特有OTUs数量分别为9、12、12、2和6个,共有OTUs数量为77个。与DZ组相比,JD1、JD2、DX1和DX2组特有OTUs数量分别为37、44、36和30个;而与4个试验组相比,DZ组特有OTUs数量依次为31、27、51和37个。
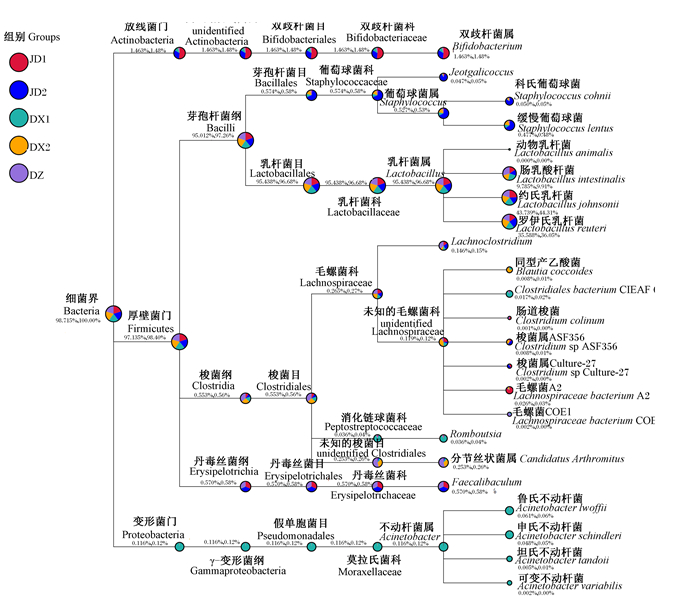
筛选最高相对丰度前10的属进行物种分类树统计(图 2),主要有3类门水平:一是放线菌门(Actinobacteria,1.48%),主要包括双歧杆菌属(Bifidobacterium,1.48%),它们在JD1、JD2和DX1组的相对丰度均高于DZ组;二是变形菌门(Proteobacteria,0.12%),主要包括不动杆菌属(Acinetobacter,0.12%),它们在DX1组的相对丰度远高于其他各组,而坦氏不动杆菌(Acinetobacter tandoii)和可变不动杆菌(Acinetobacter variabilis)为DX1组特有菌群;三是厚壁菌门(Firmicutes,98.40%),它们是各组小鼠肠道内的主要菌群,在此门水平下主要有乳杆菌属(Lactobacillus,96.68%)、Faecalibaculum(0.58%)、葡萄球菌属(Staphylococcus,0.53%)等。此外,各组乳杆菌属、双歧杆菌属相对丰度百分率分别为JD1组93.81%、3.79%,JD2组92.05%、2.37%,DX1组97.12%、0.80%,DX2组97.47%、0.09%和DZ组96.74%、0.30%。选取各组在各分类水平上平均相对丰度前10的物种进行三元相图(ternary plot)分析,得各组优势物种分别为:JD1组,约氏乳杆菌(53.54%);JD2组,罗伊氏乳杆菌(44.56%);DX1组,约氏乳杆菌(45.21%);DX2组,约氏乳杆菌(41.38%);DZ组,约氏乳杆菌(44.51%)。
|
图 2 物种分类树 Fig. 2 Species classification tree |
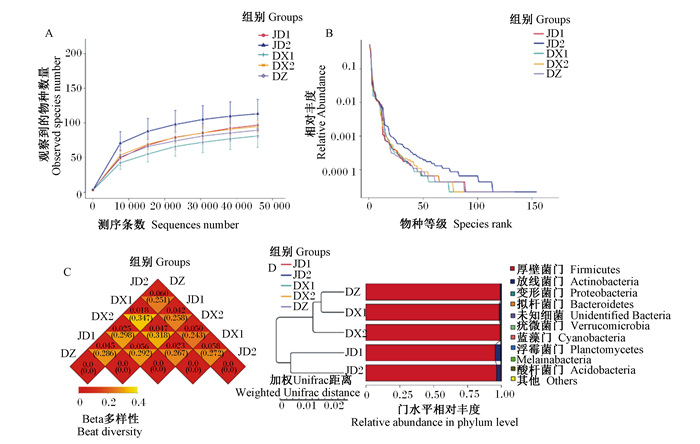
为分析各组样本内菌群多样性,对各种样品进行多样性分析并获得Alpha多样性指数(表 4)。其中,Simpson指数是用来估算微生物多样性的参数之一,Chao1指数和ACE指数是度量物种丰富度的参数。各组的Simpson指数均低于DZ组,结合稀释曲线(图 3-A),可知各组的群落多样性均高于DZ组。从Chao1指数、ACE指数并结合等级聚类曲线(图 3-B)来看,JD1、JD2和DX2组的物种丰富度高于DZ组,而DX1组低于DZ组。
|
|
表 4 Alpha多样性指数 Table 4 Alpha diversity indexes |
|
A:稀释曲线Rarefaction curve;B:等级聚类曲线Rank clustering curve;C:Beta多样性指数热图Beta diversity index heatmap;D:基于Weighted Unifrac距离的UPGMA聚类树UPGMA clustering tree based on Weighted Unifrac distance。 图 3 物种多样性比较和差异贡献度结果 Fig. 3 Results of species diversity comparison and differential contribution |
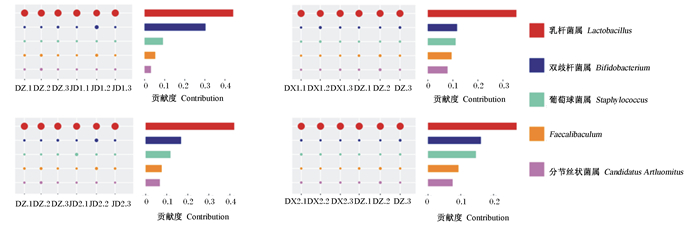
为比较分析各组微生物群落构成,根据样本的物种注释结果和OTUs的丰度信息对其进行Beta多样性分析。Beta多样性指数热图(图 3-C)可以衡量2个样本间的相异系数,JD1、JD2、DX1和DX2组与DZ组相异系数分别为0.045、0.060、0.018和0.025,JD1和JD2组分别与DX1和DX2组相异系数均在0.047以上,说明JD1和JD2组与DZ组物种多样性差异大于DX1和DX2组与DZ组的差异。UPGMA聚类树可直观地看出不同样本间的相似性,从聚类树(图 3-D)结果可以看出,首先与DZ组聚在一起的是DX1组,其次是DX2组,最后是JD1和JD2组,各试验组与DZ组的相似性也由此顺序依次递减,这与图 3-C的结果一致。Simper分析可以量化每个物种对2组间差异的贡献度。Simper分析结果显示(图 4),各试验组分别与DZ组的组间差异贡献度前2的属均为乳杆菌属和双歧杆菌属。
|
DZ.1、DZ.2和DZ.3为DZ组3个重复。其他组同。 DZ.1, DZ.2 and DZ.3 are three replicates in DZ group. The same as other groups. 图 4 属水平的Simper分析 Fig. 4 Simper analysis in genus level |
根据不同组间的基因信息绘制功能注释Venn图(图 5-A),从图中可知,JD1、JD2、DX1、DX2和DZ组基因数分别为6 198、5 643、6 044、5 592和5 527,除DX2组外,其余试验组均包含DZ组全部功能基因。与DZ组相比,各试验组特有基因数依次为671、116、517和122。对各组基因进行功能预测(图 5-B),JD1组仅在遗传信息处理(genetic information processing)功能丰度高于DZ组,其他试验组功能丰度高于DZ组的分别为:1)JD2组,遗传信息处理、生物体系统(organismal systems)和细胞过程(cellular processes);2)DX1组,环境信息处理(environmental information processing)、新陈代谢(metabolism)、人类疾病(human diseases)和生物体系统;3)DX2组,环境信息处理、新陈代谢、生物体系统和细胞过程。
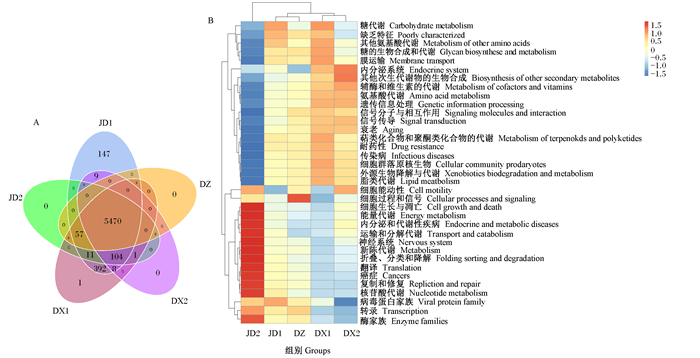
|
A:功能注释Venn图Function annotation Venn diagram;B:功能注释聚类热图Function annotation cluster heatmap。 图 5 Tax4Fun分析 Fig. 5 Tax4Fun analysis |
解淀粉芽孢杆菌和短小芽孢杆菌具有广谱抑制各种真菌和细菌生长的作用,可产生多种抗菌蛋白,如抗菌肽、细胞壁降解酶和细菌素等[4, 9-11]。Zhang等[12]从番茄根部分离出的解淀粉芽孢杆菌W10中纯化到了抗菌肽5240,其对多种植物病原菌具有广谱抑菌效果。Gao等[13]研究表明,解淀粉芽孢杆菌YL-10可以抑制多种鱼类致病菌的生长和感染。Saggese等[14]研究发现,短小芽孢杆菌SF214至少产生2种抗菌活性物质。Fang等[15]报道,解淀粉芽孢杆菌CMN1308发酵上清抑菌效果最佳,抑菌圈直径为12.3 mm。本试验从川中黑山羊粪便中筛选出解淀粉芽孢杆菌fsznc-06和短小芽孢杆菌fsznc-09,并发现2个分离菌株主要抑菌活性物质可能存在于菌液发酵上清液。通过将2分离菌株的高浓度菌液分别灌胃小鼠,发现2分离菌株未对小鼠造成不利影响,说明解淀粉芽孢杆菌fsznc-06和短小芽孢杆菌fsznc-09对小鼠具有较好的安全性并可作为动物益生菌进行研究[6, 16]。
解淀粉芽孢杆菌和短小芽孢杆菌对动物血清和肠道组织生化指标具有促进作用[17-18]。超氧化物歧化酶(SOD)是广泛存在于动植物中抗氧化酶系的重要指标之一,其在机体内平衡氧化和抗氧化起到非常重要的作用。AKP广泛分布于肝脏、骨骼、肠等组织中,它是动物生长代谢、维持机体健康的必须的酶,是评价动物生长是否旺盛的重要指标之一。LZM是一种可以水解细菌细胞壁、与病毒蛋白结合形成复盐的碱性酶,它可使细菌破裂溶解,使病毒失活,机体内LZM活性的高低可反映机体清除致病菌的能力。Kang等[19]在解淀粉芽孢杆菌GF423中发现一种可以编码产生SOD的基因,可减少小鼠肠道炎症反应。Sun等[17]通过在饲料中添加短小芽孢杆菌SE5并饲喂点带石斑鱼,发现可提高点带石斑鱼的生长性能和免疫功能。本试验中,分别饲喂1×108 CFU/mL的菌株fsznc-06和fsznc-09时均可提高小肠组织T-SOD、AKP和LZM活性,但高浓度(1×1010 CFU/mL)的菌株fsznc-09却使小肠组织T-SOD和LZM活性略有下降,具体原因尚需进一步试验。
动物肠道内存在着大量的微生物,这些微生物帮助宿主完成多种生理生化功能,与机体的消化、免疫、生理调控等方面息息相关。研究表明,解淀粉芽孢杆菌和短小芽孢杆菌均具有调节动物肠道菌群的作用[5, 20-21]。Hong等[22]通过在饲粮中添加解淀粉芽孢杆菌TL观察该菌对鸡生长性能和盲肠微生物菌群的影响,结果发现该菌可调节盲肠菌群,并起到了与抗生素相似的作用。Yang等[23]将1×108 CFU/g短小芽孢杆菌SE5的部分组分饲喂点带石斑鱼,发现各组分均能调节石斑鱼肠道菌群总体结构,显著提高肠道内乳酸杆菌的相对丰度,显著降低致病菌的相对丰度。本试验结果显示,菌株fsznc-06和fsznc-09均可以提高小鼠肠道菌群多样性和丰富度。各试验组与DZ组组间差异贡献度前2位的属为乳杆菌属和双歧杆菌属,JD1和JD2组中乳杆菌属的相对丰度均低于DZ组,但明显提高了双歧杆菌属的相对丰度,而DX1和DX2组乳杆菌属和双歧杆菌属的相对丰度均高于DZ组。Jiang等[24]报道,饲喂1×109 CFU/mL解淀粉芽孢杆菌的大菱鲆肠道中乳酸菌相对丰度提高了3.5%,假单胞菌相对丰度降低了0.8%。Haldar等[25]报道,饲喂1×108~1×109 CFU/d短小芽孢杆菌B9可使小鼠肠道中乳酸菌数量增加。在本试验中,从肠道菌群优势物种丰度来看,各组优势物种均为乳杆菌属,除DX2组外,其他试验组优势物种相对丰度均高于DZ组。这说明fsznc-06有利于双歧杆菌属微生物的生长,乳杆菌属相对丰度的降低可能是由于双歧杆菌属相对丰度的明显提高,但不会对优势物种的生长产生负面影响。而菌株fsznc-09对乳杆菌属和双歧杆菌属微生物的生长均有促进作用,DX1组丰富度降低可能是由于乳杆菌属和双歧杆菌属相对丰度的提高,使非优势物种或相对丰度低的物种生长受到抑制。从群落相似性方面看,DX1和DX2组与DZ组相似性大于JD1和JD2组,因此菌株fsznc-06对小鼠肠道菌群的影响大于菌株fsznc-09。从基因功能预测方面看,菌株fsznc-06主要提高了遗传信息处理方面的功能,而菌株fsznc-09主要提高了环境信息处理、新陈代谢和生物体系统方面的功能,因此菌株fsznc-09在提高肠道菌群基因功能方面优于菌株fsznc-06。
4 结论解淀粉芽孢杆菌fsznc-06和短小芽孢杆菌fsznc-09能提高小鼠小肠组织T-SOD、AKP和LZM活性,增加小鼠小肠肠道菌群多样性和有益菌群相对丰度,对小鼠肠道菌群具有一定的调节和促进作用。采用浓度为1×108 CFU/mL的解淀粉芽孢杆菌fsznc-06和短小芽孢杆菌fsznc-09饲喂小鼠效果相对更佳。
| [1] |
ABBAS A, KHAN S U, KHAN W U, et al. Antagonist effects of strains of Bacillus spp. against Rhizoctonia solani for their protection against several plant diseases:alternatives to chemical pesticides[J]. Comptes Rendus Biologies, 2019, 342(5/6): 124-135. |
| [2] |
LARSEN N, THORSEN L, KPIKPI E N, et al. Characterization of Bacillus spp. strains for use as probiotic additives in pig feed[J]. Applied Microbiology and Biotechnology, 2014, 98(3): 1105-1118. |
| [3] |
YAN H, YUN J, AI D, et al. Two novel cationic antifungal peptides isolated from Bacillus pumilus HN-10 and their inhibitory activity against Trichothecium roseum[J]. World Journal of Microbiology and Biotechnology, 2018, 34(2): 21. |
| [4] |
CHU J, WANG Y, ZHAO B, et al. Isolation and identification of new antibacterial compounds from Bacillus pumilus[J]. Applied Microbiology and Biotechnology, 2019, 103(20): 8375-8381. |
| [5] |
DU W, XU H, MEI X, et al. Probiotic Bacillus enhance the intestinal epithelial cell barrier and immune function of piglets[J]. Beneficial Microbes, 2018, 9(5): 743-754. |
| [6] |
PRIETO M L, O'SULLIVAN L, TAN S P, et al. Evaluation of the efficacy and safety of a marine-derived Bacillus strain for use as an in-feed probiotic for newly weaned pigs[J]. PLoS One, 2014, 9(2): e88599. |
| [7] |
TRUONG THY H T, TRI N N, QUY O M, et al. Effects of the dietary supplementation of mixed probiotic spores of Bacillus amyloliquefaciens 54A, and Bacillus pumilus 47B on growth, innate immunity and stress responses of striped catfish (Pangasianodon hypophthalmus)[J]. Fish and Shellfish Immunology, 2017, 60: 391-399. |
| [8] |
秦会平, 王学红. 小肠菌群与肠道及代谢性疾病[J]. 世界华人消化杂志, 2016, 24(03): 375-381. |
| [9] |
LIU D, LI K, HU J, et al. Biocontrol and action mechanism of Bacillus amyloliquefaciens and Bacillus subtilis in soybean phytophthora blight[J]. International Journal of Molecular Sciences, 2019, 20(12): 2908. |
| [10] |
BINDIYA E S, TINA K J, SASIDHARAN R S, et al. BaCf3:highly thermostable bacteriocin from Bacillus amyloliquefaciens BTSS3 antagonistic on food-borne pathogens[J]. 3 Biotech, 2019, 9(4): 136. |
| [11] |
HAO K, ULLAH H, QIN X, et al. Effectiveness of Bacillus pumilus PDSLzg-1, an innovative hydrocarbon-degrading bacterium conferring antifungal and plant growth-promoting function[J]. 3 Biotech, 2019, 9(8): 305. |
| [12] |
ZHANG Q X, ZHANG Y, SHAN H H, et al. Isolation and identification of antifungal peptides from Bacillus amyloliquefaciens W10[J]. Environmental Science and Pollution Research, 2017, 24(32): 25000-25009. |
| [13] |
GAO X L, KE C H, ZHANG M, et al. Effects of the probiotic Bacillus amyloliquefaciens on the growth, immunity, and disease resistance of Haliotis discus hannai[J]. Fish and Shellfish Immunology, 2019, 94: 617-627. |
| [14] |
SAGGESE A, CULURCIELLO R, CASILLO A, et al. A marine isolate of Bacillus pumilus secretes a pumilacidin active against Staphylococcus aureus[J]. Marine Drugs, 2018, 16(6): 180. |
| [15] |
FANG Y Y, LI L L, ZHENG Y L, et al. Extraction, isolation and identification of antimicrobial substances from Bacillus amyloliquefaciens Cmn1308[J]. Notulae Botanicae Horti Agrobotanici Cluj-napoca, 2017, 45(1): 308-315. |
| [16] |
PRIETO M L, O'SULLIVAN L, TAN S P, et al. In vitro assessment of marine Bacillus for use as livestock probiotics[J]. Marine Drugs, 2014, 12(5): 2422-2445. |
| [17] |
SUN Y Z, YANG H L, MA R L, et al. Probiotic applications of two dominant gut Bacillus strains with antagonistic activity improved the growth performance and immune responses of grouper Epinephelus coioides[J]. Fish and Shellfish Immunology, 2010, 29(5): 803-809. |
| [18] |
SAPUTRA F, SHIU Y L, CHEN Y C, et al. Dietary supplementation with xylanase-expressing B. amyloliquefaciens R8 improves growth performance and enhances immunity against Aeromonas hydrophila in Nile tilapia (Oreochromis niloticus)[J]. Fish and Shellfish Immunology, 2016, 58: 397-405. |
| [19] |
KANG J E, KIM H D, PARK S Y, et al. Dietary supplementation with a Bacillus superoxide dismutase protects against γ-radiation-induced oxidative stress and ameliorates dextran sulphate sodium-induced ulcerative colitis in mice[J]. Journal of Crohn's and Colitis, 2018, 12(7): 860-869. |
| [20] |
SUN Y Z, YANG H L, MA R L, et al. Molecular analysis of autochthonous microbiota along the digestive tract of juvenile grouper Epinephelus coioides following probiotic Bacillus pumilus administration[J]. Journal of Applied Microbiology, 2011, 110(4): 1093-1103. |
| [21] |
YANG H L, XIA H Q, YE Y D, et al. Probiotic Bacillus pumilus SE5 shapes the intestinal microbiota and mucosal immunity in grouper Epinephelus coioides[J]. Diseases of Aquatic Organisms, 2014, 111(2): 119-127. |
| [22] |
HONG Y, CHENG Y, LI Y, et al.Preliminary study on the effect of Bacillus amyloliquefaciens TL on cecal bacterial community structure of broiler chickens[J/OL].BioMed Research International, 2019, doi: 10.1155/2019/5431354.
|
| [23] |
YANG H L, SUN Y Z, HU X, et al. Bacillus pumilus SE5 originated PG and LTA tuned the intestinal TLRs/MyD88 signaling and microbiota in grouper (Epinephelus coioides)[J]. Fish and Shellfish Immunology, 2019, 88: 266-271. |
| [24] |
JIANG Y, WANG Y, ZHANG Z, et al. Responses of microbial community structure in turbot (Scophthalmus maximus) larval intestine to the regulation of probiotic introduced through live feed[J]. PLoS One, 2019, 14(5): e0216590. |
| [25] |
HALDAR L, GANDHI D N. Effect of oral administration of Bacillus coagulans B37 and Bacillus pumilus B9 strains on fecal coliforms, Lactobacillus and Bacillus spp. in rat animal model[J]. Veterinary World, 2016, 9(7): 766-772. |




