2. 北京农学院, 奶牛营养学北京市重点实验室, 北京 102206
2. Beijing Key Laboratory for Dairy Cow Nutrition, Beijing University of Agriculture, Beijing 102206, China
能量负平衡(NEB)是奶牛产后能量代谢障碍性疾病(酮病、脂肪肝)的共同病理学基础,多发于日产奶30 kg以上的高产牛。泌乳早期的奶牛易出现NEB,由此引起的体脂动员导致奶牛血浆非酯化脂肪酸(NEFA)浓度升高[1],同时高浓度NEFA通过刺激相关基因诱导细胞凋亡DNA片段化因子45样效应因子A(CIDEA)的表达影响乳脂含量[2],从而制约养殖业以及奶业的发展。
过瘤胃葡萄糖(RPG)对于奶牛NEB的缓解具有重要意义[3],目前已经在生产中得到广泛地应用。研究表明,在奶牛饲粮中补充200 g/(头·d) RPG能够显著提高产奶量,降低炎症相关指标[5];同时,还有研究发现在奶牛饲粮中补充RPG能够促进新陈代谢以及回肠上皮的免疫稳态[6]。燕麦干草是奶牛重要的粗饲料来源之一,中性洗涤纤维(NDF)消化率高,而且吸收效果很好,能够符合围产后期奶牛的实际营养需求,可减缓体况损失。在添加燕麦草的同时合理利用其他优质粗饲料,营养优势互补,可确保奶牛瘤胃保持健康高效的消化功能,对草料的利用效率达到最大化,有效减少产后代谢病的发生,使新产牛提前达到泌乳高峰值,并延长泌乳高峰时段[7]。李明华等[4]研究干奶前期饲喂燕麦草对奶牛围产后期的影响时发现,燕麦草能明显降低奶牛产后酮病的发病率,提高奶牛产后21 d以内的产奶量,还可降低奶牛产犊时人工助产的比率。Zou等[8]研究发现,用燕麦干草部分替代紫花苜蓿干草可以改善瘤胃发酵,提高氮的利用率。RPG以氢化脂肪为包衣,在瘤胃内的滞留可能会影响微生物的发酵及燕麦干草在瘤胃内的降解。因此,RPG的瘤胃稳定性及其脂肪包衣对粗饲料瘤胃降解特性的影响成为了其能否广泛应用的关键。尼龙袋法又叫半体内法,是评价饲料瘤胃降解率的常用方法。本试验通过尼龙袋法研究RPG的瘤胃稳定性及其不同剂量对燕麦干草瘤胃降解特性的影响,以探究在缓解奶牛NEB的同时不影响燕麦干草消化的RPG最适添加剂量,为生产中合理应用RPG提供理论参考。
1 材料与方法 1.1 试验动物与饲养管理选用6头体重相近、体况相似、产奶量相近、胎次相同、健康且安装有永久性瘤胃瘘管的荷斯坦奶牛作为试验动物,饲养试验于2019年9月在北京奶牛中心延庆基地良种场开展。试验期间,奶牛采用散栏式饲养,每日饲喂全混合日粮(TMR)3次(07:00、14:00和21:00),自由采食和饮水。TMR组成及营养水平见表 1。
|
|
表 1 TMR组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the TMR (DM basis) % |
试验选用的RPG产品壁材为氢化脂肪,芯材为食品级葡萄糖。试验选用的燕麦干草为北京奶牛中心延庆基地良种场进口燕麦干草。为充分模拟燕麦干草瘤胃降解特性,本试验采用TMR原料中燕麦干草即已经轧短的燕麦干草开展尼龙袋试验。
1.3 试验方法 1.3.1 尼龙袋法测定RPG瘤胃稳定性选择5 cm×10 cm,孔径30~50 μm的尼龙袋,将尼龙袋于40 ℃[10-11]烘至恒重(48 h)备用。准确称取10 g RPG样品,小心放入已知质量的尼龙袋中。选择4头瘤胃瘘管牛,每头瘘管牛共投放18个装有10 g RPG样品的尼龙袋,于晨饲前1 h投放到瘤胃中,另一端用尼龙绳固定在瘘管塞上。分别于放置后2、4、6、8、12、24 h后取出每头瘘管牛瘤胃中的3个尼龙袋,记录编号。将取出的尼龙袋立即放在自来水下冲洗,然后放入水中浸泡55 min,随后用中等流速的自来水漂洗,直至流水澄清为止。将3个装有10 g RPG样品的尼龙袋放入37 ℃温水中浸泡5 min后取出,记录编号,作为0 h时样品,用流水冲洗至澄清。将冲洗干净的尼龙袋于40 ℃的烘箱中烘至恒重(48 h),称重后取出尼龙袋中的剩余物,放入自封袋中于4 ℃下保存待测。
1.3.2 尼龙袋法测定不同剂量RPG对燕麦干草瘤胃降解特性的影响按体重和产奶量将6头瘘管牛随机分为3组,每组2头。对照组饲喂基础饲粮,200和350 g组分别在基础饲粮的基础上添加200和350 g/(头·d)的RPG,将RPG均匀混合于精料中进行饲喂。预试期7 d,正试期3 d。
准确称取通过2.5 mm筛的燕麦干草风干样品3 g于尼龙袋中,将21个尼龙袋于晨饲前1 h投放到每头瘘管牛的瘤胃中,另一端将尼龙绳固定在瘘管塞上。分别于放置2、6、12、24、36、48、72 h后取出每头瘘管牛瘤胃中的3个尼龙袋,记录编号。将取出的尼龙袋立即放在自来水下冲洗,然后放入水中浸泡55 min,随后用中等流速的自来水漂洗直至流水澄清为止。将冲洗干净的尼龙袋于65 ℃的烘箱中烘至恒重(48 h,称重后取出尼龙袋中的剩余物,磨碎过1 mm筛,放入自封袋中于4 ℃下保存备用。
在正试期的最后1天,采集试验牛空腹状态下07:00、14:00、21:00 3个时间点的瘤胃液,一部分立即测定pH,另一部分-20 ℃保存待测氨态氮(NH3-N)及挥发性脂肪酸(VFA)浓度。
1.4 测定指标及方法对于RPG样品,采用蒽酮法[12]对不同时间点尼龙袋剩余物中葡萄糖含量进行测定;对于燕麦干草样品,各个时间点干物质(DM)、粗蛋白质(CP)含量分别参照GB/T 6435—2006、GB/T 6432—1994中方法测定,NDF、酸性洗涤纤维(ADF)含量参照Van Soest等[13]的方法测定。
使用便携式pH计(Testo-205, Testo AG,Lenzkirch,德国)测定并记录不同时间点瘤胃液pH。使用气相色谱仪(GC-14B,津岛公司,日本)测定瘤胃液VFA浓度[12]。采用苯酚-次氯酸钠比色法[12]测定瘤胃液NH3-N浓度。
1.5 计算公式 1.5.1 瘤胃降解率

|
瘤胃降解参数依据Ørskov等[14]的指数模型计算:
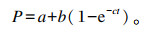
|
式中:t为饲料原料在瘤胃内停留时间(h);P为t时刻某营养成分的瘤胃降解率(%);a为该营养成分的快速降解部分(%);b为该营养成分的慢速降解部分(%);c为b的降解速率(%/h)。
用最小二乘法计算出a、b和c值,再代入下面的公式中,计算出饲料原料成分的有效降解率:
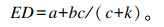
|
式中:ED为有效降解率(%);k为饲料原料的外流速度(h-1),k=0.036+0.017x,x为饲养水平,本试验中,RPG和燕麦干草的k值均取0.03[15-16]。
1.6 数据统计与分析采用SAS 9.2软件中非线性指数模型NLIN过程计算a、b、c值,再用ANOVA程序进行平均值的方差分析,并采用Duncan氏法进行多重比较,结果用平均值±标准差表示,以P < 0.05作为差异显著性的判断标准。
2 结果与分析 2.1 RPG的瘤胃稳定性由表 2可知,RPG在瘤胃中的降解率随着在瘤胃中培养时间的延长而增加,在瘤胃滞留24 h时降解率达到57.25%。由表 3可知,RPG在瘤胃内的慢速降解部分达到46.25%,同时RPG在瘤胃内的有效降解率为45.97%,即过瘤胃率为54.03%。
|
|
表 2 RPG的瘤胃降解率及降解参数 Table 2 Ruminal degradability and degradation parameters of RPG |
|
|
表 3 RPG对奶牛瘤胃液pH、氨态氮、挥发性脂肪酸浓度的影响 Table 3 Effects of RPG on pH, NH3-N and VFA concentrations in rumen fluid of dairy cows |
由表 3可知,瘤胃液pH随着RPG添加剂量的增加而降低,且各时间点时350 g组均显著低于对照组(P < 0.05)。各时间点瘤胃液NH3-N浓度均表现为200 g组显著高于对照组和350 g组(P < 0.05),对照组和350 g组之间差异不显著(P>0.05)。不同剂量RPG对14:00的瘤胃液丁酸和异戊酸浓度有显著影响(P < 0.05),均以200 g组浓度最高,对各时间点的其他VFA和总VFA浓度无显著影响(P>0.05)。
2.3 不同剂量的RPG对燕麦干草瘤胃降解特性的影响 2.3.1 不同剂量的RPG对燕麦干草DM瘤胃降解特性的影响由表 4可以看出,对照组2、6、12、48 h的DM瘤胃降解率显著高于200和350 g组(P < 0.05),同时在36 h的DM瘤胃降解率显著高于200 g组(P < 0.05),但对照组24 h的DM瘤胃降解率显著低于200和350 g组(P < 0.05)。DM快速降解部分最高的是对照组,达14.94%,显著高于依次降低的200、350 g组(P < 0.05);对照组和200 g组的DM慢速降解部分及潜在可降解部分显著高于350 g组(P < 0.05),但是3组之间的DM有效降解率没有显著差异(P>0.05)。
|
|
表 4 燕麦干草的DM瘤胃降解率及降解参数 Table 4 DM ruminal degradability and degradation parameters of oat hay |
由表 5可以看出,只有48和72 h的NDF瘤胃降解率对照组显著高于350 g组(P < 0.05),其他各个时间点NDF瘤胃降解率在各组之间均没有显著差异(P>0.05),但是总体来看对照组的NDF瘤胃降解率在各个时间点普遍高于依次降低的200、350 g组。200 g组的NDF慢速降解部分显著高于依次降低的对照组和350 g组(P < 0.05),并且其NDF慢速降解部分的降解速率显著低于对照组和350 g组(P < 0.05)。分析NDF潜在可降解部分数据发现,200 g组显著高于依次降低的对照组和350 g组(P < 0.05)。350 g组的NDF有效降解率显著低于对照组和200 g组(P < 0.05)。
|
|
表 5 燕麦干草的NDF瘤胃降解率及降解参数 Table 5 NDF ruminal degradability and degradation parameters of oat hay |
由表 6可以看出,350 g组的ADF瘤胃降解率在48 h内增速缓慢,在48 h后增速较快,其48 h的ADF瘤胃降解率最低,为42.48%,而其72 h的ADF瘤胃降解率则最高,显著高于对照组和200 g组(P < 0.05)。对照组的ADF快速降解部分最高,但是3组之间无显著差异(P>0.05)。对照组的ADF慢速降解部分以及潜在可降解部分均显著低于200和350 g组(P < 0.05),但其有效降解率显著高于200和350 g组(P < 0.05)。
|
|
表 6 燕麦干草的ADF瘤胃降解率及降解参数 Table 6 ADF ruminal degradability and degradation parameters of oat hay |
由表 7可以看出,对照组48 h的CP瘤胃降解率显著高于200和350 g组(P < 0.05),其他时间点的CP降解率各组之间没有显著差异(P>0.05)。CP瘤胃降解参数各组之间差异不显著(P>0.05),并且数值波动较小。
|
|
表 7 燕麦干草的CP瘤胃降解率及降解参数 Table 7 CP ruminal degradability and degradation parameters of oat hay |
RPG的瘤胃稳定性是其作为过瘤胃产品的重要指标,稳定性强的RPG在瘤胃内经过包衣的包裹能够达到很好的瘤胃保护效果和后肠释放功能。本试验结果表明,经氢化脂肪包被的葡萄糖,其瘤胃有效降解率为45.97%,本试验结果与薛倩等[16]测得的以乙基纤维素、聚丙烯酸树脂和壳聚糖作为包衣壁材的葡萄糖微胶囊瘤胃有效降解率基本一致。
3.2 不同剂量的RPG对奶牛瘤胃液pH、NH3-N和VFA浓度的影响瘤胃液pH、NH3-N和VFA浓度是反映瘤胃发酵情况的重要指标。pH的降低是由于强烈的瘤胃发酵及其引起的短链脂肪酸增加所致[17]。本试验中,添加的RPG在短时间内所释放出的葡萄糖,使得瘤胃pH迅速降低。本研究发现,饲粮添加RPG能够降低瘤胃液NH3-N浓度,此前有研究通过为泌乳奶牛提供淀粉、蔗糖及乳糖等非纤维性碳水化合物(NFC)来探究高糖饲粮对奶牛瘤胃发酵的影响,发现试验组NH3-N浓度有类似的降低趋势,并且对照组极显著高于试验组[18],这些结果可能表明当饲粮NFC含量增加时,在瘤胃中有更多的有机物发酵和微生物蛋白合成,造成瘤胃NH3-N浓度降低[19-20]。
Van Soest[21]指出,包括乙酸、丙酸和丁酸在内的VFA是碳水化合物瘤胃发酵的最终产物,是反刍动物代谢能的主要来源。本试验结果发现,不同剂量的RPG对瘤胃液VFA浓度的影响不大,这与李海霞等[22]的研究结果一致,过瘤胃产品并没有对瘤胃液中乙酸和丙酸的浓度造成显著影响。瘤胃液中VFA的产生与瘤胃微生物有着密切的关系,正如Leng[23]所指出的,瘤胃微生物生长的效率取决于能量和蛋白质的可得性及二者的同步,而其中能量与瘤胃液中VFA浓度有密切的关系。
3.3 不同剂量的RPG对燕麦干草瘤胃降解特性的影响 3.3.1 不同剂量的RPG对燕麦干草DM瘤胃降解特性的影响本试验中,总的来看,添加高剂量RPG组DM瘤胃降解率最低,原因是RPG的包衣壁材氢化脂肪对瘤胃中的微生物产生了抑制作用,此前已有研究发现脂肪会抑制瘤胃微生物的生长,Rabiee等[24]和Martin等[25]试验均发现饲粮中添加脂肪对干物质采食量(DMI)有显著影响,并能够调控瘤胃微生物群落,降低甲烷排放。可见,由于RPG的氢化脂肪包衣影响了瘤胃微生物的活动,进而降低了DM的瘤胃降解率。
3.3.2 不同剂量的RPG对燕麦干草NDF及ADF瘤胃降解特性的影响NDF和ADF的瘤胃降解率是衡量燕麦干草营养价值的重要指标。本试验中,大部分时间点对应的NDF及ADF瘤胃降解率各组之间差异不显著,这与李妍等[26]的报道一致,说明RPG的添加剂量不会显著影响粗饲料在瘤胃内的消化。但是对照组的NDF及ADF瘤胃降解率普遍较高,这主要是由于2个RPG添加组奶牛瘤胃中RPG损失部分的脂质包被在饲粮颗粒上,导致微生物对饲粮的吸附受到影响,在影响纤维分解菌生长的同时,降低了纤维降解率[27];同时,瘤胃液pH较低时会对瘤胃纤维分解菌产生较大的影响,当瘤胃中pH低于6.2时,瘤胃纤维分解菌的生长将会受到抑制[28]。Grant等[29]试验结果表明,瘤胃液pH从6.8降到5.8时,会使NDF的降解时间延长且降解率下降。Barbosa等[30]的研究也发现,反刍动物瘤胃液pH在5.5~7.2,在喂食高浓缩饲粮后不久出现最低值;而瘤胃液pH在6.0以下可能会抑制纤维素分解菌的活性,这是导致纤维降解率降低的一个因素。
饲料在瘤胃内的发酵过程中会产生大量的VFA,导致瘤胃液pH降低,进而扰乱瘤胃微生物区系,抑制纤维降解。前人研究发现,适宜瘤胃发酵的NH3-N浓度最小值高于10 mg/dL[31]。值得注意的是,维持微生物合成所需的最低NH3-N浓度为10 mg/dL,而发酵(尤其是纤维发酵)所需NH3-N浓度的理想值为15~29 mg/dL[32]。
研究发现燕麦干草能够增强瘤胃微生物的活动,从而提高产气量,并且在提高总VFA浓度的同时不影响丙酸的比例[33],这与本试验结果不一致,其原因可能是本试验中RPG影响了瘤胃内发酵环境,从而对瘤胃的消化代谢产生了影响,但是具体的影响因素有待探究。本试验中各组之间的NDF和ADF瘤胃动态降解模型参数差异较大,350 g组的降解情况处于较低水平,这与Li等[5]及Zhang等[6]研究结果一致,RPG影响了NDF及ADF的降解速度,表现出较缓的增速。虽然RPG可能阻碍了瘤胃微生物的生长及功能,但是有研究发现其能够促进奶牛回肠上皮代谢,改善回肠免疫稳态[34],并且对回肠消化和黏膜相关菌群无显著影响[6]。此外,本试验中对照组的燕麦干草相关数据与刘艳芳等[35]及刘祥圣等[36]的测定结果保持一致,说明试验及测定过程合理,各组之间的差异是由处理所致。
3.3.3 不同剂量的RPG对燕麦干草CP瘤胃降解特性的影响CP瘤胃降解率主要受饲粮粗蛋白质的含量、组成以及在瘤胃内滞留时间的影响[37]。NRC(2001)表明,燕麦干草粗蛋白质含量为9.1%,其中10种必需氨基酸的含量占到粗蛋白质总量的35.35%。本试验中,2个RPG添加组的CP瘤胃降解率在除48 h时的各时间点与对照组均无显著差异,说明RPG对奶牛瘤胃微生物蛋白质分解菌没有显著的抑制作用。研究显示蛋白质有效消化的瘤胃最佳氨浓度为5.0~25.0 mg/dL[38]和15~30 mg/dL[39]。Wallace等[40]也观察到,当瘤胃液中氨浓度从9.7 mg/dL增加到21.4 mg/dL时,DM和CP的瘤胃降解速率增加,这与本研究结果不尽一致,一部分原因可能是燕麦干草的可降解蛋白质(RDP)较少[11],而苜蓿草虽然粗蛋白质含量(18%~20%)高,但RDP比例较大,大部分蛋白质在瘤胃中直接被消化[41],究其确切因素还需进一步开展试验探究。在Doran等[42]的研究中也发现燕麦干草组的RDP含量要比苜蓿干草与燕麦干草混合组以及桑叶与燕麦干草混合组少,所以其CP瘤胃降解特性几乎不受RPG的影响。
4 结论① RPG在瘤胃内的有效降解率为45.97%,即过瘤胃率为54.03%。
② 不同剂量的RPG对瘤胃发酵有一定的影响,奶牛饲粮中添加350 g/(头·d) RPG影响了燕麦干草常规营养成分瘤胃降解特性,其中主要对DM的72 h降解率和NDF、ADF的有效降解率产生了显著影响。
③ 从瘤胃发酵参数及燕麦干草DM、NDF、ADF、CP等瘤胃降解特性分析,奶牛饲粮中添加200 g/(头·d) RPG可调控瘤胃发酵,同时不会对燕麦干草瘤胃降解特性造成显著影响,但是生产中奶牛所需最适剂量还需结合机体代谢及生产性能等指标进一步探究。
| [1] |
WHITE H M. The role of TCA cycle anaplerosis in ketosis and fatty liver in periparturient dairy cows[J]. Animals, 2015, 5(3): 793-802. |
| [2] |
SUN X D, WANG Y Z, LOOR J J, et al. High expression of cell death-inducing DFFA-like effector a (CIDEA) promotes milk fat content in dairy cows with clinical ketosis[J]. Journal of Dairy Science, 2019, 102(2): 1682-1692. |
| [3] |
李影, 李徐延, 张洪友, 等. 过瘤胃葡萄糖对奶牛能量代谢的影响[J]. 中国兽医杂志, 2014, 50(1): 6-8. |
| [4] |
LI X P, TAN Z L, JIAO J Z, et al. Supplementation with fat-coated rumen-protected glucose during the transition period enhances milk production and influences blood biochemical parameters of liver function and inflammation in dairy cows[J]. Animal Feed Science and Technology, 2019, 252: 92-102. |
| [5] |
ZHANG X L, WU J, HAN X F, et al. Effects of rumen-protected glucose on ileal microbiota and genes involved in ileal epithelial metabolism and immune homeostasis in transition dairy cows[J]. Animal Feed Science and Technology, 2019, 254: 114199. |
| [6] |
白廷军, 杨茁萌. 燕麦干草的生产与利用[J]. 中国奶牛, 2015(18): 26-28. |
| [7] |
李明华, 李锡智, 周玉财, 等. 干奶前期饲喂燕麦草对奶牛围产后期生产性能的影响[J]. 中国奶牛, 2016(7): 11-14. |
| [8] |
ZOU Y, ZOU X P, LI X Z, et al. Substituting oat hay or maize silage for portion of alfalfa hay affects growth performance, ruminal fermentation, and nutrient digestibility of weaned calves[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(3): 369-378. |
| [9] |
ALI M, VAN DUINKERKEN G, CONE J W, et al. Relationship between chemical composition and in situ rumen degradation characteristics of maize silages in dairy cows[J]. Animal, 2014, 8(11): 1832-1838. |
| [10] |
谢实勇, 贾志海, 范俊英. 瘤胃保护性蛋氨酸稳定性检验研究[J]. 当代畜牧, 2003(5): 31-32. |
| [11] |
李金霞, 孙海洲, 赵存发, 等. 过瘤胃保护性精氨酸稳定性检验研究[J]. 畜牧与饲料科学, 2011, 32(2): 72-73. |
| [12] |
王加启. 反刍动物营养学研究方法[M]. 北京: 现代教育出版社, 2011.
|
| [13] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. |
| [14] |
ØRSKOV E R, MCDONALD I. The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage[J]. The Journal of Agricultural Science, 1979, 92(2): 499-503. |
| [15] |
颜品勋, 冯仰廉, 王燕兵, 等.青粗饲料通过牛瘤胃外流速度的研究[C].反刍动物营养需要及饲料营养价值评定与应用.北京: 中国畜牧兽医学会动物营养学分会, 2011: 33-35..
|
| [16] |
薛倩, 高艳霞, 陈子宁, 等. 不同壁材对过瘤胃葡萄糖微胶囊稳定性的影响[J]. 中国饲料, 2015(6): 25-27, 31. |
| [17] |
DONKIN S S. Glycerol from biodiesel production:the new corn for dairy cattle[J]. Revista Brasileira de Zootecnia, 2008, 37: 280-286. |
| [18] |
GAO X, OBA M. Effect of increasing dietary nonfiber carbohydrate with starch, sucrose, or lactose on rumen fermentation and productivity of lactating dairy cows[J]. Journal of Dairy Science, 2016, 99(1): 291-300. |
| [19] |
RUSSELL J B, O'CONNOR J D, FOX D G, et al. A net carbohydrate and protein system for evaluating cattle diets:Ⅰ.Ruminal fermentation[J]. Journal of Animal Science, 1992, 70(11): 3551-3561. |
| [20] |
NOCEK J E, RUSSELL J B. Protein and energy as an integrated system.Relationship of ruminal protein and carbohydrate availability to microbial synthesis and milk production[J]. Journal of Dairy Science, 1988, 71(8): 2070-2107. |
| [21] |
VAN SOEST P J. Nutritional ecology of the ruminant[M]. 2nd ed. Ithaca, New York: Cornell University Press, 1994: 476.
|
| [22] |
李海霞, 杨美英, 吴文海, 等. 过瘤胃蛋氨酸对黔北麻羊生长性能、养分表观消化率、血浆生化指标及瘤胃发酵的影响[J]. 动物营养学报, 2019, 31(6): 2933-2940. |
| [23] |
LENG R A.Modification of rumen fermentation[M]//HACKER J B.Nutritional limits to animal production from pastures.Farnham Royal, U.K.: CAB, 1982: 427-453.
|
| [24] |
RABIEE A R, BREINHILD K, SCOTT W, et al. Effect of fat additions to diets of dairy cattle on milk production and components:a meta-analysis and meta-regression[J]. Journal of Dairy Science, 2012, 95(6): 3225-3247. |
| [25] |
MARTIN C, FERLAY A, MOSONI P, et al. Increasing linseed supply in dairy cow diets based on hay or corn silage:effect on enteric methane emission, rumen microbial fermentation, and digestion[J]. Journal of Dairy Science, 2016, 99(5): 3445-3456. |
| [26] |
李妍, 薛倩, 高艳霞, 等. 瘤胃保护葡萄糖对围产后期荷斯坦奶牛生产性能及血清生化指标的影响[J]. 畜牧兽医学报, 2016, 47(1): 113-119. |
| [27] |
DEVENDRA C, LEWIS D. The interaction between dietary lipids and fibre in the sheep 2.Digestibility studies[J]. Animal Science, 1974, 19(1): 67-76. |
| [28] |
RUSSELL J B, WILSON D B. Why are ruminal cellulolytic bacteria unable to digest cellulose at low pH?[J]. Journal of Dairy Science, 1996, 79(8): 1503-1509. |
| [29] |
GRANT R H, MERTENS D R. Influence of buffer pH and raw corn starch addition on in vitro fiber digestion kinetics[J]. Journal of Dairy Science, 1992, 75(10): 2762-2768. |
| [30] |
BARBOSA A M, VALADARES R F D, VALADARES FILHO S C, et al. Endogenous fraction and urinary recovery of purine derivatives obtained by different methods in Nellore cattle[J]. Journal of Animal Science, 2011, 89(2): 510-519. |
| [31] |
LENG R A. Factors affecting the utilization of 'poor-quality' forages by ruminants particularly under tropical conditions[J]. Nutrition research reviews, 1990, 3(1): 277-303. |
| [32] |
PRESTON T R.Better utilization of crop residues and by-products in animal feeding: research guidelines.2.A practical manual for research workers[R].Rome: Food and Agriculture Organization of the United Nations, 1986.
|
| [33] |
张毕阳, 赵桂琴, 焦婷, 等. 饲粮中添加燕麦干草对绵羊体外发酵的影响[J]. 草业学报, 2018, 27(2): 182-191. |
| [34] |
张小丽, 吴建, 韩雪峰, 等. 过瘤胃葡萄糖对围产期奶牛空肠微生物群落和黏膜代谢及免疫相关基因表达的影响[J]. 动物营养学报, 2019, 31(7): 3143-3155. |
| [35] |
刘艳芳, 马健, 都文, 等. 常规与非常规粗饲料在奶牛瘤胃中的降解特性[J]. 动物营养学报, 2018, 30(4): 1592-1602. |
| [36] |
刘祥圣, 王琳, 宁丽丽, 等. 构树不同部位与奶牛常用粗饲料瘤胃降解特性对比研究[J]. 动物营养学报, 2019, 31(8): 3612-3620. |
| [37] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004.
|
| [38] |
PRESTON T R, LENG R A. Matching ruminant production systems with available resources in the tropics and sub-tropics[M]. Armidale: Penambul Books, 1987.
|
| [39] |
WANAPAT M, PIMPA O. Effect of ruminal NH3-N levels on ruminal fermentation, purine derivatives, digestibility and rice straw intake in swamp buffaloes[J]. Asian-Australasian Journal of Animal Sciences, 1999, 12(6): 904-907. |
| [40] |
WALLACE R J. Effect of ammonia concentration on the composition, hydrolytic activity and nitrogen metabolism of the microbial flora of the rumen[J]. Journal of Applied Bacteriology, 1979, 47(3): 443-455. |
| [41] |
张颖, 毛华明. 不同种类牧草营养物质瘤胃降解率研究[J]. 饲料工业, 2014, 35(21): 54-57. |
| [42] |
DORAN M P, LACA E A, SAINZ R D. Total tract and rumen digestibility of mulberry foliage (Morus alba), alfalfa hay and oat hay in sheep[J]. Animal Feed Science and Technology, 2007, 138(3/4): 239-253. |




