2. 浙江农林大学林业与生物技术学院, 杭州 311300
2. School of Forestry and Biotechnology, Zhejiang A&F University, Hangzhou 311300, China
黄粉虫(Tenebrio molitor)又名面包虫,属鞘翅目(Coleoptera)拟步甲科(Tenebrionidae)粉甲属(Tenebrionin)。黄粉虫体内富含氨基酸、蛋白质以及脂肪酸等营养物质[1],目前作为资源昆虫正大量饲养[2],除用作禽畜饲料外,也可作为人类的膳食营养来源[3-4]。研究表明黄粉虫中的多不饱和脂肪酸能够调节小鼠的脂质代谢[5-6]。Dabbou等[7]研究发现,饲喂含有黄粉虫幼虫饲粮的鸡肉含有更高比例的油酸与α-亚油酸。脂肪酸是昆虫合成脂肪醇、鞘脂、甘油酯以及烃类等的重要前体物质[8-9],在昆虫繁殖[10]、能量代谢、抵御不良环境[11-12]、免疫反应[13-15]及信号识别[16-20]等活动中均具有重要作用。脂肪酸合成是一个复杂的生物学过程,需要多种酶参与,包括乙酰辅酶A羧化酶(ACC)、脂肪酸合成酶(FAS)、超长链脂肪酸延伸酶(ELO)、脂肪酸去饱和酶(FAD)以及脂酰辅酶A还原酶(FAR)等[9]。ACC是脂肪酸合成通路第1步的限速酶,参与昆虫的脂质积累及繁殖活动。Pan等[21]研究表明,干扰棉蚜的ACC表达会降低其生殖力并导致螺虫乙酯抗性种群的角质层形成受阻;Zhang等[22]研究表明,井岗霉素处理后繁殖力提高的褐飞虱可以通过干扰ACC表达使其繁殖力恢复到正常水平。FAS是催化脂肪酸形成软脂酸的酶,与昆虫的滞育相关[23]。ELO是脂肪酸延伸反应第1步的限速缩合酶,影响昆虫的信息素合成、生殖能力以及表皮功能等[24-25]。FAD(又称为desat)是催化双键合成的酶,作用于昆虫的信息素合成[26]。FAR可将脂肪酸转化为脂肪醇,主要参与昆虫信息素以及蜡酯的合成[27-29]。黄粉虫虫体的脂肪酸成分与含量在卵、幼虫、蛹以及成虫这4个发育阶段存在差异[4],因此脂肪酸合成关键基因的表达量在这几个发育阶段亦可能存在不同。转录组可以反映不同发育阶段、不同组织部位生物体内基因的表达模式,是揭示昆虫形态、生理、行为及发育等对环境适应、进化等遗传机制的有力工具[30-34]。目前,已进行转录组测序的鞘翅目昆虫包括赤拟谷盗(Tribolium castaneum)、松墨天牛(Monochamus alternatus)、异色瓢虫(Harmonia axyridis)与黄粉虫等30多个物种[32]。其中Oppert等[35]利用转录组数据研究了黄粉虫幼虫食用苏云金芽孢杆菌Cry3Aa后肠道基因表达量的变化;Liu等[36]分析了黄粉虫触角的转录组序列信息;Liu等[37]从头测序分析了黄粉虫的转录组序列并鉴定了谷胱甘肽硫转移酶(GST)基因;Noh等[38]从黄粉虫转录组基因序列鉴定了脂质转运蛋白(LTP)基因。到目前为止,尚无不同发育阶段黄粉虫基因表达特性的相关报道。因此,本研究拟通过对不同发育阶段的黄粉虫进行高通量测序,从中获取与脂肪酸合成通路相关的基因信息,并对脂肪酸合成关键基因的特性与表达特征进行研究,以期为今后研究黄粉虫脂肪酸合成通路的调控机制奠定理论基础。
1 材料与方法 1.1 供试虫源本试验所需黄粉虫由山东农业大学赠送,并于本实验室的智能人工气候箱饲养1代以上。饲养条件为温度(26±1) ℃,相对湿度(65±5)%,光照条件8L:16D,以麦麸为饲料。收集足量的卵、1龄幼虫、2龄幼虫、老熟幼虫、蛹、雌成虫以及雄成虫虫体。供试黄粉虫进行饥饿24 h处理,以排出食物残渣。将供试黄粉虫用液氮处理后于-80 ℃超低温冰箱保存备用。
1.2 总RNA的提取与检测采用Trizol提取法分别提取黄粉虫各虫态RNA,用1%的琼脂糖凝胶电泳检测总RNA质量,Bio Drop超微量核酸蛋白测定仪测定吸光度(OD)值,检测RNA纯度。
1.3 cDNA建库及Illumina测序将检测合格的RNA用Sera-mag Magnetic Oligo (dT) Beads(Thermo Fisher)分离获得mRNA,加NaOH溶液将其打断为200~700 nt的短片段,随后用S-hex RT Primers合成双链cDNA,纯化回收并连接测序接头后进行扩增。用6% TBE PAGE Gel分离并回收300~500 bp的扩增产物作为测序文库,在Illumina HiSeqTM 2000高通量测序平台上进行测序。
1.4 reads预处理拼接组装及功能注释测序获得的reads经过去接头,去除质量值小于20(错误率小于1%)、比例阈值为40%以及含N部分比例大于4%的reads得到clean reads。采用Trinity软件进行无参组装,具体方法如下:对有一定重叠长度的片段进行拼接获得contigs,用paired-end reads比对,将来自同一转录本的contigs去冗余得到unigenes。unigenes通过Blastall(E值≤1E-5)后在Uniprot数据库进行功能注释,并上传至KEGG数据库预测基因代谢途径。
1.5 脂肪酸合成关键基因分析与表达通过SOAP将各龄期clean reads映射对应unigenes,得到各样本所有基因的read count集,并计算各基因的FPKM值(即每千个碱基的转录每百万映射读取的fragments数)。将7个试验组基因的FPKM均值设为虚拟对照组,依次与之比较,从中筛选拼接质量最高的脂肪酸合成关键基因。利用在线工具BLAST(https://blast.ncbi.nlm.nih.gov/Blast)搜索同源基因,DNAMAN软件翻译基因序列并进行氨基酸序列比对,ExPASy软件(http://web.expasy.org/protparam/)在线分析序列特征。
采用NCBI的Primer-blast设计定量引物,以黄粉虫的核糖体蛋白S3(RpS3)为内参基因(表 1),通过SYBRGreen染料法检测不同发育阶段脂肪酸合成关键基因的相对表达量,并根据2-△△Ct法计算相对表达量(以雌成虫期的相对表达量为1)。每个基因3个生物学重复,每个生物学重复3次技术重复。
|
|
表 1 荧光定量PCR引物序列 Table 1 Primer sequences for qRT-PCR |
采用SPSS 19.0软件进行单因素方差分析,试验数据用平均值±标准误表示,采用Turkey’s法进行多重比较检验,P < 0.05表示差异显著。
2 结果与分析 2.1 Illumina测序组装及unigenes长度分布本次转录组测序共获得284 356 830条raw reads,筛选过滤后得到228 946 500条clean reads,通过Trinity拼接获得156 761个转录子与104 937条unigenes,GC含量分别为43.25%与44.32%,unigenes的E值小于1E-5的有32 806条(表 2),上述数据表明本次测序结果良好,可以进行后续基因分析。
|
|
表 2 黄粉虫不同发育阶段样本转录组数据统计 Table 2 Transcriptome statistics of samples from different developmental stages of Tenebrio molitor |
拼接得到的unigenes平均长度为655 bp,其中长度大于3 000 nt的有3 467条,占3.30%;长度在1 000~3 000 nt的有2 991条,占10.40%;长度在500~1 000 nt的有16 320条,占15.60%;长度在200~500 nt的有74 208条,占70.70%。
2.2 Unigenes的功能注释利用Uniprot数据库成功注释了32 806条(占31.30%)unigenes。将注释成功的unigenes与Uniprot数据库进行比对,结果表明黄粉虫的基因序列与黑腹果蝇(Drosophila melanogaster)的同源性最高,达到9.53%。在进行Uniprot数据库比对,E值在0~1E-180的占6.00%;在1E-180~1E-150的占2.00%;在1E-150~1E-100的占7.00%;在1E-100~1E-50的占18.00%;在1E-50~1E-5的最多,占67.00%。
对黄粉虫不同发育阶段样本的基因序列进行比对,相似性达到100.00%的占2.00%;相似性介于90.00%~100.00%的占7.00%;相似性介于70.00%~90.00%的占14.00%;相似性介于50.00%~70.00%的占27.00%;相似性介于40.00%~50.00%的占21.00%;相似性低于40.00%的占29.00%。
2.3 Unigenes的功能分类将拼接获得的unigenes上传至KEGG数据库预测基因代谢通路,共有44 586条unigenes成功匹配到331条代谢通路中,其中基因富集前3的通路为代谢途径通路(5 227条,占11.72%),次生代谢产物生物合成通路(2 392条,占5.36%)以及在多种环境中的微生物代谢通路(1 548条,占3.47%)(表 3)。
|
|
表 3 Cotings匹配到KEGG数据库基因富集前10的通路 Table 3 Cotings matches the top 10 pathways for gene enrichment in KEGG database |
从上述331条代谢通路中筛选得到了17条3级通路与脂质代谢相关(表 4),其中与脂肪酸合成相关的有脂肪酸生物合成(fatty acid biosynthesis)通路,不饱和脂肪酸生物合成(biosynthesis of unsaturated fatty acids)通路与脂肪酸延伸(fatty acid elongation)通路,分别匹配到113、119以及49条cotings。
|
|
表 4 KEGG数据库中contigs匹配到的脂质代谢通路 Table 4 Lipid metabolism pathways matched by contigs in KEGG database |
将与脂肪酸合成相关的基因(删除长度 < 500 nt及重复的基因)进行聚类分析,发现不同发育阶段的基因表达量存在差异。脂肪酸合成通路的大部分基因在卵期与1龄幼虫期高表达,部分基因在2龄幼虫期与成虫期高表达,在老熟幼虫期与蛹期高表达的基因较少(图 1)。
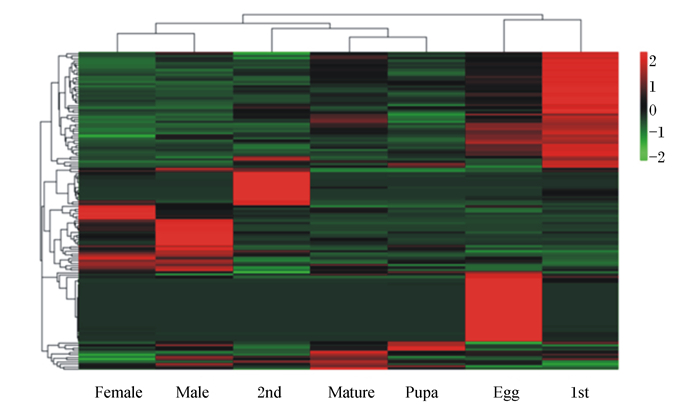
|
颜色从红到绿表示表达量从高到低,结果是基于FPKM的聚类分析。The color from red to green indicates the expression level from high to low, and the result is a cluster analysis based on FPKM. Egg:卵egg;1st:1龄幼虫1st instar larva;2nd:2龄幼虫2nd instar larva;Mature:老熟幼虫mature larva;Pupa:蛹pupa;Female:雌成虫female adult;Male:雄成虫male adult。图 6同The same as Fig. 6。 图 1 脂肪酸合成相关基因在不同发育阶段的表达量 Fig. 1 Expression levels of fatty acid synthesis-related genes at different developmental stages |
将获得的unigenes与Uniprot数据库进行比对,筛选脂肪酸合成相关通路的关键基因,共鉴定出14条ACC、75条FAS、101条FAR以及75条FAD基因。分别筛选1条含有该基因全长cDNA的序列分析其基因特性以及基因表达特征。
由表 5可知,ACC基因开放阅读框(ORF)长7 134 bp,编码2 375个氨基酸;FAS基因ORF长7 149 bp,编码2 382个氨基酸;FAR基因ORF长1 596 bp,编码531个氨基酸;FAD基因ORF长1 098 bp,编码365个氨基酸。除ACC为不稳定亲水蛋白外,FAS、FAR与FAD均为稳定亲水蛋白。
|
|
表 5 脂肪酸合成通路关键基因的特性 Table 5 Characteristics of key genes in fatty acid synthesis pathway |
将相应的基因序列翻译成氨基酸序列,与赤拟谷盗的同源基因进行序列比对,具体见图 2至图 5。黄粉虫的ACC基因与赤拟谷盗的ACC基因(XP_008194741.1)的相似性高达90.35%,具有生物素羧化酶(第158~278位氨基酸)、生物素羧化载体蛋白(第543~650位氨基酸)以及乙酰基辅酶A羧转移酶结构域(第1 697~2 264位氨基酸),并且有保守的赖氨酸残基(图 2中第822位氨基酸)。黄粉虫的FAD基因与赤拟谷盗的FAD基因(NP_001308592.1)的相似性较低,为37.87%,具有2个保守的组氨酸结构HXXHH(图 4中第122~126位氨基酸以及第263~267位氨基酸;X代表任意氨基酸,下同)。黄粉虫的FAS基因与赤拟谷盗的FAS基因(XP_008200285.1)的相似性达83.31%,具有7个功能域,包括β-酮酯酰合酶(KS,第175位氨基酸)、乙酰/丙二酸单酰基转移酶(AT/MT,第590位氨基酸)、脱水酶(DH,第888~897位氨基酸)、酰基载体蛋白(ACP,第1 162位氨基酸)、烯酰基还原酶(ER,第1569~1 574位氨基酸)、酮酯酰还原酶(KR,第1 784~1 789位氨基酸)以及硫酯酶(Th,第2 127~2 379位氨基酸)。黄粉虫的FAR基因与赤拟谷盗的FAR基因(XP_966905.1)比对有33.52%的相似性,具有TGXXGG、YXXXK 2个保守区域(图 5中第35~39位氨基酸以及第223~227位氨基酸)。

|
TcACC:赤拟谷盗的ACC基因;TmFAD:黄粉虫的ACC基因。 TcACC: ACC gene of Tribolium castaneum; TmFAD: ACC gene of Tenebrio molitor. 图 2 ACC基因氨基酸序列比对 Fig. 2 Amino acid sequence alignment of ACC gene |

|
TcFAS:赤拟谷盗的FAS基因;TmFAS:黄粉虫的FAS基因。 TcFAS: FAS gene of Tribolium castaneum; TmFAS: FAS gene of Tenebrio molitor. 图 3 FAS基因氨基酸序列比对 Fig. 3 Amino acid sequence alignment of FAS gene |

|
TcFAD:赤拟谷盗的FAD基因;TmFAD:黄粉虫的FAD基因。 TcFAD: FAS gene of Tribolium castaneum; TmFAD: FAD gene of Tenebrio molitor. 图 4 FAD基因氨基酸序列比对 Fig. 4 Amino acid sequence alignment of FAD gene |

|
TcFAR:赤拟谷盗的FAR基因;TmFAR:黄粉虫的FAR基因。 TcFAR: FAR gene of Tribolium castaneum; TmFAR: FAR gene of Tenebrio molitor. 图 5 FAR基因氨基酸序列比对 Fig. 5 Amino acid sequence alignment of FAR gene |
定量分析发现ACC、FAS、FAR与FAD基因在黄粉虫各个发育阶段均有表达(图 6)。其中ACC与FAS基因在雄成虫期高表达,与其他发育阶段存在显著差异(P < 0.05);FAD基因在雌成虫期相对表达量最高,与其他发育阶段存在显著差异(P < 0.05),其他发育阶段相对表达量较低且互相之间无显著差异(P>0.05)。上述结果表明ACC、FAS与FAD基因的表达可能和黄粉虫成虫性成熟或成虫化学通讯等相关,以及FAR基因参与了黄粉虫各个发育阶段中脂肪酸的合成。
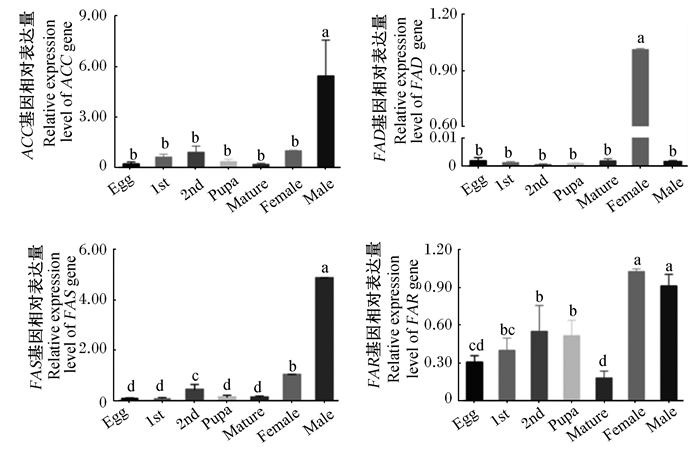
|
数据柱形标注不同小写字母表示差异显著(P < 0.05),相同小写字母表示差异不显著(P>0.05)。 Data column labels with different small letters indicate significant differences (P < 0.05), while with the same small letters mean no significant difference (P>0.05). 图 6 黄粉虫的ACC、FAD、FAS与FAR基因在不同发育阶段的相对表达量 Fig. 6 Relative expression levels of ACC, FAD, FAS and FAR genes of Tenebrio molitor at different developmental stages |
本次测序获得的104 937条unigenes在Uniprot数据库中进行注释,仅有32 806 (31.30%)条注释成功,还有68.70%未注释成功,其原因可能是只和Uniprot数据库进行了对比,数据量较少,以及测序和拼接质量存在差异,导致部分unigenes无效。
脂肪酸代谢是昆虫体内重要的代谢途径,对昆虫的能量代谢、免疫应答、生殖发育等活动都有影响。本研究获得的unigenes在KEGG数据库中进行代谢途径预测,共有44 586条unigenes匹配到331条代谢通路中,与脂肪酸合成相关的代谢途径有脂肪酸生物合成途径、不饱和脂肪酸生物合成途径以及脂肪酸延伸途径。聚类分析结果表明,卵期与1龄幼虫期高表达的基因较多,说明低龄幼虫的脂肪酸合成活动较其他发育阶段频繁,这与低龄幼虫期的代谢强度高、能量消耗高相对应。成虫期也有部分脂肪酸合成相关基因高表达,可能与脂肪酸是合成一些信息素比如碳氢化合物的前体物质有关。信息素在昆虫选择配偶及繁殖方面具有重要的作用[9-11],因此成虫期脂肪酸合成较为活跃。
脂肪酸合成关键基因的定量分析结果表明黄粉虫雄成虫期需要合成特定的脂肪酸,这可能是由于雄成虫性发育成熟会产生大量的生殖细胞,而脂肪酸是细胞膜的重要组成成分[39]。成虫期脂肪酸合成活动频繁表明ACC、FAS与FAD基因可能在黄粉虫成虫的信息素合成过程中发挥特定的作用[40]。FAR与ELO[41]基因在各个发育阶段都有表达,表明长链与超长链脂肪酸是黄粉虫各个发育阶段所必需的,推测FAR基因可能参与黄粉虫蜡酯的合成。本次定量分析仅筛选了拼接质量最好的基因序列,从黄粉虫转录组序列里共鉴定了14条ACC、75条FAS、101条FAR以及75条FAD基因,其他基因序列在不同发育阶段的表达特征以及基因功能还有待研究。本研究通过对黄粉虫不同发育阶段的转录组进行分析,挖掘了与脂肪酸合成相关的基因,并发现了不同发育阶段脂肪酸合成相关通路关键基因的表达具有特异性,为深入研究脂肪酸合成相关通路奠定了基础。
4 结论① 黄粉虫脂肪酸合成与发育阶段相关,低龄幼虫代谢活动高,脂肪酸合成通路相关基因的表达量相对较高。
② 本试验鉴定了ACC、FAS、FAR与FAD基因,研究发现这几个基因在黄粉虫的不同发育阶段具有表达特异性。
| [1] |
刘泽玉, 李龙, 武国华. 几种常见食用昆虫营养功能概况[J]. 中国蚕业, 2019, 40(3): 48-51. |
| [2] |
郑天祥.黄粉虫脂肪酸合成关键基因的发育表达以及超长链脂肪酸延伸酶的功能研究[D].硕士学位论文.杭州: 浙江农林大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10341-1017273812.htm
|
| [3] |
DREASSI E, CITO A, ZANFINI A, et al. Dietary fatty acids influence the growth and fatty acid composition of the yellow mealworm Tenebrio molitor (Coleoptera:Tenebrionidae)[J]. Lipids, 2017, 52(3): 285-294. |
| [4] |
PAUL A, FREDERICH M, MEGIDO R C, et al. Insect fatty acids:a comparison of lipids from three orthopterans and Tenebrio molitor L.larvae[J]. Journal of Asia-Pacific Entomology, 2017, 20(2): 337-340. |
| [5] |
王雷, 付勇, 严善春, 等. 黄粉虫幼虫多不饱和脂肪酸的降脂作用[J]. 东北林业大学学报, 2014, 42(5): 132-135. |
| [6] |
张建新, 张立佳, 王临宾, 等. 黄粉虫油对高脂血症小鼠血脂水平及抗氧化能力的影响[J]. 食品科学, 2011, 32(5): 263-266. |
| [7] |
DABBOU S, GASCO L, LUSSIANA C, et al. Yellow mealworm (Tenebrio molitor L.) larvae inclusion in diets for free-range chickens:effects on meat quality and fatty acid profile[J]. Renewable Agriculture and Food Systems, 2019, 97(2): 540-548. |
| [8] |
杨璞, 徐冬丽, 陈晓鸣, 等. 蜡酯合成途径及关键酶的研究进展[J]. 中国细胞生物学学报, 2012, 34(7): 695-703. |
| [9] |
郑天祥, 钱雨农, 张大羽. 昆虫脂肪酸合成通路关键基因的研究进展[J]. 中国生物工程杂志, 2017, 37(11): 19-27. |
| [10] |
SEENIVASAGAN T, SHARMA K R, PRAKASH S. Electroantennogram, flight orientation and oviposition responses of Anopheles stephensi and Aedes aegypti to a fatty acid ester-propyl octadecanoate[J]. Acta Tropica, 2012, 124(1): 54-61. |
| [11] |
史彩华, 胡静荣, 李传仁, 等. 环境胁迫下昆虫的耐寒适应机制研究进展[J]. 植物保护, 2016, 42(6): 21-28. |
| [12] |
易杰群, 邹志文, 张古忍. 昆虫脂肪酸及其脱饱和酶与耐寒性的关系概述[J]. 环境昆虫学报, 2015, 37(1): 155-162. |
| [13] |
URBANEK A, SZADZIEWSKI R, STEPNOWSKI P, et al. Composition and antimicrobial activity of fatty acids detected in the hygroscopic secretion collected from the secretory setae of larvae of the biting midge Forcipomyia nigra (Diptera:Ceratopogonidae)[J]. Journal of Insect Physiology, 2012, 58(9): 1265-1276. |
| [14] |
王奎, 冯颖, 孙龙, 等. 美洲大蠊乙酸乙酯提取物的分离和抑菌活性分析[J]. 林业科学研究, 2013, 26(2): 163-166. |
| [15] |
张希, 杨明, 宋飞, 等. 脂肪酸及其衍生物的抑菌活性[J]. 浙江大学学报(农业与生命科学版), 2013, 39(2): 155-160. |
| [16] |
杨锦锦, 嵇保中, 刘曙雯, 等. 白蚁表皮碳氢化合物研究进展[J]. 昆虫学报, 2013, 56(12): 1480-1488. |
| [17] |
杨锦锦, 嵇保中, 刘曙雯, 等. 黑翅土白蚁表皮碳氢化合物固相微萃取条件优化[J]. 科学技术与工程, 2014, 14(31): 19-24. |
| [18] |
SHARMA K R, ENZMANN B L, SCHMIDT Y, et al. Cuticular hydrocarbon pheromones for social behavior and their coding in the ant antenna[J]. Cell Reports, 2015, 12(8): 1261-1271. |
| [19] |
SMITH A A, LIEBIG J. The evolution of cuticular fertility signals in eusocial insects[J]. Current Opinion in Insect Science, 2017, 22: 79-84. |
| [20] |
SIMMONS L W, THOMAS M L, GRAY B, et al. Replicated evolutionary divergence in the cuticular hydrocarbon profile of male crickets associated with the loss of song in the Hawaiian archipelago[J]. Journal of Evolutionary Biology, 2014, 27(10): 2249-2257. |
| [21] |
PAN Y, ZHU E, GAO X, et al. Novel mutations and expression changes of acetyl-coenzyme a carboxylase are associated with spirotetramat resistance in Aphis gossypii glover[J]. Insect Molecular Biology, 2017, 26(4): 383-391. |
| [22] |
ZHANG Y X, GE L Q, JIANG Y P, et al. RNAi knockdown of acetyl-CoA carboxylase gene eliminates jinggangmycin-enhanced reproduction and population growth in the brown planthopper, Nilaparvata lugens[J]. Scientific Report, 2015, 5: 15360. |
| [23] |
TAN Q Q, LIU W, ZHU F, et al. Fatty acid synthase 2 contributes to diapause preparation in a beetle by regulating lipid accumulation and stress tolerance genes expression[J]. Scientific Report, 2017, 7: 40509. |
| [24] |
NG W C, CHIN J S R, TAN K J, et al. The fatty acid elongase bond is essential for Drosophila sex pheromone synthesis and male fertility[J]. Nature Communications, 2015, 6: 8263. |
| [25] |
FALC N T, FERREIRA-CALIMAN M J, NUNES F M F, et al. Exoskeleton formation in Apis mellifera:cuticular hydrocarbons profiles and expression of desaturase and elongase genes during pupal and adult development[J]. Insect Biochemistry and Molecular Biology, 2014, 50: 68-81. |
| [26] |
FUJII T, SUZUKI M G, KATSUMA S, et al. Discovery of a disused desaturase gene from the pheromone gland of the moth Ascotis selenaria, which secretes an epoxyalkenyl sex pheromone[J]. Biochemical and Biophysical Research Communications, 2013, 441(4): 849-855. |
| [27] |
YIN J M, CHEN G M, LAN Y Y, et al. Effect of Escherichia coli vaccine on gene expression of pulmonary surfactant proteins in fetal rabbit lungs[J]. Insect Molecular Biology, 2015, 24(1): 82-92. |
| [28] |
LIÉNARD M A, HAGSTRÖM A K, LASSANCE J M, et al. Evolution of multicomponent pheromone signals in small ermine moths involves a single fatty-acyl reductase gene[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(24): 10955-10960. |
| [29] |
HAGSTRÖM A K, LIÉNARD M A, GROOT A T, et al. Semi-selective fatty acyl reductases from four heliothine moths influence the specific pheromone composition[J]. PLoS One, 2012, 7(5): e37230. |
| [30] |
张棋麟, 袁明龙. 基于新一代测序技术的昆虫转录组学研究进展[J]. 昆虫学报, 2013, 56(12): 1489-1508. |
| [31] |
赵小凡. 昆虫学的基本科学问题及分子生物学技术[J]. 昆虫学报, 2016, 59(8): 896-905. |
| [32] |
王超群, 热孜宛古丽·阿卜杜克热木, 马艳华, 等.鞘翅目昆虫转录组研究进展[C]//绿色生态可持续发展与植物保护——中国植物保护学会第十二次全国会员代表大会暨学术年会论文集.长沙: 中国农业科学技术出版社, 2017: 93-96.
|
| [33] |
张赞, 刘金定, 黄水清, 等. 生物信息学在昆虫学研究中的应用[J]. 应用昆虫学报, 2012, 49(1): 1-11. |
| [34] |
顾欣悦, 柳丽君, 粟耘, 等. 实蝇科昆虫转录组研究进展[J]. 植物保护学报, 2018, 45(3): 399-408. |
| [35] |
OPPERT B, DOWD S E, BOUFFARD P, et al. Transcriptome profiling of the intoxication response of Tenebrio molitor larvae to Bacillus thuringiensis Cry3Aa protoxin[J]. PLoS One, 2012, 7(4): e34624. |
| [36] |
LIU S, RAO X J, LI M Y, et al. Identification of candidate chemosensory genes in the antennal transcriptome of Tenebrio molitor (Coleoptera:Tenebrionidae)[J]. Comparative Biochemistry and Physiology Part D:Genomics Proteomics, 2015, 13: 44-51. |
| [37] |
LIU S, SHI X X, JIANG Y D, et al. De novo analysis of the Tenebrio molitor (Coleoptera:Tenebrionidae) transcriptome and identification of putative glutathione S-transferase genes[J]. Applied Entomology and Zoology, 2015, 50(1): 63-71. |
| [38] |
NOH M Y, JO Y H. Identification and sequence analysis of two thaumatin-like protein (TmTLP) genes from Tenebrio molitor[J]. Entomological Research, 2016, 46(6): 354-359. |
| [39] |
FLEMING A D, YANAGIMACHI R. Evidence suggesting the importance of fatty acids and the fatty acid moieties of sperm membrane phospholipids in the acrosome reaction of guinea pig spermatozoa[J]. Journal of Experimental Zoology, 1984, 229(3): 485-489. |
| [40] |
CHERTEMPS T, DUPORTETS L, LABEUR C, et al. A female-specific desaturase gene responsible for diene hydrocarbon biosynthesis and courtship behaviour in Drosophila melanogaster[J]. Insect Molecular Biology, 2006, 15(4): 465-473. |
| [41] |
ZHENG T X, LI H S, HAN N, et al. Functional characterization of two elongases of very long-chain fatty acid from Tenebrio molitor L. (Coleoptera:Tenebrionidae)[J]. Scientific Reports, 2017, 7: 10990. |




