鞭毛是细菌主要的运动器官,可以促使细菌向有利环境游动,从而避免环境胁迫造成的损伤。在细菌的整个生命周期,鞭毛会帮助细菌从“游离向固着”,再由“固着向游离”状态转换,最终完成对新环境或是宿主的探索。鞭毛丝是从细胞质直接横穿到细菌的外部,由几十种蛋白组合而成,具有高度精密的空间构象[1]。在这些构成鞭毛的复杂多样的蛋白之中,鞭毛蛋白是鞭毛丝的主成分。鞭毛蛋白属于结构蛋白,亦是细菌运动的重要支架、动力元件和毒力因子[2-3]。鞭毛蛋白是宿主膜蛋白受体——Toll样受体5(TLR5)唯一的特异性配体(个别菌种除外),具有极强的免疫原性。现已证实,“鞭毛蛋白与TLR5的互作”在细菌的黏附定植、动物肠道的营养代谢、免疫调控过程中都担当着重要的角色[2, 4]。本文综述了鞭毛蛋白在菌体运动中的作用、免疫特性及其与肠道健康的关系、黏膜表皮细胞的免疫特征、功能结构和药物研发,并讨论了研究中存在的问题与解决策略。
1 鞭毛蛋白的功能结构随着对鞭毛蛋白研究的不断深入,鞭毛蛋白的蛋白构象和功能结构逐渐被解析。一般情况下,鞭毛蛋白的肽链折叠成4个结构域,即D0、D1、D2和D3。在鞭毛丝的空间结构中,D0和D1结构域主要是介导蛋白分子间和结构域间的相互作用,负责将鞭毛蛋白连接成规整的呈细丝状的螺旋茎。所以D0和D1结构域是鞭毛丝形成的核心和基石,维持整个鞭毛丝空间构架的稳定性,因此D0和D1序列在鞭毛蛋白同源序列中高度保守[5]。与此相反,D2和D3结构域并非鞭毛结构的主体,其是以D1结构域为中心向外扩散和延伸而成,并修饰鞭毛丝的表面,主要起辅助作用。因此,D2和D3结构域在蛋白质肽链的氨基酸组成、长度和构象上是超可变的,甚至在一些细菌中不存在(图 1)。例如,枯草芽孢杆菌、绿脓杆菌和肠道沙门氏菌的鞭毛蛋白分别具有2个(D0和D1)、3个(D0、D1和D2)和4个(D0、D1、D2和D3)结构域[6]。
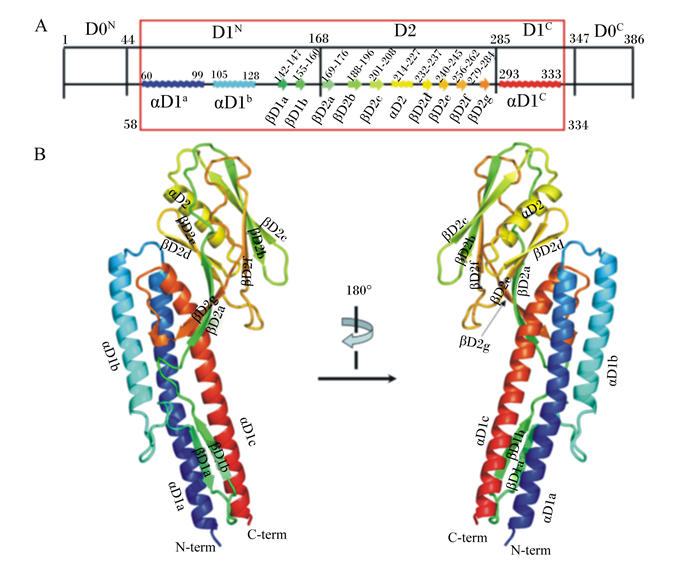
|
A:鞭毛蛋白二级结构。α-螺旋和β-折叠分别用波浪线和箭头表示。每个二级结构域的末端残基用黑线标出。鞭毛蛋白的核心结构域用红色框标出。B:鞭毛蛋白的晶体结构用彩虹色带标记(从蓝色的N端到红色的C端)。D0、D1、D2和D3表示鞭毛蛋白的4个结构域,D0N和D0C表示D0区域的N端和C端,D1N和D1C表示D1区域的N端和C端。αD1a、αD1b、αD1c和αD2表示各区域的α-螺旋结构;βD1a和βD1b表示D1区域的β-折叠结构;βD2a~βD2g表示D2区域的β-折叠结构。N-term表示N端,C-term表示C端。 A: secondary structure elements in flagellin. α-helices and β-strands are represented by waves and arrows, respectively. Domain boundary residues and terminal residues of each secondary structure are labeled in black. The protein region that was built in the flagellin structure is highlighted by a red box with terminal residue numbers shown in red. B: the flagellin structure in rainbow ribbons from the N-terminus in blue to the C-terminus in red. D0, D1, D2 and D3 represent four domains of flagellin. D0N and D0C represent N-terminal and C-terminal of D0 region; D1N and D1C represent N-terminal and C-terminal of D1 region. αD1a, αD1b, αD1c and αD2 represent the α-helix structure of D1 and D2; βD1a and βD1b represent the β-fold structure of D1; βD2a to βD2g represent the β-fold structure of D2. N-term refers to N-terminal, and C-term refers to C-terminal. 图 1 典型的鞭毛蛋白结构和晶体结构(绿脓杆菌为例) Fig. 1 Domain protein and crystal structure of flagellin (take Pseudomonas aeruginosa as an example)[5] |
有学者分析了“TLR5-鞭毛蛋白”互作形成的配合物的晶体结构,发现鞭毛蛋白分子可借助其D1结构域与TLR5结合,通过高亲和力的“初级结合”形成“1 : 1”的复合体,而后再通过低亲和力的“二次聚合”形成一个“2 : 2”的聚合体[7-9]。除了D1结构域外,D0亦是鞭毛蛋白激活TLR5通路信号所必需的功能结构[10]。
2 鞭毛蛋白在菌体运动中的作用鞭毛是细菌重要的定植因子[11],而鞭毛蛋白是鞭毛的主成分,所以鞭毛蛋白可能在细菌的黏附定植过程中发挥着重要的作用。鞭毛蛋白的D1结构域与TLR5胞外区的亮氨酸富集的重复序列(LRR)存在着较强的互作,所以鞭毛蛋白可能协助菌体完成对宿主的致病性定植。鞭毛蛋白之间具有典型的协同作用,包括协同维持鞭毛丝的结构形态和运动特性。一种鞭毛蛋白的缺失会促使其他鞭毛蛋白的表达,从而通过“补充表达”来维持鞭毛结构的完整性[2]。有报道指出,选择性地敲除单个鞭毛蛋白基因并不影响鞭毛的形成和能动性[12-13]。然而亦有报道显示,敲除鞭毛蛋白的一种基因可降低细菌的黏附定植和侵染宿主的能力[14]。Verma等[15]发现,敲除沙门氏菌的鞭毛蛋白可以降低沙门氏菌的能动性,并且减少了沙门氏菌诱导的炎性因子的表达水平,但是却对沙门氏菌的黏附定植能力没有显著的影响。
鞭毛丝可以由单个鞭毛蛋白组成(如大肠杆菌),也可以由多个鞭毛蛋白组成(如农杆菌)。不同的鞭毛蛋白在功能上不可能具有完全相似的特性,而且一般都具有独特的特征。Mohari等[2]发现,农杆菌具有鞭毛蛋白A(FlaA)、鞭毛蛋白B(FlaB)、鞭毛蛋白C(FlaC)和鞭毛蛋白D(FlaD)4种鞭毛蛋白,其中FlaA和FlaB比FlaC和FlaD丰富得多,使用FlaB、FlaC和FlaD的任何1种都可以产生具有运动特性的鞭毛丝,唯独使用FlaA不能构成具有运动特性的鞭毛丝。鞭毛丝的螺旋结构需要一个关键的天冬酰胺残基,该残基存在于FlaA中,而在其他鞭毛蛋白中不存在。然而,在没有FlaA的情况下,FlaB可以自发突变形成螺旋鞭毛,这反映了它们存在结构上的相似性,而且反映了它们在进化过程中所形成的功能上的细微差异。植物病原体农杆菌FlaA至少需要1种其他鞭毛蛋白才能发挥作用,因为FlaA突变体产生非螺旋鞭毛,不能有效地游动[2, 12]。因此,由于鞭毛蛋白成员之间在蛋白结构和免疫特性方面存在着差异,有些细菌的鞭毛蛋白甚至不会诱发宿主的炎症反应,因此敲除1种鞭毛蛋白对细菌运动特性和黏附能力造成的影响亦有差异[16]。
3 鞭毛蛋白的免疫特性鞭毛蛋白是细菌特有的结构性蛋白,也是菌体中最丰富的蛋白之一,其作为致毒因子可促进致病菌的侵袭,所以鞭毛蛋白是宿主免疫监控的一个关键性靶点[17]。TLR5是一种存在于动物细胞表面的天然免疫受体,主要由胞外的LRR、跨膜区和胞内区组成[18]。TLR5可依靠胞外的LRR结构域识别鞭毛蛋白,并激活依赖髓样分化因子88(MyD88)的信号通路,最后诱发核因子-κB(NF-κB)介导的炎症反应(图 2)。在致病菌侵染宿主时,天然免疫受体TLR5极易发现鞭毛蛋白,一旦识别鞭毛蛋白便向免疫系统发出报警信息,继而诱发宿主先天性免疫反应,协助宿主及时有效地清除病原体[18]。Tran等[19]给小鼠注射鞭毛蛋白,可增加抗鞭毛蛋白免疫球蛋白A(IgA)的含量,防止肠道微生物区系的破坏,并且可以避免白细胞介素-10(IL-10)缺乏性结肠炎。
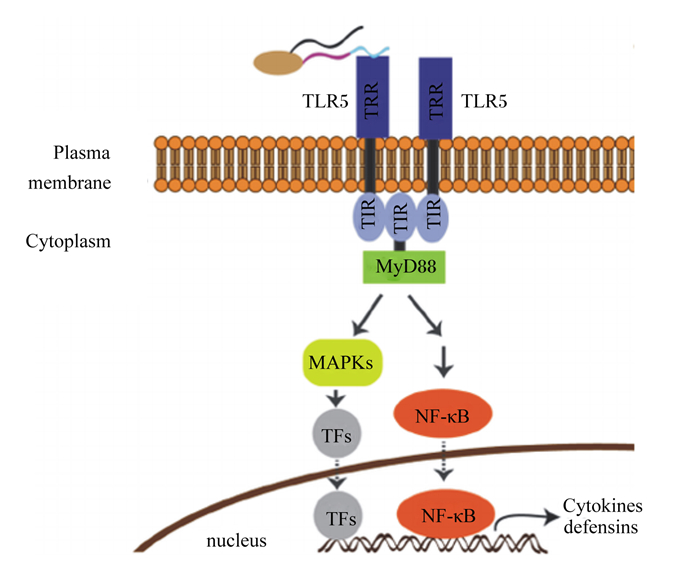
|
Plasma membrane:细胞膜;Cytoplasm:细胞质;MAPKs:丝裂原活化蛋白激酶mitogen-activated protein kinase;TFs:转录因子tranion factors;TLR5:Toll样受体5 Toll-like receptor 5;LRR:亮氨酸富集的重复序列leucine rich repeats;TIR:Toll/IL-1受体同源区Toll/IL-1 receptor homologous region;MyD88:髓样分化因子88 myeloid differentiation primary response 88;NF-κB:核转录因子-κB nuclear factor kappa-B;Nucleus:细胞核;Cytokines defensins:细胞因子防御素。 图 2 鞭毛蛋白诱导的TLR5信号传导通路 Fig. 2 TLR5 signaling pathway induced by flagellin[22] |
然而并非所有的鞭毛蛋白都能激活TLR5受体通路,有报道指出某些致病菌为了便于侵入宿主细胞,其鞭毛蛋白已经进化成了一种独特的可逃避机体免疫监测的蛋白分子,从而避免了被宿主免疫系统发现和清除,如空肠弯曲菌、幽门螺杆菌和类鼻疽伯克氏菌等[20-21]。
虽然鞭毛蛋白是TLR5的特异性配体,但是不同细菌的鞭毛蛋白或某一细菌的不同鞭毛蛋白与TLR5的互作特性均存在着差异。经研究证实,“TLR5-鞭毛蛋白”的互作特性存在物种的特异性。Forstneri c ˇ等[17]指出虽然小鼠与人的TLR5的功能结构区域的序列相似,但是在同一鞭毛蛋白的刺激下,小鼠TLR5呈现出更强的免疫活性。Tahoun等[23]通过分析不同鞭毛蛋白刺激下牛和人TLR5介导的炎症反应发现,“TLR5和鞭毛蛋白”的相互作用具有明显的物种特异性。González-Stegmaier等[24-25]亦指出,鱼类细胞的TLR5与鞭毛蛋白的互作存在着物种的特异性。
4 鞭毛蛋白与肠道健康的关系肠道是动物最大的免疫器官,并且每天不停地消化、吸收食物,以提供足够的养分,是动物的“营养加工中心”。然而维持肠道健康最重要的是保持肠道内菌群的平衡和稳定,只有这样肠道菌群才能协同肠道器官发挥正常的生理功能,包括营养、免疫和消化等。经证实,细菌鞭毛蛋白的靶向免疫可以改善肠道菌群的组成和功能,从而促进动物对营养物质的消化代谢。TLR5可以促使动物宿主与肠道菌群之间的健康共生。TLR5可以通过识别鞭毛蛋白从而抑制致病菌的早期定植,并且接纳益生菌的入住。罗佳等[26]指出,动物的TLR5可以区分益生菌和致病菌的鞭毛蛋白,从而可以通过识别鞭毛蛋白而引发对致病菌的免疫反应和对益生菌的免疫耐受,从而达到驱除致病菌和接纳益生菌的目的。肠道营养可以加强肠道的免疫屏障作用,保持TLR5的活性,进而维持肠道菌群的平衡。此外,对细菌所需的特定营养元素进行调节必然对鞭毛蛋白的表达水平和活性产生影响,所以可以利用肠道营养对鞭毛蛋白的表达进行人为调控,从而对益生菌或是致病菌的黏附定植进行管控,这可能成为未来营养与免疫学研究的新方向。
TLR5的缺失会引发肠道代谢紊乱,并且可严重影响对饲粮的消化利用率。卢军锋[27]发现,投喂益生菌发酵饲粮可以显著提高育肥猪肠道TLR5的表达水平。TLR5的缺失则会引发肠道菌群紊乱,并且导致肠道代谢异常,比如体重增加、肝脏中脂肪变化等[4, 28-29]。Chassaing等[4]发现,TLR5缺失型小鼠的肠道菌群结构失衡,并极易发生严重的代谢综合征。TLR5不仅会影响动物对营养物质的消化代谢,同时也作用于动物生长等有关的经济性状[30]。缺失TLR5导致的先天免疫系统缺陷可引发肠道微生物诱导的信号通路传导受阻,进而影响胰岛素受体的信号通路,使得食物摄取增加,并最终导致代谢紊乱[28]。鞭毛蛋白是TLR5的唯一特异性配体,所以“鞭毛蛋白与TLR5”的互作必然在肠道微生物的黏附定植、营养代谢和免疫调控过程中担当着重要的角色。
5 黏膜表皮细胞的免疫特征在所有的宿主细胞之中,黏膜细胞最容易发生鞭毛蛋白介导的免疫反应[31]。因为黏膜表面是第1层接触鞭毛蛋白的细胞,所以黏膜细胞具有快速识别鞭毛蛋白并有效发送危险信号的功能特征[32]。经证实,黏膜细胞的TLR5识别鞭毛蛋白的特性非常典型和普遍,这与微生物与宿主的协同进化密切相关[15]。肠道、呼吸道和泌尿生殖道的黏膜表层细胞对于鞭毛蛋白诱导的TLR5免疫反应高度灵敏,能够快速地传导鞭毛蛋白的入侵信号[33]。
鞭毛蛋白诱导黏膜细胞释放的趋化因子,包括趋化因子C-X-C基序配体(CXCL)1、CXCL2、CXCL5、CXCL8、CXCL10以及趋化因子C-C基序配体(CCL)2和CCL20,这些趋化因子吸引属于髓系和淋巴系的免疫细胞[34]。这个过程对于募集参与免疫反应的细胞至关重要,可以形成对抗细菌入侵的免疫屏障(图 2)。TLR5介导的信号传导可以诱发产生大量的细胞因子,并进一步诱导细胞的募集和激活[18]。鞭毛蛋白还能刺激黏膜细胞产生各种抗菌肽,包括黏膜腔中的黏蛋白和β-防御素,这都有助于宿主的免疫防御。此外,黏膜层TLR5介导的信号传导也可通过调节黏膜固有层的抗原转运和DC激活而增强宿主的免疫屏障。鞭毛蛋白在黏膜表层的免疫途径包括辅助性T细胞1(Th1)和辅助性T细胞2(Th2)型免疫反应以及免疫球蛋白G(IgG)和IgA的产生[35]。在黏膜细胞分泌的一种增殖诱导配体(APRIL)是由鞭毛蛋白调节产生的,其可以调控肠道B细胞IgA的转化[36]。
6 鞭毛蛋白药物的研发由于鞭毛蛋白是宿主免疫系统第1道防线(膜蛋白受体TLR5)重点监视的对象,所以鞭毛蛋白被广泛的用于疫苗研发,经研究证实其作为疫苗佐剂可以显著增强疫苗的免疫原性。由于鞭毛蛋白极其容易通过DNA重组技术与一种蛋白抗原融合,所以制备鞭毛蛋白融合蛋白疫苗的流程简单、操作方便,目前已经成为应用较多的一类疫苗。现已证实,鞭毛蛋白与抗原蛋白融合制备的疫苗可以预防多种传染病,包括口蹄疫、霍乱、流感、疟疾、鼠疫和肺结核,并能够协助治疗多种癌症[37-40]。
虽然鞭毛蛋白和抗原制备的融合蛋白疫苗在预防传染病方面应用广泛,但是有一个潜在的隐患却被忽视,那就是将这2个蛋白融合过程中可能会引发分子间的空间位阻从而导致疫苗的稳定性下降,甚至丧失活力。众所周知,鞭毛蛋白-抗原融合蛋白疫苗作用的发起点是鞭毛蛋白与TLR5定向结合,即在免疫反应的上游快速激活TLR5免疫通路。有报道提出,虽然鞭毛蛋白已被广泛用于疫苗的制备,但是“鞭毛蛋白-TLR5”间的免疫效应在融合蛋白疫苗强化机体免疫力的过程中是否发挥了应有的作用仍然值得商榷[17]。复合药物可能会因未充分考虑蛋白分子的结构完整性、空间构象和折叠特性而造成了药效的不稳定性。Song等[6]指出,新型的抗辐射药物-CBLB502因将沙门氏菌鞭毛蛋白的D2结构域的部分序列和16个人工合成的氨基酸插入D1结构域中,因忽略了鞭毛蛋白的功能氨基酸残基和结构域的完整性从而造成了药物的不稳定性。
鞭毛蛋白与TLR5互作的关键性氨基酸残基的信息缺乏,将极大地限制疫苗的蛋白质工程技术的发展。将抗原直接插入或连入鞭毛蛋白过程中,如何精确定位和避开鞭毛蛋白的关键性氨基酸残基和功能结构域是确保疫苗效价的关键。在水产养殖领域,鳗弧菌和溶藻弧菌等鞭毛蛋白疫苗相继问世[41],这将为鱼类高质量疫苗的研发和应用增添新动能,然而这些鞭毛蛋白融合疫苗的制备流程和技术方法却没有涉及鞭毛蛋白的蛋白构象和功能结构,因此无法保证融合蛋白疫苗佐剂的生化特性和结构的稳定性。所以在将鞭毛蛋白用于制备疫苗之前,需要结合生物学和结构学,运用分子动力学模拟技术和基因定点技术寻找鞭毛蛋白的关键氨基酸残基和功能结构域。
7 小结“细菌鞭毛蛋白与TLR5的互作特性”得到了国内外学者的普遍关注,然而当前的研究大多聚焦在免疫学领域。大量研究已经证实,TLR5的缺失可导致代谢综合征的发生,并影响动物的生长发育。首先,动物宿主会通过TLR5识别鞭毛蛋白,从而优化菌群结构,促进营养物质的消化吸收,并改善动物的生长性能,因此以现代免疫学和营养学的理论和应用研究为基础进一步解析鞭毛蛋白与TLR5的功能特性,将有助于深化对“鞭毛蛋白与TLR5”互作特征的认识;其次,当前有关鞭毛蛋白的功能结构的研究较少,这必然无法从结构信息学的角度深层次的探索鞭毛蛋白的作用机制。虽然鞭毛蛋白融合蛋白疫苗已经在医药领域占据一席之地,然而这类疫苗在设计过程中却未充分考虑鞭毛蛋白功能结构域的完整性,从而可能导致疫苗的不稳定性,甚至降低药效,所以对鞭毛蛋白的结构信息及其与TLR5的互作模式和结合特征进行全面、系统的解析,可为改进鞭毛蛋白融合蛋白疫苗的设计策略和技术水平提供基础数据。
| [1] |
张维佳, 李颖, WU L F. 细菌鞭毛推进器复杂的蛋白组成和精致的空间结构[J]. 科学通报, 2014, 59(20): 1912-1918. |
| [2] |
MOHARI B, THOMPSON M A, TRINIDAD J C, et al. Multiple flagellin proteins have distinct and synergistic roles in Agrobacterium tumefaciens motility[J]. Journal of Bacteriology, 2018, 200(23): e00327-18. DOI:10.1128/JB.00327-18 |
| [3] |
刘明月, 程古月, 王旭, 等. 空肠弯曲杆菌鞭毛的研究进展[J]. 中国畜牧兽医, 2018, 45(9): 2591-2599. |
| [4] |
CHASSAING B, LEY R E, GEWIRTZ A T. Intestinal epithelial cell toll-like receptor 5 regulates the intestinal microbiota to prevent low-grade inflammation and metabolic syndrome in mice[J]. Gastroenterology, 2014, 147(6): 1363-1377. DOI:10.1053/j.gastro.2014.08.033 |
| [5] |
SONG W S, YOON S I. Crystal structure of FliC flagellin from Pseudomonas aeruginosa and its implication in TLR5 binding and formation of the flagellar filament[J]. Biochemical and Biophysical Research Communications, 2014, 444(2): 109-115. DOI:10.1016/j.bbrc.2014.01.008 |
| [6] |
SONG W S, JEON Y J, NAMGUNG B, et al. A conserved TLR5 binding and activation hot spot on flagellin[J]. Scientific Reports, 2017, 7: 40878. DOI:10.1038/srep40878 |
| [7] |
YOON S I, KURNASOV O, NATARAJAN V, et al. Structural basis of TLR5-flagellin recognition and signaling[J]. Science, 2012, 335(6070): 859-864. DOI:10.1126/science.1215584 |
| [8] |
LU J H, SUN P D. The structure of the TLR5-flagellin complex:a new mode of pathogen detection, conserved receptor dimerization for signaling[J]. Science Signaling, 2012, 5(223): pe11. |
| [9] |
IVICAK-KOCJAN K, FORSTNERIC V, PANTER G, et al. Extension and refinement of the recognition motif for Toll-like receptor 5 activation by flagellin[J]. Journal of Leukocyte Biology, 2018, 104(4): 767-776. DOI:10.1002/JLB.3VMA0118-035R |
| [10] |
FORSTNERIČ V, IVIČAK-KOCJAN K, PLAPER T, et al. The role of the C-terminal D0 domain of flagellin in activation of Toll like receptor 5[J]. PLoS Pathogens, 2017, 13(8): e1006574. DOI:10.1371/journal.ppat.1006574 |
| [11] |
FRIEDLANDER R S, VLAMAKIS H, KIM P, et al. Bacterial flagella explore microscale hummocks and hollows to increase adhesion[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(14): 5624-5629. DOI:10.1073/pnas.1219662110 |
| [12] |
IIDA Y, HOBLEY L, LAMBERT C, et al. Roles of multiple flagellins in flagellar formation and flagellar growth post bdelloplast lysis in Bdellovibrio bacteriovorus[J]. Journal of Molecular Biology, 2009, 394(5): 1011-1021. DOI:10.1016/j.jmb.2009.10.003 |
| [13] |
MCGEE K, HÖRSTEDT P, MILTON D L. Identification and characterization of additional flagellin genes from Vibrio anguillarum[J]. Journal of Bacteriology, 1996, 178(17): 5188-5198. DOI:10.1128/JB.178.17.5188-5198.1996 |
| [14] |
DUAN Q D, ZHOU M X, ZHU X F, et al. The flagella of F18ab Escherichia coli is a virulence factor that contributes to infection in a IPEC-J2 cell model in vitro[J]. Veterinary Microbiology, 2012, 160(1/2): 132-140. |
| [15] |
VERMA S, PRESCOTT R A, INGANO L, et al. The YrbE phospholipid transporter of Salmonella enterica serovar Typhi regulates the expression of flagellin and influences motility, adhesion and induction of epithelial inflammatory responses[J]. Gut Microbes, 2019, 12: 1-13. |
| [16] |
ASADISHAD B, HIDALGO G, TUFENKJI N. Pomegranate materials inhibit flagellin gene expression and flagellar-propelled motility of uropathogenic Escherichia coli strain CFT073[J]. FEMS Microbiology Letters, 2012, 334(2): 87-94. DOI:10.1111/j.1574-6968.2012.02622.x |
| [17] |
FORSTNERIČ V, IVIČAK-KOCJAN K, LJUBETIČ A, et al. Distinctive recognition of flagellin by human and mouse toll-like receptor 5[J]. PLoS One, 2016, 11(7): e0158894. DOI:10.1371/journal.pone.0158894 |
| [18] |
HAJAM I A, DAR P A, SHAHNAWAZ I, et al. Bacterial flagellin—a potent immunomodulatory agent[J]. Experimental & Molecular Medicine, 2017, 49(9): e373. |
| [19] |
TRAN H Q, LEY R E, GEWIRTZ A T, et al. Flagellin-elicited adaptive immunity suppresses flagellated microbiota and vaccinates against chronic inflammatory diseases[J]. Nature Communications, 2019, 10: 5650. DOI:10.1038/s41467-019-13538-y |
| [20] |
ANDERSEN-NISSEN E, SMITH K D, STROBE K L, et al. Evasion of Toll-like receptor 5 by flagellated bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(26): 9247-9252. DOI:10.1073/pnas.0502040102 |
| [21] |
DICKEY A K, CHANTRATITA N, TANDHAVANANT S, et al. Flagellin-independent effects of a Toll-like receptor 5 polymorphism in the inflammatory response to Burkholderia pseudomallei[J]. PLoS Neglected Tropical Diseases, 2019, 13(5): e0007354. DOI:10.1371/journal.pntd.0007354 |
| [22] |
HANEY C H. Innate immunity in plants and animals[J]. Biochemist, 2014, 36(5): 1-5. |
| [23] |
TAHOUN A, JENSEN K, CORRIPIO-MIYAR Y, et al. Host species adaptation of TLR5 signalling and flagellin recognition[J]. Scientific Reports, 2017, 7: 17677. DOI:10.1038/s41598-017-17935-5 |
| [24] |
GONZÁLEZ-STEGMAIER R, GUZMÁN F, ALBERICIO F, et al. A synthetic peptide derived from the D1 domain of flagellin induced the expression of proinflammatory cytokines in fish macrophages[J]. Fish & Shellfish Immunology, 2015, 47(1): 239-244. |
| [25] |
GONZÁLEZ-STEGMAIER R, ROMERO A, ESTEPA A, et al. Effects of recombinant flagellin B and its ND1 domain from Vibrio anguillarum on macrophages from gilthead seabream (Sparus aurata L.) and rainbow trout (Oncorhynchus mykiss, W.)[J]. Fish & Shellfish Immunology, 2015, 42(1): 144-152. |
| [26] |
罗佳, 李薇, 段云峰, 等. Toll样受体5和鞭毛蛋白的相互作用影响宿主区分病原菌和益生菌[J]. 微生物学通报, 2014, 41(7): 1368-1375. |
| [27] |
卢军锋.益生菌发酵饲料对育肥猪免疫指标和肠道健康的影响[D].硕士学位论文.杨凌: 西北农林科技大学, 2019.
|
| [28] |
VIJAY-KUMAR M, AITKEN J D, CARVALHO F A, et al. Metabolic syndrome and altered gut microbiota in mice lacking Toll-like receptor 5[J]. Science, 2010, 328(5975): 228-231. DOI:10.1126/science.1179721 |
| [29] |
CARVALHO F A, KOREN O, GOODRICH J K, et al. Transient inability to manage proteobacteria promotes chronic gut inflammation in TLR5-deficient mice[J]. Cell Host & Microbe, 2012, 12(2): 139-152. |
| [30] |
朱学农, 谭玉文, 史宪伟.大河乌猪TLR5基因变异与经济性状的相关性分析[C]//第十一次全国畜禽遗传标记研讨会论文集.青岛: 中国畜牧兽医学会, 2008: 195-201.
|
| [31] |
SHARMA P, LEVY O, DOWLING D J. The TLR5 agonist flagellin modifies phenotypical and enhances functional activation of lung mucosal antigen presenting cells in neonatal mice[J]. bioRxiv, 2019. DOI:10.1101/564054 |
| [32] |
VIJAYAN A, RUMBO M, CARNOY C, et al. Compartmentalized antimicrobial defenses in response to flagellin[J]. Trends in Microbiology, 2018, 26(5): 423-435. DOI:10.1016/j.tim.2017.10.008 |
| [33] |
HORSTMANN J A, ZSCHIESCHANG E, TRUSCHEL T, et al. Flagellin phase-dependent swimming on epithelial cell surfaces contributes to productive Salmonella gut colonisation[J]. Cellular Microbiology, 2017, 19(8): e12739. DOI:10.1111/cmi.12739 |
| [34] |
KIM E H, KIM J H, SAMIVEL R, et al. Intralymphatic treatment of flagellin-ovalbumin mixture reduced allergic inflammation in murine model of allergic rhinitis[J]. Allergy, 2016, 71(5): 629-639. DOI:10.1111/all.12839 |
| [35] |
LI Q N, XU Z X, WU T T, et al. A flagellin-adjuvanted PED subunit vaccine improved protective efficiency against PEDV variant challenge in pigs[J]. Vaccine, 2018, 36(29): 4228-4235. DOI:10.1016/j.vaccine.2018.05.124 |
| [36] |
HE B, XU W F, SANTINI P A, et al. Intestinal bacteria trigger T cell-independent immunoglobulin A2 class switching by inducing epithelial-cell secretion of the cytokine APRIL[J]. Immunity, 2007, 26(6): 812-826. DOI:10.1016/j.immuni.2007.04.014 |
| [37] |
崔保峰.基于鞭毛蛋白载体的口蹄疫表位疫苗研究[D].博士学位论文.北京: 中国农业科学院, 2019.
|
| [38] |
KIM M I, LEE C, PARK J, et al. Crystal structure of Bacillus cereus flagellin and structure-guided fusion-protein designs[J]. Scientific Reports, 2018, 8: 5814. DOI:10.1038/s41598-018-24254-w |
| [39] |
METT V, KOMAROVA E A, GREENE K, et al. Mobilan:a recombinant adenovirus carrying Toll-like receptor 5 self-activating cassette for cancer immunotherapy[J]. Oncogene, 2018, 37(4): 439-449. DOI:10.1038/onc.2017.346 |
| [40] |
HONG M S, LEE P S, HOFFMAN R M B, et al. Antibody recognition of the pandemic H1N1 influenza virus hemagglutinin receptor binding site[J]. Journal of Virology, 2013, 87(22): 12471-12480. DOI:10.1128/JVI.01388-13 |
| [41] |
梁海鹰, 陈永新, 简纪常, 等. 溶藻弧菌鞭毛蛋白flaC基因DNA疫苗对红笛鲷的免疫保护[J]. 水产学报, 2013, 37(1): 125-131. |




