支链氨基酸(BCAA)是动物机体所必需的营养物质,是组成蛋白质的基本单位[1]。它参与各种营养代谢过程,可作为信号分子调控机体糖脂代谢和能量平衡[2],对于人体健康和畜禽生产都具有重要意义。对人类而言,营养过剩会导致脂肪沉积增加、机体糖脂代谢功能紊乱,这大大增加了其他相关并发症的患病风险。例如肥胖可导致胰岛素抵抗进而引发2型糖尿病、血脂异常可导致高血压和动脉粥样硬化等[3],改变BCAA的摄入量对缓解此类病症有一定帮助。对畜禽动物而言,为了保证畜产品质量,适当的沉积脂肪是必要的。通过在饲粮中补充BCAA的方式调控糖脂代谢可以提升动物的生长与生产性能,增加肌间脂肪,改善肉质和畜产品品质[4]。然而畜禽集约化养殖较多关注生产效率和经济效益,常选择高蛋白质、高能饲料满足生产需求。营养密度高的饲粮容易导致机体糖脂代谢稳态失调,脂肪沉积过多影响生产性能,通过减少BCAA的摄入可降低脂肪沉积[5]。因此针对不同情况的生产需求,BCAA的最适摄入量也不尽相同。本文总结了BCAA对动物机体糖脂代谢的影响及其调控机理,为相关研究提供参考。
1 BCAA概述BCAA因其特殊的侧链结构被命名,包括亮氨酸、异亮氨酸和缬氨酸,它们都属于人和畜禽体内不能合成而必须从外源摄入的氨基酸,是维持动物机体生长需要的营养物质。BCAA主要参与蛋白质的合成与分解代谢过程、促进肌肉蛋白的合成、防止肌肉流失[6];BCAA被证明能够激活与线粒体活动增加有关的调节靶点,从而可增强细胞代谢;BCAA又可增强机体免疫功能、促进肠道发育、调节雌性泌乳功能和促进胚胎发育[7-8]。体重趋于稳定的肥胖个体中,BCAA的含量与肝脂肪的储存和胰岛素抵抗密切相关[9],这暗示着BCAA参与调控哺乳动物的糖脂代谢。
2 BCAA对糖脂代谢的调控 2.1 BCAA对糖脂代谢的影响BCAA可调控机体的能量消耗、脂肪沉积、葡萄糖稳态和胰岛素敏感性,单独补充一种BCAA与补充混合BCAA产生的效果不相同,其中亮氨酸调控糖脂代谢的效果尤为明显,相关报道也不完全一致。给断奶仔猪饲喂高亮氨酸饲粮(2.10%亮氨酸)和正常亮氨酸饲粮(1.66%亮氨酸)发现,与正常饲粮相比,高亮氨酸饲粮可改变能量代谢,抑制肌肉的脂肪酸β-氧化,激活糖酵解作用,并能促进骨骼肌的发育[10];在肉鸡卵内注射亮氨酸不仅可以促进雏鸡的胚胎生长、采食量、肌肉发育,还能缓解热应激条件下的肉鸡血浆葡萄糖含量升高和甘油三酯含量降低的现象。通过注射亮氨酸,显著提升了雏鸡血浆甘油三酯和非酯化脂肪酸的含量,帮助提高肝脏脂质代谢,增强耐热性[11];另有报道显示,增加亮氨酸的摄入降低了血清和肝脏中胆固醇和甘油三酯的含量,有助于缓解C57BL/6J小鼠由于饮食不当诱导的肥胖、高血糖症[12-13]。
Woo等[14]给肥胖和糖尿病前期的患者每日额外补充3种混合的BCAA,4周后发现患者的葡萄糖代谢有所改善。而Cummings等[15]的试验发现,额外补充3种BCAA使得C57BL/6J小鼠的体内皮下和肝脏脂肪含量升高,并没有缓解肥胖病症;相反,减少BCAA的含量可降低小鼠体内的脂肪含量,提高葡萄糖和胰岛素耐量,改善肥胖和胰岛素抵抗。
2.2 缺乏BCAA对糖脂代谢的影响与外源补充BCAA对于糖脂代谢会产生不同试验结果相比,饮食中缺乏BCAA的试验模型一般都会改善动物机体的糖脂代谢水平。当体内的亮氨酸缺乏时,全身各个组织和神经系统均会感应亮氨酸含量下降并对其产生应答。给C57BL/6J小鼠饲喂缺乏亮氨酸的饲粮,不仅可以降低空腹血糖、胰岛素含量以及胰岛素抵抗指数[16],还能增加小鼠的日常能量消耗同时降低采食量和体重,尤其使白色脂肪组织(WAT)大幅减少[16-17]。WAT感应到体内亮氨酸缺乏,并在神经系统的帮助下促进脂质和能量代谢,使体脂肪氧化分解增多[18]。而且在小鼠缺乏亮氨酸饮食一段时间后,通过在下丘脑注射补充亮氨酸,可以阻断由于亮氨酸缺乏引起的能量消耗和脂肪损失[18]。同样,当饲粮中缺乏异亮氨酸或缬氨酸时,脂肪组织中生脂基因和脂解基因的表达分别减少和增加,这与饲粮中缺乏亮氨酸的效果类似[19]。因此,对于肥胖相关的糖尿病症来说,短时期内在饮食中剥夺BCAA有助于缓解病症。
2.3 BCAA对畜禽糖脂代谢的影响蛋白质限制是节约蛋白质原料、降低饲料成本和减少畜禽养殖中氮排放的一种常用方法[20]。但是饲喂低蛋白质饲粮的畜禽常常体重和生产性能不达标,也因摄入了更高比例的碳水化合物,沉积背膘增加,影响胴体品质。这可能与低蛋白质饲粮中缺少参与蛋白质合成和糖脂代谢的功能性氨基酸相关[21]。许多试验结果表明,BCAA的补充很大程度上可以补偿由于蛋白质限制引起的损失。在猪的蛋白质限制饲粮中添加组合BCAA可使猪的生长性能和体组成得到改善,体重和体脂肪能增加到与普通饲粮相似的效果[4, 22]。BCAA的补充改变了猪的脂质代谢,提高了脂质摄取和生脂基因的mRNA表达水平,缓解了由于蛋白质限制引起瘦素含量升高的现象[22]。
饲粮中BCAA含量过多也可能会损害细胞代谢和生长。对于集约化饲养的肉鸡来说,高密度的饲养和高能值的饲粮使其在短时期内消耗大量饲粮,胸肌和脂肪迅速增加,体重成倍增长,而过多的脂肪组织会降低鸡肉品质[23]。给雌性肉鸡饲喂不同BCAA含量的饲粮发现,与相对较高含量的BCAA组相比,低BCAA组的生长性能和免疫力无显著差异,但能通过调节肝脏中生脂基因的表达提高脂肪酸β氧化,有效降低了脂肪沉积[5]。
添加BCAA的剂量和比例也是影响调控效果关键因素,合适的剂量与比例能在一定程度上改善动物的代谢功能和生长性能。不同的BCAA比例对脂质代谢和各部位脂肪组织造成的影响不相同。猪饲粮的BCAA比例(亮氨酸:异亮氨酸:缬氨酸)在1 : 0.75 : 0.75~1 : 0.25 : 0.25时,可以降低脂肪酸合成,促进脂解和脂联素分泌,从而减少脂肪积累[24]。因此,针对不同的生产需要可以改变BCAA的含量来调控脂肪的沉积。
3 BCAA调控糖脂代谢的机理 3.1 BCAA稳态影响糖脂代谢BCAA在机体代谢过程中存在着稳态,BCAA的动态平衡主要取决于其在组织中的分解代谢活性。BCAA的氧化分解主要是在肌肉组织,而肝脏是其初级分解产物的重要代谢器官。BCAA分解代谢是由支链氨基酸转氨酶(BCAT)起始的,它由2种异构体BCAT1(存在细胞质中)和BCAT2(存在于线粒体中)组成[25]。BCAT催化的脱氨反应主要发生在线粒体内,产生第1个分解代谢的BCAA产物,即支链α-酮酸(BCKA)[26]。亮氨酸、异亮氨酸和缬氨酸的脱氨基分解代谢物分别为2-酮异己酸、2-酮-3-甲基戊酸和2-酮异戊酸[27]。然后这些产物经过氧化脱羧化(E1α和E1β亚基)、转酰化(E2亚基)和脱氢(E3亚基),生成乙酰乙酸、琥珀酰辅酶A和乙酰辅酶A[25],随即进入三羧酸循环等代谢途径。该反应步骤由支链α-酮酸脱氢酶(BCKDH)复合物催化,BCKDH复合物是BCAA分解代谢的限速酶,也是维持BCAA稳态的关键因素[26]。支链α-酮酸脱氢酶激酶(BCKDK)可对BCKDH磷酸化修饰并抑制其活性,线粒体磷酸酶2C(PP2Cm)可对BCKDH去磷酸化修饰并增强其活性[28-29]。
动物体多种代谢疾病都与BCAA稳态失调有密切关联,因此BCAA及其衍生物可作为多种疾病包括胰岛素抵抗、2型糖尿病、心血管疾病的潜在生物标志物[30]。在肥胖个体中,BCAA的分解代谢基因表达相对下调,导致血浆中BCAA和BCKA积累增多[31]。最近也有研究表明,肥胖和糖尿病的动物和人类中BCKDH的表达降低,这可能导致了BCAA分解代谢缺陷,进而引发胰岛素抵抗和糖尿病的发展[32-33]。Zhou等[34]用BCKDK的抑制剂增强BCKDH的活性,使遗传性肥胖(ob/ob)小鼠的BCAA分解代谢恢复正常,并显著缓解了肥胖和胰岛素抵抗。这些试验证明了肥胖相关的胰岛素抵抗和BCAA分解代谢缺陷紧密相关,并为通过操纵BCAA代谢来治疗糖尿病提供概念性依据。
然而在肥胖的背景下,包括糖脂代谢异常的各种因素都会影响胰岛素敏感性和血糖调节。如今还尚不清楚BCAA分解代谢缺陷如何在不受肥胖影响的情况下直接影响糖脂代谢,因此需用相对健康或较低体重的动物进行试验。让人意外的是,相比于野生型对照组,PP2Cm基因敲除小鼠体重和脂肪组织减少且胰岛素敏感性得到提高[35]。所以BCAA分解代谢缺陷可能对正常动物和肥胖动物的葡萄糖代谢产生不同的甚至相反的影响,但这其中的复杂机制仍不清楚。
3.2 BCAA调控糖脂代谢的信号通路哺乳动物雷帕霉素靶蛋白(mTOR)是PI3K相关激酶(PIKK)家族中1种丝氨酸/苏氨酸激酶,mTOR信号通路是机体调控各种营养代谢途径的基础信号通路,也是人和动物体一些代谢疾病的调节中枢[30]。葡萄糖、胰岛素、生长因子、氨基酸等营养物质均可刺激mTOR信号通路,从而影响机体多种代谢过程。mTOR系统包括mTORCl和mTORC2 2个复合体[36]。mTORCl可以磷酸化真核翻译起始因子4E(eIF4E)结合蛋白1(4EBPl)和核糖体蛋白S6激酶(S6K),进而调控蛋白合成的起始[37-38]。此外,氨基酸可通过脂酰肌醇-4, 5-二磷酸3-激酶(PI3K)激活蛋白激酶B(Akt)信号传导,该途径又激活mTORC2,并调控细胞的生长、发育、增殖[30]。PI3K/Akt/mTOR信号通路是BCAA影响糖脂代谢、蛋白质合成、以及肠道健康的主要途径[30],故此信号途径可以作为BCAA干预改善营养代谢的潜在靶点。
当动物体内循环脂质水平上升、能量过剩时会抑制BCKDH的表达并导致BCAA的分解代谢缺陷,使BCAA和BCKA水平升高[39]。外源BCAA摄入过多也会使BCAA积累,积累的BCAA,尤其是亮氨酸可以直接与其传感受器Sestrin2相互作用,并通过溶酶体表面上的多种蛋白质相互作用来正向调节mTORC1的活性[40-41]。已经有研究表明,mTOR/S6K1信号通路的激活加剧了胰岛素抵抗。mTORC1下游目标S6K1可直接磷酸化胰岛素受体底物1(IRS1)的丝氨酸残基,包括Ser-302/307、Ser-307/312、Ser-632/636和Ser-1097/1101[16]。IRS1丝氨酸磷酸化的增加会降低IRS1的活性,使PI3K/Akt信号传导受到抑制并降低胰岛素敏感性以及糖原合成[42]。BCAA分解代谢缺陷引起胰岛素抵抗的过程如图 1所示。
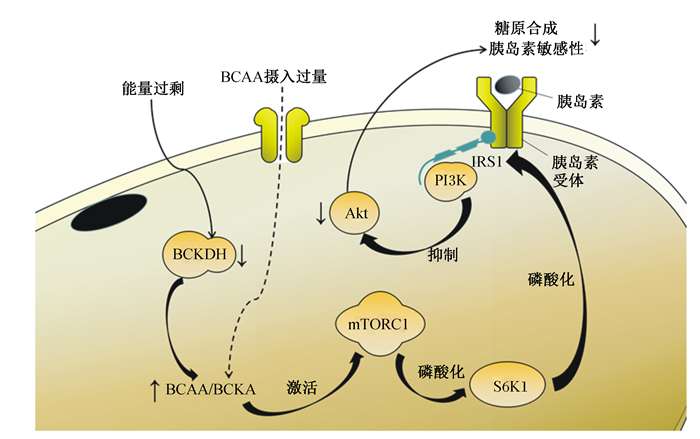
|
BCAA:支链氨基酸branched chain amino acid;BCKDH:支链α-酮酸脱氢酶branched-chain alpha-keto acid dehydrogenase;BCKA:支链α-酮酸branched-chain alpha-keto acids;Akt:蛋白激酶B protein kinase B;mTORC1:哺乳动物雷帕霉素靶蛋白复合物1 mammalian target of rapamycin complex 1;PI3K:脂酰肌醇-4, 5-二磷酸3-激酶phosphatidylinositol-4, 5-bisphosphate 3-kinase;IRS1:胰岛素受体底物1 insulin receptor substrate 1;S6K1:核糖体蛋白S6激酶ribosomal protein S6 kinase。 图 1 BCAA分解代谢缺陷引起胰岛素抵抗 Fig. 1 Insulin resistance caused by BCAA catabolic defects |
相反,动物体内缺乏BCAA可以提升胰岛素敏感性和抑制脂肪组织生成。一方面,BCAA剥夺使一般性调控阻遏蛋白激酶2(GCN2)磷酸化,GCN2是一种可以感应氨基酸缺乏的丝/苏氨酸蛋白激酶,其进一步激活下丘脑真核起始因子2α(eIF2α)的磷酸化,eIF2α信号的激活会减少动物采食量。且有试验发现,缺乏BCAA的饮食使eIF2α的磷酸化显著增加[43]。另一方面,BCAA剥夺不仅抑制了mTOR/S6K1通路也激活了AMP依赖的蛋白激酶信号通路(AMPK)。AMPK是机体调节能量平衡的关键,其激活有助于提高胰岛素敏感性和脂肪组织动员[44]。由于mTOR的下调和AMPK的上调促进了PI3K/Akt信号传导[16],进而诱导转录因子Kruppel样因子15(KLF15)的表达。KLF15是葡萄糖、脂质、胆汁酸以及氨基酸代谢的重要调节因子,KLF15的诱导可抑制脂肪生成和调节肌肉和脂肪组织中胰岛素敏感性葡萄糖转运蛋白4(GLUT4)的转运[25, 45],使动物体各个组织包括肝脏、肌肉、脂肪组织中胰岛素敏感性增强,糖原合成增多。而在高含量BCAA条件下,KLF15的表达受到抑制,也就是说,BCAA可以通过PI3K/Akt对KLF15进行负调控[45]。
3.3 BCAA对脂肪组织的调控脂肪组织不仅能通过对多余能量的储存和脂解来调节机体糖脂代谢水平,还可通过调节脂肪细胞中BCAA的分解代谢酶来调节体内循环BCAA的水平[31]。反之,BCAA的分解代谢对于脂肪生成也产生影响。在脂肪形成过程中BCAA分解代谢酶增加,BCAA分解氧化为合成脂质(如胆固醇、奇链脂肪酸)提供了中间体,且高含量的BCAA会增加脂肪细胞分化过程中的脂质含量[46]。因此,BCAA显著影响并调控脂肪组织的活动。
首先,BCAA能对脂肪酸合成或分解酶进行调节,从而调控脂肪沉积。在小鼠的高脂模型中添加亮氨酸可以抑制脂肪合成并促进脂肪分解[47]。添加亮氨酸显著抑制了脂肪合成相关酶包括脂肪酸合成酶(FAS)、乙酰辅酶A羧化酶(ACC)以及调节脂肪酸合成关键酶基因表达的转录因子——固醇调节元件结合蛋白1(SREBP-1)等的表达,同时促进了脂肪分解相关酶包括激素敏感性脂肪酶(HSL)、甘油三酯脂肪酶(ATGL)的表达,从而改善高脂诱导的肥胖和肝脂肪变性[12, 47]。Ma等[48]发现在小鼠高脂饲粮中添加异亮氨酸与添加亮氨酸效果相似,均能促进脂解基因的表达。
其次,BCAA可提高脂肪细胞线粒体活动和产热,促进白色脂肪棕色化[12, 47]。WAT是机体储存能量的主要器官,而棕色脂肪组织(BAT)是在机体冷刺激下适应性生热的主要器官。最新研究发现,在冷刺激下BAT不仅能增加葡萄糖和脂肪酸的氧化,还能通过棕色脂肪细胞中的转运体SLC25A44把BCAA转运到线粒体中,从而增加体内循环BCAA的消耗,有效防止肥胖和胰岛素抵抗。反之,在肥胖或糖尿病动物中BAT活性受损则会降低循环BCAA的清除率使体内BCAA积累[49]。由于BAT的特殊作用,WAT棕色化已成为众多肥胖疗法的目标[50]。WAT棕色化后的脂肪组织称为米色脂肪,其重要特征是解偶联蛋白(UCP)基因在WAT中的过表达。试验证明,UCP1和UCP3在小鼠脂肪组织中的表达增强可以减少脂肪积累[13, 17]。同时,成纤维细胞生长因子21(FGF21)也已被证明能刺激肥胖小鼠和人WAT棕色化[51-52]。补充亮氨酸的小鼠WAT和BAT中UCP和FGF21的表达显著上调,可增加WAT棕色化和脂肪产热分解[12-13]。
再者,BCAA可以调控沉默信息调节因子2相关酶1(Sirt1)的表达,Sirt1能通过多种方式调节脂代谢基因的表达,并降低脂肪沉积[53]。例如,它能促进过氧化物酶体增殖物激活受体γ辅助激活因子1α(PGC-1α)[54]和抑制过氧化物酶增殖物激活受体γ(PPARγ)[55]的表达。PGC-1α使脂肪细胞线粒体含量和脂肪分泌因子脂联素含量增加,促进脂肪分解[12, 54]。PPARγ是脂肪细胞分化的主要调节剂,其受到抑制能使前体脂肪细胞分化减少,脂肪组织的氧化分解增多[54]。PPARγ的活性也影响着机体BCAA含量以及胰岛素敏感性。Blanchard等[56]发现,WAT和BAT中PPARγ基因的敲除降低了BCAA分解代谢相关酶BCAT2和BCKDH的mRNA表达水平,抑制了BCAA的代谢过程。在肥胖条件下,使用PPARγ激动剂能增强BCAA的氧化并降低循环BCAA的含量,改善肌肉和其他组织的胰岛素敏感性,进而减轻mTORC1介导的抑制性IRS1磷酸化[56]。
4 小结综上所述,BCAA显著影响并调控动物机体的糖脂代谢。动物体糖脂代谢功能与动物BCAA分解代谢相互影响。若机体糖脂代谢功能紊乱(例如肥胖和胰岛素抵抗)则会导致BCAA代谢失调,体内循环BCAA含量升高;若外源BCAA摄入量过多打破了机体原有的BCAA稳态平衡则会引起BCAA分解代谢缺陷,进而影响正常的糖脂代谢功能。在畜禽生产养殖的不同阶段,通过控制外源供给BCAA的用量能达到动物健康生长的生产目标,通过动物体内的循环BCAA含量作为标记物可判断机体代谢情况,从而达到最佳的生产效率。
目前BCAA对动物糖脂代谢调控机制的研究不够深入,仍在进一步探索中。而且得到的试验数据也存在局限性,这可能是由于试验模型不同、摄入营养物质不一致或供给方式、饲喂阶段不同所导致的。到目前为止,在3种BCAA中有关亮氨酸的研究颇多,而有关异亮氨酸、缬氨酸的研究相对较少,且其相关功能还有待于挖掘。深入了解BCAA调控糖脂代谢的机理并将其应用于实际生产中,对于动物的营养调控以及治疗人类的肥胖、糖尿病症有重大意义。
| [1] |
LOFTFIELD R B, HARRIS A. Participation of free amino acids in protein synthesis[J]. Journal of Biological Chemistry, 1956, 219(1): 151-159. |
| [2] |
KIMBALL S R, JEFFERSON L S. Signaling pathways and molecular mechanisms through which branched-chain amino acids mediate translational control of protein synthesis[J]. Journal of Nutrition, 2006, 136(Suppl.1): 227S-231S. |
| [3] |
覃羽乔, 徐永芳, 梁桂民, 等. 超重和肥胖与高血压、糖尿病的关系[J]. 中国公共卫生, 2004, 20(6): 656-657. |
| [4] |
LI Y H, WEI H K, LI F N, et al. Supplementation of branched-chain amino acids in protein-restricted diets modulates the expression levels of amino acid transporters and energy metabolism associated regulators in the adipose tissue of growing pigs[J]. Animal Nutrition, 2016, 2(1): 24-32. |
| [5] |
BAI J, GREENE E, LI W F, et al. Branched-chain amino acids modulate the expression of hepatic fatty acid metabolism-related genes in female broiler chickens[J]. Molecular Nutrition and Food Research, 2015, 59(6): 1171-1181. DOI:10.1002/mnfr.201400918 |
| [6] |
WILKINSON D J, HOSSAIN T, HILL D S, et al. Effects of leucine and its metabolite β-hydroxy-β-methylbutyrate on human skeletal muscle protein metabolism[J]. The Journal of Physiology, 2013, 591(11): 2911-2923. DOI:10.1113/jphysiol.2013.253203 |
| [7] |
HUTSON S M, SWEATT A J, LANOUE K F. Branched-chain amino acid metabolism:implications for establishing safe intakes[J]. Journal of Nutrition, 2005, 135(Suppl.6): 1557S-1564S. |
| [8] |
LEI J, FENG D Y, ZHANG Y L, et al. Regulation of leucine catabolism by metabolic fuels in mammary epithelial cells[J]. Amino Acids, 2012, 43(5): 2179-2189. DOI:10.1007/s00726-012-1302-2 |
| [9] |
HAUFE S, WITT H, ENGELI S, et al. Branched-chain and aromatic amino acids, insulin resistance and liver specific ectopic fat storage in overweight to obese subjects[J]. Nutrition, Metabolism and Cardiovascular Diseases, 2016, 26(7): 637-642. DOI:10.1016/j.numecd.2016.03.013 |
| [10] |
FAN Q W, LONG B S, YAN G K, et al. Dietary leucine supplementation alters energy metabolism and induces slow-to-fast transitions in longissimus dorsi muscle of weanling piglets[J]. British Journal of Nutrition, 2017, 117(9): 1222-1234. DOI:10.1017/S0007114517001209 |
| [11] |
HAN G F, YANG H, BUNGO T, et al. In ovo L-leucine administration stimulates lipid metabolisms in heat-exposed male, but not female, chicks to afford thermotolerance[J]. Journal of Thermal Biology, 2017, 71: 74-82. |
| [12] |
JIAO J, HAN S F, ZHANG W, et al. Chronic leucine supplementation improves lipid metabolism in C57BL/6J mice fed with a high-fat/cholesterol diet[J]. Food & Nutrition Research, 2016, 60(1): 31304. |
| [13] |
ZHANG Y Y, GUO K Y, LEBLANC R E, et al. Increasing dietary leucine intake reduces diet-induced obesity and improves glucose and cholesterol metabolism in mice via multimechanisms[J]. Diabetes, 2007, 56(6): 1647-1654. DOI:10.2337/db07-0123 |
| [14] |
WOO S L, YANG J P, HSU M, et al. Effects of branched-chain amino acids on glucose metabolism in obese, prediabetic men and women:a randomized, crossover study[J]. The American Journal of Clinical Nutrition, 2019, 109(6): 1569-1577. DOI:10.1093/ajcn/nqz024 |
| [15] |
CUMMINGS N E, WILLIAMS E M, KASZA I, et al. Restoration of metabolic health by decreased consumption of branched-chain amino acids[J]. The Journal of Physiology, 2018, 596(4): 623-645. DOI:10.1113/JP275075 |
| [16] |
XIAO F, HUANG Z Y, LI H K, et al. Leucine deprivation increases hepatic insulin sensitivity via GCN2/mTOR/S6K1 and AMPK pathways[J]. Diabetes, 2011, 60(3): 746-756. |
| [17] |
CHENG Y, MENG Q S, WANG C X, et al. Leucine depri-vation decreases fat mass by stimulation of lipolysis in white adipose tissue and upregulation of uncoupling protein 1(UCP 1) in brown pose tissue[J]. Diabetes, 2010, 59(1): 17-25. |
| [18] |
CHENG Y, ZHANG Q, MENG Q S, et al. Leucine deprivation stimulates fat loss via increasing CRH expression in the hypothalamus and activating the sympathetic nervous system[J]. Molecular Endocrinology, 2011, 25(9): 1624-1635. DOI:10.1210/me.2011-0028 |
| [19] |
DU Y, MENG Q S, ZHANG Q, et al. Isoleucine or valine depri-vation stimulates fat loss via increasing energy expenditure and regulating lipid metabolism in WAT[J]. Amino Acids, 2012, 43(2): 725-734. DOI:10.1007/s00726-011-1123-8 |
| [20] |
WANG Y M, ZHOU J Y, WANG G, et al. Advances in low-protein diets for swine[J]. Journal of animal Science and Biotechnology, 2018, 9: 60. DOI:10.1186/s40104-018-0276-7 |
| [21] |
HENG J H, WU Z H, TIAN M, et al. Excessive BCAA regulates fat metabolism partially through the modification of m6A RNA methylation in weanling piglets[J]. Nutrition & Metabolism, 2020, 17(1): 10. |
| [22] |
LI Y H, WEI H K, LI F N, et al. Effects of low-protein diets supplemented with branched-chain amino acid on lipid metabolism in white adipose tissue of piglets[J]. Journal of Agricultural and Food Chemistry, 2017, 65(13): 2839-2848. DOI:10.1021/acs.jafc.7b00488 |
| [23] |
SCHEUERMANN G N, BILGILI S F, HESS J B, et al. Breast muscle development in commercial broiler chickens[J]. Poultry Science, 2003, 82(10): 1648-1658. DOI:10.1093/ps/82.10.1648 |
| [24] |
DUAN Y H, LI F N, GUO Q P, et al. Branched-chain amino acid ratios modulate lipid metabolism in adipose tissues of growing pigs[J]. Journal of Functional Foods, 2018, 40: 614-624. DOI:10.1016/j.jff.2017.12.004 |
| [25] |
BISWAS D, DUFFLEY L, PULINILKUNNIL T. Role of branched-chain amino acid-catabolizing enzymes in intertissue signaling, metabolic remodeling, and energy homeostasis[J]. The FASEB Journal, 2019, 33(8): 8711-8731. DOI:10.1096/fj.201802842RR |
| [26] |
BROSNAN J T, BROSNAN M E. Branched-chain amino acids:enzyme and substrate regulation[J]. Journal of Nutrition, 2006, 136(Suppl.1): 207S-211S. |
| [27] |
SURYAWAN A, HAWES J W, HARRIS R A, et al. A molecular model of human branched-chain amino acid metabolism[J]. The American Journal of Clinical Nutrition, 1998, 68(1): 72-81. DOI:10.1093/ajcn/68.1.72 |
| [28] |
LU G, SUN H P, SHE P X, et al. Protein phosphatase 2Cm is a critical regulator of branched-chain amino acid catabolism in mice and cultured cells[J]. The Journal of Clinical Investigation, 2009, 119(6): 1678-1687. DOI:10.1172/JCI38151 |
| [29] |
LYNCH C J, ADAMS S H. Branched-chain amino acids in metabolic signalling and insulin resistance[J]. Nature Reviews Endocrinology, 2014, 10(12): 723-736. DOI:10.1038/nrendo.2014.171 |
| [30] |
NIE C X, HE T, ZHANG W J, et al. Branched chain amino acids:beyond nutrition metabolism[J]. International Journal of Molecular Sciences, 2018, 19(4): 954. DOI:10.3390/ijms19040954 |
| [31] |
HERMAN M A, SHE P X, PERONI O D, et al. Adipose tissue branched chain amino acid (BCAA) metabolism modulates circulating BCAA levels[J]. Journal of Biological Chemistry, 2010, 285(15): 11348-11356. DOI:10.1074/jbc.M109.075184 |
| [32] |
LACKEY D E, LYNCH C J, OLSON K C, et al. Regulation of adipose branched-chain amino acid catabolism enzyme expression and cross-adipose amino acid flux in human obesity[J]. American Journal of Physiology:Endocrinology and Metabolism, 2013, 304(11): E1175-E1187. DOI:10.1152/ajpendo.00630.2012 |
| [33] |
ESTRADA-ALCALDE I, TENORIO-GUZMAN M R, TOVAR A R, et al. Metabolic fate of branched-chain amino acids during adipogenesis, in adipocytes from obese mice and C2C12 myotubes[J]. Journal of Cellular Biochemistry, 2016, 118(4): 808-818. |
| [34] |
ZHOU M Y, SHAO J, WU C Y, et al. Targeting BCAA catabolism to treat obesity-associated insulin resistance[J]. Diabetes, 2019, 68(9): 1730-1746. DOI:10.2337/db18-0927 |
| [35] |
WANG J, LIU Y X, LIAN K, et al. BCAA catabolic defect alters glucose metabolism in lean mice[J]. Frontiers in Physiology, 2019(10): 1140. |
| [36] |
SARBASSOV D D, GUERTIN D A, ALI S M, et al. Phosphorylation and regulation of Akt/PKB by the rictor-mtor complex[J]. Science, 2005, 307(5712): 1098-1101. DOI:10.1126/science.1106148 |
| [37] |
WANG X M, PROUD C G. The mTOR pathway in the control of protein synthesis[J]. Physiology, 2006, 21(5): 362-369. DOI:10.1152/physiol.00024.2006 |
| [38] |
MIEULET V, ROCERI M, ESPEILLAC C, et al. S6 kinase inactivation impairs growth and translational target phosphorylation in muscle cells maintaining proper regulation of protein turnover[J]. American Journal of Physiology:Cell Physiology, 2007, 293(2): C712-C722. DOI:10.1152/ajpcell.00499.2006 |
| [39] |
GANNON N P, SCHNUCK J K, VAUGHAN R A. BCAA metabolism and insulin sensitivity-dysregulated by metabolic status?[J]. Molecular Nutrition and Food Research, 2018, 62(6): 1700756. DOI:10.1002/mnfr.201700756 |
| [40] |
NEWGARD C. Interplay between lipids and branched-chain amino acids in development of insulin resistance[J]. Cell Metabolism, 2012, 15(5): 606-614. DOI:10.1016/j.cmet.2012.01.024 |
| [41] |
SAXTON R A, KNOCKENHAUER K E, WOLFSON R L, et al. Structural basis for leucine sensing by the Sestrin 2-mTORC1 pathway[J]. Science, 2016, 351(6268): 53-58. DOI:10.1126/science.aad2087 |
| [42] |
LOPICCOLO J, BLUMENTHAL G M, BERNSTEIN W B, et al. Targeting the PI3K/Akt/mTOR pathway:effective combinations and clinical considerations[J]. Drug Resistance Updates, 2008, 11(1/2): 32-50. |
| [43] |
ZHENG L F, WEI H K, CHENG C S, et al. Supplementation of branched-chain amino acids to a reduced-protein diet improves growth performance in piglets:involvement of increased feed intake and direct muscle growth-promoting effect[J]. British Journal of Nutrition, 2016, 115(12): 2236-2245. DOI:10.1017/S0007114516000842 |
| [44] |
HARDIE G D. AMP-activated protein kinase:a key regulator of energy balance with many roles in human disease[J]. Internal Medicine, 2014, 276(6): 543-559. DOI:10.1111/joim.12268 |
| [45] |
LIU Y X, DONG W B, SHAO J, et al. Branched-chain amino acid negatively regulates klf15 expression via PI3K-AKT pathway[J]. Frontiers in Physiology, 2017(8): 853. |
| [46] |
SALINAS-RUBIO D, TOVAR A R, NORIEGA L G. Emerging perspectives on branched-chain amino acid metabolism during adipocyte differentiation[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2018, 21(1): 49-57. DOI:10.1097/MCO.0000000000000429 |
| [47] |
BINDER E, BERM U ' DEZ-SILVA F J, ANDRÉ C, et al. Leucine supplementation protects from insulin resistance by regulating adiposity levels[J]. PLoS One, 2013, 8(9): e74705. DOI:10.1371/journal.pone.0074705 |
| [48] |
MA Q Q, ZHOU X B, HU L L, et al. Leucine and Isoleucine have similar effects on reducing lipid accumulation, improving insulin sensitivity and increasing the browning of WAT in high-fat diet-induced obese mice[J]. Food & Function, 2020, 11(3): 2279-2290. |
| [49] |
YONESHIRO T, WANG Q, TAJIMA K, et al. BCAA catabolism in brown fat controls energy homeostasis through SLC25A44[J]. Nature, 2019, 572(7771): 614-619. DOI:10.1038/s41586-019-1503-x |
| [50] |
KOZAK L P. Brown fat and the myth of diet-induced thermogenesis[J]. Cell Metabolism, 2010, 11(4): 263-267. DOI:10.1016/j.cmet.2010.03.009 |
| [51] |
COSKUN T, BINA H A, SCHNEIDER M A, et al. Fibroblast growth factor 21 corrects obesity in mice[J]. Endocrinology, 2008, 149(12): 6018-6027. DOI:10.1210/en.2008-0816 |
| [52] |
HANSSEN M J W, BROEDERS E, SAMMS R J, et al. Serum FGF21 levels are associated with brown adipose tissue activity in humans[J]. Scientific Reports, 2015, 5: 10275. DOI:10.1038/srep10275 |
| [53] |
马清泉, 王国红, 周昕博, 等. 亮氨酸和异亮氨酸对脂肪沉积的影响及机制[J]. 东北农业大学学报, 2020, 51(1): 50-56, 64. |
| [54] |
SUN X C, ZEMEL M B. Leucine modulation of mitochondrial mass and oxygen consumption in skeletal muscle cells and adipocytes[J]. Nutrition and Metabolism, 2009, 6(1): 26. DOI:10.1186/1743-7075-6-26 |
| [55] |
PICARD F, KURTEV M, CHUNG N, et al. Sirt1 promotes fat mobilization in white adipocytes by repressing PPAR-γ[J]. Nature, 2004, 429(6993): 771-776. DOI:10.1038/nature02583 |
| [56] |
BLANCHARD P G, MOREIRA R J, CASTRO É, et al. PPARγ is a major regulator of branched-chain amino acid blood levels and catabolism in white and brown adipose tissues[J]. Metabolism, 2018, 89: 27-38. DOI:10.1016/j.metabol.2018.09.007 |




