2. 通威股份有限公司, 成都 610041
2. Tongwei Co., Ltd., Chengdu 610041, China
蛋白质是水产动物最主要的营养素,占水产饲料的20%~50%。鱼粉和豆粕作为水产饲料中最主要的蛋白质源,面临来源紧张、价格持续上涨等问题[1-3]。油菜作为我国第2大蛋白质原料资源,因其来源广、营养价值高等优势,已成为最具发展潜力的蛋白质源之一。据报道,自2010年以来我国油菜种植面积达7万km2以上,是5个种植面积超过亿亩(1亩≈666.67 m2)的作物之一[4]。菜籽粕具有较高的营养价值,其粗蛋白质含量为35%~45%,且氨基酸组成较平衡;与其他植物蛋白质相比,菜籽粕中蛋氨酸、精氨酸等多种氨基酸含量相对较高。此外,菜籽粕中还含有较多微量元素、维生素和矿物质;其中,钙、磷、镁含量是豆粕的3倍,硒含量是豆粕的8倍[5]。然而,菜籽粕中也存在多种毒素和抗营养因子,包括硫代葡萄糖甙(GLS)及其降解产物、芥子碱、单宁、植酸等,这些物质的存在限制了菜籽粕在水产饲料中的使用[6]。
菜籽粕中营养物质有效性、抗营养因子及毒素含量都是影响菜籽粕作为蛋白质源的主要因素,而油菜的产地、品种以及加工都会对这些因素产生影响[4]。由于生长环境和起源地的不同,菜籽粕在理化品质上存在着较大差异。中国、印度、加拿大和欧洲是世界四大油菜主产地[7],按照产地的不同,可将菜籽粕分为国产、加拿大、印度、埃塞俄比亚菜籽粕等多种类型,其中前3种菜籽粕在水产饲料中应用较多。经不同榨油方式生产的菜籽粕,在粗蛋白质、粗脂肪、总能等方面也存在较大差异。目前,我国菜籽粕生产工艺主要有3类,分别为低温机榨、螺旋压榨和预压浸提。按照生产工艺的不同,国产菜籽粕可分为95型、200型、冷生榨型、混合型等。由于加工工艺和产地的不同,不同类型菜籽粕中抗营养因子含量存在差异较大。其中,冷生榨菜籽饼(coolant mustard meal,CMM)中硫代葡萄糖苷和芥酸含量较高,印度菜籽粕(India rapeseed meal,IRM)中异硫氰酸酯、唑烷硫酮和芥子碱含量较高,国产95型菜籽粕(Chinese 95-type rapeseed meal,C95RM)、国产200型菜籽粕(Chinese 200-type rapeseed meal,C200RM)和加拿大菜籽粕(Canadian rapeseed meal,CRM)中抗营养因子含量相对较低。目前,菜籽粕在水产饲料中的应用研究较多,研究对象涉及较广,但大多仅考虑单一品种或多品种单一水平比较[8-9],而涉及多种菜籽粕来源不同水平比较的研究相对较少。因此,本试验以草鱼为研究对象,选用5种不同类型菜籽粕(C95RM、C200RM、CMM、CRM和IRM)和2个添加水平(20%、35%)等蛋白质替代豆粕,研究其对草鱼生长、抗氧化能力、非特异性免疫力和肝脏组织形态的影响,评价不同类型菜籽粕对草鱼健康状况的影响,探讨5种菜籽粕作为草鱼饲料蛋白质源的可行性和安全性,为菜籽粕在水产饲料中的使用提供参考。
1 材料与方法 1.1 试验饲料以豆粕为主要蛋白质源,豆油为主要脂肪源,配制草鱼基础饲料;分别采用5种不同类型菜籽粕(C95RM、C200RM、CMM、CRM和IRM,其营养水平及抗营养因子含量见表 1)在2个添加水平(20%和35%)下等蛋白质替代基础饲料中豆粕,配制10种与基础饲料等氮等能的试验饲料。试验饲料组成及营养水平表 2。此外,采用添加晶体氨基酸方式调节试验饲料中蛋氨酸和赖氨酸含量基本一致。
|
|
表 1 不同类型菜籽粕营养水平及抗营养因子含量 Table 1 Nutrient levels and antinutritional factor contents of different types of rapeseed meal |
|
|
表 2 试验饲料组成及营养水平(干物质基础) Table 2 Composition and nutrient levels of experimental diets (DM basis) |
配制饲料前,所有原料经粉碎机(9FZ-300型,河南荥阳农机试验厂生产)粉碎,且全部过60目筛。将所有粉碎好的饲料原料按饲料配方混合均匀,然后再加入豆油和大豆卵磷脂(先溶于豆油中),手工将油脂微小颗粒搓散,最后再加入适宜蒸馏水使粉状饲料形成硬团,于平模饲料颗粒机(SKJ-200,济南牧龙机械有限公司生产)中将饲料挤压成直径1.5 mm的颗粒条状,在40 ℃烘箱中干燥12 h,置-20 ℃冰箱保存备用。
1.2 试验设计及饲养管理选取大小均匀、体格健壮草鱼幼鱼(初始平均体重1.8 g)990尾,随机分为11组,每组3个重复,每个重复30尾。对照组投喂基础饲料,试验组分别投喂20%(C95RM-Ⅰ、C200RM-Ⅰ、CMM-Ⅰ、IRM-Ⅰ、CRM-Ⅰ组)和35%添加水平(C95RM-Ⅱ、C200RM-Ⅱ、CMM-Ⅱ、IRM-Ⅱ、CRM-Ⅱ组)下5种不同类型菜籽粕等蛋白质替代基础饲料中豆粕配制的试验饲料。
试验用草鱼幼鱼为当年人工培育的同一批苗种,由广东省佛山市南海通威水产科技有限公司提供。试验于广东省佛山市南海通威水产科技有限公司池塘中进行。试验前,试验幼鱼在试验网箱中暂养2周适应环境。试验开始前禁食24 h,选择大小均匀、体格健壮草鱼幼鱼,随机分配于33个网箱(11个组,每组3个重复),每个网箱30尾鱼。每天投饵2次(07:00、17:00),达饱食水平。试验共进行8周,期间自然充氧,自然光照,水温保持在24~28 ℃。
1.3 样品收集养殖试验结束后,禁食24 h,称量每个网箱鱼体总重,记录鱼体个数,计算生长性能指标。每网箱随机取6尾鱼作为全鱼样品,分析测定鱼体常规组成;另取6尾鱼用丁香酚(1 : 12 000)麻醉,尾静脉取血,一部分收集于普通离心管中,一部分收集于抗凝离心管中,4 000 r/min下离心10 min,所得血清、血浆样品于-80 ℃下保存备用。随机选取2尾鱼,解剖后将肝脏取出,分为2部分,分别保存在4%甲醛固定液和电镜固定液中,用于组织切片和扫描电镜切片的制作。
1.4 分析方法鱼体和饲料常规成分均参照AOAC(2000)的方法测定。水分含量采用恒温烘箱105 ℃下烘至恒重,粗蛋白质含量采用全自动凯氏定氮仪(JK9830,济南精密科学仪器仪表有限公司)测定,粗脂肪含量采用索氏提取法(以石油醚为溶剂)测定,粗灰分含量采用箱式电阻炉(SX-410,北京市永光明医疗仪器有限公司)550 ℃灼烧法(16 h)测定,总能采用氧弹式能量仪(ZDHW-6,鹤壁市华泰仪器仪表有限公司)测定。
血清或血浆中三碘甲状腺原氨酸(T3)、甲状腺素(T4)和皮质醇含量均采用化学发光法测定;总胆固醇(TC)含量采用氧化酶法测定,甘油三酯(TG)含量采用甘油氧化酶法测定,尿素氮(UN)含量采用脲酶法测定,碱性磷酸酶(AKP)活性采用连续监测法测定,谷草转氨酶(AST)和谷丙转氨酶(ALT)活性采用赖氏法测定,总蛋白(TP)含量采用考马斯亮兰法测定,葡萄糖(GLU)含量采用过氧化物酶法测定,谷胱甘肽还原酶(GR)活性采用紫外比色法测定,超氧化物歧化酶(SOD)活性采用黄嘌呤氧化酶法测定,丙二醛(MDA)含量及过氧化物酶(POD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)活性均采用可见光法测定,溶菌酶(LZM)活性及免疫球蛋白(IgM)、补体3(C3)和补体4(C4)含量均采用免疫比浊法测定,各项指标均采用南京建成生物工程研究所试剂盒,按照使用说明进行操作。
肝脏样本使用4%甲醛固定,经脱水浸蜡、包埋、切片、展片、烤片后,用苏木精-伊红(HE)染色法染色并中性树胶封固,获得肝脏组织切片,通过显微镜拍照;使用戊二醛固定后,经后固定、脱水、干燥、样本导电处理后获得电镜切片,扫描电子显微镜下观察拍照。
1.5 计算公式

|
采用SPSS 17.0软件进行统计分析,采用单因素方差分析(one-way ANOVA),当组间存在显著差异时,用Duncan氏法进行多重比较分析。试验结果均表示为平均值±标准误,P < 0.05表示差异显著。
2 结果 2.1 不同类型菜籽粕对草鱼生长性能的影响由表 3可知,20%菜籽粕添加水平下,IRM-Ⅰ组草鱼FI和FCR显著高于对照组(P < 0.05),但WG、DGC和PER显著低于对照组(P < 0.05);C200RM-Ⅰ和CMM-Ⅰ组草鱼VSI显著低于对照组(P < 0.05);C95RM-Ⅰ、CMM-Ⅰ、IRM-Ⅰ和CRM-Ⅰ组草鱼PPV显著低于对照组(P < 0.05)。35%菜籽粕添加水平下,IRM-Ⅱ和CRM-Ⅱ组草鱼FI显著高于对照组(P < 0.05);CMM-Ⅱ、IRM-Ⅱ和CRM-Ⅱ组草鱼FCR显著高于对照组(P < 0.05),但WG、DGC和PER显著低于对照组(P < 0.05);C95RM-Ⅱ和IRM-Ⅱ组草鱼VSI显著低于对照组,CMM-Ⅱ组草鱼HSI显著低于对照组(P < 0.05);C95RM-Ⅱ、CMM-Ⅱ、IRM-Ⅱ和CRM-Ⅱ组草鱼PPV显著低于对照组(P < 0.05)。随着菜籽粕添加水平的提高,IRM-Ⅱ组草鱼FCR显著高于IRM-Ⅰ组(P < 0.05),但IRM-Ⅱ组草鱼PPV显著低于IRM-Ⅰ组(P < 0.05)。
|
|
表 3 不同类型菜籽粕对草鱼生长性能的影响 Table 3 Effects of different types of rapeseed meal on growth performance of grass carp |
由表 4可知,20%菜籽粕添加水平下,C200RM-Ⅰ组血浆MDA含量显著高于对照组(P < 0.05);CMM-Ⅰ、IRM-Ⅰ和CRM-Ⅰ组血浆CAT活性显著高于对照组(P < 0.05);C95RM-Ⅰ和CRM-Ⅰ组血浆GR活性显著高于对照组(P < 0.05)。35%菜籽粕添加水平下,C200RM-Ⅱ组血浆SOD活性显著高于对照组(P < 0.05);CRM-Ⅱ组血浆GSH-Px活性显著高于对照组(P < 0.05);CMM-Ⅱ、IRM-Ⅱ、CRM-Ⅱ和C200RM-Ⅱ组血浆CAT活性显著高于对照组(P < 0.05)。随着菜籽粕添加水平的提高,C95RM-Ⅰ组血浆GR活性显著低于C95RM-Ⅱ组(P < 0.05),C200RM-Ⅱ组血浆SOD和CAT活性显著高于C200RM-Ⅰ组(P < 0.05)。
|
|
表 4 不同类型菜籽粕对草鱼血浆抗氧化指标的影响 Table 4 Effects of different types of rapeseed meal on plasma antioxidant parameters of grass carp |
由表 5可知,20%菜籽粕添加水平下,C95RM-Ⅰ、CMM-Ⅰ、IRM-Ⅰ和CRM-Ⅰ组血清IgM含量显著低于对照组(P < 0.05);C200RM-Ⅰ、CMM-Ⅰ、IRM-Ⅰ和CRM-Ⅰ组血清C3含量低于对照组(P>0.05);CRM-Ⅰ组血清C4含量显著高于对照组(P < 0.05);C200RM-Ⅰ组血清AKP活性显著高于对照组(P < 0.05)。35%菜籽粕添加水平下,C95RM-Ⅱ、CMM-Ⅱ、IRM-Ⅱ和CRM-Ⅱ组血清IgM含量显著低于对照组(P < 0.05);C200RM-Ⅱ、C95RM-Ⅱ、CMM-Ⅱ、IRM-Ⅱ和CRM-Ⅱ组血清C3含量低于对照组,其中CMM-Ⅱ组和IRM-Ⅱ组显著低于对照组(P < 0.05)。随着菜籽粕添加水平的提高,CMM-Ⅱ组血清C3含量显著低于CMM-Ⅰ组(P < 0.05)。
|
|
表 5 不同类型菜籽粕对草鱼血清非特异性免疫指标的影响 Table 5 Effects of different types of rapeseed meal on serum non-specific immune parameters of grass carp |
由表 6可知,20%菜籽粕添加水平下,C200RM-Ⅰ和CRM-Ⅰ组血清TP含量显著高于对照组(P < 0.05);CRM-Ⅰ和CMM-Ⅰ组血清TG含量显著高于对照组(P < 0.05);C95RM-Ⅰ组血清ALT活性显著高于对照组(P < 0.05);CMM-Ⅰ组血清GLU含量显著低于对照组(P < 0.05);C95RM-Ⅰ和CMM-Ⅰ组血清T3含量显著高于对照组(P < 0.05)。35%菜籽粕添加水平下,C200RM-Ⅱ和CRM-Ⅱ组血清TP含量显著高于对照组(P < 0.05);CRM-Ⅱ和CMM-Ⅱ组血清TG含量显著高于对照组(P < 0.05),CMM-Ⅱ组血清ALT活性显著高于对照组(P < 0.05)。随着菜籽粕添加水平的提高,C95RM-Ⅱ组血清T3含量显著低于C95RM-Ⅰ组(P < 0.05);CMM-Ⅱ和CRM-Ⅱ组血清ALT活性分别显著高于CMM-Ⅰ和CRM-Ⅰ组(P < 0.05),而C95RM-Ⅱ组血清ALT活性显著低于C95RM-Ⅰ组(P < 0.05);C95RM-Ⅱ和CRM-Ⅱ组血清皮质醇含量分别显著低于C95RM-Ⅰ和CRM-Ⅰ组(P < 0.05)。
|
|
表 6 不同类型菜籽粕对草鱼血清生化指标的影响 Table 6 Effects of different types of rapeseed meal on serum biochemical parameters of grass carp |
由表 7可知,20%菜籽粕添加水平下,C95RM-Ⅰ和IRM-Ⅰ组鱼体粗脂肪含量低于对照组,但差异不显著(P>0.05)。35%菜籽粕添加水平下,IRM-Ⅱ组鱼体粗脂肪含量显著低于对照组(P < 0.05)。随着菜籽粕添加水平的提高,CMM-Ⅱ组鱼体粗脂肪含量显著低于CMM-Ⅰ组(P < 0.05)。
|
|
表 7 不同类型菜籽粕对草鱼鱼体组成的影响 Table 7 Effects of different types of rapeseed meal on body composition of grass carp |
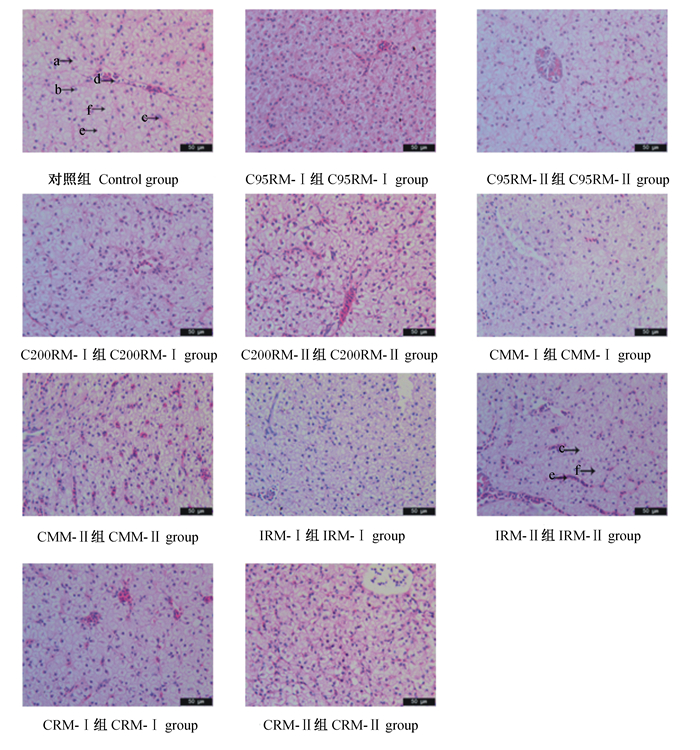
由图 1石蜡切片和图 2扫描电镜结果可知,不同类型菜籽粕替代豆粕均明显影响草鱼肝脏组织结构。对照组肝脏细胞形态正常,肝血窦、小叶间静脉、细胞核等结构清晰,无细胞空泡化和细胞核溶解等现象。20%菜籽粕添加水平下,CMM-Ⅰ和IRM-Ⅰ组草鱼出现少量细胞空泡化、细胞核溶解等现象。35%菜籽粕添加水平下,C95RM-Ⅱ和IRM-Ⅱ组草鱼肝细胞空泡化现象加剧,CMM-Ⅱ和IRM-Ⅱ组草鱼肝细胞出现细胞核偏移、溶解或缺失现象;IRM-Ⅱ组草鱼肝脏肝被膜被破坏,露出大量脂滴和线粒体。
|
a:肝细胞hepatocyte;b:细胞核nucleus;c:肝血窦hepatic sinusoid;d:小叶间静脉interlobular vein;e:细胞空泡化cell vacuolation;f:细胞核偏移nuclear migration。 图 1 不同类型菜籽粕对草鱼肝脏组织结构的影响 Fig. 1 Effects of different types of rapeseed meal on hepatic morphological structure of grass carp (400×) |

|
A:细胞器organelle;B:肝被膜hepatic capsule。 图 2 不同来源菜籽粕对草鱼肝脏组织结构的影响 Fig. 2 Effects of different types of rapeseed meal on hepatic morphological structure of grass carp (1 000×) |
研究表明,菜籽粕添加水平过高会对多种鱼类生长性能产生负面影响。Dossou等[10]研究表明,当菜籽粕添加水平达50%时,红鲷(Pagrus major)生长性能显著下降。Xu等[11]研究表明,当菜籽粕完全替代鱼粉时,鲫鱼(Carassius gibelio)生长性能显著下降。此外,金素雅等[12]研究表明,草鱼基础饲料中IRM、国产菜籽粕和CRM替代比例可高达34.5%。同时,有关虹鳟(Oncorhynchus mykiss)[13]、大西洋鲑(Salmo salar)[14]、杂交罗非鱼(Oreochromis niloticus)[15]的研究皆证实,菜籽粕添加水平过高可导致鱼类生长性能下降。类似地,本试验研究表明:试验组草鱼FI和FCR均呈上升趋势,而WG、DGC、PPV和PER则呈下降趋势。在不影响草鱼生长性能的前提下,C95RM和C200RM添加水平可达35%,CMM和CRM添加水平应控制在20%~35%;IRM添加水平最低,应小于20%。该结果可能与菜籽粕中抗营养因子有关,单宁[16]、芥子碱[17]、硫代葡萄糖苷[13, 18]和植酸[19]均会对鱼体生长性能产生负面影响。当饲料中单宁、芥酸、植酸及硫代葡萄糖苷含量分别高达1.75%[20]、0.64%[21]、2.17%[22]和7 μmol/g[23]时,草鱼生长性能显著下降。本试验中单宁、芥酸、植酸的含量最高仅达1.65 mg/g、0.57%和2.96 mg/g,而硫代葡萄糖苷含量除对照组和CRM组外,均大于7 μmol/g,其中,CMM组饲料硫代葡萄糖苷水平高达2.3%。5种菜籽粕抗营养因子含量显示,CMM和IRM中硫代葡萄糖苷、异硫氰酸酯及唑烷硫酮含量远高于其他3种菜籽粕。本试验中,CMM和IRM组草鱼生长性能较差,可见饲料硫代葡萄糖苷及其水解产物是抑制草鱼生长的关键因素。饲料硫代葡萄糖苷及其水解产物可通过刺激鱼体消化道黏膜而影响饲料利用率[24]。低剂量的单宁[20]和植酸[22]虽不是导致草鱼生长性能下降的主要原因,却能抑制草鱼对营养物质的吸收与利用,从而导致草鱼PPV和PER下降。为弥补饲料利用率低所造成的营养缺失,草鱼采取提高FI的方法来缓解。
脏器指数是一项重要的生理指标,可在一定程度上反映动物自身机能的状况。肝脏是动物机体最重要的代谢器官,也是机体最重要的免疫器官之一。若肝脏相对质量出现下降趋势,则说明机体的代谢能力受到了一定破坏[25]。本试验中,试验组草鱼HSI和VSI均低于对照组,表明菜籽粕中的抗营养因子可通过降低草鱼代谢能力而降低鱼类生长性能。Von Danwitz等[26]研究发现,当饲料中植酸含量达到10.6 g/kg或芥酸含量达到316 mg/kg时,大菱鲆HSI呈显著下降趋势。本研究也证实饲料芥酸含量与草鱼HIS存在着密切关联,当芥酸含量达0.57%时,草鱼HIS呈显著下降趋势。然而,孟玉琼等[27]研究发现,随着双低菜籽粕替代水平的不断上升,大黄鱼HSI和VSI指标未出现下降趋势,该现象可能与菜籽粕种类及其抗营养因子含量有关。孟玉琼等[27]研究中所用菜籽粕是双低菜籽粕,抗营养因子含量相对较低,对大黄鱼肝脏的毒害作用影响不明显。
评价肝脏组织形态是了解肝脏病理情况的一个重要手段,通过肝脏组织学观察发现,当菜籽粕添加水平达到35%时,CMM和IRM组草鱼肝脏均出现细胞空泡化现象,且少量细胞存在细胞核缺失、偏移、溶解等现象;扫描电镜下,IRM组草鱼肝脏肝被膜被破坏,露出大量脂滴和线粒体。该结果与鲤鱼(Leuciscus chuanchicus)[28]和异育银鲫(Carassius auratus gibelio)[29]的研究结果一致,即当菜籽粕水平分别达到69.5%和60.0%时,鲤鱼和异育银鲫肝细胞均出现坏死症状。高水平菜籽粕引起鱼体肝脏病变可能与硫代葡萄糖苷含量的增加有关。硫代葡萄糖甙本身没有毒害,但其水解产物腈化物对鱼体肝脏所带来的毒害作用大于其他物质。于炎湖[30]指出,腈化物可造成细胞窒息,对动物肝脏、肾脏等多个器官产生负作用。腈化物主要蓄积在动物肝脏中,当肝脏中腈含量达到一定程度时,机体无法通过肝脏自身的解毒功能来消除腈所带来的毒害作用,因此毒害作用就会表现出来[31]。
血液生化指标能反映鱼类的生理代谢状态,并与营养状况密切相关[32]。AST、ALT是2种主要转氨酶,可在一定程度上反映肝脏损害状况。当肝脏组织发生病变或损伤时,细胞通透性增高,细胞内转氨酶就大量释放到血清中,促使血清中转氨酶含量大幅度上升[33]。本试验中,C95RM和CMM组草鱼血清ALT活性显著高于对照组,说明抗营养因子对肝脏产生了一定的负面作用。该结果与Bu等[34]、Cheng等[35]结果相似。Mawson等[36]研究表明,肝脏损害可能与菜籽粕中的硫代葡萄糖苷有关。本研究结果证实,饲料硫代葡萄糖苷水平与血清ALT活性之间存在着密切相关,同时发现饲料植酸水平对血清ALT活性也会产生影响。T3和T4是甲状腺激素的2种形式,可对机体的蛋白质、脂肪和糖代谢产生影响。Wang等[37]研究表明,饲料中菜籽粕含量对黄鲶血清T3、T4含量及基因表达水平无影响,该结果与Burel等[13]结果不一致。Burel等[13]研究发现,当饲料中菜籽粕添加水平高达30%时,虹鳟血清T3、T4含量呈下降趋势。Burr等[14]研究发现,大菱鲆血清T4含量呈上升趋势,但对血清T3含量无显著影响。本研究发现,随着菜籽粕添加水平的升高,试验草鱼血清T3含量均呈下降趋势,但对血清T4含量无显著影响。该现象可能与鱼类大小、品种及养殖环境有关。硫氰酸酯和异硫氰酸酯对甲状腺产生毒害作用的机理是硫氰离子与碘离子的竞争作用,通过抑制甲状腺滤泡细胞对碘的聚集能力,导致甲状腺肿大。若水中碘离子含量较高,则毒害作用会被大幅度减弱,因此海水鱼的大菱鲆其毒害作用比淡水鱼的虹鳟、草鱼和黄鲶低。Von Danwitz等[26]研究发现,随着硫代葡萄糖苷含量的增加,血清T3含量有下降趋势。Hossain等[38]观察发现,当鲤鱼饲喂含有不同数量的硫代葡萄糖苷饲料时,甲状腺受到影响。由此说明硫代葡萄糖苷对鱼类的甲状腺功能会产生不利影响。硫代葡萄糖苷本身没有毒,但其代谢所产生的硫氰酸酯和3-唑烷-2-硫酮会对机体产生毒害作用。此外,Qiao等[39]研究表明,当饲料中添加芥子碱或菜籽粕时,鱼的甲状腺激素含量受到影响。由此可知,菜籽粕中芥子碱对鱼类甲状腺功能会产生不利影响。鱼体血清T3含量对抗氧化酶也具有调节作用[40]。当草鱼血清T3含量下降时,其体内抗氧化酶活性也会受到一定的抑制。本研究发现,饲料中添加C95RM、C200RM、IRM和CRM均会使草鱼血浆MAD含量呈上升趋势;随着菜籽粕添加水平的提高,试验组草鱼血浆GR和POD活性呈下降趋势,从而表现出抗氧化功能下降,该结果与Dossou等[41]研究结果类似。此外,也有研究表明,酚类化合物与硫代葡萄糖苷及其水解产物可通过调节Kelch样环氧氯丙烷相关蛋白-1(Keap-1)、核因子E2相关因子2(Nrf2)、抗氧化反应元件(ARE)等多条途径触发氧化应激反应[42]。因此,对照组草鱼血浆多个抗氧化酶活性低于试验组。
鱼类是特异性免疫和非特异性免疫并存的脊椎动物,其中以非特异性免疫为主[43]。本试验结果表明,5种菜籽粕对草鱼血清LZM活性无显著影响,但当菜籽粕添加水平达到35%时,试验组草鱼血清C3含量低于对照组,该结果与金素雅等[12]、Dossou等[41]研究结果基本一致。IgM是机体内最大的免疫球蛋白,存在于血液、淋巴液组织液及其他外分泌液中,在机体特异性免疫中发挥着重要作用。本研究中,菜籽粕替代组草鱼血清IgM含量低于对照组,该结果与Sitjà-Bobadilla等[44]、Kokou等[45]的研究结果一致。由此可知,菜籽粕中抗营养因子可抑制鱼类免疫力,从而降低鱼类生长性能。赵飞[46]研究表明,菜籽粕中抗营养因子,如植酸和单宁限制了微量元素锌和铁的消化和吸收,使鱼体内的抗体含量下降,从而降低了异育银鲫的免疫能力。抗营养因子也可通过抑制鱼体对多种营养物质的吸收,引起免疫器官和免疫细胞的损伤,从而降低鱼体免疫能力。
综上所述,菜籽粕中单宁[47]、芥子碱[48]和植酸等抗营养因子均会对草鱼的生长产生负面影响,但硫代葡萄糖苷及其水解产物的影响最为显著,其对草鱼适口性影响较小,但可破坏肝脏组织形态和生理功能、抑制营养物质的消化吸收、降低机体免疫力等,从而降低草鱼生长性能和饲料利用率。
4 结论① 当菜籽粕添加水平为20%时,IRM可导致草鱼出现氧化应激反应并降低非特异性免疫力,从而抑制其生长性能。因此,IRM在草鱼饲料中的添加水平应小于20%。
② 当菜籽粕添加水平为35%时,IRM、CRM及CMM可导致草鱼出现氧化应激反应并降低非特异性免疫力,破坏肝脏完整性从而导致生长性能下降。因此,CMM和CRM在草鱼饲料中的添加水平应控制在20%~35%。
③ 当菜籽粕添加水平为35%时,C95RM和C200RM对草鱼生长性能无显著影响,可见这2种菜籽粕在草鱼饲料中的添加水平可达35%。
| [1] |
GOMES E F, REMA P, KAUSHIK S J. Replacement of fish meal by plant proteins in the diet of rainbow trout (Oncorhynchus mykiss):digestibility and growth performance[J]. Aquaculture, 1995, 130(2/3): 177-186. |
| [2] |
PANSERAT S, HORTOPAN G A, PLAGNES-JUAN E, et al. Differential gene expression after total replacement of dietary fish meal and fish oil by plant products in rainbow trout (Oncorhynchus mykiss) liver[J]. Aquaculture, 2009, 294(1/2): 123-131. |
| [3] |
刘琦. 豆粕市场:2018年受贸易争端左右2019年或受仍其影响[J]. 今日养猪业, 2019(1): 31-35. |
| [4] |
郝生燕.不同来源菜籽粕养分含量和有效能值的变异度分析及酶制剂的添加效果评估[D].硕士学位论文.兰州: 甘肃农业大学, 2013: 1-20. http://cdmd.cnki.com.cn/article/cdmd-10733-1014012340.htm
|
| [5] |
CAMPBELL L, REMPEL C B, WANASUNDARA J P D. Canola/rapeseed protein:future opportunities and directions-workshop proceedings of IRC 2015[J]. Plants, 2016, 5(2): 17. DOI:10.3390/plants5020017 |
| [6] |
BELL J M. Factors affecting the nutritional value of canola meal:a review[J]. Canadian Journal of Animal Science, 1993, 73(4): 689-697. DOI:10.4141/cjas93-075 |
| [7] |
李波.不同来源菜籽饼粕对生长猪的消化能值及氨基酸回肠消化率的测定[D].硕士学位论文.雅安: 四川农业大学, 2011: 1-72. http://cdmd.cnki.com.cn/Article/CDMD-10626-1011222354.htm
|
| [8] |
LUO Y W, AI Q H, MAI K S, et al. Effects of dietary rapeseed meal on growth performance, digestion and protein metabolism in relation to gene expression of juvenile cobia (Rachycentron canadum)[J]. Aquaculture, 2012, 368-369: 109-116. DOI:10.1016/j.aquaculture.2012.09.013 |
| [9] |
陆有宽, 李国立, 高淑慧. 不同菜粕对鲤鱼生长影响的比较[J]. 河北渔业, 2012(10): 15-16. |
| [10] |
DOSSOU S, KOSHIO S, ISHIKAWA M, et al. Effects of replacing fishmeal with fermented and non-fermented rapeseed meal on the growth, immune and antioxidant responses of red sea bream (Pagrus major)[J]. Aquaculture Nutrition, 2019, 25(2): 508-517. |
| [11] |
XU W J, JIN J Y, HAN D, et al. Physiological and transcriptomic responses to fishmeal-based diet and rapeseed meal-based diet in two strains of gibel carp (Carassius gibelio)[J]. Fish Physiology and Biochemistry, 2019, 45(1): 267-286. |
| [12] |
金素雅, 叶元土, 肖顺应, 等. 不同菜籽饼粕对草鱼生长性能及生理指标的影响[J]. 饲料研究, 2011(5): 5-8. |
| [13] |
BUREL C, BOUJARD T, ESCAFFRE A M, et al. Dietary low-glucosinolate rapeseed meal affects thyroid status and nutrient utilization in rainbow trout (Oncorhynchus mykiss)[J]. British Journal of Nutrition, 2000, 83(6): 653-664. DOI:10.1017/S0007114500000830 |
| [14] |
BURR G S, WOLTERS W R, BARROWS F T. Evaluation of a canola protein concentrate as a replacement for fishmeal and poultry by-product meal in a commercial production diet for Atlantic salmon (Salmo salar)[J]. International Aquatic Research, 2013, 5(1): 5. DOI:10.1186/2008-6970-5-5 |
| [15] |
ZHOU Q C, YUE Y R. Effect of replacing soybean meal with canola meal on growth, feed utilization and haematological indices of juvenile hybrid tilapia, Oreochromis niloticus×Oreochromis aureus[J]. Aquaculture Research, 2010, 41(7): 982-990. |
| [16] |
FRANCIS G, MAKKAR H P S, BECKER K. Antinutritional factors present in plant-derived alternate fish feed ingredients and their effects in fish[J]. Aquaculture, 2001, 199(3/4): 197-227. |
| [17] |
刘文斌, 王爱民, 王恬. 菜籽粕中芥子酸和硫甙对异育银鲫生长和生理机能的影响[J]. 南京农业大学学报, 2004, 27(1): 78-80. |
| [18] |
NAGEL F, VON DANWITZ A, TUSCHE K, et al. Nutritional evaluation of rapeseed protein isolate as fish meal substitute for juvenile turbot (Psetta maxima L.)-Impact on growth performance, body composition, nutrient digestibility and blood physiology[J]. Aquaculture, 2012, 356-357: 357-364. DOI:10.1016/j.aquaculture.2012.04.045 |
| [19] |
RICHARDSON N L, HIGGS D A, BEAMES R M, et al. Influence of dietary calcium, phosphorus, zinc and sodium phytate level on cataract incidence, growth and histopathology in juvenile chinook salmon (Oncorhynchus tshawytscha)[J]. The Journal of Nutrition, 1985, 115(5): 553-567. DOI:10.1093/jn/115.5.553 |
| [20] |
YAO J T, CHEN P, APRAKU A, et al. Hydrolysable tannin supplementation alters digestibility and utilization of dietary protein, lipid, and carbohydrate in grass carp (Ctenopharyngodon idellus)[J]. Frontiers in Nutrition, 2019, 6: 183. DOI:10.3389/fnut.2019.00183 |
| [21] |
GAN L, WU P, FENG L, et al. Erucic acid inhibits growth performance and disrupts intestinal structural integrity of on-growing grass carp (Ctenopharyngodon idella)[J]. Aquaculture, 2019, 513: 734437. DOI:10.1016/j.aquaculture.2019.734437 |
| [22] |
ZHONG J R, FENG L, JIANG W D, et al. Phytic acid disrupted intestinal immune status and suppressed growth performance in on-growing grass carp (Ctenopharyngodon idella)[J]. Fish & Shellfish Immunology, 2019, 92: 536-551. |
| [23] |
TAN Q S, LIU Q, CHEN X X, et al. Growth performance, biochemical indices and hepatopancreatic function of grass carp, Ctenopharyngodon idellus, would be impaired by dietary rapeseed meal[J]. Aquaculture, 2013, 414-415: 119-126. DOI:10.1016/j.aquaculture.2013.07.036 |
| [24] |
程进. 菜籽饼硫代葡萄糖苷降解产物对猪、鸡、鸭甲状腺的影响[J]. 浙江农业大学学报, 1993, 19(2): 209-214. |
| [25] |
宋妍妍, 陈代文, 余冰, 等. 高剂量单宁酸对断奶仔猪血液学参数、脏器指数和组织病理学的影响[J]. 动物营养学报, 2020, 32(4): 1899-1907. |
| [26] |
VON DANWITZ A, SCHULZ C. Effects of dietary rapeseed glucosinolates, sinapic acid and phytic acid on feed intake, growth performance and fish health in turbot (Psetta maxima L.)[J]. Aquaculture, 2020, 516: 734624. DOI:10.1016/j.aquaculture.2019.734624 |
| [27] |
孟玉琼, 苗新, 孙瑞健, 等. 双低菜粕高水平替代饲料鱼粉对大黄鱼潜在风险的评估:生长、健康和营养价值[J]. 水生生物学报, 2017, 41(1): 127-138. |
| [28] |
吴志新, 覃江凤, 陈孝煊, 等. 双低菜籽粕对草鱼和鲤甲状腺、肝、肾组织结构的影响[J]. 华中农业大学学报, 2006, 25(4): 426-430. |
| [29] |
蒋春琴, 冷向军, 李小勤, 等. 饲料中菜粕和棉粕的不同配比对异育银鲫生长性能、血浆生化指标和棉酚残留的影响[J]. 水产学报, 2010, 34(12): 1917-1925. |
| [30] |
于炎湖. 饲料毒物学附毒物分析[M]. 北京: 农业出版社, 1992: 60-70.
|
| [31] |
林一帆, 邵仙萍, 金燕, 等. 复合动植物蛋白质源替代鱼粉对青鱼幼鱼形体指标、组织脂肪酸组成、血清生化指标及肝脏组织形态的影响[J]. 动物营养学报, 2019, 31(2): 732-745. |
| [32] |
DAWOOD M A O, KOSHIO S, ISHIKAWA M, et al. Physiological response, blood chemistry profile and mucus secretion of red sea bream (Pagrus major) fed diets supplemented with Lactobacillus rhamnosus under low salinity stress[J]. Fish Physiology and Biochemistry, 2017, 43(1): 179-192. DOI:10.1007/s10695-016-0277-4 |
| [33] |
NAGAI H, AOKI M, SHIMAZAWA T, et al. Effect of OKY-046 and ONO-3708 on liver injury in mice[J]. The Japanese Journal of Pharmacology, 1989, 51(2): 191-197. |
| [34] |
BU X Y, WANG Y Y, CHEN F Y, et al. An evaluation of replacing fishmeal with rapeseed meal in the diet of pseudobagrus ussuriensis:growth, feed utilization, nonspecific immunity, and growth-related gene expression[J]. Journal of the World Aquaculture Society, 2018, 49(6): 1068-1080. DOI:10.1111/jwas.12470 |
| [35] |
CHENG Z Y, AI Q H, MAI K S, et al. Effects of dietary canola meal on growth performance, digestion and metabolism of Japanese seabass, Lateolabrax japonicus[J]. Aquaculture, 2010, 305(1/2/3/4): 102-108. |
| [36] |
MAWSON R, HEANEY R K, ZDUNCZYK Z, et al. Rapeseed meal-glucosinolates and their antinutritional effects Part 4.Goitrogenicity and internal organs abnormalities in animals[J]. Molecular Nutrition & Food Research, 1994, 38(2): 178-191. |
| [37] |
WANG C L, JIANG L L, QIAN G Y, et al. Supplying rapeseed meal to the diets with or without potassium iodide for yellow catfish (Tachysurus fulvidraco)[J]. Aquaculture International, 2017, 25(6): 2061-2078. DOI:10.1007/s10499-017-0171-9 |
| [38] |
HOSSAIN M A, JAUNCEY K. Toxic effects of glucosinolate (allyl isothiocyanate)(synthetic and from mustard oilcake) on growth and food utilization in common carp[J]. Indian Journal of fisheries, 1988, 35(3): 186-196. |
| [39] |
QIAO H Y, CLASSEN H L. Nutritional and physiological effects of rapeseed meal sinapine in broiler chickens and its metabolism in the digestive tract[J]. Journal of the Science of Food and Agriculture, 2003, 83(14): 1430-1438. DOI:10.1002/jsfa.1559 |
| [40] |
SREEJITH P, OOMMEN O V. Rapid regulatory effect of tri-iodothyronine(T3)on antioxidant enzyme activities in a fish Anabas testudineus (Bloch):short-term in vivo and in vitro study[J]. Indian Journal of Biochemistry & Biophysics, 2007, 43(2): 119-122. |
| [41] |
DOSSOU S, KOSHIO S, ISHIKAWA M, et al. Effect of partial replacement of fish meal by fermented rapeseed meal on growth, immune response and oxidative condition of red sea bream juvenile, Pagrus major[J]. Aquaculture, 2018, 490: 228-235. DOI:10.1016/j.aquaculture.2018.02.010 |
| [42] |
MOHAMMADI M, IMANI A, FARHANGI M, et al. Replacement of fishmeal with processed canola meal in diets for juvenile Nile tilapia (Oreochromis niloticus): growth performance, mucosal innate immunity, hepatic oxidative status, liver and intestine histology[J]. Aquaculture, 2020, 518: 734824. DOI:10.1016/j.aquaculture.2019.734824 |
| [43] |
ANDERSON D P. Immunostimulants, adjuvants, and vaccine carriers in fish:applications to aquaculture[J]. Annual Review of Fish Diseases, 1992, 2: 281-307. DOI:10.1016/0959-8030(92)90067-8 |
| [44] |
SITJÀ-BOBADILLA A, PEÑA-LLOPIS S, GÓMEZ-REQUENI P, et al. Effect of fish meal replacement by plant protein sources on non-specific defence mechanisms and oxidative stress in gilthead sea bream (Sparus aurata)[J]. Aquaculture, 2005, 249(1/2/3/4): 387-400. |
| [45] |
KOKOU F, RIGOS G, HENRY M, et al. Growth performance, feed utilization and non-specific immune response of gilthead sea bream (Sparus aurata L.) fed graded levels of a bioprocessed soybean meal[J]. Aquaculture, 2012, 364-365: 74-81. DOI:10.1016/j.aquaculture.2012.08.009 |
| [46] |
赵飞.菜籽粕对异育银鲫免疫机能的影响[D].硕士学位论文.武汉: 华中农业大学, 2005: 1-65. http://cdmd.cnki.com.cn/Article/CDMD-10504-2005153499.htm
|
| [47] |
LI J N, LIU J K, TAO S L. Effects of hunger and tannic acid on food intake and foraging behavior in Microtus fortis[J]. Acta Ecologica Sinica, 2007, 27(11): 4478-4484. DOI:10.1016/S1872-2032(08)60004-9 |
| [48] |
CLANDININ D R. Rapeseed oil meal studies:4.Effect of sinapin, the bitter substance in rapeseed oil meal, on the growth of chickens[J]. Poultry Science, 1961, 40(2): 484-487. DOI:10.3382/ps.0400484 |




