2. 河南省食品加工与流通安全控制工程技术研究中心, 郑州 450002
2. Henan Engineering Research Center for Food Processing and Distribution Safety Control, Zhengzhou 450002, China
铅(Pb)是一种具有蓄积毒性的重金属,当与被铅污染的水、空气接触时,铅可经过呼吸、饮食及皮肤黏膜等途径进入人和动物体内[1]。铅暴露可诱导胃肠道、血液、脏器、生殖系统、免疫调节、神经功能紊乱。研究发现大鼠口服0.5 g/L的乙酸铅会诱导因氧化应激和内质网应激造成的心脏损伤[2]。Samarghandian等[3]研究表明醋酸铅通过诱导氧化应激引起呼吸紊乱,对肺脏造成损伤。氧化应激会引起过量的活性氧(ROS)和活性氮(RNS)生成和抗氧化酶活性降低,进而导致人体和动物细胞损伤[4]。核因子E2相关因子2(Nrf2)是一种通过大量的ROS和RNS来响应细胞损伤的氧化应激表达中的关键转录因子,与抗氧化反应元件(ARE)结合,并介导血红素氧合酶-1(HO-1)的表达,共同在细胞氧化损伤方面发挥着重要的抑制作用,可作为机体内拮抗氧化损伤的第1道防线[5-6]。氧化应激可促使内质网应激参与细胞凋亡,这与内质网应激相关蛋白C/EBP同源蛋白(CHOP)、葡萄糖调节蛋白78(GRP78)表达的上调和半胱氨酸蛋白酶-12(Caspase-12)的激活有关[7-8]。GRP78是内质网腔内的Ca2+结合分子伴侣,具有调节高氧相关内质网应激的作用。高氧诱导的GRP78表达上调激活了内质网上介导细胞凋亡的关键信号传导组件CHOP的过表达,促进了高氧时肺上皮细胞的凋亡[9]。氧化应激相关蛋白Nrf2、HO-1和内质网应激相关蛋白GRP78、CHOP之间存在有一定关系。一方面,Nrf2可通过抑制内质网GRP78、CHOP和Caspase-12凋亡通路来抑制内质网应激神经细胞凋亡[10];另一方面,低水平的GRP78可能通过改变E-钙黏蛋白和波形蛋白的表达,激活Nrf2/HO-1信号通路,导致结肠癌细胞转移和侵袭能力增强[11]。铅暴露导致的氧化应激和内质网应激对机体各个器官和组织均造成不同程度的损伤。
一项研究发现维生素C、维生素E、β-胡萝卜素、锌和硒等对铅诱导的脏器及组织的氧化损伤具有保护作用[12],还有研究表明0.4 mg/kg的叶酸对0.2%醋酸铅暴露导致的大脑海马和皮层[13]、肝脏[14]的氧化损伤具有保护作用。叶酸是B族维生素之一,可以作为自由基清除剂增强内源性抗氧化酶活性,起到抗氧化作用[15]。关于叶酸干预脏器和组织氧化损伤的研究较多,但是叶酸对铅诱导的氧化应激和内质网应激引起的肺脏损伤的干预作用尚未见报道。本试验拟通过观察叶酸对铅暴露大鼠体重、肺脏指数以及肺脏中Nrf2、HO-1、CHOP、GRP78蛋白表达水平的影响,探讨叶酸对铅暴露大鼠因氧化应激和内质网应激引起的肺脏损伤的干预作用。
1 材料与方法 1.1 试验材料醋酸铅,北京化工厂;叶酸,英国Abcam公司;鼠单克隆一抗(Nrf2、HO-1、CHOP和GRP78)及二抗[辣根过氧化物酶(HRP)标记羊抗鼠抗体和羊抗兔抗体],美国CST公司。
1.2 动物分组及模型的建立选择32只成年无特定病原体(SPF)级雄性SD大鼠[河南省实验动物中心,合格证号:SYXK(豫)2018-0005],体重200~220 g,按体重一致的原则平均分成4组(n=8),各组进行如下处理:对照组(C组),自由饮水+1 mL去离子水灌胃;染铅组(L组),自由饮0.2%的醋酸铅溶液+1 mL去离子水灌胃;干预组(I组),自由饮0.2%的醋酸铅溶液+1 mL叶酸(剂量为0.4 mg/kg BW)悬浊液灌胃;叶酸组(F组),自由饮水+1 mL叶酸(剂量为0.4 mg/kg BW)悬浊液灌胃。叶酸每2 d配制1次,并避光保存,每天固定时间(15:00—17:00)灌胃1次,连续灌胃14 d。试验大鼠在温度为20~25 ℃,相对湿度为50%~55%,光、暗分别为12 h的清洁标准房间内饲养,所喂饲粮为河南省实验动物中心提供的辐照灭菌颗粒饲料。
1.3 大鼠体重变化的记录试验从开始到结束期间,每天用分析天平称量大鼠体重,测定各组大鼠的体重变化。
1.4 样本采集与脏器指数测定腹腔注射7%水合氯醛(3.5 mL/kg)将大鼠麻醉后处死,解剖后在冰上迅速分离出左肺组织,吸干组织表面水分并称重。将左肺的上半叶组织和下半叶组织分开,以分别测定氧化应激相关蛋白Nrf2和HO-1和内质网应激相关蛋白CHOP和GRP78的表达情况。去其脂肪、筋膜,滤纸除污血,随后立即冷冻于无菌冻存管内,待取样全部结束后,转至-80 ℃冰箱中保存、待用。
肺脏指数计算公式如下:
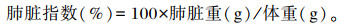
|
将肺脏组织从冰箱中取出,4%甲醛固定24 h,经石蜡包埋切片,二甲苯脱蜡,梯度乙醇脱水。取出左肺上半叶组织切片,用柠檬酸抗原在微波中热修复12 min,冷却后用磷酸盐缓冲液(PBS)洗4次,滴入10%封闭液,常温放置20 min后甩去,加一抗(Nrf2和HO-1,按1 : 200稀释)置4 ℃孵育过夜。同时取出左肺下半叶组织切片,同样经PBS洗4次,抗原热修复12 min,滴入10%封闭液,常温放置20 min后甩去,加一抗(按1 : 800稀释的CHOP和按1 : 1 000稀释的GRP78)置4 ℃孵育过夜。次日,用PBS洗后加入按1 : 1 000稀释后的二抗(HRP标记羊抗鼠和羊抗兔),在37 ℃孵育90 min。再用PBS洗3次,使用显色剂二氨基苯联胺(DAB)显色,并经4′, 6-二脒基-2-苯基吲哚(DAPI)复染细胞核1 min、防猝灭剂封片后,镜检拍照。选择显微镜(200×)下5个不同视野采集图像,用Image pro plus (IPP) 6.0软件进行分析,计算出阳性反应物的平均积分光密度(AIOD)值(AIOD=总AIOD/面积)。
1.6 统计分析数据采用SPSS 16.0软件进行单因素方差分析(one-way ANOVA),P < 0.05表示差异显著。数据用平均值±标准差表示。
2 结果与分析 2.1 各组大鼠体重变化及肺脏指数由表 1可知,与C组相比,L组、I组和F组的初体重、末体重、日增重、净增重和肺脏指数均有所降低,但差异均不显著(P>0.05);与L组相比,I组和F组的初体重和肺脏指数以及F组的末体重均有所升高,I组和F组的日增重、净增重有所降低,但差异均不显著(P>0.05);I组的末体重较L组降低,但差异不显著(P>0.05)。
|
|
表 1 各组大鼠体重变化及肺脏指数 Table 1 Body weight changes and lung index of rats in each group (n=8) |
图 1-A为大鼠肺脏中Nrf2蛋白免疫荧光染色的结果,图中可见阳性反应物中的淡蓝色颗粒是细胞核,红色颗粒是Nrf2蛋白的阳性表达,红色颗粒数量与Nrf2蛋白表达水平成正比,即红色颗粒数量越多,Nrf2蛋白在肺脏中表达的就越多。由图 1-B可知,与C组相比,L组和I组肺脏中阳性反应物的AIOD值升高,F组阳性反应物的AIOD值下降,但差异均无统计学意义(P>0.05);与L组相比较,I组阳性反应物的AIOD值升高,F组阳性反应物的AIOD值下降,但差异均无统计学意义(P>0.05)。
|
图A是各组肺脏中Nrf2蛋白免疫荧光染色的结果,图B是各组肺脏中Nrf2蛋白的表达水平(以阳性反应物的AIOD值表示,n=8)。 *表示与C组相比差异显著(P < 0.05),#表示与L组相比差异显著(P < 0.05)。下图同。 A was the result of immunofluorescence staining of Nrf2 protein in lung of each group, and B was the expression level of Nrf2 protein in lung of each group (expressed as the AIOD value of positive reactant, n=8). * mean significant difference compared with the group C (P < 0.05), and # mean significant difference compared with the group L (P < 0.05). The same as below. 图 1 各组肺脏中Nrf2蛋白的表达水平 Fig. 1 Nrf2 protein expression level in lung of each group |
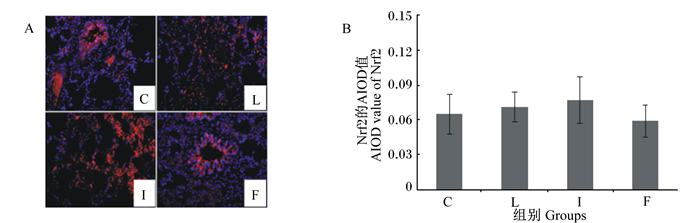
图 2-A为大鼠肺脏中HO-1蛋白免疫荧光染色的结果,图中可见阳性反应物中的淡蓝色颗粒是细胞核,红色颗粒是HO-1蛋白的阳性表达,红色颗粒数量与HO-1蛋白表达水平成正比,即红色颗粒数量越多,HO-1蛋白在肺脏中表达的就越多。由图 2-B可知,与C组相比,L组和I组阳性反应物的AIOD值显著升高(P < 0.05),F组阳性反应物的AIOD值下降,但差异无统计学意义(P>0.05);与L组相比,I组和F组阳性反应物的AIOD值显著下降(P < 0.05)。
|
图A是各组肺脏中HO-1蛋白免疫荧光染色的结果,图B是各组肺脏中HO-1蛋白的表达水平(以阳性反应物的AIOD值表示,n=8)。 A was the result of immunofluorescence staining of HO-1 protein in lung of each group, and B was the expression level of HO-1 protein in lung of each group (expressed as the AIOD value of positive reactant, n=8). 图 2 各组肺脏中HO-1蛋白的表达水平 Fig. 2 HO-1 protein expression level in lung of each group |
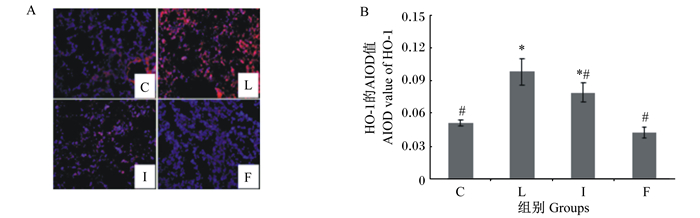
图 3-A为大鼠肺脏中CHOP蛋白免疫荧光染色的结果,图中可见阳性反应物中的淡蓝色颗粒是细胞核,红色颗粒是CHOP蛋白的阳性表达,红色颗粒数量与CHOP蛋白表达水平成正比,即红色颗粒数量越多,CHOP蛋白在肺脏中表达的就越多。由图 3-B可知,与C组相比,L组、I组和F组阳性反应物的AIOD值显著升高(P < 0.05);与L组相比,I组和F组阳性反应物的AIOD值显著下降(P < 0.05)。
|
图A是各组肺脏中CHOP蛋白免疫荧光染色的结果,图B是各组肺脏中CHOP蛋白的表达水平(以阳性反应物的AIOD值表示,n=8)。 A was the result of immunofluorescence staining of CHOP protein in lung of each group, and B was the expression level of CHOP protein in lung of each group (expressed as the AIOD value of positive reactant, n=8). 图 3 各组肺脏中CHOP蛋白的表达水平 Fig. 3 CHOP protein expression level in lung of each group |
图 4-A为大鼠肺脏中GRP78蛋白免疫荧光染色的结果,图中可见阳性反应物中的淡蓝色颗粒是细胞核,红色颗粒是GRP78蛋白的阳性表达,红色颗粒数量与GRP78蛋白表达水平成正比,即红色颗粒数量越多,GRP78蛋白在肺脏中表达的就越多。由图 4-B可知,与C组相比,L组、I组和F组阳性反应物的AIOD值显著升高(P < 0.05);与L组相比,I组和F组阳性反应物的AIOD值下降,但差异无统计学意义(P>0.05)。
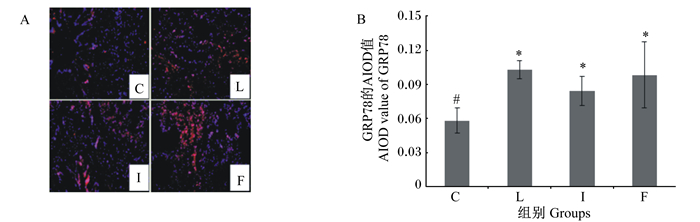
|
图A是各组肺脏中GRP78蛋白免疫荧光染色的结果,图B是各组肺脏中GRP78蛋白的表达水平(以阳性反应物的AIOD值表示,n=8)。 A was the result of immunofluorescence staining of GRP78 protein in lung of each group, and B was the expression level of GRP78 protein in lung of each group (expressed as the AIOD value of positive reactant, n=8). 图 4 各组肺脏中GRP78蛋白的表达水平 Fig. 4 GRP78 protein expression level in lung of each group |
本试验结果显示,在叶酸干预铅暴露的大鼠过程中,各组大鼠的体重变化和肺脏指数差异不显著。许多动物试验表明,铅中毒可显著影响机体的生长发育,导致体增重下降[16-18]。铅对生长发育的抑制机制尚不清楚,可能原因是铅暴露造成体内超氧化物歧化酶、谷胱甘肽过氧化物酶等一些抗氧化酶的活性降低,致使机体产生氧化损伤[19]。一项研究结果显示,0.75 mg/kg叶酸致使动物的体重减少,1.50和3.00 mg/kg的叶酸使动物体重显著增加,叶酸剂量为3.00 mg/kg时体重达到最佳,表明体重增加和叶酸剂量呈剂量依赖性[20]。杨霄鹏等[21]的研究发现,铅暴露不同时间后,各组大鼠尤其是高铅组大鼠的各个脏器都有不同程度的损伤,损伤的程度由重到轻顺序为肾脏>心脏>肝脏>肺脏,肺脏的损伤最轻,但在高铅环境下暴露180 d时,个别动物出现肺泡间隔增宽,肺脏充血、水肿。这说明铅致脏器损害程度与铅染毒剂量和暴露时间长短密切相关。研究表明叶酸对大鼠肺脏损伤有一定的保护作用, 且此作用在一定范围内随叶酸剂量的增加而增强[22-23]。
叶酸作为动物机体必需的一种维生素,对动物的生长发育有很重要的生理作用。在动物饲粮中补充适量的叶酸可改善大鼠的生长性能,但适宜的添加量需要进一步做试验来确定。
3.2 叶酸对大鼠肺脏中氧化应激相关蛋白表达的影响研究表明铅对人体和动物的多种器官和组织造成毒性作用,尤其是对呼吸系统的危害极大,导致肺部出现炎症和病变[3, 24]。Nirmallya等[19]的研究表明其主要机制是铅暴露诱导的ROS、RNS等自由基大量堆积引起了机体内氧化还原状态的不平衡,当人体和动物的肺脏组织长期处在铅暴露下,谷胱甘肽含量和一些重要的抗氧化酶如超氧化物歧化酶活性降低甚至失活,丙二醛和一氧化氮含量升高,加快细胞膜中的脂质过氧化过程,这和Dumková等[25]的研究结果相一致。这种变化促使转录因子Nrf2蛋白表达上调,从而激活HO-1蛋白的表达,这些都构成了体内氧化应激中的第1道抗氧化屏障[26]。
大量研究表明,0.4 mg/(kg·d)的叶酸对0.1%~0.2%醋酸铅导致的脏器和中枢神经氧化损伤起到了一定的保护作用[13-14, 27-28]。Gomaa等[29]研究了2 mg/(kg·d)叶酸对由10 mg/(kg·d)醋酸铅导致的大鼠睾丸功能障碍的保护作用,结果表明叶酸可减轻氧化应激和炎症反应,保护了大鼠的睾丸功能。本研究结果显示,与C组相比,L组肺脏中氧化应激相关蛋白Nrf2、HO-1的表达水平升高,进一步证实了Nrf2作为氧化应激的传感器,在细胞受到铅诱导的氧化应激时,能够迅速启动防御功能,激活抗氧化基因HO-1的高水平表达,发挥其抗氧化的作用[26]。但在叶酸干预后,与L组相比,I组肺脏中HO-1蛋白的表达水平显著降低,而Nrf2蛋白的表达水平虽有增加却无显著差异,这可能与叶酸的剂量高低和观察时间的长短有关,低剂量的叶酸在短时间内未观察到其对Nrf2蛋白造成影响。
3.3 叶酸对大鼠肺脏中内质网应激相关蛋白表达的影响内质网是机体内一种重要的多功能细胞器,氧化应激可导致内质网中未折叠和错折叠的蛋白质过度积累,即内质网应激,GRP78是内质网中的应激传感器,CHOP是内质网应激诱导的细胞凋亡的关键介质。在长时间的内质网应激中,GRP78促使正常条件下低水平表达的CHOP高水平表达,诱导细胞凋亡[8]。
本研究结果显示,与C组相比,L组的内质网应激相关蛋白CHOP、GRP78的表达水平均显著升高。这充分说明了当受到内质网应激时,GRP78蛋白的表达大量上调,诱导CHOP蛋白的高水平表达,修复细胞损伤,维持机体健康状态[30]。但叶酸干预后,I组肺脏中GRP78、CHOP蛋白的表达水平较L组降低,提示叶酸可能通过下调GRP78蛋白的表达及减少CHOP的激活,来减轻铅暴露引起的内质网应激,抑制肺脏细胞凋亡。F组肺脏中GRP78蛋白的表达水平与L组相比无显著变化,这可能是因为有其他诱导GRP78蛋白表达的一些因素,如葡萄糖缺乏、糖基化拮抗剂、实体肿瘤微环境变化及病理状态均可以促使GRP78蛋白表达上调[31]。Lu等[32]的研究结果表明,2 mg/(kg·d)叶酸降低了同型半胱氨酸高血压大鼠血管平滑肌细胞GRP78和CHOP蛋白的表达,减轻内质网应激和血管损伤。Wang等[33]研究发现350 mg/L醋酸铅诱导的内质网应激引起肾脏细胞凋亡,上调了GRP78蛋白的表达,这与本研究结果一致。
4 结论铅暴露引起的大鼠氧化应激、内质网应激分别与Nrf2/HO-1、GRP78/CHOP通路密切相关,给0.2%醋酸铅染毒大鼠每日灌胃0.4 mg/kg BW的叶酸可显著降低肝脏中HO-1、CHOP的表达水平,表明叶酸对铅暴露引起的氧化应激和内质网应激而造成的大鼠肺脏损伤具有一定的拮抗作用。
| [1] |
LI H W, LAN T J, YUN C X, et al. Mangiferin exerts neuroprotective activity against lead-induced toxicity and oxidative stress via Nrf2 pathway[J]. Chinese Herbal Medicines, 2019, 12(1): 36-46. |
| [2] |
YANG D Q, LI S Y, GAO L, et al. Dietary grape seed procyanidin extract protects against lead-induced heart injury in rats involving endoplasmic reticulum stress inhibition and AKT activation[J]. The Journal of Nutritional Biochemistry, 2018, 62: 43-49. DOI:10.1016/j.jnutbio.2018.07.013 |
| [3] |
SAMARGHANDIAN S, BORJI A, AFSHARI R, et al. The effect of lead acetate on oxidative stress and antioxidant status in rat bronchoalveolar lavage fluid and lung tissue[J]. Toxicology Mechanisms and Methods, 2013, 23(6): 432-436. DOI:10.3109/15376516.2013.777136 |
| [4] |
HASSAN E, KAHILO K, KAMAL T, et al. Protective effect of diallyl sulfide against lead-mediated oxidative damage, apoptosis and down-regulation of CYP19 gene expression in rat testes[J]. Life Sciences, 2019, 226: 193-201. DOI:10.1016/j.lfs.2019.04.020 |
| [5] |
ZHANG L, QIN Z Q, LI R, et al. The role of ANXA5 in DBP-induced oxidative stress through ERK/Nrf2 pathway[J]. Environmental Toxicology and Pharmacology, 2019, 72: 103236. DOI:10.1016/j.etap.2019.103236 |
| [6] |
TAIRA J, OGI T. Induction of antioxidant protein HO-1 through Nrf2-ARE signaling due to pteryxin in Peucedanum japonicum Thunb in RAW264.7 macrophage cells[J]. Antioxidants, 2019, 8(12): 621. DOI:10.3390/antiox8120621 |
| [7] |
HOU S, WANG L L, ZHANG G P. Mitofusin-2 regulates inflammation-mediated mouse neuroblastoma N2a cells dysfunction and endoplasmic reticulum stress via the Yap-Hippo pathway[J]. The Journal of Physiological Sciences, 2019, 69(5): 697-709. DOI:10.1007/s12576-019-00685-6 |
| [8] |
HUANG H, AN Y, JIAO W Y, et al. CHOP/caspase-3 signal pathway involves in mitigative effect of selenium on lead-induced apoptosis via endoplasmic reticulum pathway in chicken testes[J]. Environmental Science and Pollution Research, 2018, 25(19): 18838-18845. DOI:10.1007/s11356-018-1950-1 |
| [9] |
LU H Y, CHEN X Q, TANG W, et al. GRP78 silencing enhances hyperoxia-induced alveolar epithelial cell apoptosis via CHOP pathway[J]. Molecular Medicine Reports, 2017, 16(2): 1493-1501. DOI:10.3892/mmr.2017.6681 |
| [10] |
赵奇韬.Nrf2对液压冲击脑损伤内质网应激凋亡的调控作用及机制[D].硕士学位论文.石家庄: 河北医科大学, 2019.
|
| [11] |
CHANG Y J, CHEN W Y, HUANG C Y, et al. Glucose-regulated protein 78(GRP78) regulates colon cancer metastasis through EMT biomarkers and the NRF-2/HO-1 pathway[J]. Tumor Biology, 2015, 36(3): 1859-1869. DOI:10.1007/s13277-014-2788-x |
| [12] |
HSU P C, YUELIANG L G. Antioxidant nutrients and lead toxicity[J]. Toxicology, 2002, 180(1): 33-44. DOI:10.1016/S0300-483X(02)00380-3 |
| [13] |
李宁, 张迪, 乔明武, 等. 叶酸对急性铅中毒大鼠海马和皮层组织中GSH及Nrf2、HO-1表达的影响[J]. 中国兽医学报, 2019, 39(11): 2238-2241, 2259. |
| [14] |
李宁, 曹帅, 沈玥, 等. 叶酸对铅暴露大鼠肝脏氧化损伤的影响[J]. 动物营养学报, 2019, 31(11): 5178-5183. |
| [15] |
ZOJA C, BENIGNI A, REMUZZI G. The Nrf2 pathway in the progression of renal disease[J]. Nephrology Dialysis Transplantation, 2014, 29(Suppl.1): i19-i24. |
| [16] |
张楠.白藜芦醇对铅暴露小鼠海马组织氧化应激及NGF mRNA表达的影响[D].硕士学位论文.郑州: 郑州大学, 2012.
|
| [17] |
郭芳, 周岩民, 孙亚楠, 等.超细茶粉对肉鸡生产性能、抗氧化性能和重金属残留的影响[C]//第十一届全国家畜环境科学讨论会论文集.南昌: 中国畜牧兽医学会, 2008: 161-164.
|
| [18] |
TAHA H S A, ABDELNOUR S A, ALAGAWANY M. Growth performance, biochemical, cytological and molecular aspects of rabbits exposed to lead toxicity[J]. Journal of Animal Physiology and Animal Nutrition, 2019, 103(3): 747-755. DOI:10.1111/jpn.13073 |
| [19] |
ACHARYYA N, DEB B, CHATTOPADHYAY S, et al. Arsenic-induced antioxidant depletion, oxidative DNA breakage, and tissue damages are prevented by the combined action of folate and vitamin B12[J]. Biological Trace Element Research, 2015, 168(1): 122-132. DOI:10.1007/s12011-015-0324-5 |
| [20] |
李轶伟, 张卫东, 刘照文. 叶酸对肉仔鸡生产性能影响的研究[J]. 畜牧业环境, 2020(5): 37-38. |
| [21] |
杨霄鹏, 惠玲, 昌业伟, 等. 慢性铅中毒肾脏改变的病理形态观察[J]. 职业与健康, 2012, 28(5): 546-547. |
| [22] |
夏艳.叶酸对大鼠肺缺血再灌注损伤的保护作用[D].硕士学位论文.镇江: 江苏大学, 2019.
|
| [23] |
BOSKABADY M, MAREFATI N, FARKHONDEH T, et al. The effect of environmental lead exposure on human health and the contribution of inflammatory mechanisms, a review[J]. Environment International, 2018, 120: 404-420. DOI:10.1016/j.envint.2018.08.013 |
| [24] |
LI Q Z, HU X L, BAI Y P, et al. The oxidative damage and inflammatory response induced by lead sulfide nanoparticles in rat lung[J]. Food and Chemical Toxicology, 2013, 60: 213-217. DOI:10.1016/j.fct.2013.07.046 |
| [25] |
DUMKOVÁ J, SMUTNÁ T, VRÍKOVÁ L, et al. Sub-chronic inhalation of lead oxide nanoparticles revealed their broad distribution and tissue-specific subcellular localization in target organs[J]. Particle and Fibre Toxicology, 2017, 14: 55. DOI:10.1186/s12989-017-0236-y |
| [26] |
INNAMORATO N G, ROJO A I, GARCÍA-YAGUE Á J, et al. The transcription factor Nrf2 is a therapeutic target against brain inflammation[J]. The Journal of Immunology, 2008, 181(1): 680-689. DOI:10.4049/jimmunol.181.1.680 |
| [27] |
权福实, 钟原, 孙权, 等. 叶酸对铅中毒幼年大鼠中枢神经系统的保护作用[J]. 中国兽医学报, 2012, 32(12): 1882-1885. |
| [28] |
QUAN F S, YU X F, GAO Y, et al. Protective effects of folic acid against central nervous system neurotoxicity induced by lead exposure in rat pups[J]. Genetics and Molecular Research, 2015, 14(4): 12466-12471. DOI:10.4238/2015.October.16.13 |
| [29] |
GOMAA A M S, KHALIL N S A, ABDEL-GHANI M A. The protective role of folic acid against testicular dysfunction in lead-intoxicated rat model[J]. General Physiology and Biophysics, 2017, 36(3): 297-308. DOI:10.4149/gpb_2016048 |
| [30] |
WANG H J, CHEN L Y, ZHANG X Y, et al. Kaempferol protects mice from d-GalN/LPS-induced acute liver failure by regulating the ER stress-Grp78-CHOP signaling pathway[J]. Biomedicine & Pharmacotherapy, 2019, 111: 468-475. |
| [31] |
张莹. GRP78的研究进展[J]. 国外医学(生理、病理科学与临床分册), 2005, 25(3): 251-253. DOI:10.3969/j.issn.1673-2588.2005.03.020 |
| [32] |
LU F, ZHAO L Y, ZHANG Z M, et al. The intervention of enalapril maleate and folic acid tablet on the expressions of the GRP78 and CHOP and vascular remodeling in the vascular smooth muscle cells of H-hypertensive rats with homocysteine[J]. European Review for Medical and Pharmacological Sciences, 2018, 22(7): 2160-2168. |
| [33] |
WANG X Y, AN Y, JIAO W Y, et al. Selenium protects against lead-induced apoptosis via endoplasmic reticulum stress in chicken kidneys[J]. Biological Trace Element Research, 2018, 182(2): 354-363. DOI:10.1007/s12011-017-1097-9 |



