2. 长沙绿叶生物科技有限公司, 长沙 410100;
3. 湖南省农业科学院农产品加工研究所, 长沙 410125;
4. 湖南畜禽安全生产协同创新中心, 长沙 410128
2. Changsha Lvye Biotechnology Co., Ltd., Changsha 410100, China;
3. Hunan Agricultural Product Processing Institute, Hunan Academy of Agricultural Sciences, Changsha 410125, China;
4. Hunan Collaborative Innovation Center of Animal Production Safety, Changsha 410128, China
单宁是天然存在的水溶性多酚化合物[1],广泛分布于动物长期饲用的植物如油菜、高粱和豆科植物中。根据其化学结构,单宁可分为两大类,即水解单宁和缩合单宁[2]。单宁酸(tannic acid, TA)是单宁的次生代谢物,其是水解单宁中最典型的物质,为黄白色或浅棕色的无定形粉末,且伴有特殊气味[3],在动物生产中具有一定的毒性作用。TA的化学结构为C76H52O46,其中心葡萄糖单元与酯化没食子酸相连[4],TA的酚羟基有助于其独特的化学性质,包括多糖和蛋白质的沉淀,以及与金属的络合[5],这些结构是其呈现细胞毒性的重要原因。因为摄入过高的单宁在生产中对动物的生长存有不利的影响,因此单宁通常被称为抗营养因子[6-7]。在动物生产中,单宁会导致营养源利用率降低和生长抑制,因为其会导致动物进食减少、消化不良和吸收不良,以及肠道菌群失调[8-9]。单宁通过结合降低饲料营养成分的消化率,特别是蛋白质的消化率,下降幅度最大,其他成分如碳水化合物和淀粉的消化率也会受到影响[10]。有研究报道,单宁对消化酶活性的抑制可能是其导致蛋白质和干物质消化率降低的另一个重要原因[11-12]。在一些试验动物模型中,吸入和摄取TA会对机体造成有害的影响。此外,口服TA会引起出血性胃炎、胃黏膜坏死、肾炎和肝毒性[13]。摄入大剂量的TA可能导致急性毒性、便秘、腹痛和肝脏坏死等机体损伤[14-16],但目前尚无探讨TA对猪肾脏毒性作用机理的研究。线粒体在细胞的存活和死亡中起着重要的作用,因此线粒体依赖性的细胞凋亡被认为是一条内在的细胞程序性死亡通路。在该通路中,B细胞淋巴瘤2(Bcl-2)蛋白家族介导线粒体膜电位(MMP)和线粒体内膜通透性的改变[17],可引起细胞色素c(Cyt c)被释放进入细胞质[18-19],后者与活化半胱天冬酶(Caspase)-9所需的凋亡相关因子-1(Apaf-1)结合,诱导Caspase级联的发生,最终,通过Caspase-3的激活而导致细胞的不可逆死亡[20]。本研究以猪肾细胞系PK-15细胞为模型,基于细胞的线粒体途径探讨TA对猪肾细胞的毒性作用及其分子机理,以期为为消减和利用饲料中的抗营养因子提供试验依据。
1 材料与方法 1.1 试验材料TA,购自上海麦克林生化科技有限公司;胎牛血清(FBS),为HyClone(美国)产品。RPMI-1640培养基,为Gibco(美国)产品;5, 5’, 6, 6’-四氯-1, 1’, 3, 3’-四乙基苯并咪唑羰花青碘化物(JC-1)、四甲基偶氮唑盐(MTT)和2’, 7’二氯乙酸二氯荧光素(DCFH-DA),购自贝约泰姆生物技术研究所;细胞周期检测试剂盒,购自江苏KeyGEN生物技术有限公司;总超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒、细胞谷胱甘肽过氧化物酶(GSH-Px)试剂盒、谷胱甘肽(GSH)试剂盒、丙二醛(MDA)试剂盒、ATP试剂盒,购自南京建成生物工程研究所;兔抗Bcl-2单克隆抗体、兔抗Bcl-2相关X(Bax)单克隆抗体、兔抗Caspase-3单克隆抗体、兔抗Caspase-9单克隆抗体、兔抗β-肌动蛋白(β-actin)单克隆抗体和羊抗兔免疫球蛋白G(IgG)-辣根过氧化物酶(HRP),均为Proteintech(美国)产品;PK-15细胞为CellBank产品,购自北纳生物细胞库。
1.2 细胞培养PK-15细胞在含10%胎牛血清和1%青霉素/链霉亲和素的RPMI-1640培养基中,37 ℃、5%CO2培养。TA用双蒸水溶解,用上述培养基进一步稀释,达到指定的最终浓度[0(空白对照)、10、20、30 μmol/L]。各指标进行检测时均将PK-15细胞接种于培养皿中,常规培养24 h后更换含不同浓度TA的RPMI-1640培养基,然后继续培养24 h。
1.3 细胞活力测定将PK-15细胞接种于96孔板中24 h后,加入TA,使其终浓度分别达到0、10、15、20、25、30、35、40、45 μmol/L,继续培养24 h。之后,每孔加入20 μL MTT(5 mg/mL)于磷酸盐缓冲溶液(PBS)中。4 h后,去除含有MTT的培养基,用二甲基亚砜溶解活细胞的福马赞晶体。使用酶标仪(Infinite M1000Pro,TECAN,奥地利)在570 nm波长下测定光密度(OD)值。
1.4 乳酸脱氢酶(LDH)活性测定为评价TA对PK-15细胞的毒性作用,用试剂盒检测培养基中LDH活性,所有操作步骤均按照试剂盒说明书执行。
1.5 氧化损伤指标测定为评价TA对PK-15细胞的氧化损伤,按照相应试剂盒的说明,采用生化方法测定细胞中MDA、GSH含量与SOD、CAT和GSH-Px活性,上述指标以均每毫克蛋白质单位表示。
1.6 活性氧(ROS)含量测定采用DCFH-DA法测定ROS含量。将用TA处理24 h的PK-15细胞用硫代巴比妥钠洗涤2次,然后用10 μL DCFH-DA溶液(DCFH-DA溶解在无血清RPMI-1640培养基中)以37 ℃孵育20 min。用无血清RPMI-1640培养基洗涤3次,去除非特异性染色。用倒置荧光法测量DCF荧光强度,使用仪器为徕卡DMI 3000B型倒置荧光显微镜,激发波长为488 nm,发射波长为525 nm。
1.7 MMP测定TA处理24 h后收集PK-15细胞,PBS洗涤,37 ℃下JC-1染色20 min,JC-1染色缓冲液洗涤,4 ℃、12 000 r/min离心5 min,重复2次。然后加入PBS,用荧光分光光度法对细胞进行分析。在激发波长488 nm和发射波长525 nm处检测到聚集体JC-1(红色荧光),而在激发波长490 nm和发射波长530 nm处检测到单体JC-1(绿色荧光)。
1.8 目的蛋白提取和Western blottingTA处理24 h后收集PK-15细胞,用含有蛋白酶抑制剂的预冷RIPA裂解缓冲液裂解PK-15细胞,4 ℃、12 000 r/min离心5 min,收集上清液。用BCA试剂盒测定总蛋白浓度。将等量蛋白质负载到4%~12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳上,转移到聚偏二氟乙烯膜上。膜用含0.2%明胶的TBS-T缓冲液室温封闭1 h,然后在4 ℃条件下分别孵一抗(抗Caspase-3、抗Caspase-9、抗Bcl-2、抗Bax、抗β-actin)过夜和二抗(抗Caspase-3、抗Caspase-9、抗Bcl-2、抗Bax、抗β-actin)在室温下孵育1 h,用增强化学发光法显示所有条带,并用图像密度计进行定量分析。内参为β-actin。
1.9 细胞周期分析按照细胞周期检测试剂盒所述方法进行分析。TA处理24 h后收集PK-15细胞,用PBS洗涤,将细胞浓度调整为1×106个/mL,用70%乙醇固定过夜。以4 ℃、1 000 r/min离心3 min,用PBS洗涤,用碘化丙啶(PI)/RNaseA染色液在37 ℃黑暗中孵育30 min。用流式细胞仪绘制的DNA含量直方图,分析细胞在细胞周期不同时相的分布。
1.10 统计分析结果以至少3个独立试验的平均值±标准误(mean±SE)表示。试验结果采用SPSS 20.0统计软件的单因素方差分析(one-way ANOVA)和LSD事后检验进行分析,以P < 0.05为差异显著,P < 0.05为差异极显著性。
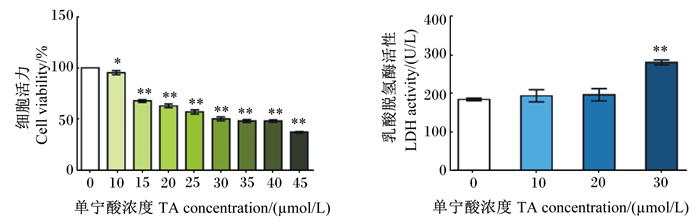
2 结果与分析 2.1 TA抑制细胞增殖为了解不同浓度的TA对PK-15细胞的毒性作用,我们首先用MTT法检测了不同浓度TA处理后PK-15细胞的活力(图 1-A)。结果显示,TA处理导致PK-15细胞活力在24 h内呈剂量依赖性(10~45 μmol/L)下降。由于半抑制浓度(IC50)值为(31.33±2.08) μmol/L,因此选择10、20和30 μmol/L的浓度进行后续研究。LDH是存在于细胞质的重要酶类,当细胞膜受到损伤时,LDH会被释放到培养基中。因此,我们通过检测培养基中游离的LDH活性来验证TA诱导的细胞毒性。结果显示,与空白对照相比,30 μmol/L TA处理后培养基中LDH活性极显著增加(P < 0.01)(图 1-B)。
|
“*”和“**”分别表示与空白对照相比差异显著(P < 0.05)和极显著(P < 0.01)。下图同。 "*" and "**" indicated significant difference (P < 0.05) and extremely significant difference (P < 0.01) compared with the blank control, respectively. The same as below. 图 1 TA对PK-15细胞的毒性作用 Fig. 1 Cytotoxic effects of TA in PK-15 cells |
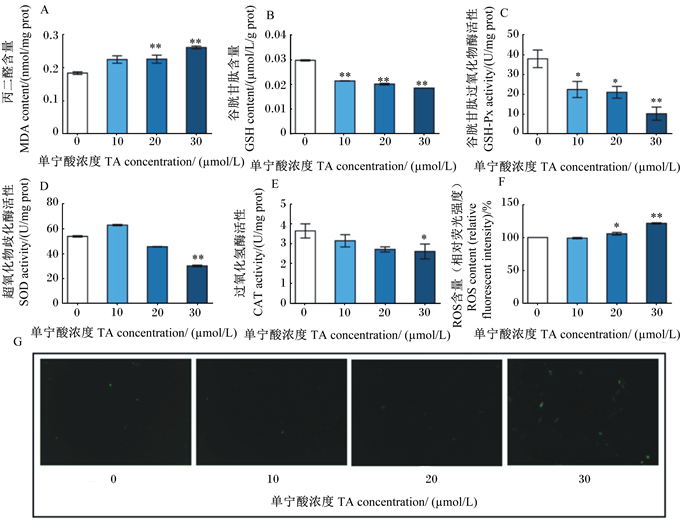
ROS是主要发生在氧化应激反应中的重要的信号分子。相反,SOD、GSH-Px和CAT是清除ROS的3种重要抗氧化酶。当抗氧化酶活性降低时,ROS的积累会引起脂质过氧化,主要表现为MDA含量的增加。通过分析不同浓度TA对MDA含量的影响(图 2-A)发现,随着TA浓度的增加,MDA含量呈剂量依赖性增加,且20、30 μmol/L TA处理PK-15细胞24 h后MDA含量较空白对照极显著增加(P < 0.01)。如图 2-B至图 2-E所示,高浓度(30 μmol/L)TA处理PK15细胞后,GSH-Px(P < 0.01)、SOD(P < 0.01)和CAT活性(P < 0.05)显著或极显著降低;如图 2-F和图 2-G所示,ROS含量与TA浓度成正比,20、30 μmol/L TA处理PK-15细胞24 h后ROS含量较空白对照极显著增加(P < 0.01)。此外,与空白对照相比,10、20、30 μmol/L TA处理PK-15细胞24 h后GSH含量均极显著降低(P < 0.01)。上述结果证实了TA可以诱导PK-15细胞产生氧化应激反应。
|
图 2 TA对PK-15细胞ROS生成和氧化应激的影响 Fig. 2 Effects of TA on ROS generation and oxidative stress in PK-15 cells |
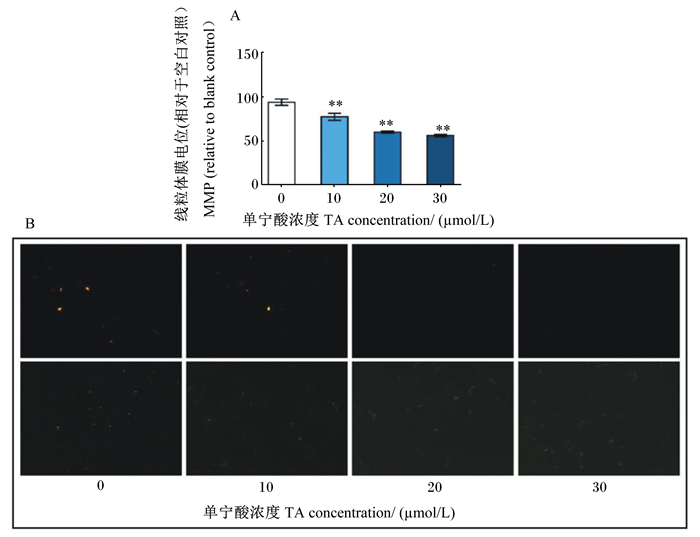
线粒体是亚细胞器,在调节细胞死亡方面起着重要作用。MMP的崩溃是诱导细胞凋亡的早期关键步骤。因此,我们用聚集体与单体JC-1的比率量化MMP的变化,聚集体与单体JC-1的比率下降代表线粒体的去极化,从而表明MMP的减少。如图 3-A和图 3-B所示,10、20、30 μmol/L TA处理导致MMP极显著降低(P < 0.01),且呈剂量依赖性。
|
图 3 TA对PK-15细胞MMP的影响 Fig. 3 Effects of TA on MMP in PK-15 cells |
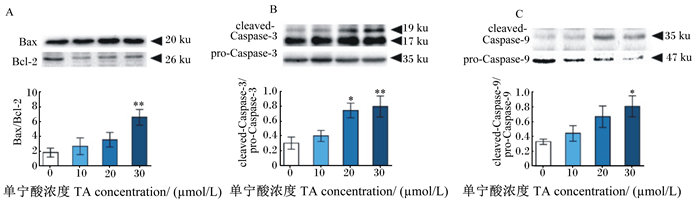
Bax/Bcl-2可作为细胞凋亡的评判参考指标,图 4-A显示,随着TA浓度的增加,Bax/Bcl-2呈剂量依赖升高,且30 μmol/L TA处理PK-15细胞24 h后Bax/Bcl-2较空白对照极显著升高(P < 0.01)。Caspase-3是细胞凋亡的关键执行者,图 4-B显示,20和30 μmol/L TA处理PK-15细胞24 h后,剪切体-Caspase-3(cleaved-Caspase-3)/前体-Caspase-3(pro-Caspase-3)较空白对照显著或极显著升高(P < 0.05或P < 0.01)。图 4-C显示,30 μmol/L TA处理PK-15细胞24 h使得剪切体-Caspase-9(cleaved-Caspase-9)/前体-Caspase-9(pro-Caspase-9)较空白对照显著升高(P < 0.05),这进一步支撑了TA在线粒体介导的凋亡中的作用。综上所述,这些数据表明内源性凋亡程序参与了高浓度TA诱导的细胞凋亡。
|
Bcl-2:B细胞淋巴瘤-2 B cell lymphoma-2;Bax:Bcl-2相关的X蛋白Bcl-2 associated X protein;cleaved-Caspase-3:剪切体-半胱天冬酶-3 cleaved-cysteinyl asparate-specificproteinase-3;pro-Caspase-3:前体-半胱天冬酶-3 pro-cysteinyl asparate-specificproteinase-3;cleaved-Caspase-9:剪切体-半胱天冬酶-9 cleaved-cysteinyl asparate-specificproteinase-9;pro-Caspase-9:前体-半胱天冬酶-9 pro-cysteinyl asparate-specificproteinase-9。 图 4 TA对PK-15细胞线粒体通路凋亡蛋白表达的影响 Fig. 4 Effects of TA on expression of apoptotic proteins of mitochondrial pathway in PK-15 cells |
采用PI/RNaseA染色液和流式细胞仪进行细胞周期分析。经30 μmol/L的TA处理24 h后,PK-15细胞的S期状态较未处理细胞显著增加(图 5-A和图 5-B)。与空白对照相比,PK-15细胞处于S期的比例由22.15%增加到46.82%,说明30 μmol/L TA处理使PK-15细胞S期阻滞。
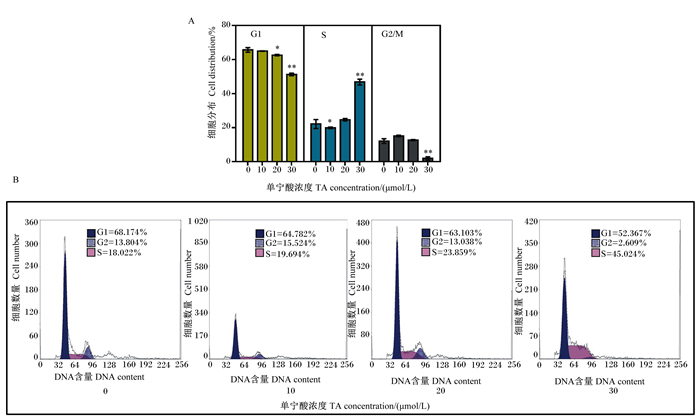
|
图 5 TA对PK-15细胞周期的影响 Fig. 5 Effects of TA on cell cycle in PK-15 cells |
在畜牧生产中,TA是一把双刃剑。已有大量研究报道TA具有抗菌、抗氧化、抗癌、改善肉类品质[3, 21-23]等特性,适量使用对动物的生产有一定的积极作用。在养猪生产中,已有不少研究发现,不同来源的TA作为饲料添加剂可有效改善断奶仔猪肠道健康(1 000 mg/kg栗树单宁酸)[24],提高保育猪生产性能(100 mg/kg五倍子单宁酸)[25],并能在一定程度上作为保育猪饲粮中高锌的替代品(500 mg/kg五倍子粉单宁酸、五倍子水解单宁酸、栗木粉单宁酸)[26]。然而,这均是基于适宜的添加浓度,而过高浓度的TA不仅对猪群生长性能无益处,还可能降低猪的采食量,并存在一定的毒害作用[25]。本课题组前期的研究发现,过高浓度的TA可引起猪小肠上皮细胞的氧化损伤和凋亡,对动物的生长具有抑制作用[27]。本研究针对在生猪养殖过程中过量的抗营养因子对猪肾细胞产生毒性的问题,以PK-15细胞为模型,研究不同浓度的TA对猪肾细胞的毒性作用及其潜在的分子机理,对TA在临床上的利用提供试验依据。
已有研究证明,不同的器官、组织、细胞类型可能对TA表现出不同程度的敏感性。在我们前期的研究中,用不同浓度(2.5~80.0 μmol/L)的TA处理猪空肠上皮细胞(IPEC-J2细胞)24 h,与对照组相比,当TA浓度≥5 μmol/L时,细胞活力出现显著下降,且存在量效关系[27]。另有数据表明用不同浓度(1.25~40.0 μmol/L)的TA分别处理前列腺癌细胞(C4-2、DU 145和PC-3细胞)48和72 h后,细胞活力出现下降,且呈剂量依赖性[23]。为探讨TA和PK-15细胞的量效关系,本试验测定了不同浓度的TA对PK-15细胞的毒性作用,结果显示,TA浓度高于10 μmol/L时对PK-15细胞具有严重的毒性作用,且TA对细胞活力的抑制作用呈剂量依赖性。LDH是糖酵解和糖异生的重要酶,广泛分布于细胞质中,当细胞受损时,LDH被迅速释放到培养基中。如图 1-B所示,30 μmol/L TA可显著提高培养基中LDH的活性,进一步证实了其对细胞的损害作用。
ROS包括超氧阴离子自由基(O2-·)、过氧化氢(H2O2)和羟自由基(·OH)等,在健康条件下,ROS是调节细胞生长和存活的重要信号分子[28]。在病理条件下,过量的ROS产生会耗尽抗氧化成分,表现为GSH含量和抗氧化酶(包括GSH-Px、SOD和CAT)活性的降低,以及对细胞成分损伤的增加(如MDA含量升高)[29]。SOD、CAT和GSH-Px是清除多余ROS的3种普遍存在的酶。其中,SOD催化O2-·转化为过氧化氢[30],所产生的过氧化氢随后在CAT的催化下分解为水和氧气;而GSH-Px通过与GSH反应将其转化为氧化型谷胱甘肽(GSSG)来清除过氧化物,以防止细胞脂质的过氧化。在本研究中,经过TA处理后,3种抗氧化酶的活性均受到抑制,GSH含量出现了降低,这一结果使得ROS和MDA含量增加,由此可见,TA诱导PK-15细胞产生了氧化应激反应。已有研究证明,细胞质中过量的ROS可通过多种机制损伤线粒体功能,包括诱导线粒体DNA损伤、增加过量的钙离子内流、抑制关键磷酸酶、诱导关键激酶和转录因子[31];此外,过量的ROS还可导致线粒体膜脂质过氧化,降低MMP,引起线粒体膜通透性降低[32]。在本研究中,经30 μmol/L TA处理后的PK-15细胞抗氧化系统中酶活性显著或极显著降低,ROS含量极显著升高,细胞活性亦极显著降低,故推测TA可能通过诱导PK-15细胞氧化应激并介导线粒体途径引起细胞凋亡。
线粒体是细胞中最重要的细胞器,通过沿电子传递链的呼吸链复合体的电子流动,以ATP的形式产生能量。如前文所述,线粒体通常被认为是ROS的主要靶点,ROS可损伤线粒体DNA并诱导MMP的改变,最终加重氧化应激并破坏ATP的产生[28]。本试验对MMP的研究结果证明了前文的推测,TA处理极显著降低了线粒体MMP,引起线粒体膜通透性的改变,从而导致线粒体功能损伤。而线粒体膜通透性的改变可导致Cyt c被释放到细胞质中[28],并导致凋亡诱导因子如Bax和Bcl-2引起的Caspase级联激活[33]。Bcl-2家族成员包括抗凋亡蛋白Bcl-2和促凋亡蛋白Bax,在线粒体凋亡途径中起着至关重要的作用,当细胞中Bax/Bcl-2升高时,会增加线粒体Cyt c的释放[34],细胞质中升高的Cyt c可激活下游的Caspase级联反应,导致Caspase-9和Caspase-3被依次剪切、激活,最终触发细胞凋亡[35-36]。本研究结果显示,TA在降低MMP的同时,升高了Bax/Bcl-2以及cleaved-Caspase-9和cleaved-Caspase-3的表达量,验证了TA通过线粒体途径诱导PK-15细胞凋亡的推测。
哺乳动物的细胞周期分为4个阶段,即G1、S、G2和M期。在细胞的S期,主要功能是双链DNA的复制。已有不少研究证明,许多因素可以导致细胞的S期阻滞,如辐射、药物[37-38],其中双链DNA损伤是重要的潜在机制之一[27],例如,天然产物特噻吩α-三硫烯基甲醇可通过ROS介导的DNA损伤诱导人卵巢癌细胞阻滞在S期[39]。有证据表明,细胞中过多的ROS可与DNA的核糖发生反应,导致DNA结构不稳而引起DNA链的断裂[40],最终导致细胞S期阻滞[27]。此外,毛细血管扩张性共济失调突变因子(ATM)/ATM与Rad3相关蛋白激酶(ATR)信号通路与感知氧化应激信号以及DNA双链断裂关系密切[41],有研究揭示了依赖于GSH/GSSG失衡激活的ATM/ATR信号通路可能参与了细胞的S期阻滞、自噬和凋亡,最终导致癌细胞生长抑制[42]。在本试验中,TA诱导PK-15细胞抗氧化系统中酶活性降低、ROS生成增加同时,伴随出现了严重的细胞S期阻滞,这与本课题组前期的研究结果[27]相似,其中的潜在机制可能与ATM/ATR信号通路相关的DNA损伤有关,这一点有待进一步研究证实。
本研究揭示了氧化损伤和ROS介导的线粒体途径细胞凋亡和S期阻滞是高浓度TA对猪肾毒性的潜在机制之一,为养殖生产中抗营养因子的消减与利用提供了试验依据,同时也提示,在养猪生产中将TA作为饲料添加剂时应谨慎用量,避免过高浓度TA对机体产生的生理毒性作用。
4 结论综上所述,高浓度的TA通过降低PK-15细胞内GSH含量以及CAT、SOD、GSH-Px活性,导致细胞出现氧化损伤,使MDA和ROS含量增加,后者介导了线粒体途径的细胞凋亡以及细胞S期阻滞。
| [1] |
LI M S, YAO K, HE Q, et al. Biodegradation of gallotannins and ellagitannins[J]. Journal of Basic Microbiology, 2006, 46(1): 68-84. DOI:10.1002/jobm.200510600 |
| [2] |
OKUDA T, ITO H. Tannins of constant structure in medicinal and food plants-hydrolyzable tannins and polyphenols related to tannins[J]. Molecules, 2011, 16(3): 2191-2217. DOI:10.3390/molecules16032191 |
| [3] |
AL-HIJAZEEN M, LEE E J, MENDONCA A F, et al. Effects of tannic acid on lipid and protein oxidation, color, and volatiles of raw and cooked chicken breast meat during storage[J]. Antioxidants, 2016, 5(2): 19. DOI:10.3390/antiox5020019 |
| [4] |
SERRANO J M, PUUPPONEN-PIMIÄ R, DAUER A, et al. Tannins:current knowledge of food sources, intake, bioavailability and biological effects[J]. Molecular Nutrition & Food Research, 2009, 53(Suppl.2): S310-S329. |
| [5] |
MAKKAR H P S. Effects and fate of tannins in ruminant animals, adaptation to tannins, and strategies to overcome detrimental effects of feeding tannin-rich feeds[J]. Small Ruminant Research, 2003, 49(3): 241-256. DOI:10.1016/S0921-4488(03)00142-1 |
| [6] |
KUMAR R, SINGH M. Tannins:their adverse role in ruminant nutrition[J]. Journal of Agricultural and Food Chemistry, 1984, 32(3): 447-453. DOI:10.1021/jf00123a006 |
| [7] |
MCLEOD M N. Plant tannins-their role in forage quality[J]. Nutrition Abstracts Review, 1974, 44: 803-815. |
| [8] |
MUELLER-HARVEY I. Unravelling the conundrum of tannins in animal nutrition and health[J]. Journal of the Science of Food & Agriculture, 2006, 86(13): 2010-2037. |
| [9] |
艾庆辉, 苗又青, 麦康森. 单宁的抗营养作用与去除方法的研究进展[J]. 中国海洋大学学报(自然科学版), 2011, 41(增刊1): 33-40. |
| [10] |
BRAVO L. Polyphenols:chemistry, dietary sources, metabolism, and nutritional significance[J]. Nutrition Reviews, 1998, 56(11): 317-333. DOI:10.1111/j.1753-4887.1998.tb01670.x |
| [11] |
HORIGOME T, KUMAR R, OKAMOTO K. Effects of condensed tannins prepared from leaves of fodder plants on digestive enzymes in vitro and in the intestine of rats[J]. British Journal of Nutrition, 1988, 60(2): 275-285. DOI:10.1079/BJN19880099 |
| [12] |
KUMAR R, VAITHIYANATHAN S. Occurrence, nutritional significance and effect on animal productivity of tannins in tree leaves[J]. Animal Feed Science and Technology, 1990, 30(1/2): 21-38. |
| [13] |
FRUTOS P, HERVÁS G, GIRÁLDEZ F J, et al. An in vitro study on the ability of polyethylene glycol to inhibit the effect of quebracho tannins and tannic acid on rumen fermentation in sheep, goats, cows, and deer[J]. Australian Journal of Agricultural Research, 2004, 55(11): 1125-1132. DOI:10.1071/AR04058 |
| [14] |
秦绪军, 海春旭, 何伟, 等. 单宁急性毒性及其对小鼠丙二醛和抗氧化酶的影响[J]. 卫生毒理学杂志, 2004(2): 79-81. |
| [15] |
HERIBERTO R. Tannic acid[J]. Encyclopedia of Toxicology, 1994, 522(12): 134-136. |
| [16] |
LABIENIEC M, GABRYELAK T, FALCIONI G. Antioxidant and pro-oxidant effects of tannins in digestive cells of the freshwater mussel Unio tumidus[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2003, 539(1/2): 19-28. |
| [17] |
SHARPE J C, ARNOULT D, YOULE R J. Control of mitochondrial permeability by Bcl-2 family members[J]. Biochimica Biophysica Acta:Molecular Cell Research, 2004, 1644(2/3): 107-113. DOI:10.1016/j.bbamcr.2003.10.016 |
| [18] |
GREEN D R, REED J C. Mitochondria and apoptosis[J]. Science, 1998, 281(5381): 1309-1312. DOI:10.1126/science.281.5381.1309 |
| [19] |
GRANVILLE D J, CASSIDY B A, RUEHLMANN D O, et al. Mitochondrial release of apoptosis-inducing factor and cytochrome c during smooth muscle cell apoptosis[J]. The American Journal of Pathology, 2001, 159(1): 305-311. DOI:10.1016/S0002-9440(10)61696-3 |
| [20] |
SRINIVASULA S M, AHMAD M, FERNANDES-ALNEMRI T, et al. Autoactivation of Procaspase-9 by Apaf-1-Mediated oligomerization[J]. Molecular Cell, 1998, 1(7): 949-957. DOI:10.1016/S1097-2765(00)80095-7 |
| [21] |
REYES A W B, HOP H T, ARAYAN L T, et al. Tannic acid-mediated immune activation attenuates Brucella abortus infection in mice[J]. Journal of Veterinary Science, 2018, 19(1): 51-57. DOI:10.4142/jvs.2018.19.1.51 |
| [22] |
ZHANG J, CHEN D, HAN D M, et al. Tannic acid mediated induction of apoptosis in human glioma Hs 683 cells[J]. Oncology Letters, 2018, 15(5): 6845-6850. |
| [23] |
NAGESH P K B, HATAMI E, CHOWDHURY P, et al. Tannic acid induces endoplasmic reticulum stress-mediated apoptosis in prostate cancer[J]. Cancers, 2018, 10(3): 68. DOI:10.3390/cancers10030068 |
| [24] |
蓝林诚, 沈水宝, 农斯伟, 等. 不同来源单宁酸替代高锌对保育猪生长性能、血清生化指标和抗氧化指标的影响[J]. 饲料研究, 2019, 42(7): 34-37. |
| [25] |
胡爱国.单宁酸提高保育猪生产性能及其机制研究[D].硕士学位论文.福州: 福建农林大学, 2018.
|
| [26] |
邓文, 张世昌, 蔡荣斌, 等. 栗树单宁对断奶仔猪生产性能、肠道形态和通透性及抗氧化性能的影响[J]. 中国饲料, 2018(1): 44-48. |
| [27] |
WANG J, XIAO H S, ZHU Y Y, et al. Tannic acid induces the mitochondrial pathway of apoptosis and S phase arrest in porcine intestinal IPEC-J2 cells[J]. Toxins, 2019, 11(7): 397. DOI:10.3390/toxins11070397 |
| [28] |
GALLEY H F. Oxidative stress and mitochondrial dysfunction in sepsis[J]. British Journal of Anaesthesia, 2011, 107(1): 57-64. DOI:10.1093/bja/aer093 |
| [29] |
NEWSHOLME P, CRUZAT V F, KEANE K N, et al. Molecular mechanisms of ROS production and oxidative stress in diabetes[J]. Biochemical Journal, 2016, 473(24): 4527-4550. DOI:10.1042/BCJ20160503C |
| [30] |
SAKAMOTO T, IMAI H. Hydrogen peroxide produced by superoxide dismutase SOD-2 activates sperm in Caenorhabditis elegans[J]. The Journal of Biological Chemistry, 2017, 292(36): 14804-14813. DOI:10.1074/jbc.M117.788901 |
| [31] |
MODICA-NAPOLITANO J S, SINGH K K. Mitochondrial dysfunction in cancer[J]. Mitochondrion, 2004, 4(5/6): 755-762. DOI:10.1016/j.mito.2004.07.027 |
| [32] |
BHAT A H, DAR K B, ANEES S, et al. Oxidative stress, mitochondrial dysfunction and neurodegenerative diseases; a mechanistic insight[J]. Biomedicine & Pharmacotherapy, 2015, 74: 101-110. |
| [33] |
MUÑOZ-PINEDO C, GUÍO-ARRIÓN A, GOLDSTEIN J C, et al. Different mitochondrial-intermembrane space proteins are released during apoptosis in a manner that is coordinately initiated but can vary in duration[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(31): 11573-11578. DOI:10.1073/pnas.0603007103 |
| [34] |
CAO G D, MINAMI M, WEI P, et al. Intracellular bax translocation after transient cerebral ischemia:implications for a role of the mitochondrial apoptotic signaling pathway in ischemic neuronal death[J]. Journal of Cerebral Blood Flow and Metabolism, 2001, 21(4): 321-333. DOI:10.1097/00004647-200104000-00001 |
| [35] |
FUCHS Y, STELLER H. Programmed cell death in animal development and disease[J]. Cell, 2011, 147(4): 742-758. DOI:10.1016/j.cell.2011.10.033 |
| [36] |
WANG J, YANG C L, YUAN Z H, et al. T-2 toxin exposure induces apoptosis in TM3 cells by inhibiting mammalian target of rapamycin/serine/threonine protein kinase(mTORC2/AKT) to promote Ca2+ production[J]. International Journal of Molocular Sciences, 2018, 19(11): 3360. DOI:10.3390/ijms19113360 |
| [37] |
LEE Y S, CHOI K M, KIM W, et al. Hinokitiol inhibits cell growth through induction of S-phase arrest and apoptosis in human colon cancer cells and suppresses tumor growth in a mouse xenograft experiment[J]. Journal of Natural Products, 2013, 76(12): 2195-2202. DOI:10.1021/np4005135 |
| [38] |
YONG W K, HO Y F, MALEK S N A. Xanthohumol induces apoptosis and S phase cell cycle arrest in A549 non-small cell lung cancer cells[J]. Pharmacognosy Magazine, 2015, 11(44): 275-283. DOI:10.4103/0973-1296.166069 |
| [39] |
PREYA U H, LEE K T, KIM N J, et al. The natural terthiophene α-terthienylmethanol induces S phase cell cycle arrest of human ovarian cancer cells via the generation of ROS stress[J]. Chemico-Biological Interactions, 2017, 272: 72-79. DOI:10.1016/j.cbi.2017.05.011 |
| [40] |
YOUNG I S, WOODSIDE J V. Antioxidants in health and disease[J]. Journal of Clinical Pathology, 2001, 54(3): 176-186. DOI:10.1136/jcp.54.3.176 |
| [41] |
GULERIA A, CHANDNA S. ATM kinase:much more than a DNA damage responsive protein[J]. DNA Repair, 2016, 39: 1-20. DOI:10.1016/j.dnarep.2015.12.009 |
| [42] |
SHE T T, FENG J N, LIAN S Y, et al. Sarsaparilla (smilax glabra rhizome) extract activates redox-dependent ATM/ATR pathway to inhibit cancer cell growth by S phase arrest, apoptosis, and autophagy[J]. Nutrition and Cancer, 2017, 69(8): 1281-1289. DOI:10.1080/01635581.2017.1362447 |




