肠道不仅是营养物质消化吸收的主要场所,也是机体重要的免疫器官,在抵御病原入侵、维持机体内环境的稳定中发挥着重要作用[1]。肠上皮细胞在营养物质的消化吸收和免疫功能中起着重要作用[2]。当机体受到外来细菌、病毒等病原微生物的刺激时,可引起炎症信号相关通路的激活,诱导炎性细胞因子如肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1(IL-1)等的产生,造成肠道结构和功能损伤[3]。因此,建立相应的肠细胞损伤模型,对于研究肠道的保护机制有十分重要的意义。
TNF-α作为重要的炎性细胞因子,在机体抵御外来病原入侵时发挥着重要的作用。正常情况下,低浓度的TNF-α能起到保护机体免受病原感染的作用[4]。但是,当机体内的TNF-α过量产生或释放时,可引发炎症信号通路的激活,进一步诱导炎性细胞因子大量产生,诱发肠道损伤[5-6]。过度的炎症反应会激活机体的负调控因子,如单免疫球蛋白白细胞介素-1受体相关蛋白(SIGIRR)和细胞因子信号转导抑制因子1(SOCS1),达到抑制炎性反应的目的[7-8]。本课题组前期的研究也发现,肠道中TNF-α浓度与肠道损伤密切相关,TNF-α浓度越高,肠道组织损伤越严重[9]。Mankertz等[10]研究发现,TNF-α刺激导致HT-29/B6细胞的通透性增大,引起跨膜电位改变,使细胞对细菌、病毒、霉菌毒素等的屏障作用减弱。Al-Sadi等[11]和Field等[12]研究发现,TNF-α刺激导致Caco-2细胞的通透性增大,使细胞对营养物质的利用率下降。TNF-α可促进内皮细胞和中性粒细胞的促炎反应,增加内皮细胞的通透性,最终导致细胞损伤和多器官功能障碍[13]。本试验以IPEC-1细胞为研究对象,探究不同TNF-α浓度和不同刺激时间对IPEC-1细胞的影响,旨在选取TNF-α的合适浓度和刺激时间,建立IPEC-1细胞损伤模型。
1 材料与方法 1.1 试验材料TNF-α,购于Prospec公司;IPEC-1细胞,购于德克萨斯农工大学;一抗抗体闭合蛋白-1(Claudin-1)(猪源),型号519000,购于Invitrogen公司;二抗抗体辣根过氧化物酶标记羊抗兔免疫球蛋白G(HRP-Goat Anti-Rabbit IgG)(ANT020),购于武汉安特捷生物技术公司;CCK8试剂盒(CK04)、β-肌动蛋白(β-actin)抗体(A2228),购于武汉安特捷生物技术公司;凯基全蛋白抽提试剂盒和BCA蛋白浓度测定试剂盒,购于江苏凯基生物技术股份有限公司;DMEM/F-12培养基,购于美国Hyclone公司;乳酸脱氢酶(LDH)试剂盒,购于南京建成生物工程研究所。
1.2 完全培养基的配制在DMEM/F-12培养基中,按比例加入5%的胎牛血清、1%的双抗、1%的谷氨酰胺、1‰的ITS-X、0.5‰的EGF(均购于Gibco公司),配制成完全培养基,待用。
1.3 细胞培养将冻存的IPEC-1细胞复苏,在恒温培养箱中进行细胞培养,培养条件5% CO2、37 ℃。当贴壁细胞量达到90%~95%,即细胞量达到可消化的程度,此时用胰蛋白酶进行消化。消化后,将得到的细胞进行适当稀释、铺板。
1.4 指标测定 1.4.1 细胞活力将经过胰蛋白酶消化后的细胞接种到96孔板中进行培养。观察贴壁细胞量,当贴壁细胞量达到60%时,用含有不同浓度[0(对照)、10、20、40、50 ng/mL]TNF-α的培养液刺激细胞,分别刺激12、24、48 h,每个处理8个重复。在刺激结束时,换上含有CCK8的培养基(CCK8和完全培养基按1 : 9配制),在恒温培养箱中静置1 h,注意避光,再用酶标仪在波长450 nm处进行检测读数。
1.4.2 LDH活性将经过胰蛋白酶消化后的细胞接种到12孔板中进行培养。观察贴壁细胞量,待贴壁细胞量达到60%~70%时,用含有不同浓度[0(对照)、10、20、40、50 ng/mL]TNF-α的培养液刺激细胞,分别刺激12、24、48 h,每个处理4个重复。在刺激结束时,收集细胞培养液,采用LDH试剂盒对LDH活性进行检测。
1.4.3 紧密连接蛋白和炎症相关基因mRNA表达量将经胰蛋白酶消化后的细胞接种到12孔板中培养,当贴壁细胞量达到60%~70%时,用含有不同浓度[0(对照)、10、20、40、50 ng/mL]TNF-α的培养液分别刺激细胞,之后分别在12、24、48 h用RNA裂解后收取细胞,每个处理4个重复,用于紧密连接蛋白和炎症相关基因mRNA表达量的测定。按照TRIzol试剂(美国Invitrogen公司)的说明,裂解后的样品经过提取、沉淀清洗、溶解等步骤,提取得到总RNA。之后,反转得到cDNA,反转步骤按照反转试剂盒说明书进行。实时荧光定量PCR按照SYBRⓇ Premix Ex TaqTM(Tli RNaseH Plus)试剂盒[宝生物工程(大连)有限公司]说明书完成。反应体系为20 μL,由10.0 μL SYBRⓇ Premix Ex TaqTM (2×)、0.4 μL ROX reference dyeⅡ (10×)、2.0 μL cDNA、6.8 μL RNase free dH2O、0.4 μL上游引物(10 μmol/L)、0.4 μL下游引物(10 μmol/L)组成。使用ABI 7 500 Real-time PCR仪(Applied Biosystems公司)进行扩增,PCR反应条件为:95 ℃ 30 s,随后95 ℃ 5 s,60 ℃ 34 s,进行40个循环。以β-actin为内参进行数据分析,采用Livak等[14]的2-ΔΔCt法计算目的基因mRNA表达量。相关基因的引物序列见表 1。
|
|
表 1 相关基因的引物序列 Table 1 Primer sequences of related genes |
贴壁细胞经过胰蛋白酶消化,稀释至合适浓度后,接种到小皿(60 mm)中进行培养。待贴壁细胞长至60%~70%,分别用含有不同浓度[0(对照)、10、20、40、50 ng/mL]TNF-α的培养液刺激细胞,每个处理4个重复,48 h后弃培养液,用磷酸盐缓冲液(PBS)清洗2遍,随后在每个培养皿中加入蛋白提取液[按照1 mL Lysis Buffer、10 μL磷酸酶抑制剂、1 μL蛋白酶抑制剂、5 μL 100 mmol/L苯甲基磺酰氟(PMSF)配制],收集样品,提取蛋白样品。采用Western Blot的方法,得到蛋白条带。试验以β-actin为内参,采用Alpha Innotech成像系统显色,最终按照Claudin-1和β-actin的光密度值的比值进行相关数据的分析。
1.5 统计分析采用SPSS 22.0软件进行单因素方差分析(one-way ANOVA),并采用Duncan氏法进行组间多重比较,结果以平均值±标准误表示,以P≤0.05为差异显著性标准,0.05 < P≤0.10为具有显著性趋势。
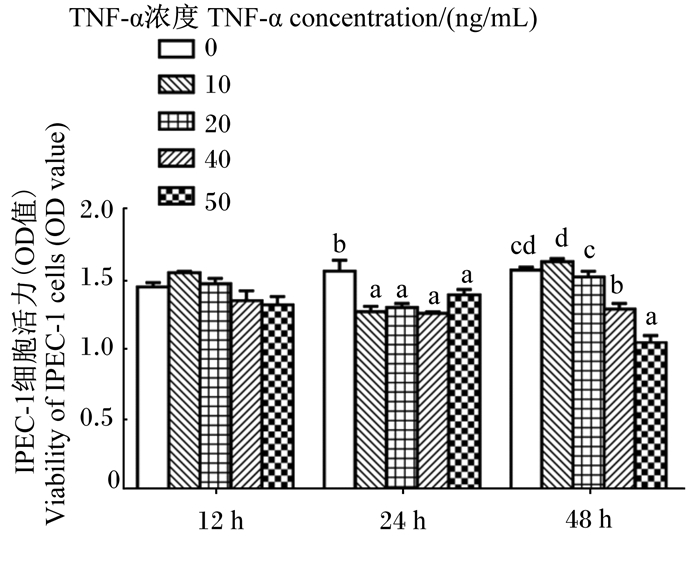
2 结果与分析 2.1 不同浓度TNF-α对IPEC-1细胞活力的影响由图 1可知,与对照组相比,当刺激时间为12 h时,不同浓度(10、20、40、50 ng/mL)的TNF-α对细胞活力均无显著影响(P>0.05)。当刺激时间为24 h时,不同浓度的TNF-α均导致细胞活力显著下降(P < 0.05)。当刺激时间为48 h时,仅40和50 ng/mL的TNF-α导致细胞活力显著下降(P < 0.05)。
|
数据柱标注相同字母或无字母表示差异不显著(P>0.05),不同字母表示差异显著(P < 0.05)。下图同。 Date columns with the same or no letters mean no significant difference (P>0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 1 不同浓度TNF-α对IPEC-1细胞活力的影响 Fig. 1 Effects of different concentrations of TNF-α on viability of IPEC-1 cells |
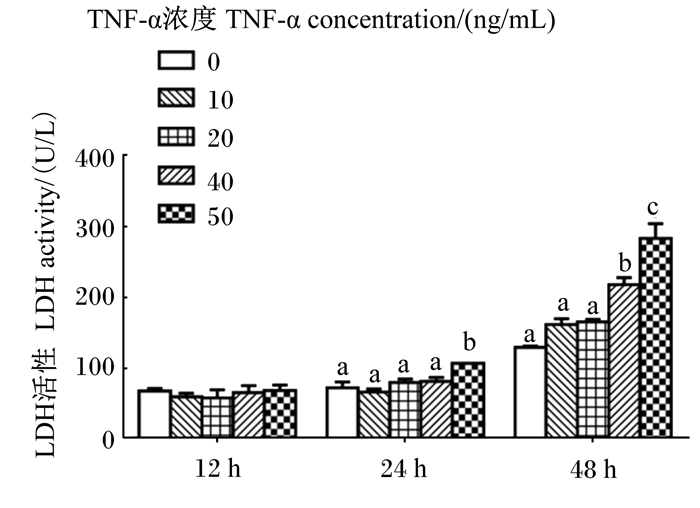
由图 2可知,与对照组相比,当刺激时间为12 h时,不同浓度的TNF-α对LDH活性均无显著影响(P>0.05)。当刺激时间为24 h时,50 ng/mL的TNF-α导致LDH活性显著上升(P < 0.05)。当刺激时间为48 h时,仅40和50 ng/mL的TNF-α导致LDH活性显著上升(P < 0.05),且随着TNF-α浓度和刺激时间的增加,LDH活性上升的幅度变大。
|
图 2 不同浓度TNF-α对IPEC-1细胞培养液LDH活性的影响 Fig. 2 Effects of different concentrations of TNF-α on LDH activity in culture medium of IPEC-1 cells |
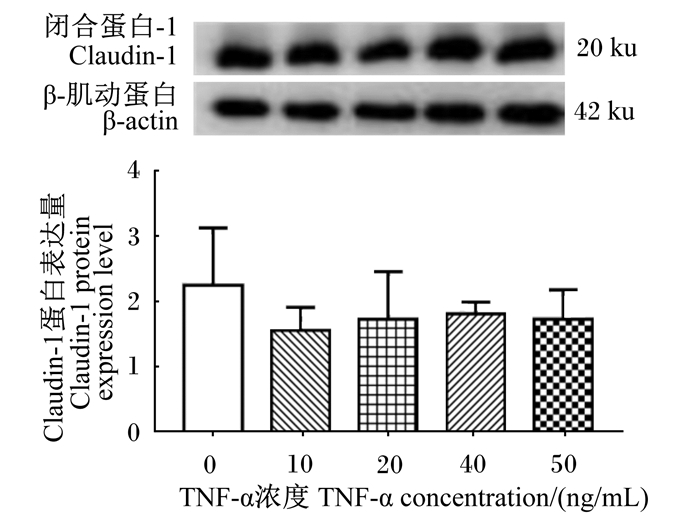
由表 2可知,与对照组相比,当刺激时间为12和48 h时,不同浓度的TNF-α对闭合小环蛋白-1(ZO-1)、Claudin-1和咬合蛋白(Occludin)的mRNA表达量均无显著影响(P>0.05)。当刺激时间为24 h时,40和50 ng/mL的TNF-α导致ZO-1、Claudin-1和Occludin的mRNA表达量显著上升(P < 0.05)。由图 3可知,与对照组相比,当刺激时间为48 h时,不同浓度的TNF-α对Claudin-1的蛋白表达量均无显著影响(P>0.05)。
|
|
表 2 不同浓度TNF-α对IPEC-1细胞紧密连接蛋白mRNA表达量的影响 Table 2 Effects of different concentrations of TNF-α on mRNA expression levels of tight junction proteins of IPEC-1 cells |
|
图 3 不同浓度TNF-α刺激IPEC-1细胞48 h对Claudin-1蛋白表达的影响 Fig. 3 Effects of different concentrations of TNF-α on Claudin-1 protein expression of IPEC-1 cells at stimulation for 48 h |
由表 3可知,与对照组相比,当刺激时间为12 h时,不同浓度的TNF-α均导致TNF-α的mRNA表达量显著上升(P < 0.05)。当刺激时间为24和48 h时,不同浓度的TNF-α均导致TNF-α和白细胞介素-8(IL-8)的mRNA表达量显著上升(P < 0.05),且随着TNF-α浓度和刺激时间的增加,其mRNA表达量增加的幅度变大。当刺激时间为12、24和48 h时,不同浓度的TNF-α对SOCS1和SIGIRR的mRNA表达量均无显著差异(P>0.05)。
|
|
表 3 不同浓度TNF-α对IPEC-1细胞炎症相关基因mRNA表达的影响 Table 3 Effects of different concentrations of TNF-α on mRNA expression of genes related to inflammation of IPEC-1 cells |
肠道在机体的生长发育过程中扮演着十分重要的角色,不仅能够满足机体的营养需要,还是抵御各种内源或外源感染的有效屏障。环境中细菌、病毒、霉菌毒素等极易造成肠道结构和功能的损伤。这些不利因素可导致肠黏膜损伤和功能障碍,最终危害人和动物健康。因此,本试验采用不同浓度TNF-α刺激IPEC-1细胞,建立肠细胞损伤模型。
本试验中测定的指标包括细胞活力、LDH活性、炎症相关基因mRNA表达以及紧密连接蛋白mRNA或蛋白表达。其中,细胞的损伤情况可以通过显微镜观察,以细胞活力作为衡量细胞损伤的指标[15]。通过定量LDH的释放量,测定TNF-α对IPEC-1细胞的细胞毒性[16]。LDH主要存在于细胞内,当细胞损伤时,会被释放到培养液中。通过测定培养液LDH的活性,可以检测细胞的受损情况[17]。本试验发现,TNF-α刺激导致IPEC-1细胞活力显著下降,LDH的活性显著上升,表明TNF-α刺激诱导了IPEC-1细胞损伤。与本试验结果类似,Zhang等[18]研究发现,TNF-α刺激导致肠道Caco-2细胞损伤。此外,TNF-α也可诱导其他细胞的损伤。如Mcclain等[19]研究报道,大量的TNF-α产生造成肝细胞死亡。TNF-α是主要的细胞因子,在刺激炎症级联反应中具有重叠和协同作用,TNF-α可促进内皮细胞和中性粒细胞的促炎反应,增加内皮细胞的通透性,最终导致细胞损伤和多器官功能障碍[13]。倪虹等[20]研究表明,TNF-α刺激会导致胰腺细胞的细胞活力下降,使培养液中LDH的活性上升。TNF-α能够上调肌球蛋白轻链激酶(MLCK)蛋白表达及诱导核转录因子-κB(NF-κB)的启动,MLCK作为一种Ca2+/钙调蛋白依赖的丝氨酸/苏氨酸激酶,活化后可诱导MLCK1募集以及下游肌球蛋白轻链(MLC)磷酸化,最终引起肠上皮的通透性增加。
肠上皮细胞通过细胞间紧密连接蛋白(包括ZO-1、Occludin和Claudin-1等)紧密结合在一起,该蛋白调节细胞旁通透性,对于上皮屏障的完整性至关重要。肠上皮细胞在营养物质的消化吸收和免疫功能中起着重要作用[21]。肠道屏障功能的完整性是由基底膜、上皮细胞层和黏液层构成,在抵抗病原入侵中发挥着重要的作用[22]。炎症反应是一种防御机制,保护宿主免受感染,促进组织修复和伤口愈合[23]。炎性细胞因子TNF-α会影响肠上皮细胞的完整性,损伤肠黏膜屏障[24-25]。本试验中,在刺激时间为24 h时,40和50 ng/mL的TNF-α刺激导致ZO-1、Occludin和Claudin-1的mRNA表达量显著上升,但对Claudin-1的蛋白表达量无显著影响。与本试验结果相似,Xiao等[26]研究发现,TNF-α刺激对Claudin-1的蛋白表达量无显著影响。但是,宋红丽等[27]研究发现,采用TNF-α刺激24 h,肠细胞中ZO-1的mRNA表达量显著下降。我们猜测,可能是TNF-α损伤了IPEC-1细胞的屏障功能,IPEC-1细胞通过负反馈调节促进紧密连接蛋白的mRNA表达,从而防止IPEC-1细胞的屏障功能进一步损伤。
TNF-α是一种促炎细胞因子,能够诱导细胞产生炎症反应,引起细胞内炎性因子水平上调[28]。本试验中,TNF-α刺激导致TNF-α和IL-8的mRNA表达量显著上升,表明TNF-α诱导了IPEC-1细胞的炎症反应。与本试验结果类似,Zhu等[29]研究发现,炎性细胞因子如TNF-α和IL-8的大量产生,会导致肠道结构与功能的损伤。Xiao等[26]的研究显示,在培养基中加入浓度为20 ng/mL的TNF-α可降低IPEC-J2细胞中Occludin和ZO-1的蛋白表达量。在细胞方面,Mankertz等[10]研究发现,TNF-α刺激导致HT-29/B6细胞的通透性增大,引起跨膜电位改变,使细胞对细菌、病毒、霉菌毒素等的屏障作用减弱。Al-Sadi等[11]的研究也显示,TNF-α刺激导致Caco-2细胞紧密连接蛋白ZO-1和Occludin的mRNA表达量下降。
大量证据表明,促炎细胞因子TNF-α与包括肠上皮细胞在内的各种细胞类型的肠屏障功能障碍有关。TNF-α导致细胞膜的通透性增大,使细胞对病原的抵抗力下降,病原入侵机体后,不仅会降低肠道对营养物质的利用率,还会引起肠道疾病的发生。因此,建立肠上皮细胞损伤模型,并探究肠道细胞受损后的分子机制,不仅对改善动物的肠道健康具有重要的参考价值,还可为人类炎症性肠病的治疗提供理论依据。
4 结论TNF-α可导致IPEC-1细胞活力下降,LDH活性上升,炎性细胞因子IL-8和TNF-α的mRNA表达量显著升高。综合考虑各指标,可采用40 ng/mL TNF-α刺激IPEC-1细胞48 h构建IPEC-1细胞损伤模型。
| [1] |
KOLODZIEJ L E, LODOLCE J P, CHANG J E, et al. TNFAIP3 maintains intestinal barrier function and supports epithelial cell tight junctions[J]. PLoS One, 2011, 6(10): e26352. DOI:10.1371/journal.pone.0026352 |
| [2] |
WANG Z L, WANG L, CHEN Z, et al. In vitro evaluation of swine-derived lactobacillus reuteri:probiotic properties and effects on intestinal porcine epithelial cells challenged with enterotoxigenic Escherichia coli K88[J]. Journal of Microbiology and Biotechnology, 2016, 26(6): 1018-1025. DOI:10.4014/jmb.1510.10089 |
| [3] |
BLIKSLAGER A T, MOESER A J, GOOKIN J L, et al. Restoration of barrier function in injured intestinal mucosa[J]. Physiological Reviews, 2007, 87(2): 545-564. DOI:10.1152/physrev.00012.2006 |
| [4] |
KILLAR L, WHITE J, BLACK R, et al. Adamalysins:a family of metzincins including TNF-α converting enzyme (TACE)[J]. Annals of the New York Academy of Sciences, 1999, 878(1): 442-452. DOI:10.1111/j.1749-6632.1999.tb07701.x |
| [5] |
KITANO K, RIVAS C I, BALDWIN G C, et al. Tumor necrosis factor dependent production of human immunedeficiency virus 1 in chronically infected Hl-60 cells[J]. Blood, 1993, 82(9): 2742-2748. DOI:10.1182/blood.V82.9.2742.2742 |
| [6] |
张晶, 钟武, 李松. TNF-α抑制剂的研究进展[J]. 中国药物化学杂志, 2010, 20(4): 310-318, 329. |
| [7] |
WANG J, HU Y, DENG W W, et al. Negative regulation of Toll-like receptor signaling pathway[J]. Microbes and Infection, 2009, 11(3): 321-327. DOI:10.1016/j.micinf.2008.12.011 |
| [8] |
SHAM H P, YU E Y S, GULEN M F, et al. SIGIRR, a negative regulator of TLR/IL-1R signalling promotes microbiota dependent resistance to colonization by enteric bacterial pathogens[J]. PLoS Pathogens, 2013, 9(8): e1003539. DOI:10.1371/journal.ppat.1003539 |
| [9] |
LIU Y L, CHEN F, ODLE J, et al. Fish oil enhances intestinal integrity and inhibits TLR4 and NOD2 signaling pathways in weaned pigs after LPS challenge[J]. The Journal of Nutrition, 2012, 142(11): 2017-2024. DOI:10.3945/jn.112.164947 |
| [10] |
MANKERTZ J, AMASHEH M, KRUG S M, et al. TNFα up-regulates Claudin-2 expression in epithelial HT-29/B6 cells via phosphatidylinositol-3-kinase signaling[J]. Cell and Tissue Research, 2009, 336(1): 67-77. DOI:10.1007/s00441-009-0751-8 |
| [11] |
AL-SADI R, GUO S H, YE D M, et al. TNF-α modulation of intestinal epithelial tight junction barrier is regulated by ERK1/2 activation of ELK-1[J]. The American Journal of Pathology, 2013, 183(6): 1871-1884. DOI:10.1016/j.ajpath.2013.09.001 |
| [12] |
FIELD F J, WATT K, MATHUR S N. TNF-α decreases ABCA1 expression and attenuates HDL cholesterol efflux in the human intestinal cell line Caco-2[J]. Journal of Lipid Research, 2011, 51(6): 1407-1415. |
| [13] |
ZHAO H L, KUANG L, HE J J, et al. Role of tumor necrosis factor-α in vascular hyporeactivity following endotoxic shock and its mechanism[J]. Journal of Trauma and Acute Care Surgery, 2019, 87(6): 1346-1353. DOI:10.1097/TA.0000000000002490 |
| [14] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [15] |
李红艳, 夏启胜, 徐梅, 等. MTT MTS WST-1在细胞增殖检测中最佳实验条件的研究[J]. 中国康复医学杂志, 2005, 20(11): 824-826. |
| [16] |
TANG Y L, TAN B, XIONG X, et al. Methionine deficiency reduces autophagy and accelerates death in intestinal epithelial cells infected with enterotoxigenic Escherichia coli[J]. Amino Acids, 2015, 47(10): 2199-2204. DOI:10.1007/s00726-014-1781-4 |
| [17] |
LEGRAND C, BOUR J M, JACOB C, et al. Lactate dehydrogenase (LDH) activity of the number of dead cells in the medium of cultured eukaryotic cells as marker[J]. Journal of Biotechnology, 1992, 25(3): 231-243. |
| [18] |
ZHANG J W, LU Y, WEI J A, et al. Protective effect of carboxytmethylpachymaran on TNF-α-induced damage in Caco-2 cell monolayers[J]. International Journal of Biological Macromolecules, 2016, 93: 506-511. DOI:10.1016/j.ijbiomac.2016.07.095 |
| [19] |
MCCLAIN C J, HILL D B, SONG Z Y, et al. S-adenosylmethionine, cytokines, and alcoholic liver disease[J]. Alcohol, 2002, 27(3): 185-192. |
| [20] |
倪虹, 李继坤, 房洁, 等. 大黄酸对肿瘤坏死因子α所致胰腺细胞损伤的保护作用[J]. 中国中西医结合消化杂志, 2001, 9(3): 139-140. |
| [21] |
TANG J Y, CAO L, JIA G, et al. The protective effect of selenium from heat stress-induced porcine small intestinal epithelial cell line (IPEC-J2) injury is associated with regulation expression of selenoproteins[J]. British Journal of Nutrition, 2019, 122(10): 1081-1090. DOI:10.1017/S0007114519001910 |
| [22] |
孙博云, 王师英, 胡鸿毅. 肠黏膜通透性改变与炎症性肠病关系的研究进展[J]. 中国中西医结合消化杂志, 2016, 24(11): 891-894. |
| [23] |
XIA L, DAI L, ZHU L Q, et al. Proteomic analysis of IPEC-J2 cells in response to coinfection by porcine transmissible gastroenteritis virus and enterotoxigenic Escherichia coli K88[J]. Proteomics Clinical Applications, 2017, 11(11/12): 1600137. DOI:10.1002/prca.201600137 |
| [24] |
BRUEWER M, LUEGERING A, KUCHARZIK T, et al. Proinflammatory cytokines disrupt epithelial barrier function by apoptosis independent mechanisms[J]. The Journal of Immunology, 2003, 171(11): 6164-6172. DOI:10.4049/jimmunol.171.11.6164 |
| [25] |
WANG F J, GRAHAM W V, WANG Y M, et al. Interferon-γ and tumor necrosis factor-α synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression[J]. The American Journal of Pathology, 2005, 166(2): 409-419. DOI:10.1016/S0002-9440(10)62264-X |
| [26] |
XIAO K, CAO S T, JIAO L F, et al. TGF-β1 protects intestinal integrity and influences Smads and MAPK signal pathways in IPEC-J2 after TNF-α challenge[J]. Innate Immunity, 2017, 23(3): 276-284. DOI:10.1177/1753425917690815 |
| [27] |
宋红丽, 吕飒, 马力, 等. TNF-α影响肠黏膜上皮细胞间紧密连接蛋白的表达[J]. 世界华人消化杂志, 2004, 12(6): 1303-1306. |
| [28] |
THEJASS P, KUTTAN G. Inhibition of endothelial cell differentiation and proinflammatory cytokine production during angiogenesis by allyl isothiocyanate and phenyl isothiocyanate[J]. Integrative Cancer Therapies, 2007, 6(4): 389-399. DOI:10.1177/1534735407309084 |
| [29] |
ZHU H L, LIU Y L, XIE X L, et al. Effect of L-arginine on intestinal mucosal immune barrier function in weaned pigs after Escherichia coli LPS challenge[J]. Innate Immunity, 2013, 19(3): 242-252. DOI:10.1177/1753425912456223 |




