益生菌被世界卫生组织定义为“当摄入足够数量时能给宿主带来健康益处的活的微生物”[1]。该定义明确指出益生菌是“活的”微生物。虽然益生菌有益宿主健康的作用已得到广泛认可,但是随着研究与应用地不断深入,一些公共卫生安全问题逐渐凸显,包括引起感染性疾病的发生[1]、抗生素耐药基因传递[2-3]以及致病菌污染[3]。为了确保益生菌制剂的安全性,除了严格监管益生菌制剂的质量以外,应该合理开发利用益生菌的灭活菌。灭活菌不需要定植就能发挥作用,不但在运输、贮存和保质期等方面具有突出优点,更重要的是灭活菌不存在细菌易位、耐药性基因传递或者致病菌污染等严重安全隐患。但是,益生菌经过灭活处理之后,某些理化特性会发生改变[4],可能影响到其生物学功能。因此,很有必要对灭活菌与其活菌的益生特性进行对比研究。
免疫调节功能是益生菌的重要特性之一[5-8]。肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α)和白细胞介素(interleukin, IL)-10是介导细胞免疫和体液免疫平衡的细胞因子,在调节机体免疫稳态中起关键作用[9-10]。TNF-α是巨噬细胞在免疫应答初期迅速分泌的一种促炎细胞因子。适量的TNF-α有利于活化免疫系统并抵抗病原体感染,但是过量的TNF-α则引发过度炎症反应而损伤组织[9]。IL-10则是巨噬细胞分泌的一种抗炎细胞因子,与TNF-α的作用相反,具有抑制巨噬细胞活化而防止过度促炎应答的作用[10-11]。因此,维持TNF-α/IL-10平衡对免疫稳态至关重要。很多研究表明,不但益生菌的活菌形式能诱导免疫细胞表达或分泌多种细胞因子[5, 7, 12-14],而且热灭活菌形式同样也能够刺激细胞因子的分泌[7],有的菌株热灭活之后的作用甚至强于其活菌形式[14]。但是也有研究结果表明热灭活菌的免疫活性弱于活菌[12-13]。可见热灭活菌的研究结果很不一致。Giahi等[5]发现,热灭活菌和活菌一样,诱导细胞因子分泌的能力和剂量有关,而且也有菌种和菌株特异性[5]。此外,还有研究发现,有的益生菌活菌及其热灭活菌都能够抑制脂多糖(lipopolysaccharide, LPS)的促炎反应,但是不同器官或者细胞的细胞因子反应不同[15-16]。丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)信号通路是哺乳动物细胞内参与先天免疫应答的重要信号转导通路之一,该通路主要由细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinases, ERK)、p38 MAPK和c-Jun氨基末端激酶(c-Jun NH2-terminal kinases, JNK)3个关键通路组成[17]。研究表明,益生菌的活菌或热灭活菌诱导细胞因子应答都与活化MAPK信号通路有关[18-22],但是益生菌的作用有菌种和菌株特异性,而且同一株益生菌对不同信号通路的影响也不同。上述有关益生菌免疫调节功能的研究目前集中于人用益生菌,未见有关于动物用益生菌的相关研究报道,灭活益生菌及其活菌在调节TNF-α/IL-10平衡方面的研究鲜见。
热灭活的益生肠球菌具有诱导抗炎应答并增强抵抗病原微生物感染的免疫调节功能[23-25]。屎肠球菌是猪生产中最常用的益生菌之一[26]。分离自猪肠道的屎肠球菌活菌可调节仔猪肠黏膜免疫[27],影响肠道菌群组成[28],而且屎肠球菌热灭活菌及其活菌在减少仔猪腹泻以及增强仔猪小肠消化酶活性的作用上差别不显著[29],但是热灭活菌的免疫特性及其与活菌之间的差异尚未清楚。本研究以巨噬细胞RAW264.7细胞进行体外试验,对比研究屎肠球菌活菌和热灭活菌在诱导TNF-α和IL-10产生及关键影响因素、调节TNF-α/IL-10平衡的能力、恢复由LPS引起的TNF-α/IL-10失衡的功能以及对MAPK信号通路的影响等方面的差别,旨在为掌握益生菌屎肠球菌热灭活菌的免疫特性及其与活菌的差异,从而为今后合理开发利用动物用益生菌提供科学参考。
1 材料与方法 1.1 试验材料屎肠球菌菌株由浙江大学动物科学学院微生物与基因工程实验室惠赠;RAW264.7细胞系(TIB-71TM)购自中国科学院典型培养物保藏委员会细胞库;蛋白胨(peptone,CM0009)和酵母浸粉(yeast extract,LP0021)购自英国OXOID公司;MRS培养基的其他成分购自北京索莱宝科技有限公司;DMEM细胞基础培养基(Dulbecco’s modified Eagle’s medium, R15-017-CV)、胎牛血清(FBS, 10091148)、磷酸盐缓冲液(PBS, 14190250)和台盼蓝(trypan blue, 15250061)购自美国Giobco公司;二甲基亚砜(DMSO, D4540)和LPS(L4391)购自美国Sigma公司;青霉素-链霉素溶液(penicillin-streptomycin solution, 100×, C0222)、Western及IP细胞裂解液(cell lysis buffer for Western and IP, P0013)、细胞因子小鼠TNF-α酶联免疫吸附测定(ELISA)试剂盒(mouse TNF-α ELISA kit, PT512)和小鼠IL-10 ELISA试剂盒(mouse IL-10 ELISA kit, PI522)、二喹啉甲酸(BCA)蛋白浓度测定试剂盒(BCA protein assay kit, P0011)、Western blot相关试剂、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)小鼠单克隆抗体(mouse GAPDH monoclonal antibody, AF0006)、辣根过氧化物酶(horseradish peroxidase, HRP)标记山羊抗小鼠免疫球蛋白G(IgG)(HRP-labeled goat anti-mouse IgG, A0216)(H+L)、HRP标记山羊抗兔IgG(HRP-labeled goat anti-rabbit IgG, A0208)(H+L)、磷酸化ERK1(Thr202/Tyr204)/ERK2(Thr185/Tyr187)兔单克隆抗体[(phospho-ERK1 (Thr202/Tyr204)/ERK2 (Thr185/Tyr187) rabbit monoclonal antibody, AF1891]、磷酸化p38 MAPK小鼠单克隆抗体(phospho-p38 MAPK mouse monoclonal antibody, AM063)、磷酸化JNK/应激活化蛋白激酶(stress-activated protein kinase, SAPK)小鼠单克隆抗体(phospho-JNK/SAPK mouse monoclonal antibody, AJ516)购自上海碧云天生物技术有限公司;CCK-8细胞增殖与细胞毒性检测试剂盒(TransDetectⓇ cell counting kit, FC101-02)购自北京全式金生物技术有限公司。
1.2 试验方法 1.2.1 屎肠球菌活菌和热灭活菌的准备将屎肠球菌接种于MRS培养基,在37 ℃恒温培养箱静止培养24 h,用比浊法结合平板菌落计数法检测活菌浓度。将菌液在4 ℃、3 000 r/min离心15 min,用无菌PBS(pH=7.4)洗涤3次,再用PBS重悬并调整浓度为2×1010 CFU/mL(OD600 nm=1.2),然后分为2份。其中一份保存于4 ℃备用,另一份用于制备热灭活菌。用于制备热灭活菌的菌悬液放入100 ℃水浴中加热30 min[23],冷却后保存于4 ℃备用。菌悬液灭活后立即取样,用无菌PBS(pH=7.4)稀释涂布MRS琼脂平板,在37 ℃恒温培养箱静止培养48 h,检测灭活效果。如果平板没有菌落长出,则表明灭活成功[13]。在进行细胞试验时,用DMEM细胞基础培养基将活菌和热灭活菌分别稀释到相应的浓度。
1.2.2 RAW264.7细胞的培养和传代将RAW264.7细胞用DMEM细胞完全培养液(即DMEM细胞基础培养基90 mL+胎牛血清10 mL+青霉素100 U/mL和链霉素100 μg/mL)在37 ℃、5% CO2培养箱中培养,当细胞汇合达80%~90%时进行传代[15]。
1.2.3 屎肠球菌的类型、剂量和作用时间对TNF-α/IL-10平衡影响的试验[15, 30]采用CCK-8法检测不同剂量的屎肠球菌活菌或热灭活菌对RAW264.7细胞活力的影响,确定后续试验的适宜细菌与细胞比率。将RAW264.7细胞培养至汇合达80%~90%时进行传代铺板。用DMEM细胞完全培养液调整细胞密度为5×105个/mL,在6孔板中每孔加细胞悬液和DMEM细胞完全培养液各1 mL,放入37 ℃、5% CO2培养箱中孵育24 h,去上清,用PBS洗涤2次,然后根据3因素2水平设计试验方案。因素1和水平:屎肠球菌类型,活菌或灭活菌;因素2和水平:剂量,106或108 CFU/mL;因素3和水平:作用时间,3或6 h。在3和6 h作用时间下分别设置阴性对照(DMEM细胞基础培养液,即不含血清、不含抗生素)和阳性对照(LPS,2 μg/mL)。试验共设12个组(表 1),每个组各设6个重复。各组的细胞都在37 ℃、5% CO2培养箱中孵育。试验结束后,将细胞培养板放置于冰上,马上收集各个组的细胞培养上清,并将上清于4 ℃、6 000 r/min离心10 min去除颗粒物质,然后-40 ℃保存,待检测细胞因子含量。
|
|
表 1 分组方案 Table 1 Grouping scheme |
细胞传代铺板方法同1.2.3。细胞在6孔板中于37 ℃、5% CO2培养箱中孵育24 h后,去上清,用PBS洗涤2次。试验设8个组。在每孔中加入DMEM细胞基础培养基(即不含血清、不含抗生素)各1 mL,在对照组中加入DMEM细胞基础培养基1 mL/孔,在LPS组中加LPS(2 μg/mL)1 mL/孔,将细胞放入37 ℃、5% CO2培养箱中共孵育3 h。在LB-LPS或HB-LPS组中,先用屎肠球菌活菌(106 CFU/mL)或热灭活菌(106 CFU/mL)处理细胞3 h,再用LPS(2 μg/mL)处理3 h;在LPS-LB或LPS-HB组中,先用LPS(2 μg/mL)处理细胞3 h,再用屎肠球菌活菌(106 CFU/mL)或热灭活菌(106 CFU/mL)处理3 h;在LPS+LB或LPS+HB组中,同时用LPS(2 μg/mL)和屎肠球菌活菌(106 CFU/mL)或LPS(2 μg/mL)和热灭活菌(106 CFU/mL)共处理细胞3 h。所有组各设6个重复,细胞培养条件一致(37 ℃、5% CO2)。试验结束后,立即收集和处理上清,方法同1.2.3。
1.2.5 ELISA法检测细胞因子含量[15]将1.2.3和1.2.4中收集并经离心处理的细胞培养上清用ELISA法检测细胞因子TNF-α和IL-10的含量,分别根据相应试剂盒的说明书进行操作。
1.2.6 Western blot检测MAPK信号通路关键蛋白的相对表达量[21, 31]将1.2.4试验的细胞培养上清采集完成之后,把细胞培养板保留在冰上,立即用预冷的PBS轻轻洗涤细胞2次,然后用含蛋白酶和磷酸酶抑制剂的Western及IP细胞裂解液裂解细胞,-80 ℃保存。细胞裂解样品在2周内在干冰条件下寄送上海碧云天生物技术有限公司检测磷酸化ERK(p-ERK)、磷酸化p38(p-p38)和磷酸化JNK(p-JNK)的蛋白相对表达量。细胞裂解样品首先于14 000 r/min离心10 min,收集上清,用BCA法测定细胞样品的蛋白质浓度。将细胞样品蛋白质浓度调整到相同水平,加入十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白质上样缓冲液,100 ℃水浴加热10 min使蛋白质充分变性。样本冷却后进行SDS-PAGE(150 V,40 min),然后转移至聚偏二氟乙烯(PVDF)膜(300 mA,冰浴60 min)。随后依次进行封闭(37 ℃、1.5 h);一抗孵育(4 ℃过夜)和二抗孵育(室温2 h)。最后将清洗后的PVDF膜用化学发光试剂(ECL)进行显色。
1.3 数据处理与分析数据以平均值±标准差表示,采用SPSS 19.0统计软件对所有组间数据进行单因素方差分析(one-way ANOVA)和Duncan氏法多重比较;此外,用一般线性模型单变量方法分析1.2.3试验的屎肠球菌类型、剂量和作用时间的主效应以及它们的交互效应,以P<0.05为显著水平,P<0.01为极显著水平。Western blot结果用Quantity One v4.6.6软件进行定量分析,以GAPDH为内参蛋白计算目的蛋白相对表达量,最后结果以各试验组与对照组的比值表示。
2 结果与分析 2.1 屎肠球菌活菌和热灭活菌对RAW264.7细胞分泌TNF-α和IL-10以及TNF-α/IL-10平衡的不同影响屎肠球菌类型、剂量和作用时间对RAW264.7细胞分泌TNF-α和IL-10以及TNF-α/IL-10平衡的影响见表 2和表 3。
|
|
表 2 屎肠球菌的类型、剂量和作用时间影响TNF-α和IL-10含量以及TNF-α/IL-10比值的主效应和交互效应 Table 2 Main effects and interaction effects of Enterococcus faecium's type, dose and duration time on TNF-α and IL-10 contents and TNF-α/IL-10 ratio |
|
|
表 3 屎肠球菌活菌和热灭活菌对RAW264.7细胞TNF-α和IL-10含量以及TNF-α/IL-10平衡的影响 Table 3 Effects of viable and heat-inactivated Enterococcus faecium on TNF-α and IL-10 contents and TNF-α/IL-10 balance in RAW264.7 cells |
从表 2可以看出,屎肠球菌的类型(下文简称“菌型”,即活菌或灭活菌)、剂量(106或108 CFU/mL)以及作用时间(3或6 h)3种因素对TNF-α产量的影响均有极显著的主效应(P<0.01);此外,菌型与剂量,菌型与作用时间,菌型、剂量与作用时间之间都存在极显著的交互效应(P<0.01)。对于IL-10含量的影响,剂量和作用时间对其均有极显著的主效应(P<0.01),而且剂量与作用时间之间存在极显著的交互效应(P<0.01)。菌型和剂量对TNF-α/IL-10比值的影响均有极显著的主效应(P<0.01),并且菌型与剂量、剂量与作用时间之间表现出了极显著的交互效应(P<0.01)。
从表 3可以看出,不同处理对TNF-α和IL-10含量以及TNF-α/IL-10比值均产生了极显著影响(P<0.01)。LPS刺激RAW264.7细胞分泌大量的TNF-α,但是不能同时刺激等比例的IL-10释放,因此导致TNF-α/IL-10比值严重失衡。屎肠球菌活菌极显著诱导了TNF-α的分泌(P<0.01),但是仅在剂量为106 CFU/mL且作用3 h(LB1-1组)才能极显著提高IL-10的含量(P<0.01),因此导致活菌对TNF-α/IL-10比值的影响显著或极显著(P<0.05或P<0.01)。热灭活菌也显著或极显著促进TNF-α分泌(P<0.05或P<0.01),但作用弱于活菌(P<0.01),对IL-10的调节作用则与活菌一致(P>0.05),而对TNF-α/IL-10比值的影响极显著小于相同条件的活菌(P<0.01);剂量为106 CFU/mL且与作用3 h(HB1-1组)时TNF-α/IL-10比值与对照组(C-1、C-2组)无显著差异(P>0.05)。
结果表明,菌型、剂量、作用时间中的1个或多个因素显著影响TNF-α或IL-10含量以及TNF-α/IL-10的平衡,3个因素的两两或三者之间的交互效应因细胞因子而异。热灭活菌诱导TNF-α分泌的能力比活菌弱,而对IL-10含量的影响与活菌相似,对TNF-α/IL-10平衡的影响小于相同条件的活菌。低剂量热灭活菌在作用时间较短时能维持TNF-α/IL-10平衡。
2.2 屎肠球菌活菌和热灭活菌对LPS刺激RAW264.7细胞分泌TNF-α和IL-10以及TNF-α/IL-10失衡的不同调节作用用屎肠球菌活菌或热灭活菌预处理巨噬细胞之后再用LPS刺激;或先用LPS处理巨噬细胞,再与屎肠球菌活菌或热灭活菌共孵育;或用屎肠球菌活菌或热灭活菌与LPS共同处理巨噬细胞,各处理对TNF-α和IL-10含量以及TNF-α/IL-10平衡的影响如表 4所示。
|
|
表 4 屎肠球菌活菌和热灭活菌对LPS刺激RAW264.7细胞TNF-α和IL-10含量以及TNF-α/IL-10平衡的影响 Table 4 Effects of viable or heat-inactivated Enterococcus faecium on LPS-induced TNF-α and IL-10 contents and TNF-α/IL-10 balance in RAW264.7 cells |
从表 4可以看出,LPS组的TNF-α含量比对照组提高260.68%(P<0.01),而IL-10含量与对照组相比没有显著变化(P>0.05),TNF-α/IL-10比值比对照组升高2.65倍(P<0.01)。HB-LPS组TNF-α含量比LPS组减少79.54%(P<0.01),其他试验组与LPS组相比均没有显著变化(P>0.05);LB-LPS、LPS-LB和LPS+LB组的IL-10含量分别比LPS组提高78.24%(P<0.01)、402.59%(P<0.01)和44.60%(P<0.01),其他组与LPS组相比均没有显著变化(P>0.05)。
从表 4可以看出,LB-LPS、LPS-LB、LPS+LB和HB-LPS组的TNF-α/IL-10比值分别比LPS组下降43.74%(P<0.01)、80.00%(P<0.01)、30.80%(P<0.01)和72.46%(P<0.01),其中LPS-LB和HB-LPS组与对照组没有显著差异(P>0.05);而LPS-HB组的TNF-α/IL-10比值与LPS组无显著差异(P>0.05),但LPS+HB组却极显著高于LPS组(P<0.01)。
结果表明,LPS引起强烈的促炎反应,严重破坏TNF-α/IL-10平衡,而屎肠球菌活菌和热灭活菌分别通过促进IL-10分泌和抑制TNF-α释放来抵抗LPS对TNF-α/IL-10平衡的破坏作用,且经热灭活菌预处理的细胞能够完全保持TNF-α/IL-10平衡。
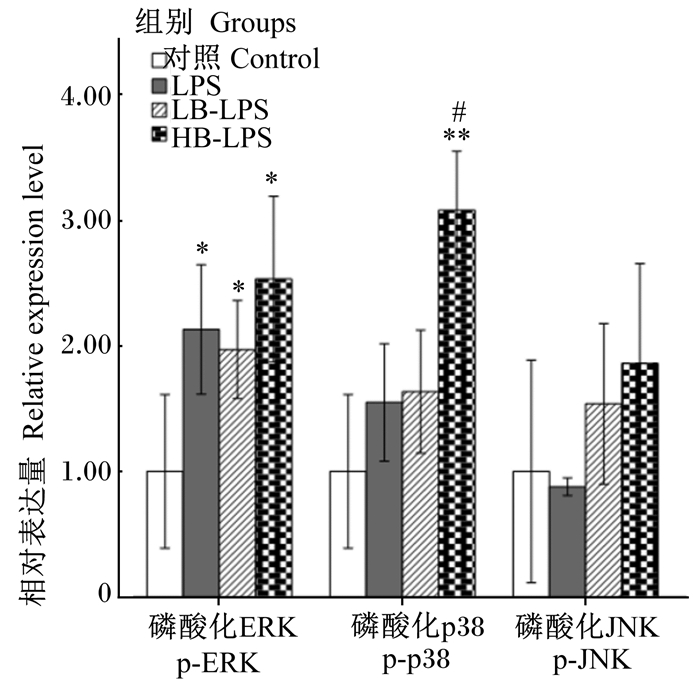
2.3 屎肠球菌活菌和热灭活菌预处理RAW264.7细胞对LPS活化MAPK信号通路的不同影响RAW264.7细胞用屎肠球菌活菌或热灭活菌预处理之后,再用LPS刺激,细胞的p-ERK、p-p38以及p-JNK蛋白的相对表达量见图 1。
|
*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异极显著(P<0.01),#表示与LPS组相比差异显著(P<0.05)。 The bar with * showed significant difference compared with control group (P < 0.05), the bar with * * showed extremely significant difference compared with control group (P < 0.01), and the bar with # showed significant difference compared with LPS group (P < 0.05). 图 1 屎肠球菌活菌或热灭活菌预处理RAW264.7细胞对LPS活化MAPK信号通路的影响 Fig. 1 Effects of pretreatment with viable or heat-inactivated Enterococcus faecium on LPS activated MAPK signaling pathway in RAW264.7 cells |
从图 1可以看出,与对照组相比,LPS、LB-LPS和HB-LPS组的p-ERK蛋白相对表达量显著上调(P<0.05),但是LB-LPS和HB-LPS组与LPS组差异不显著(P>0.05);此外,HB-LPS组的p-p38蛋白相对表达量较对照组极显著增加(P<0.01),较LPS组显著增加(P<0.05);其他各组间各磷酸化蛋白相对表达量均没有显著变化(P>0.05)。结果表明,屎肠球菌活菌和热灭活菌预处理巨噬细胞对LPS活化ERK信号通路没有显著影响,但是热灭活菌预处理巨噬细胞极显著促进了LPS活化p38 MAPK信号通路。
3 讨论 3.1 屎肠球菌活菌或热灭活菌对TNF-α和IL-10分泌的诱导作用以及对TNF-α/IL-10平衡的影响很多益生菌菌株能够诱导TNF-α和IL-10的分泌或表达[5-6, 8, 12, 32-33],但是影响益生菌作用效果的关键因素尚未明确,可能与剂量[21]或作用时间有关[12-13]。益生菌活菌和灭活菌免疫特性的差别在不同的研究结果[7, 12-14]中不太一致。到目前为止,益生菌对TNF-α/IL-10平衡的影响鲜有报道。本试验发现,屎肠球菌活菌和热灭活菌对TNF-α分泌的诱导作用有显著差别,前者作用更强,这与在干酪乳杆菌[13]以及植物乳杆菌[30]上的研究结果一致。灭活菌的免疫活性物质只有细胞壁的结构成分,而活菌中除了细胞壁之外,还有多种代谢产物[21, 23, 30],这可能是活菌作用更强的原因。本试验结果表明,屎肠球菌活菌和热灭活菌对IL-10分泌的调节作用却是相似的,都是只在低剂量且作用时间短时具有促进作用。然而,益生菌对IL-10分泌的影响作用在不同文献中的结果不太一致。戊糖乳杆菌活菌诱导巨噬细胞产生高水平的IL-10[8],而干酪乳杆菌活菌却不诱导IL-10分泌[12]或者作用很弱[21]。热灭活的鼠李糖乳杆菌也能够诱导人单核细胞分泌高水平的IL-10[5],而热灭活的德氏乳杆菌对IL-10分泌的诱导作用不显著[5]。由此可见,不管是活菌还是灭活菌,诱导IL-10分泌的能力都与菌种关系密切。Kaji等[21]发现,植物乳杆菌磷壁酸的类型与IL-10诱导作用的强弱有关。磷壁酸是革兰氏阳性菌细胞壁的结构成分,是一种重要的免疫刺激物,其分子结构因菌株而异[34]。综上所述,益生菌免疫调节作用的菌株特异性可能与其细胞壁成分关系密切。
TNF-α/IL-10平衡与否与机体的免疫稳态和健康状态密切相关[35-37]。本试验发现,屎肠球菌热灭活菌对TNF-α/IL-10平衡的影响小于相同条件的活菌,且低剂量热灭活菌在作用时间较短时能维持TNF-α/IL-10平衡。由此可见,单独使用屎肠球菌热灭活菌可能比活菌更有利于维持免疫稳态。但是屎肠球菌热灭活菌在生产中的实际效果还有待于动物试验予以证实。本试验结果表明,屎肠球菌的类型(活菌/热灭活菌)、剂量和作用时间中的一种或多种因素是影响TNF-α和IL-10含量以及TNF-α/IL-10比值的主效应因素,而且它们之间还具有交互效应。综上所述,在实际应用屎肠球菌时,如果关注其免疫调节效果,则需要明确菌的死活,同时考虑剂量和作用时间。益生菌应用效果不稳定,可能与使用者没有充分考虑上述关键因素有关。
3.2 屎肠球菌活菌和热灭活菌对LPS引起的TNF-α和IL-10分泌以及TNF-α/IL-10失衡的调节作用具有抗炎活性的物质抑制LPS促炎反应的机理与其提高IL-10产量同时抑制TNF-α释放有关[38]。益生菌能够减弱LPS诱导的炎症应答,但是对TNF-α和IL-10分泌的调节作用因试验[15-16, 39]而异。本试验结果表明,屎肠球菌活菌不管是采用预处理巨噬细胞还是在LPS刺激之后再处理细胞,或者与LPS同时处理细胞,这3种方式都能够极显著促进IL-10分泌,与Li等[16]报道的在鼠李糖乳杆菌上的研究结果一致,但是与Oh等[15]以及Peña等[39]报道的鼠李糖乳杆菌和格氏乳杆菌不影响或者减少IL-10分泌的试验结果不同。本试验结果还表明,屎肠球菌热灭活菌通过抑制TNF-α释放来抵抗LPS的促炎反应,与热灭活[16]或者紫外线灭活[39]的鼠李糖乳杆菌不影响TNF-α分泌的研究结果不同。本试验使用的菌株、剂量、作用时间及作用对象和其他试验都不同,这可能是造成研究结果不同的主要原因。导致不同菌株作用各异的原因可能与它们各自独特的免疫活性物质有关。屎肠球菌的免疫活性物质还有待深入研究。此外,采用不同的灭活方式,如热处理、紫外照射或者化学试剂处理等,对菌株的理化特性会产生不同的影响,从而可能导致死菌的免疫特性发生改变[4]。尽管如此,本试验和前人试验研究结果都证实了益生菌可以通过抑制TNF-α分泌或者促进IL-10释放来缓解LPS的促炎作用。
本试验还发现,屎肠球菌活菌和热灭活菌都能抵抗LPS对TNF-α/IL-10平衡的破坏作用,其中活菌通过提高IL-10的分泌量来促进平衡恢复,这与Peña等[39]报道的鼠李糖乳杆菌活菌通过抑制TNF-α分泌来纠正失衡状态的结果不一致,其原因可能与试验用的菌株不同有关。灭活益生菌在这方面的研究尚未见有报道。本试验发现,虽然热灭活屎肠球菌不影响IL-10的分泌,在LPS刺激之后再处理巨噬细胞也不能左右TNF-α/IL-10平衡失调,甚至当采用热灭活菌与LPS同时处理巨噬细胞时,反而加剧了TNF-α/IL-10失衡程度。相关原因有待进一步研究。然而,采用热灭活菌预处理巨噬细胞的方式却能够显著抑制TNF-α的释放,并且能够使巨噬细胞的TNF-α/IL-10平衡不受LPS干扰。由此可见,用屎肠球菌热灭活菌预处理巨噬细胞能够达到很好的抗炎效果。但是,在实际应用中的具体作用还需要动物试验来确定。
3.3 屎肠球菌活菌和热灭活菌预处理RAW264.7细胞对LPS活化MAPK信号通路的影响Martin等[40]和Kim等[31]报道,脂肪酸结合蛋白或益生菌的脂磷壁酸都可以通过抑制ERK、p38和JNK蛋白的磷酸化作用来阻止TNF-α基因表达,减少TNF-α分泌,从而下调LPS促炎反应。但是,不同的研究结果不一致。Kozicky等[38]研究发现,用抗炎活性物质与LPS共同刺激人外周血单核细胞时,引起IL-10分泌量增加和TNF-α释放量减少,与磷酸化ERK和p38蛋白的表达量上调有关。这与本试验用屎肠球菌热灭活菌预处理巨噬细胞能够促进LPS诱导p38蛋白磷酸化并显著抑制TNF-α分泌的结果一致。但是,屎肠球菌活菌预处理巨噬细胞能够促进IL-10释放,却不影响ERK、p38和JNK蛋白的磷酸化,可能的原因是屎肠球菌活菌活化了MAPK以外的其他信号通路来诱导IL-10分泌,或者试验所采用的处理时间不合适导致蛋白的表达不明显。Iyer等[41]报道,Janus激酶/信号转导与转录激活子(Janus kinase/signal transducer and activator of tranions, JAK-STAT)信号通路参与LPS诱导巨噬细胞的IL-10转录。该信号通路是否也参与屎肠球菌活菌调节IL-10的生成有待进一步研究。Kaji等[21]和Kim等[42]研究结果提示,益生菌和LPS活化ERK、p38和JNK蛋白通路的效果受作用时间影响,而且这3种蛋白的最佳作用时间不同,作用时间过长或过短都会减弱活化效果。此外,不同益生菌菌种的最佳作用时间也不同。本试验只选择了1个作用时间点,该时间点很有可能不是屎肠球菌活菌或热灭活菌以及LPS对MAPK信号通路的最佳刺激时间。因此,屎肠球菌活菌或热灭活菌对LPS活化RAW264.7细胞MAPK信号通路的确切影响还有待进一步摸索适宜作用时间。另外,核因子-κB(nuclear factor-κB,NF-κB)信号通路是调节细胞因子分泌的另外一个重要通路[43],而且益生菌调节的细胞因子种类很多,而本试验只检测了TNF-α和IL-10,未能全面了解受影响的细胞因子谱。因此,屎肠球菌活菌和热灭活菌是否活化了NF-κB信号通路以及还影响哪些细胞因子分泌,也需要进一步研究。
4 结论① 屎肠球菌的类型和剂量是影响TNF-α/IL-10平衡的主要因素,且类型与剂量、剂量与作用时间之间都有交互效应,低剂量热灭活菌且作用时间短才有利于维持TNF-α/IL-10平衡。
② 屎肠球菌活菌与热灭活菌以不同方式减轻LPS引起的TNF-α/IL-10失衡,但它们对MAPK信号通路的确切影响还有待进一步研究确定。
致谢:
感谢浙江大学动物科学学院李卫芬研究员给予本试验构思的建议。
| [1] |
BOYLE R J, ROBINS-BROWNE R M, TANG M L K. Probiotic use in clinical practice:what are the risks[J]. The American Journal of Clinical Nutrition, 2006, 83(6): 1256-1264. DOI:10.1093/ajcn/83.6.1256 |
| [2] |
BACCOURI O, BOUKERB A M, BEN FARHAT L, et al. Probiotic potential and safety evaluation of Enterococcus faecalis OB14 and OB15, isolated from traditional tunisian testouri cheese and rigouta, using physiological and genomic analysis[J]. Frontiers Microbiology, 2019, 10: 881. DOI:10.3389/fmicb.2019.00881 |
| [3] |
FU S Z, YANG Q, HE F L, et al. National safety survey of animal-use commercial probiotics and their spillover effects from farm to humans:an emerging threat to public health[J]. Clinical Infectious Diseases, 2019, 70(11): 2386-2395. DOI:10.1093/cid/ciz642 |
| [4] |
MARKOWICZ C, KUBIAK P, GRAJEK W, et al. Inactivation of Lactobacillus rhamnosus GG by fixation modifies its probiotic properties[J]. Canadian Journal of Microbiology, 2016, 62(1): 72-82. DOI:10.1139/cjm-2015-0249 |
| [5] |
GIAHI L, ELMADFA I, HOSEINI M, et al. Heat-inactivated Lactobacillus rhamnosus and Lactobacillus delbrueckii induce efficient maturation and differential cytokine production in human monocyte derived dendritic cells[J]. Food and Agricultural Immunology, 2013, 24(1): 95-109. DOI:10.1080/09540105.2011.651445 |
| [6] |
UCHINAKA A, AZUMA N, MIZUMOTO H, et al. Anti-inflammatory effects of heat-killed Lactobacillus plantarum L-137 on cardiac and adipose tissue in rats with metabolic syndrome[J]. Scientific Reports, 2018, 8: 8156. DOI:10.1038/s41598-018-26588-x |
| [7] |
MAKIOKA Y, TSUKAHARA T, IJICHI T, et al. Oral supplementation of Bifidobacterium longum strain BR-108 alters cecal microbiota by stimulating gut immune system in mice irrespectively of viability[J]. Bioscience, Biotechnology, and Biochemistry, 2018, 82(7): 1180-1187. DOI:10.1080/09168451.2018.1451738 |
| [8] |
KIM J E, SHARMA A, SHARMA G, et al. Lactobacillus pentosus modulates immune response by inducing IL-10 producing TRL cells[J]. Immune Network, 2019, 19(6): e39. DOI:10.4110/in.2019.19.e39 |
| [9] |
CLARK I A. How TNF was recognized as a key mechanism of disease[J]. Cytokine & Growth Factor Reviews, 2007, 18(3/4): 335-343. |
| [10] |
MOORE K W, DE WAAL MALEFYT R, COFFMAN R L, et al. Interleukin-10 and the interleukin-10 receptor[J]. Annual Review of Immunology, 2001, 19: 683-765. DOI:10.1146/annurev.immunol.19.1.683 |
| [11] |
IYER S S, CHENG G H. Role of interleukin 10 transcriptional regulation in inflammation and autoimmune disease[J]. Critical ReviewsTM in Immunology, 2012, 32(1): 23-63. DOI:10.1615/CritRevImmunol.v32.i1.30 |
| [12] |
CROSS M L, GANNER A, TEILAB D, et al. Patterns of cytokine induction by Gram-positive and gram-negative probiotic bacteria[J]. FEMS Immunology & Medical Microbiology, 2004, 42(2): 173-180. |
| [13] |
WANG Y Z, XIE J M, WANG N, et al. Lactobacillus casei Zhang modulate cytokine and Toll-like receptor expression and beneficially regulate poly Ⅰ:C-induced immune responses in RAW264.7 macrophages[J]. Microbiology and Immunology, 2013, 57(1): 54-62. DOI:10.1111/j.1348-0421.516.x |
| [14] |
SHIN R, ITOH Y, KATAOKA M, et al. Anti-tumor activity of heat-killed Lactobacillus plantarum BF-LP284 on Meth-A tumor cells in BALB/c mice[J]. International Journal of Food Sciences and Nutrition, 2016, 67(6): 641-649. DOI:10.1080/09637486.2016.1185771 |
| [15] |
OH N S, JOUNG J Y, LEE J Y, et al. Probiotic and anti-inflammatory potential of Lactobacillus rhamnosus 4B15 and Lactobacillus gasseri 4M13 isolated from infant feces[J]. PLoS One, 2018, 13(2): e0192021. DOI:10.1371/journal.pone.0192021 |
| [16] |
LI N, RUSSELL W M, DOUGLAS-ESCOBAR M, et al. Live and heat-killed Lactobacillus rhamnosus GG:effects on proinflammatory and anti-inflammatory cytokines/chemokines in gastrostomy-fed infant rats[J]. Pediatric Research, 2009, 66(2): 203-207. DOI:10.1203/PDR.0b013e3181aabd4f |
| [17] |
DONG C, DAVIS R J, FLAVELL R A. Map kinases in the immune response[J]. Annual Review of Immunology, 2002, 20: 55-72. DOI:10.1146/annurev.immunol.20.091301.131133 |
| [18] |
KIM S O, SHEIKH H I, HA S D, et al. G-CSF-mediated inhibition of JNK is a key mechanism for Lactobacillus rhamnosus-induced suppression of TNF production in macrophages[J]. Cellular Microbiology, 2006, 8(12): 1958-1971. DOI:10.1111/j.1462-5822.2006.00763.x |
| [19] |
LIN Y P, THIBODEAUX C H, PEÑA J A, et al. Probiotic Lactobacillus reuteri suppress proinflammatory cytokines via c-Jun[J]. Inflammatory Bowel Diseases, 2008, 14(8): 1068-1083. DOI:10.1002/ibd.20448 |
| [20] |
LATVALA S, MIETTINEN M, KEKKONEN R A, et al. Lactobacillus rhamnosus GG and Streptococcus thermophilus induce suppressor of cytokine signalling 3(SOCS3) gene expression directly and indirectly via interleukin-10 in human primary macrophages[J]. Clinical Experimental Immunology, 2011, 165(1): 94-103. DOI:10.1111/j.1365-2249.2011.04408.x |
| [21] |
KAJI R, KIYOSHIMA-SHIBATA J, NAGAOKA M, et al. Bacterial teichoic acids reverse predominant IL-12 production induced by certain Lactobacillus strains into predominant IL-10 production via TLR2-dependent ERK activation in macrophages[J]. The Journal of Immunology, 2010, 184(7): 3505-3513. DOI:10.4049/jimmunol.0901569 |
| [22] |
UENO N, FUJIYA M, SEGAWA S, et al. Heat-killed body of Lactobacillus brevis sbc8803 ameliorates intestinal injury in a murine model of colitis by enhancing the intestinal barrier function[J]. Inflammatory Bowel Diseases, 2011, 17(11): 2235-2250. DOI:10.1002/ibd.21597 |
| [23] |
POPOVIĆ N, DJOKIĆ J, BRDARIĆ E, et al. The Influence of heat-killed Enterococcus faecium BGPAS1-3 on the tight junction protein expression and immune function in differentiated Caco-2 cells infected with Listeria monocytogenes ATCC 19111[J]. Frontiers Microbiology, 2019, 10: 412. DOI:10.3389/fmicb.2019.00412 |
| [24] |
CHUNG I C, OUYANG C N, YUAN S N, et al. Pretreatment with a heat-killed probiotic modulates the NLRP3 inflammasome and attenuates colitis-associated colorectal cancer in mice[J]. Nutrients, 2019, 11(3): 516-531. DOI:10.3390/nu11030516 |
| [25] |
CHEN M F, WENG K F, HUANG S Y, et al. Pretreatment with a heat-killed probiotic modulates monocyte chemoattractant protein-1 and reduces the pathogenicity of influenza and enterovirus 71 infections[J]. Mucosal Immunology, 2017, 10(1): 215-227. DOI:10.1038/mi.2016.31 |
| [26] |
戴正浩, 刘虎传, 江科, 等. 屎肠球菌的功能特性及其在养猪业中的应用[J]. 山东畜牧兽医, 2018, 39(5): 78-79. |
| [27] |
HUANG Y, LI Y L, HUANG Q, et al. Effect of orally administered Enterococcus faecium EF1 on intestinal cytokines and chemokines production of suckling piglets[J]. Pakistan Veterinary Journal, 2012, 32(1): 81-84. |
| [28] |
向明, 李媛媛, 郭乾鹏, 等. 屎肠球菌对哺乳期仔猪结肠微生物群落优势门属的影响[J]. 南方农业学报, 2019, 50(3): 477-484. |
| [29] |
李媛媛, 郭乾鹏, 梁世忠, 等. 热灭活屎肠球菌及其活菌对仔猪腹泻率、消化酶活性和脏器指数的影响[J]. 黑龙江畜牧兽医, 2018(15): 1-5, 10. |
| [30] |
CHON H, CHOI B, LEE E, et al. Immunomodulatory effects of specific bacterial components of Lactobacillus plantarum KFCC11389P on the murine macrophage cell line RAW 264.7[J]. Journal of Applied Microbiology, 2009, 107(5): 1588-1597. DOI:10.1111/j.1365-2672.2009.04343.x |
| [31] |
KIM J Y, KIM H, JUNG B J, et al. Lipoteichoic acid isolated from Lactobacillus plantarum suppresses LPS-mediated atherosclerotic plaque inflammation[J]. Molecules and Cells, 2013, 35(2): 115-124. DOI:10.1007/s10059-013-2190-3 |
| [32] |
AZAD A K, SARKER M, WAN D. Immunomodulatory effects of probiotics on cytokine profiles[J]. BioMed Research International, 2018, 2018: 8063647. DOI:10.1155/2018/8063647 |
| [33] |
HE F, MORITA H, OUWEH A C, et al. Stimulation of the secretion of pro-inflammatory cytokines by Bifidobacterium strains[J]. Microbiology and Immunology, 2002, 46(11): 781-785. DOI:10.1111/j.1348-0421.2002.tb02765.x |
| [34] |
PERCY M G, GRVNDLING A. Lipoteichoic acid synthesis and function in Gram-positive bacteria[J]. Annual Review of Microbiology, 2014, 68: 81-100. DOI:10.1146/annurev-micro-091213-112949 |
| [35] |
NUSSENBLATT V, MUKASA G, METZGER A, et al. Anemia and interleukin-10, tumor necrosis factor alpha, and erythropoietin levels among children with acute, uncomplicated Plasmodium falciparum malaria[J]. Clinical and Diagnostic Laboratory Immunology, 2001, 8(6): 1164-1170. DOI:10.1128/CDLI.8.6.1164-1170.2001 |
| [36] |
ISMAIL N, STEVENSON H L, WALKER D H. Role of tumor necrosis factor alpha (TNF-α) and interleukin-10 in the pathogenesis of severe murine monocytotropic ehrlichiosis:increased resistance of TNF receptor p55- and p75-deficient mice to fatal ehrlichial infection[J]. Infection and Immunity, 2006, 74(3): 1846-1856. DOI:10.1128/IAI.74.3.1846-1856.2006 |
| [37] |
LECH-MARANDA E, GRZYBOWSKA-IZYDORCZYK O, WYKA K, et al. Serum tumor necrosis factor-α and interleukin-10 levels as markers to predict outcome of patients with chronic lymphocytic leukemia in different risk groups defined by the IGHV mutation status[J]. Archivum Immunologiae et Therapiae Experimentalis, 2012, 60(6): 477-486. DOI:10.1007/s00005-012-0197-7 |
| [38] |
KOZICKY L K, MENZIES S C, ZHAO Z Y, et al.IVIg and LPS co-stimulation induces IL-10 production by human monocytes, which is compromised by an FcγRIIA disease-associated Ge[J/OL].Frontiers in Immunology, 2018, 9: 2676, doi: 10.3389/fimmu.2018.02676.
|
| [39] |
PEÑA J A, VERSALOVIC J. Lactobacillus rhamnosus GG decreases TNF-α production in lipopolysaccharide-activated murine macrophages by a contact-independent mechanism[J]. Cellular Microbiology, 2003, 5(4): 277-285. DOI:10.1046/j.1462-5822.2003.t01-1-00275.x |
| [40] |
MARTIN I, CABÁN-HERNÁNDEZ K, FIGUEROA-SANTIAGO O, et al. Fasciola hepatica fatty acid binding protein inhibits TLR4 activation and suppresses the inflammatory cytokines induced by lipopolysaccharide in vitro and in vivo[J]. The Journal of Immunology, 2015, 194(8): 3924-3936. DOI:10.4049/jimmunol.1401182 |
| [41] |
IYER S S, AIL GHAFFARI A, CHENG G H. Lipopolysaccharide-mediated IL-10 transcriptional regulation requires sequential induction of type Ⅰ IFNs and IL-27 in macrophages[J]. The Journal of Immunology, 2010, 185(11): 6599-6607. DOI:10.4049/jimmunol.1002041 |
| [42] |
KIM H G, KIM N R, GIM M G, et al. Lipoteichoic acid isolated from Lactobacillus plantarum inhibits lipopolysaccharide-induced TNFα production in THP-1 cells and endotoxin shock in mice[J]. Journal of Immunology, 2008, 180(4): 2553-2561. DOI:10.4049/jimmunol.180.4.2553 |
| [43] |
MUNIANDY K, GOTHAI S, BADRAN K M H, et al. Suppression of proinflammatory cytokines and mediators in LPS-induced RAW 264.7 macrophages by stem extract of Alternanthera sessilis via the inhibition of the NF-κB pathway[J]. Journal of Immunology Research, 2018, 2018: 3430684. DOI:10.1155/2018/3430684 |




