2. 浙江惠嘉生物科技股份有限公司, 安吉 311703
2. Zhejiang Vegamax Biotech Co., Ltd., Anji 311703, China
植物多糖是从天然植物中提取的生物高分子活性物质,具有调节动物免疫功能、抑菌抗病毒和保护肠道等作用[1]。黄芪多糖(Astragalus polysaccharides, APS)是从荚膜黄芪中提取的一种免疫调节剂,长期试验证明其无毒副作用,并且具有抗菌作用,可以作为潜在的抗生素替代物[2-4]。Zhao等[1]和Li等[3]研究发现,APS能够减轻结肠炎大鼠的肠道炎症。饲粮中添加APS能改善断奶仔猪的生长速度,增强体液免疫功能和炎性T细胞(Thl类)细胞因子[白细胞介素-2(IL-2)、γ-干扰素(IFN-γ)等)]的分泌量,减少免疫抑制[5]。生物体发育后,巨噬细胞通过调节各种活动(包括新陈代谢和神经连通性)并检测损害来调节体内平衡和正常生理活动。然而,巨噬细胞的这些调节作用经常被持续地破坏,导致产生许多与衰老有关的疾病,如试验性自身免疫性脑脊髓炎(EAE)、炎症性肠病(IBD)。巨噬细胞是与炎症性肠病的发病机制有关的许多细胞因子的关键产生者。局部环境中,在多种自身免疫性疾病和炎性疾病的发病机理中,巨噬细胞分化的变化起决定性作用[6]。目前关于APS已有较多研究,但对脂多糖(lipopolysaccharides,LPS)刺激条件下APS作用的研究较少。本试验在前人研究基础上,进一步研究APS对于LPS刺激条件下小鼠巨噬细胞形态的影响,同时研究其对细胞因子白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)分泌和Toll样受体4(TLR4)信号通路相关基因表达的影响,以期为APS的应用指供理论基础。
1 材料与方法 1.1 试验材料APS来源于浙江某生物科技股份有限公司,含量为90%,由葡萄糖、阿拉伯糖、甘露糖、半乳糖、果糖、鼠李糖、葡糖醛酸和木糖等组成[7];LPS(来源于大肠杆菌,血清型O55 : B5)购自于美国Sigma公司;小鼠单核巨噬细胞(RAW264.7细胞)来源于中国医学科学院基础医学研究所基础医学细胞中心;酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、乳酸脱氢酶(LDH)、IL-1β、TNF-α测试盒均购自南京建成生物工程研究所。
1.2 小鼠巨噬细胞的培养参考许丹等[8]的方法培养小鼠巨噬细胞,进行计数并观察细胞形态。
1.3 LPS诱导小鼠巨噬细胞炎症模型的建立巨噬细胞在37 ℃、5% CO2条件下培养24 h,分别配制0(空白组)、0.10、0.25、0.50、1.00、2.00 μg/mL LPS溶液,使用500 μL不同浓度的LPS溶液分别刺激巨噬细胞,每个浓度设置6个重复,观察细胞形态并记录细胞数量,检测其LDH活性,确定诱导小鼠巨噬细胞炎症模型建立的适宜LPS浓度。
1.4 APS对LPS刺激小鼠巨噬细胞形态的影响试验分为3组,每组6个重复。对照组采用500 μL细胞培养液处理巨噬细胞24 h,不采用LPS刺激;LPS组采用250 μL浓度为1.0 μg/mL的LPS溶液处理巨噬细胞1 h,再采用250 μL细胞培养液培养23 h;APS组采用250 μL浓度为1.0 μg/mL的LPS溶液处理巨噬细胞1 h,再采用250 μL浓度为1.0 mg/mL的APS培养液处理23 h。用显微镜观察各组细胞形态并进行拍照。
1.5 APS对LPS刺激小鼠巨噬细胞生物酶活性和促炎症因子分泌功能的影响试验分为5个组,每组6个重复,分别为对照组、LPS组(1.0 μg/mL LPS)、APS-Max组(1.0 μg/mL LPS+1.0 mg/mL APS)、APS-Med组(1.0 μg/mL LPS+0.5 mg/mL APS)、APS-Min组(1.0 μg/mL LPS+0.1 mg/mL APS)。3个APS组巨噬细胞先用250 μL浓度为1.0 μg/mL的LPS溶液处理1 h后,再分别添加250 μL不同浓度的黄芪多糖溶液,于37 ℃、5% CO2培养箱分别培养12、24和48 h。CON组和LPS组分别用250 μL细胞培养液和250 μL浓度为1.0 μg/mL的LPS溶液处理1 h后,再添加细胞处理液至500 μL,于37 ℃、5% CO2培养箱分别培养12、24和48 h。取细胞上清液,检测LDH、AKP、ACP活性以及TNF-α、IL-1β含量。
1.6 APS对LPS刺激小鼠巨噬细胞TLR4信号通路相关基因表达的影响试验分为4个组,每个组设6个重复。对照组采用500 μL细胞培养液培养24 h,不采用LPS刺激;APS组采用500 μL浓度为1.0 mg/mL的APS培养液培养24 h,不采用LPS刺激;LPS组采用250 μL浓度为1.0 μg/mL的LPS溶液刺激1 h,再添加250 μL细胞培养液培养23 h;LPS+APS组采用250 μL浓度为1.0 μg/mL的LPS溶液刺激1 h,再添加250 μL浓度为1.0 mg/mL的APS培养液培养23 h。参考戴先成等[9]的方法,用实时荧光定量PCR方法对TLR4、核因子-κB(NF-κB)、髓样分化因子88(MyD88)的mRNA表达量进行测定。以β-肌动蛋白(β-actin)为内参基因,参考韩乾杰[7]的方法设计引物序列,如表 1所示,由杭州尚亚生物科技有限公司合成和验证。
|
|
表 1 实时荧光定量PCR引物 Table 1 Quantitative real-time PCR primers |
数据采用SPSS 21.0软件进行统计分析,使用单因素方差分析(one-way ANOVA)和LSD法确定不同组别之间的差异显著性,以P < 0.05表示差异显著。数据使用Graphpad Prism 7进行图表绘制。
2 结果与分析 2.1 确定建立巨噬细胞炎症模型最适LPS浓度由LDH活性结果(表 2)可知,当LPS浓度达到1.0 μg/mL以上时,LDH活性不再随LPS浓度升高而明显提升,因此确定1.0 μg/mL是建立巨噬细胞炎症模型的最适浓度。
|
|
表 2 LPS浓度对LDH活性的影响 Table 2 Effects of LPS concentration on LDH activity |
由巨噬细胞形态结果(图 1)可知,在培养1 h后,LPS组的巨噬细胞存在较低程度变形。培养24 h后,对照组的巨噬细胞形态未发生明显变化,仍然呈椭球状并具有良好增殖能力;而受LPS刺激的巨噬细胞呈现不规则形态,细胞膜破损和细胞液外泄,增殖能力下降。LPS刺激1 h添加APS后,巨噬细胞形态恢复,轮廓清晰,数量增多,与对照组无明显差异。上述结果说明APS可以抑制由LPS引起的细胞形态损伤。
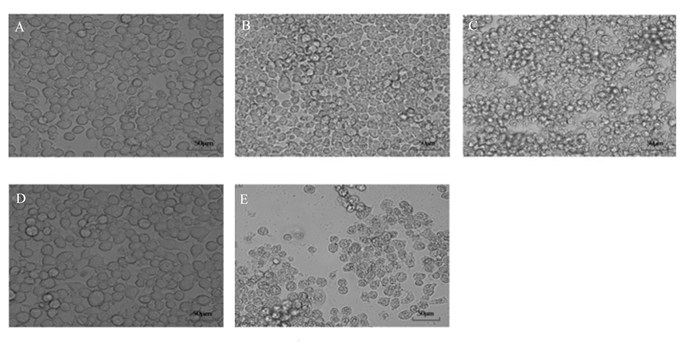
|
图A为培养1 h后的对照组细胞形态;图D为LPS处理1 h的LPS组的细胞形态;图B、E、C分别为LPS处理1 h后添加不同添加剂处理23 h的对照组、LPS组、APS组的细胞形态。 Figure A was the cell morphology of control group after 1 h of culture; figure D was the cell morphology of LPS group after 1 h of LPS treatment; figures B, E and C were the cell morphology of control group, LPS group and APS group treated with different additives for 23 h after LPS treatment for 1 h, respectively. 图 1 APS对LPS刺激巨噬细胞形态的影响 Fig. 1 Effects of APS on LPS-stimulated macrophage morphology (400×) |
由图 2可知,LPS处理后12、24和48 h,LPS组巨噬细胞的LDH活性均显著高于对照组(P < 0.05);添加APS后,除LPS处理后12 h时LPS-Min组与LPS组无显著差异(P>0.05)外,各APS组巨噬细胞的LDH活性均较LPS组显著降低(P < 0.05)。
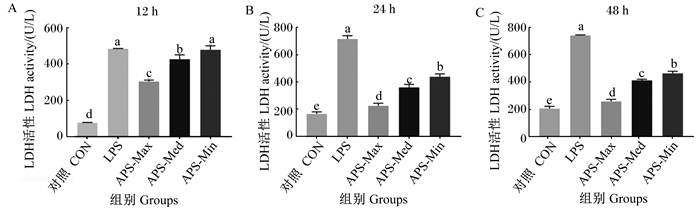
|
数据柱标注不同字母表示差异显著(P < 0.05)。下图同。 Date columns with different letters mean significant difference (P < 0.05). The same as below. 图 2 APS对LPS刺激巨噬细胞LDH活性的影响 Fig. 2 Effects of APS on LDH activity of macrophages stimulated by LPS |
由图 3可知,LPS处理后12、24和48 h,LPS组巨噬细胞的ACP活性均显著低于对照组(P < 0.05),且处理后24 h时差异最大;与LPS组相比,1.0、0.5和0.1 mg/mL的APS均能够显著提高巨噬细胞的ACP活性(P < 0.05)。
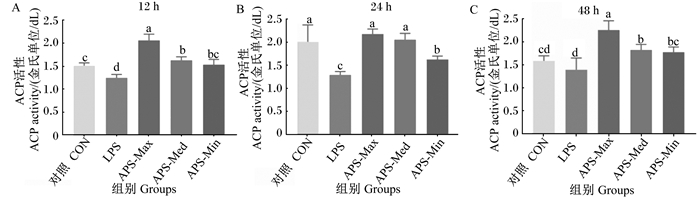
|
图 3 APS对LPS刺激巨噬细胞ACP活性的影响 Fig. 3 Effects of APS on ACP activity of macrophages stimulated by LPS |
由图 4可知,LPS诱导刺激后,巨噬细胞的AKP活性在12和24 h时均显著低于对照组(P < 0.05);各APS组巨噬细胞的AKP活性在12、24和48 h时与LPS组相比均显著增加(P < 0.05)。
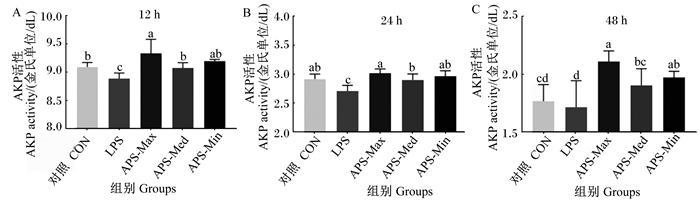
|
图 4 APS对LPS刺激巨噬细胞AKP活性的影响 Fig. 4 Effects of APS on AKP activity of macrophages stimulated by LPS |
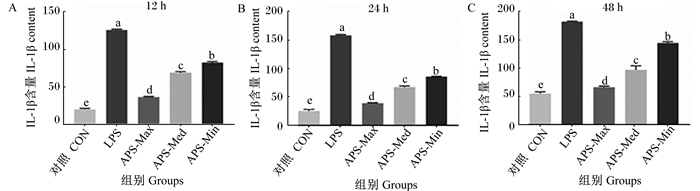
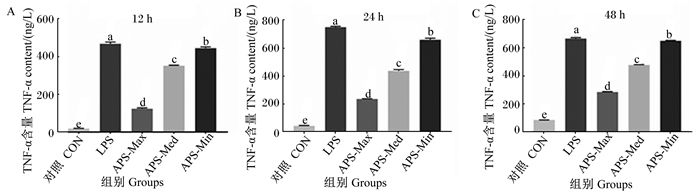
图 5和图 6显示,受到LPS刺激后,巨噬细胞的IL-1β和TNF-α含量在48 h内持续升高,与对照组差异显著(P < 0.05)。48 h内,APS能够显著减少LPS刺激导致的促炎症因子IL-1β和TNF-α含量的升高(P < 0.05),且1.0 mg/mL的APS降低炎症因子分泌的能力较其他浓度更佳。
|
图 5 APS对LPS刺激巨噬细胞IL-1β含量的影响 Fig. 5 Effects of APS on IL-1β content of macrophages stimulated by LPS |
|
图 6 APS对LPS刺激巨噬细胞TNF-α含量的影响 Fig. 6 Effects of APS on TNF-α content of macrophages stimulated by LPS |
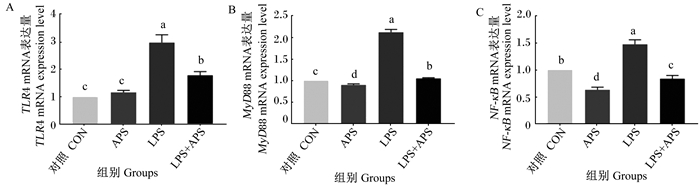
由图 7可知,LPS刺激导致巨噬细胞TLR4、MyD88、NF-κB的mRNA表达量相较于对照组显著升高(P < 0.05);LPS+APS组巨噬细胞TLR4、MyD88、NF-κB的mRNA表达量则较LPS组显著降低(P < 0.05)。
|
图 7 APS对LPS刺激巨噬细胞TLR4信号通路相关基因mRNA表达量的影响 Fig. 7 Effects of APS on mRNA expression levels of TLR4 signaling pathway related genes of macrophages stimulated by LPS |
巨噬细胞属免疫细胞,通过非特异性识别抗原物质,对病原体进行吞噬作用,诱导免疫应激,产生抗原递呈,从而激活机体的免疫系统实现免疫细胞对抗原分子识别、活化、增殖和分化,启动免疫应答[10]。LPS是革兰氏阴性菌细胞壁特有的化学成分,是一种免疫激活剂,能够引发机体的免疫激活[11]。
任琳等[12]研究表明LPS刺激巨噬细胞可诱导其分泌大量的炎症因子,过量的炎症因子会加速巨噬细胞的非程序性死亡,引起免疫应激。Xu等[13]发现APS纳米颗粒对LPS处理的H9c2细胞形态有保护作用,LPS处理24 h后H9c2细胞的细胞核受损,染色质出现凝集,添加APS纳米颗粒后H9c2细胞的形状呈卵圆型,呈均匀排列,细胞核清晰,位于卵泡中间。本研究发现LPS刺激使小鼠巨噬细胞发生形态改变,而APS可修复细胞的形态,改善细胞膜破损,减少细胞液外溢。Bao等[14]报道紫杉醇抑制RAW264.7细胞的增殖,而APS保护RAW 264.7细胞不受紫杉醇诱导的抑制,本研究发现APS改善巨噬细胞受到LPS刺激导致增殖抑制。
在与巨噬细胞增殖有关的酶中,LDH被认为是巨噬细胞活化的标志之一,它对巨噬细胞的吞噬作用有直接影响,因为吞噬过程需要糖酵解的能量,而糖酵解可以通过激活LDH来加速[15]。李异等[16]研究发现降低LDH活性表明细胞损伤降低。本研究发现APS可降低LDH活性,降低细胞损伤,使免疫应激得到缓解,并且APS浓度越高,处理时间越长,降低LDH活性的作用越明显。
ACP和AKP是2种重要的机体功能调节酶。大量研究表明磷酸酶活性是细胞和体液免疫的综合体现,也是衡量免疫功能和机体状态的指标,反映了机体对外源微生物侵染的防御能力[17]。研究发现,在蛋白质的去磷酸化过程中,ACP和AKP可能共同参与了细胞的增殖启动[18]。Wu等[19]发现添加熟地黄多糖能显著提高巨噬细胞的ACP和AKP活性。本研究发现,APS可提高由LPS刺激引起的ACP、AKP活性的降低,增强细胞增殖能力,且1 mg/mL APS的改善效果优于其他浓度。
研究表明,植物多糖调节机体的免疫过程主要通过介导免疫细胞分泌促细胞因子,诱导B淋巴细胞分泌抗体,一部分形成记忆细胞,对体液免疫进行调节[20]。诱导免疫细胞分泌多种细胞因子的关键信号通路为TLR4/NF-κB信号通路[21]。Evgenikos等[22]发现,TLR4的转录受到来自IL-1β正反馈,促炎症因子被免疫细胞大量分泌,炎症反应开始加剧,中性粒细胞和白细胞同时作用于肠道,加剧炎症反应。炎症因子的分泌量是检测炎症严重程度的量化指标。Wu等[23]研究发现,平菇多糖能够显著降低LPS刺激巨噬细胞的LDH活性以及IL-1β和TNF-α含量,降低免疫应激。TNF-α是巨噬细胞应激时产生的小分子蛋白质,具有炎症介质作用。Caillot等[24]发现经LPS处理后,巨噬细胞的NF-κB表达量显著上升,而黑莓多糖能够显著降低其表达量,并且减少促炎症因子(TNF-α和IL-1β)的分泌。Wei等[25]发现APS增强了RAW264.7细胞中一氧化氮(NO)和细胞因子的产生,APS可以快速激活TLR4相关的丝裂原活化蛋白激酶(MAPK),包括磷酸化的细胞外信号调节激酶(ERK)、磷酸化的Jun氨基末端激酶(JNK)和磷酸化的p38,并诱导NF-κB易位以及NF-κB抑制因子α(IκBα)降解。本研究结果显示,APS均能够显著抑制由LPS引起的巨噬细胞IL-1β含量的升高,且IL-1β含量降低对APS浓度呈剂量依赖;1 mg/mL的APS通过降低TLR4的mRNA表达量,缓解巨噬细胞促炎症因子的释放,表明APS可以降低细胞炎症,并且可以降低分泌多种细胞因子的关键信号通路的基因转录。
4 结论APS可以改善LPS刺激小鼠巨噬细胞(RAW264.7细胞)的形态,提高ACP和AKP活性,减少TLR4、MyD88和NF-κB基因的转录,抑制促炎症因子IL-1β和TNF-α的分泌。
| [1] |
ZHAO L J, WU H B, ZHAO A H, et al. The in vivo and in vitro study of polysaccharides from a two-herb formula on ulcerative colitis and potential mechanism of action[J]. Journal of Ethnopharmacology, 2014, 153(1): 151-159. DOI:10.1016/j.jep.2014.02.008 |
| [2] |
BAEK S H, LEE J G, PARK S Y, et al. Pectic polysaccharides from Panax ginseng as the antirotavirus principals in ginseng[J]. Biomacromolecules, 2010, 11(8): 2044-2052. DOI:10.1021/bm100397p |
| [3] |
LI J F, ZHONG Y G, LI H R, et al. Enhancement of Astragalus polysaccharide on the immune responses in pigs inoculated with foot-and-mouth disease virus vaccine[J]. International Journal of Biological Macromolecules, 2011, 49(3): 362-368. DOI:10.1016/j.ijbiomac.2011.05.015 |
| [4] |
CHEN R Z, LIU Z Q, ZHAO J M, et al. Antioxidant and immunobiological activity of water-soluble polysaccharide fractions purified from Acanthopanax senticosu[J]. Food Chemistry, 2011, 127(2): 434-440. DOI:10.1016/j.foodchem.2010.12.143 |
| [5] |
YUAN S L, PIAO X S, LI D F, et al. Effects of dietary Astragalus polysaccharide on growth performance and immune function in weaned pigs[J]. Animal Science, 2006, 82(4): 501-507. DOI:10.1079/ASC200653 |
| [6] |
WYNN T A, CHAWLA A, POLLARD J W. Macrophage biology in development, homeostasis and disease[J]. Nature, 2013, 496(7446): 445-455. DOI:10.1038/nature12034 |
| [7] |
韩乾杰.植物多糖对仔猪生长性能、免疫功能和肠道健康的影响研究[D].硕士学位论文.杭州: 浙江农林大学, 2019.
|
| [8] |
许丹, 律颖, 朱小语, 等. 小鼠单核巨噬细胞白血病细胞(RAW264.7)的培养及其在诱导破骨细胞中的应用[J]. 中国骨质疏松杂志, 2016, 22(10): 1355-1360. |
| [9] |
戴先成, 柴智锋, 徐永城, 等. Trizol法大鼠心肌总RNA提取方法探讨[J]. 刑事技术, 2014(3): 15-16. |
| [10] |
ZHANG L N, TIZARD I R. Activation of a mouse macrophage cell line by acemannan:the major carbohydrate fraction from Aloe vera gel[J]. Immunopharmacology, 1996, 35(2): 119-128. |
| [11] |
KARACA K, SHARMA J M, NORDGREN R. Nitric oxide production by chicken macrophages activated by acemannan, a complex carbohydrate extracted from Aloe vera[J]. International Journal of Immunopharmacology, 1995, 17(3): 183-188. DOI:10.1016/0192-0561(94)00102-T |
| [12] |
任琳, 李轶, 王山梅, 等. 小鼠巨噬细胞内表达结核分枝杆菌CFP10-ESAT6融合蛋白对细胞增殖和凋亡的影响[J]. 中国病理生理杂志, 2013, 29(10): 1809-1814. |
| [13] |
XU X Y, RUI S Z, CHEN C, et al. Protective effects of Astragalus polysaccharide nanoparticles on septic cardiac dysfunction through inhibition of TLR4/NF-κB signaling pathway[J]. International Journal of Biological Macromolecules, 2020, 153: 977-985. DOI:10.1016/j.ijbiomac.2019.10.227 |
| [14] |
BAO W R, LI Z P, ZHANG Q W, et al. Astragalus polysaccharide RAP selectively attenuates paclitaxel-induced cytotoxicity toward RAW 264.7 cells by reversing cell cycle arrest and apoptosis[J]. Frontiers in Pharmacology, 2018, 9: 1580. DOI:10.3389/fphar.2018.01580 |
| [15] |
SUGIURA H, SUGIURA H, UEYA S, et al. Enhanced macrophage functions and cytokine production of lymphocytes after ingestion of bon narine in female BALB/c mice[J]. Life Sciences, 2000, 68(5): 505-515. DOI:10.1016/S0024-3205(00)00946-2 |
| [16] |
李异, 王慷慨, 蒋永芳, 等. 心型脂肪酸结合蛋白对脂多糖所致心肌细胞损伤的保护作用[J]. 中南大学学报(医学版), 2015, 40(5): 457-463. |
| [17] |
BROEG K. The activity of macrophage aggregates in the liver of flounder (Platichthys flesus) and wrasse (Symphodus melops) is associated with tissue damage[J]. Marine Environmental Research, 2010, 69(1): S14-S16. |
| [18] |
MILLAR J B, RUSSELL P, DIXON J E, et al. Negative regulation of mitosis by two functionally overlapping PTPases in fission yeast[J]. The EMBO Journal, 1992, 11(13): 4943-4952. DOI:10.1002/j.1460-2075.1992.tb05601.x |
| [19] |
WU C, SHAN J F, FENG J C, et al. Effects of dietary Radix Rehmanniae preparata polysaccharides on the growth performance, immune response and disease resistance of Luciobarbus capito[J]. Fish & Shellfish Immunology, 2019, 89: 641-646. |
| [20] |
SCHEPETKIN I A, QUINN M T. Botanical polysaccharides:macrophage immuno modulation and therapeutic potential[J]. International Immunopharmacology, 2006, 6(3): 317-333. DOI:10.1016/j.intimp.2005.10.005 |
| [21] |
SHISHODIA S, AGGARWAL B B. Nuclear factor-kappaB activation:a question of life or death[J]. Journal of Biochemistry & Molecular Biology, 2002, 35(1): 28-40. |
| [22] |
EVGENIKOS N, BARTOLO D C C, HAMER-HODGES D W, et al. Assessment of ileoanal pouch inflammation by interleukin 1β and interleukin 8 concentrations in the gut lumen[J]. Diseases of the Colon & Rectum, 2002, 45(2): 249-255. |
| [23] |
WU G H, LU C L, JIANG J G, et al. Regulation effect of polysaccharides from Pleurotus tuber-regium (Fr.) on the immune activity of mice macrophages[J]. Food & Function, 2014, 5(2): 337-344. |
| [24] |
CAILLOT A R C, BEZERRA I D L, PALHARES L C G, et al. Structural characterization of blackberry wine polysaccharides and immunomodulatory effects on LPS-activated RAW 264.7 macrophages[J]. Food Chemistry, 2018, 257: 143-149. DOI:10.1016/j.foodchem.2018.02.122 |
| [25] |
WEI W, XIAO H T, BAO W R, et al. TLR-4 may mediate signaling pathways of Astragalus polysaccharide RAP induced cytokine expression of RAW264.7 cells[J]. Journal of Ethnopharmacology, 2016, 179: 243-252. DOI:10.1016/j.jep.2015.12.060 |




