2. 保定职业技术学院, 保定 071000
2. Baoding Vocational and Technical College, Baoding 071000, China
随着养殖业向绿色、环保、无公害方向发展,抗生素替代品的研究越来越广泛和深入,多糖因其优良的特性及其生理功能,正日益受到人们广泛的关注,成为能够有效替代抗生素的潜在资源。多糖是存在于自然界的醛糖和(或)酮糖通过糖苷键连接在一起的聚合物(一般10个以上),分布于动植物和微生物中。它不仅是所有生命有机体的重要组成部分,还控制细胞分裂分化,参与细胞间识别、转化及物质运输、集体免疫功能的识别、肿瘤细胞的凋亡等过程[1]。目前,香菇多糖与黄芪多糖已被列入饲料添加剂目录。枣是传统功能性营养食品之一,其风味独特,味美可口,富含糖类、蛋白质、多种维生素、纤维、微量元素等,其中以糖类最为丰富,占干物质的60%~80%。有研究表明,枣粗多糖(JPc)可以提高肉仔鸡的免疫功能[2],促进小鼠脾脏细胞增殖[3];枣中性多糖可以促进免疫细胞的生长及相关因子分泌[4];纯化的枣总多糖可以促进蛋雏鸡生长,增强其免疫功能[5];柱层析法分级纯化得到的3种枣多糖(JP)(PZMP1、PZMP2和PZMP3)均具有抗氧化活性[6]。但是前人的研究大多集中在总多糖,对不同乙醇浓度提取的JP在免疫方面的研究报道较少。因此,本试验旨在通过探究4种不同浓度乙醇提取的JP协同脂多糖(LPS)对小鼠脾脏B淋巴细胞体外增殖的影响,为JP作为免疫增强剂的开发利用提供科学依据。
1 材料与方法 1.1 试验材料与动物金丝小枣购自河北某生物食品有限公司。6周龄SPF级昆明小鼠(动物编号:NO.110)体重为(21±5) g,雌性,购自北京维通利华实验动物技术有限公司。
1.2 主要试剂与仪器95%乙醇、氯仿、正丁醇:保定市莲池区美利实验用品经销部;D900大孔阴离子吸附树脂:北京索莱宝;胎牛血清(FBS)、磷酸盐缓冲液(PBS):上海碧云天生物技术有限公司;LPS:北京科龙生物医学技术有限公司;100×青/链霉素:昆明皇宝商贸有限公司;台盼蓝:中科瑞泰生物科技有限公司;RPMI-1640培养基:北京北方同正生物技术发展有限公司;DG-5032型酶联免疫检测仪:南京华东电子集团医疗装备有限责任公司;TD-4台式低速离心机:湖南凯达科学仪器有限公司;二氧化碳培养箱:德国贺利氏。
1.3 试验方法 1.3.1 JP的提取与纯化将金丝小枣在60 ℃烘干粉碎,将枣粉和蒸馏水按1 : 20的比例混合后,置于80 ℃的恒温水浴锅中浸提4 h,6层纱布过滤,保留滤液,于水浴锅中自然蒸发至溶液的1/4左右,即得到浓缩液。在浓缩液中加入95%的乙醇至乙醇浓度达到90%,放置4 ℃冰箱中静置过夜,3 500 r/min离心10 min,弃去上清液,收集沉淀,用冷冻干燥机进行干燥,得到JPc。Sevag法脱蛋白、D900大孔阴离子吸附树脂脱色获得精多糖溶液,继续浓缩,根据JP分子质量随乙醇体积分数增加而降低的原理进行分级[7-8],即在浓缩液中加入95%的乙醇至乙醇浓度为60%,收集沉淀,再将上清液调节乙醇浓度为70%,收集沉淀,以此类推依次将上清液的乙醇浓度调节为80%、90%,将醇沉物进行冷冻干燥,依次得到4种JP(JP60、JP70、JP80和JP90),并进行称重,计算多糖得出率,计算公式如下:
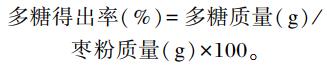
|
采用斐林试验进行JP的定性检测。用蒸馏水溶解少量多糖沉淀,将溶液分成2份,一份溶液加入稀盐酸(质量分数为10%)5滴,置沸水浴中15 min,用10%的氢氧化钠溶液中和至中性,再加入斐林试剂A液和B液各4滴;另一份不加酸直接加入斐林试剂,2管同时放置水浴锅上煮沸5 min。如果水解后生成的砖红色沉淀比未经水解的多,则表示有多糖。
1.3.3 小鼠脾脏B淋巴细胞的分离与鉴定以颈椎脱臼法处死小鼠,用75%乙醇浸泡小鼠5 min,取出小鼠置于无菌操作台上,沿腹腔中线剪开小鼠胸腔,取出脾脏置于培养皿中,剪去脂肪和筋膜组织,用PBS进行冲洗。将其粗剪成块,用注射器芯轻轻挤压,加人PBS混悬,用200目细胞过滤网过滤,再加人PBS冲洗网上剩余组织细胞。将滤过的细胞悬液轻微吹吸后离心,弃上清,加入3~5倍细胞体积的红细胞裂解液,轻轻吹打混匀,裂解1~2 min,离心5 min,弃红色上清,重复2~3次以除去红细胞。用PBS洗涤细胞3次,除去裂解液。细胞沉淀再次用RPMI-1640完全培养基(含100 U/mL青链霉素和10% FBS)重悬,37 ℃、5% CO2培养箱中静置2 h,以除去贴壁细胞,收集未贴壁细胞即为脾脏B细胞悬液[贴壁细胞为巨噬细胞、树突细胞等单核细胞,未贴壁的细胞为T淋巴细胞、B淋巴细胞、自然杀伤(NK)细胞等悬浮细胞]。台盼蓝染色计数法计数,活细胞数达到90%以上。调节细胞浓度为5×104个/mL,制成淋巴细胞悬液。
1.4 试验设计试验采用4×4双因子试验设计,乙醇浓度和JP浓度为2个主效应,4种乙醇浓度分别为60%、70%、80%和90%,4种JP浓度分别为25、50、100和150 μg/mL,另外设置1个空白对照组(不添加JP和LPS),1个LPS对照组(不添加JP,只添加LPS)。将细胞悬液随机分为18组,每组4个重复,每个重复85 μL细胞,铺于96孔板中。将细胞置于37 ℃、5% CO2培养箱中培养6~24 h至细胞贴壁后,加入LPS及不同浓度的JP,至JP终浓度分别为25、50、100和150 μg/mL,LPS终浓度为1 μg/mL。细胞放入培养箱中继续培养24 h。
1.5 测定指标及方法从培养箱中取出细胞,小心吸去上清,加入90 μL新鲜培养液,再加入10 μL MTT溶液,继续培养4 h。吸掉上清,每孔加入110 μL Formazan溶解液,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的吸光值,计算相对增殖率(RGR),计算公式如下:
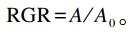
|
式中:A为LPS对照组和试验组吸光度;A0为空白对照组吸光度。
根据RGR评价细胞毒性等级[9],按RGR范围分为5级:RGR≥100%为0级,75%≤RGR≤99%为1级,50%≤RGR≤74%为2级,25%≤RGR≤49%为3级,1%≤RGR≤24%为4级,RGR=0为5级。0级和1级被认为没有细胞毒性,2级为轻度细胞毒性,3级和4级为中度细胞毒性,5级为明显的细胞毒性。
1.6 统计与分析数据通过SPSS 22.0软件处理,利用General Linear Model进行单因素和双因素方差分析,并用Duncan氏法进行多重比较,LSD检验各组间的差异显著性,P>0.05表示差异不显著,P < 0.05表示差异显著。结果以“平均值±标准误”的形式表示,并用Graphpad Prime 5作图。
2 结果与分析 2.1 JP的得出率各JP的得出率以JPc的得出率最高,达6.650%。各分级JP的得出率以JP60最高,为2.780%,以JP90最低,为0.011%,JP70和JP80的得出率分别为0.183%和0.150%。
2.2 JP的定性检测斐林试验结果显示,JPc、JP60、JP70、JP80和JP90水解组出现的砖红色沉淀明显多于未被水解组,说明有多糖存在。
2.3 细胞毒性等级评分由表 1可知,各组B淋巴细胞RGR≥100%,为0级,即说明在本试验条件下,4种乙醇浓度提取的JP与LPS协同对B淋巴细胞均无毒性。
|
|
表 1 枣多糖对小鼠脾脏B淋巴细胞体外增殖率的影响 Table 1 Effects of jujube polysaccharide on proliferation rate of spleen B lymphocytes of mice in vitro |
由表 1可知,乙醇浓度对小鼠脾脏B淋巴细胞的相对增殖率具有显著影响(P < 0.05)。在不考虑JP浓度时,乙醇浓度为90%组的相对增殖率显著高于60%、70%和80%组(P < 0.05),乙醇浓度为70%和80%组的相对增殖率显著高于60%组(P < 0.05),且乙醇浓度为70%和80%组间没有显著差异(P>0.05)。
JP浓度对小鼠脾脏B淋巴细胞的相对增殖率具有显著的影响(P < 0.05)。在不考虑乙醇浓度时,JP浓度为25、50、100和150 μg/mL组的相对增殖率均显著高于空白对照组和LPS对照组(P < 0.05);当JP浓度为25~150 μg/mL时,随着JP浓度的增加,相对增殖率先增加后降低,且组间差异显著(P < 0.05),当JP浓度为100 μg/mL时,相对增殖率最大。
乙醇浓度和JP浓度两者的互作效应对小鼠脾脏B淋巴细胞的相对增殖率具有显著协同作用(P < 0.05),且11组效果最好,即JP浓度为100 μg/mL、乙醇浓度为80%时效果最好。
与空白对照组相比,各试验组的相对增殖率均显著提高(P < 0.05);与LPS对照组相比,除1组的相对增殖率没有显著变化(P>0.05),其他各组均显著提高(P < 0.05)。
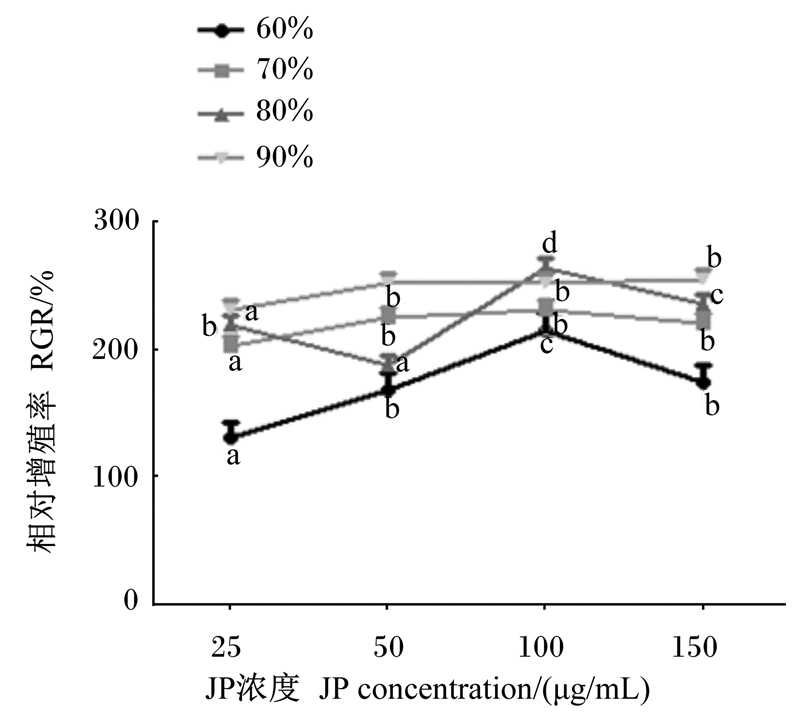
由图 1可知,当乙醇浓度为60%和70%时,相对增殖率随着JP浓度的增加,呈先增加后减少的趋势,即存在饱和浓度(100 μg/mL);当乙醇浓度增加到80%时,相对增殖率在JP低浓度范围(25~50 μg/mL)和高浓度范围(100~150 μg/mL)内随着JP浓度增加而显著降低(P < 0.05);当乙醇浓度增加到90%时,相对增殖率在JP低浓度范围(25~50 μg/mL)和高低浓度范围(100~150 μg/mL)内随着JP浓度增加而增加,且在低浓度范围内各组间差异显著(P < 0.05)。
|
同一条曲线上相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P < 0.05)。下图同。 On the same curve, the same letter superscripts mean no significant difference (P>0.05), while different letter superscripts mean significant difference (P < 0.05). The same as below. 图 1 相对增殖率随JP浓度的变化趋势 Fig. 1 Variation trend of relative proliferation rate with JP concentration |
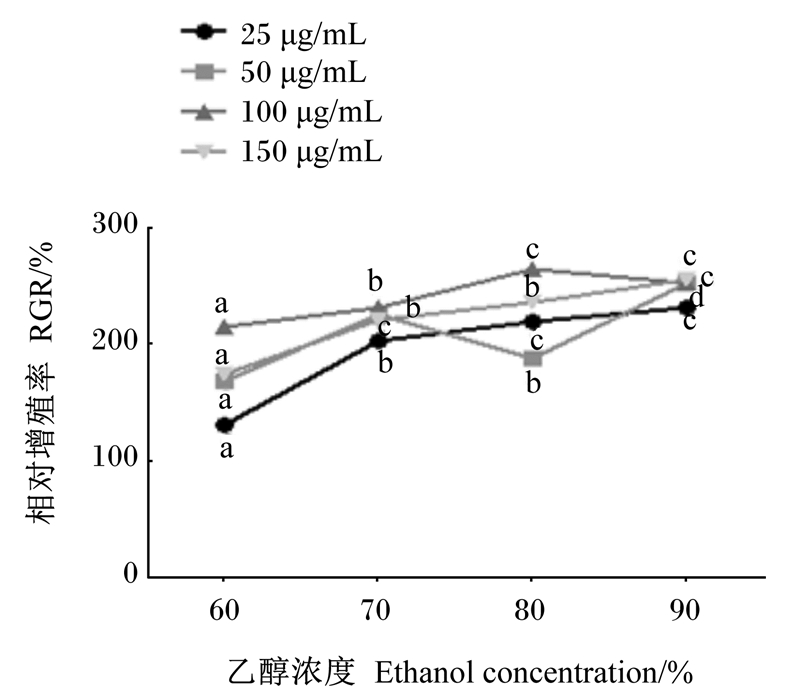
固定JP浓度,观察相对增殖率随乙醇浓度变化趋势(图 2)。结果发现,当JP浓度为25 μg/mL时,相对增殖率随着乙醇浓度的增加呈升高趋势,且乙醇浓度为70%时的相对增殖率显著高于60%(P < 0.05);当JP浓度为50 μg/mL时,相对增殖率呈“波浪型”曲线,且组间差异显著(P < 0.05);当JP浓度为100 μg/mL时,相对增殖率随着乙醇浓度增加先上升后下降,且乙醇浓度为80%时的相对增殖率显著高于70%(P < 0.05),乙醇浓度为80%时效果最好;当JP浓度为150 μg/mL时,相对增殖率随着乙醇浓度增加而增加,且乙醇浓度为70%时的相对增殖率显著高于60%(P < 0.05),乙醇浓度为90%时的相对增殖率显著高于80%(P < 0.05)。
|
图 2 相对增殖率随乙醇浓度的变化趋势 Fig. 2 Variation trend of relative proliferation rate with ethanol concentration |
植物多糖是从植物中提取的一种生物活性物质,包括淀粉、果胶、纤维素等生物大分子,具有提升机体免疫力[10]、抗病毒[11]、抗氧化[12]及抗肿瘤[13]等多种生物活性,是天然的免疫调节剂。JP是枣中含量最多、生物活性物质较明显的成分,人们对其提取纯化以及生物活性进行了大量研究。JP的提取方法主要有热水浸提法、超声波辅助提取法、微波辅助提取法和酶解辅助提取法等,其中热水浸提法是最为常用的传统方法之一,提取的多糖为水溶性多糖,成本低、不破坏生物活性、方便实用且安全性高[14],然而由此获得的JPc是由很多分子质量和结构不同的多糖混合而成,还需要进行进一步的分级,本试验用分步醇沉法进行JP分级,即根据不同结构和分子质量的JP极性不同,在乙醇中的溶解度不同,依次增加乙醇浓度,将多糖按分子质量由大到小沉淀出来。有试验表明,高体积分数的乙醇沉淀出来的单糖种类丰富且水溶性更好[7],且多糖分子质量大小与其免疫活性有一定关系[15-16]。本试验结果显示,高浓度乙醇分级出的低分子质量JP免疫效果更好,进一步证明了上述结果。糖类的提取方式不同,获得糖类的有效成分不同,从而影响到作用靶细胞的不同。本试验提取的JP主要成分是水溶性的,且根据试验结果判定其具有一定的免疫功能,与王忠[17]、叶文斌等[18]的试验结果一致。与袁红波[19]的试验结果相悖,是由于袁红波等[19]直接使用95%乙醇从枣粉中提取的糖多为单糖和寡糖,其主要成分为水不溶性的糖类[20]。
机体正常免疫功能依赖于各种免疫细胞之间的相互作用。脾脏内含有大量的淋巴细胞,其中T细胞约35%,B淋巴细胞约38%,分别参与细胞免疫和体液免疫[21],淋巴细胞增殖表现为产生效应淋巴细胞,直观表现机体免疫机能[22]。伴刀豆球蛋白A(ConA)和LPS分别作为T淋巴细胞和B淋巴细胞的致有丝分裂原,分别促进T淋巴细胞和B淋巴细胞的增殖[23]。不同多糖对不同免疫细胞的作用效果不同,这与多糖的结构、细胞种类和功能相关。研究表明,坛紫菜多糖可显著促进T淋巴细胞的增殖,却对B淋巴细胞的增殖有抑制作用[24];灵芝多糖对B细胞和巨噬细胞增殖有促进作用,但对T细胞作用效果不大[25];商陆多糖[26]对T、B淋巴细胞的增殖均有显著的促进作用;金昌枣多糖[27]能够提高RAW264.7细胞的吞噬能力,并呈一定的剂量依赖关系;拐枣多糖[18]能够促进小鼠T淋巴细胞增殖和巨噬细胞的吞噬;经DEAE-52纤维柱和Sephadex G-200柱分离纯化的4种不同分子质量的JP(YP1a、YP2、YP3和YP4a)均可促进小鼠脾淋巴细胞增殖,并呈现量效关系[28],即存在双向性,只有在适宜的剂量时才具有较高的免疫调节活性[29-31],与本试验结果一致,这可能是JP能提高动物机体抗体效价的作用基础[32]。并且本试验结果显示,试验组相对增殖率显著高于LPS对照组,提示4种浓度JP均可能是小鼠脾脏B淋巴细胞的致有丝分裂原,通过促进B淋巴细胞增殖分化,从而增强机体的体液免疫[13],可进行多糖单独刺激试验进行验证。此外,在本试验条件下RGR≥100%,对淋巴细胞无毒性,但是最大无毒浓度还需进一步扩大浓度范围进行确定。
4 结论在本试验条件下,乙醇浓度在60%~90%内提取的JP浓度在0~150 μg/mL内协同LPS均对小鼠脾脏B淋巴细胞增殖有显著促进作用,JP适宜作用浓度为100 μg/mL、乙醇提取浓度为80%。
| [1] |
陈代文, 吴德. 饲料添加剂学[M]. 2版. 北京: 中国农业出版社, 2011: 76-81.
|
| [2] |
王留, 杨艳玲. 大枣多糖对肉仔鸡生长性能和免疫功能的影响[J]. 饲料工业, 2012, 33(6): 8-9. |
| [3] |
张庆, 雷林生, 林勒保, 等. 大枣多糖体外抗补体活性及促进小鼠脾细胞增殖作用[J]. 中药药理与临床, 1998, 14(5): 19-21. |
| [4] |
张庆, 雷林生, 杨淑琴, 等. 大枣中性多糖对小鼠腹腔巨噬细胞分泌肿瘤坏死因子及其mRNA表达的影响[J]. 第一军医大学学报, 2001, 21(8): 592-594. |
| [5] |
赵耀光, 王留. 大枣多糖对蛋雏鸡生长性能和免疫功能的影响[J]. 饲料研究, 2012(7): 79-80. |
| [6] |
JI X L, HOU C Y, YAN Y Z, et al. Comparison of structural characterization and antioxidant activity of polysaccharides from jujube (Ziziphus jujuba Mill.) fruit[J]. International Journal of Biological Macromolecules, 2020, 149: 1008-1018. DOI:10.1016/j.ijbiomac.2020.02.018 |
| [7] |
蔡冰洁, 汪苗苗, 刘咏. 枳椇多糖的分级醇沉及其免疫调节活性的研究[J]. 合肥工业大学学报(自然科学版), 2018, 41(6): 852-858. |
| [8] |
胡伟莲, 戴德慧. 红参药渣中多糖的提取及其醇沉性质分析[J]. 食品研究与开发, 2015, 36(4): 58-61. |
| [9] |
WILLERSHAUSEN B, MARROQUIN B B, SCHAFER D, et al. Cytotoxicity of root canal filling materials to three different human cell lines[J]. Journal of Endodontics, 2000, 26(12): 703-707. |
| [10] |
SHINCHI H, CRAIN B, YAO S Y, et al. Enhancement of the immunostimulatory activity of a TLR7 ligand by conjugation to polysaccharides[J]. Bioconjugate Chemistry, 2015, 26(8): 1713-1723. DOI:10.1021/acs.bioconjchem.5b00285 |
| [11] |
TUVAANJAV S, SHUQIN H, KOMATA M, et al. Isolation and antiviral activity of water-soluble Cynomorium songaricum Rupr. polysaccharides[J]. Journal of Asian Natural Products Research, 2016, 18(2): 159-171. DOI:10.1080/10286020.2015.1082547 |
| [12] |
王晓利, 廖成水, 程源斌, 等. 甘草甜素甘草多糖和光甘草定对小鼠巨噬细胞的毒性与免疫功能的调节[J]. 中国兽医科学, 2014, 44(3): 320-325. |
| [13] |
ZHU Z Y, LIU N, SI C L, et al. Structure and anti-tumor activity of a high-molecular-weight polysaccharide from cultured mycelium of Cordyceps gunnii[J]. Carbohydrate Polymers, 2012, 88(3): 1072-1076. DOI:10.1016/j.carbpol.2012.01.068 |
| [14] |
刘泽华. 大枣多糖提取纯化工艺及其生物活性研究进展[J]. 农业科技与装备, 2016(10): 62-63. |
| [15] |
赵骏, 方玲, 于坤路, 等. 桑叶多糖不同分子量段降血糖作用研究[J]. 中药材, 2010, 33(1): 108-110. |
| [16] |
李赞阳, 刘红, 李炳奇, 等. 不同组分、不同纯度中药复方多糖对小鼠脾淋巴细胞增殖影响[J]. 中兽医医药杂志, 2011, 30(2): 5-7. |
| [17] |
王忠, 马儒林, 牛强, 等. 沙枣多糖对小鼠免疫功能的影响[J]. 现代预防医学, 2013, 40(2): 222-224. |
| [18] |
叶文斌, 樊亮, 王昱, 等. 拐枣多糖对环磷酰胺诱导免疫低下小鼠免疫功能的影响[J]. 现代食品科技, 2016, 32(7): 26-32. |
| [19] |
袁红波, 赵文, 赵仁邦, 等. 金丝小枣糖浆对小鼠免疫功能的影响[J]. 中国食品学报, 2008, 8(1): 13-16. |
| [20] |
赵仁, 刘孟军, 葛微, 等. 高效液相色谱法测定枣中的糖类物质[J]. 食品科学, 2004, 25(8): 138-142. |
| [21] |
杨贵贞. 医用免疫学[M]. 长春: 吉林人民出版社, 1981.
|
| [22] |
郑乃珍, 郑小香, 李萍, 等. 猴头菇多糖对小鼠脾淋巴细胞体外增殖及细胞周期的影响[J]. 中国兽医科学, 2015, 45(8): 837-842. |
| [23] |
张陆曦, 徐红丽, 顾佳雯, 等. 条斑紫菜多糖PY-D2对小鼠脾淋巴细胞生长的影响[J]. 中国免疫学杂志, 2007, 23(12): 1093-1096. |
| [24] |
赵婷婷.不同分子量坛紫菜多糖的制备及其抗衰老活性研究[D].博士学位论文.青岛: 中国科学院研究生院(海洋研究所), 2007.
|
| [25] |
SHAO B M, XU W, DAI H, et al. A study on the immune receptors for polysaccharides from the roots of Astragalus membranaceus, a Chinese medicinal herb[J]. Biochemical and Biophysical Research Communications, 2004, 320(4): 1103-1111. DOI:10.1016/j.bbrc.2004.06.065 |
| [26] |
李晓亮, 魏娜, 王鹏程, 等. 商陆均一多糖对小鼠脾细胞增殖及细胞因子分泌的影响[J]. 中医药学报, 2019, 47(3): 10-13. |
| [27] |
蔡雨晴.金昌枣多糖提取分离、结构表征及生物活性的研究[D].硕士学位论文.阿拉尔: 塔里木大学, 2018.
|
| [28] |
魏然.圆铃大枣多糖提取、纯化及生物活性研究[D].硕士学位论文.泰安: 山东农业大学, 2014.
|
| [29] |
朱轶锋, 韩顺顺, 张克英, 等. 黄芪多糖对鸡淋巴细胞体外增殖及脾脏淋巴细胞分泌细胞因子和相关mRNA表达的影响[J]. 四川农业大学学报, 2018, 36(5): 674-680. |
| [30] |
李志涛, 孙金旭, 刘海鹏, 等. 蛹虫草多糖的提取及对小鼠脾细胞增殖的影响[J]. 食品研究与开发, 2020, 41(2): 117-123. |
| [31] |
张庆, 雷林生, 杨淑琴, 等. 大枣中性多糖对小鼠脾淋巴细胞增殖的影响[J]. 第一军医大学学报, 2001, 21(6): 426-428. |
| [32] |
张红英, 王亚宾, 王学兵, 等. 板蓝根多糖对体外培养的猪脾脏淋巴细胞增殖及分泌细胞因子和NO的影响[J]. 河南农业大学学报, 2009, 43(2): 173-176. |




