随着畜牧业的快速发展,我国牛肉产量也大幅度提高,但是现有产量还远不能满足市场的缺口[1]。尤其是散养户数量和后备肉用母牛数量的减少,使得近些年来牛源出现严重危机。研究表明,荷斯坦公牛具有瘦肉率高、饲料转化率高、增重速度快等特点[2-3]。将荷斯坦公牛进行育肥可能成为弥补我国肉牛资源短缺的一种有效途径[4]。但是如何安全有效地提高荷斯坦公牛的肉用生产性能是有待解决的关键问题。微生物制剂能够在消化道内合成菌体蛋白、消化酶、生长因子和抗菌肽等物质,可以明显地改善肉牛的生长性能,尤其是复合微生物制剂,其作用效果更为突出[5-6]。本试验旨在研究复合微生物制剂(酿酒酵母、枯草芽孢杆菌、地衣芽孢杆菌)对荷斯坦育肥牛生长性能、养分表观消化率、瘤胃酶活性和糖脂代谢的影响,以期为复合微生物制剂在肉牛育肥中的应用提供理论依据。
1 材料与方法 1.1 试验材料复合微生物制剂包括酿酒酵母(活菌数200亿个/g)、枯草芽孢杆菌(活菌数200亿个/g)、地衣芽孢杆菌(活菌数1 000亿个/g),三者组成比例为7 : 2 : 1。试验菌种由本实验室前期筛选并保存。
1.2 试验饲粮试验用全混合日粮参照《肉牛饲养标准》(NY/T 815—2004)配制,其组成及营养水平见表 1。
|
|
表 1 全混合日粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the total mixed ration (DM basis) |
试验选择性别(公牛)相同、品种(荷斯坦)相同、体重[(500±25) kg]相近的荷斯坦公牛20头,按体重随机分为2组,对照组不添加复合微生物制剂,试验组每头牛添加80 g/d复合微生物制剂。试验预试期7 d,正试期55 d。单栏饲养。试验前对场地进行消毒,并对供试牛进行驱虫。饲养过程中饲喂全混合日粮,每日早晚各饲喂1次,自由饮水。
1.4 样品采集及处理于正试期的第15天开始,采用全收粪法连续收集7 d新鲜粪便,用10%硫酸固氮,65 ℃烘干后粉碎并自封袋保存,用以测定养分表观消化率。试验中期利用口腔插管法抽取瘤胃液,5层纱布过滤后-80 ℃保存,用以测定酶活性。试验结束当日清晨空腹采集静脉血,每头牛采血10 mL,3 000 r/min离心10 min,血清-20 ℃冷冻保存,用以测定糖脂代谢指标。
1.5 测定指标 1.5.1 生长性能测定每次饲喂时准确称量饲粮的投喂量和剩余量,并于试验正式开始和结束时清晨空腹称重,用以计算干物质采食量、平均日增重以及料重比。
1.5.2 养分表观消化率测定饲粮和粪样中的干物质(DM)、粗蛋白质(CP)、中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量的测定参照《饲料分析及饲料质量检测技术》的方法进行。采用酸不溶灰分(AIA)作为内源指示剂进行养分表观消化率的计算,计算公式如下:
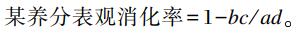
|
式中:a为饲粮中该养分的含量;b为粪样中该养分的含量;c为饲粮中AIA的含量;d为粪样中AIA的含量。
1.5.3 瘤胃液中消化酶活性测定瘤胃液中木聚糖酶、果胶酶、滤纸酶活性采用3、5-二硝基水杨酸比色法测定。取0.5%相应底物溶液0.5 mL,加入0.5 mL酶液,45 ℃水浴5 min,迅速加入3、5-二硝基水杨酸(DNS)溶液终止反应,煮沸5 min后取出加入蒸馏水10 mL摇匀,在分光光度计上550 nm处比色。瘤胃液中蛋白酶、脂肪酶和淀粉酶活性采用试剂盒测定,试剂盒均购于上海劲马试验设备有限公司,主要仪器为HWS-12型水浴锅、721型分光光度计、恒温箱和PL-6906型酶标仪。
1.5.4 血清糖脂代谢指标测定血清中尿素氮、葡萄糖、胆固醇、甘油三酯含量按照试剂盒说明书进行测定,主要仪器为恒温箱和PL-6906型酶标仪。
1.6 数据分析试验所得数据用Excel 2010进行初步整理,再用SPSS 19.0统计软件进行方差分析,并用Duncan氏法进行多重比较。P<0.05为差异显著,P<0.01为差异极显著。
2 结果 2.1 复合微生物制剂对育肥牛生长性能的影响由表 2可知,与对照组相比,试验组干物质采食量与平均日增重分别提高2.74%和28.95%(P<0.05),试验组料重比降低23.27%(P=0.06)。
|
|
表 2 复合微生物制剂对育肥牛生长性能的影响 Table 2 Effects of compound microbial preparation on growth performance of fattening cattle |
由表 3可知,与对照组相比,试验组干物质表观消化率无显著差异(P>0.05),但是试验组粗蛋白质表观消化率提高1.56%(P<0.05),中性洗涤纤维表观消化率提高1.93%(P<0.05)。
|
|
表 3 复合微生物制剂对育肥牛养分表观消化率的影响 Table 3 Effects of compound microbial preparation on nutrient apparent digestibilities of fattening cattle |
由表 4可知,与对照组相比,试验组瘤胃液中蛋白酶和淀粉酶活性分别提高8.87%(P<0.01)和10.27%(P<0.05),试验组瘤胃液中果胶酶活性提高18.63%(P<0.01),但是试验组瘤胃液中脂肪酶、木聚糖酶和滤纸酶活性差异不显著(P>0.05)。
|
|
表 4 复合微生物制剂对育肥牛瘤胃消化酶活性的影响 Table 4 Effects of compound microbial preparation on rumen digestive enzyme activities of fattening cattle |
由表 5可知,与对照组相比,试验组血清中葡萄糖含量提高11.67%(P<0.01),胆固醇和甘油三酯含量分别提高22.91%和12.84%(P<0.01)。
|
|
表 5 复合微生物制剂对育肥牛血清糖脂代谢指标的影响 Table 5 Effects of compound microbial preparation on serum glycolipid metabolism indexes of fattening cattle |
作为营养物质吸收的直接表现,增重效果一直以来都是人们关注的重点[7]。本试验中,试验组平均日增重比对照组提高28.95%,说明所添加的复合微生物制剂对荷斯坦公牛的增重效果有显著的促进作用。而采食量的提升是提高增重效果的基础,在本试验中,试验组干物质采食量比对照组提高2.74%。采食量和日增重的提升可能是由于所添加的复合微生物制剂对瘤胃的发酵起到了一定的调控作用。相关研究表明,枯草芽孢杆菌和地衣芽孢杆菌能够产生丰富的蛋白酶、淀粉酶、细胞壁裂解酶和半纤维素酶等,通过改善消化道内生理过程来促进营养物质的消化吸收,从而提高动物的生长性能[8-9]。本试验中,试验组料重比也有明显的降低,这说明复合微生物制剂不只是通过采食量的增加促使日增重的提升,而且对饲粮的消化吸收也具有调控作用。饲料转化率的提高可能来源于2方面因素:一是复合微生物制剂提高了瘤胃对营养物质的消化能力;二是其促进了机体对营养物质的吸收转运以及储备能力,其具体的作用机理还有待进一步探究。
3.2 复合微生物制剂对育肥牛养分表观消化率的影响养分消化率的改善是提高动物生长性能的基础。反刍动物进食后,饲粮首先在瘤胃内进行微生物发酵,然后再进入其他胃室进行消化[10]。其养分的消化主要依赖于瘤胃微生物的降解。本试验中,干物质表观消化率提升的并不显著,但是粗蛋白质和中性洗涤纤维表观消化率分别提升1.56%和1.93%,其原因可能是由于试验所用复合微生物制剂对瘤胃有益菌的快速繁殖起到积极的调节作用。因为酵母能够提高瘤胃内白色瘤胃球菌和黄色瘤胃球菌的数量,从而提高纤维降解酶的活性[11],而枯草芽孢杆菌能够提高瘤胃蛋白分解菌和淀粉分解菌的数量,促进蛋白质和淀粉的降解[12]。碳源和氮源的降解速度同时提高,可以为瘤胃内的有益菌群繁殖提供充足且均衡的物质基础。
3.3 复合微生物制剂对育肥牛瘤胃消化酶活性的影响蛋白酶是瘤胃内促进蛋白质降解的一类活性物质的总称。瘤胃内丰富的蛋白酶系统及较高的酶活性是蛋白质消化吸收的首要条件。因为能够进入小肠被消化吸收的蛋白质1/2以上来自微生物蛋白[13],而饲粮中的植物蛋白质要在瘤胃内完成降解和微生物合成2个过程才能转化为微生物蛋白。在本试验中,试验组瘤胃液中蛋白酶活性比对照组提高8.87%,说明本试验所采用的复合微生物制剂对提高瘤胃蛋白酶活性有显著功效。因为其中包含的微生物不仅在自身繁殖的过程中能够产生蛋白酶[14],而且能够促进瘤胃固有的蛋白降解菌产生蛋白酶[12]。本试验中,复合微生物制剂对瘤胃液中脂肪酶活性没有显著影响,但是提高了瘤胃液中淀粉酶活性,其原因可能是由于复合微生物制剂促进瘤胃微生物繁殖的过程中,瘤胃微生物菌群需要快速获得更多的能源物质而形成反馈调节,促使淀粉快速降解提供能源和前体物。复合微生物制剂还提高了瘤胃液中果胶酶的活性,这可能是中性洗涤纤维消化率得到改善的直接原因。因为果胶是初生细胞壁和次生细胞壁间纤维素、半纤维素的黏接物[15],果胶酶活性提高能够促使果胶的降解,为纤维降解提供有利条件。但是本试验中木聚糖酶和滤纸酶活性并未发生明显改变,其原因可能是微生物的效能还不足以使粗纤维的降解发生明显变化,或是微生物的快速繁殖使饲粮降解速度加快,在瘤胃内停留时间变短,酶的作用时间不足所致。
3.4 复合微生物制剂对育肥牛血清糖脂代谢指标的影响血液中胆固醇和甘油三酯的含量是衡量脂类代谢的重要指标[16-17],血液中的葡萄糖除了直接为机体供能以外,还会以糖原或脂类的形式保存于机体当中。本试验血清中胆固醇及甘油三酯含量显著升高的原因是由于进入血液的葡萄糖含量升高还是添加剂促进了脂类的直接摄入还有待深入研究。反刍动物瘤胃中的乳酸含量提升后会迅速转化为丙酸,随后被动物吸收,再进入肝脏异生为葡萄糖供机体使用[18]。本试验瘤胃中淀粉酶活性增高,为乳酸菌发酵提供了充足的糖类物质基础,同时,添加剂中的酵母又能够促进乳酸菌的快速繁殖[19],可使大量的乳酸转变为丙酸而被吸收,再由肝脏异生为糖,这可能是本试验中血清葡萄糖含量显著升高的原因。
4 结论本试验中的复合微生物制剂对荷斯坦公牛的干物质采食量和增重效果都有促进作用,能够在一定程度上改善料重比,并且复合微生态制剂能够提高部分瘤胃消化酶活性,改善营养物质的消化吸收。
| [1] |
曹婷, 李汉丰, 刘诚, 等. 我国肉牛养殖现状及存在的问题和解决对策[J]. 家畜生态学报, 2018, 39(11): 79-82. |
| [2] |
赵晓川, 王嘉博, 亓美玉. 奶公犊牛产业的发展现状[J]. 饲料广角, 2013(24): 40-43. |
| [3] |
赵洋洋, 韩永胜, 李伟, 等. 不同蛋白质水平高精料饲粮对荷斯坦奶公牛育肥性能、养分表观消化率及血清生化指标的影响[J]. 动物营养学报, 2019, 31(7): 3123-3134. |
| [4] |
李秋凤, 杜柳柳, 曹玉凤, 等. 中国荷斯坦奶公牛肉用研究进展[J]. 畜牧与兽医, 2017, 49(8): 138-141. |
| [5] |
申惠敏, 李沂肖, 杜晓明, 等. 肉牛微生态饲料添加剂的作用及机理[J]. 中国畜禽种业, 2015, 11(11): 91-92. |
| [6] |
高堂亮, 沈思军, 潘晓亮, 等. 微生态制剂对肉牛生长性能和血清生化指标的影响[J]. 畜牧与兽医, 2018, 50(7): 29-32. |
| [7] |
GRVNWALDT E G, GUEVARA J C, ESTÉVEZ O R, et al. Biochemical and haematological measurements in beef cattle in Mendoza plain rangelands (Argentina)[J]. Tropical Animal Health and Production, 2005, 37(6): 527-540. DOI:10.1007/s11250-005-2474-5 |
| [8] |
符运勤.地衣芽孢杆菌及其复合菌对后备牛生长性能和瘤胃内环境的影响[D].硕士学位论文.北京: 中国农业科学院, 2012.
|
| [9] |
SHAH N P. Functional cultures and health benefits[J]. International Dairy Journal, 2007, 17(11): 1262-1277. DOI:10.1016/j.idairyj.2007.01.014 |
| [10] |
沈美英.日粮内不同粗饲料品质对绵羊瘤胃发酵功能和微生物区系的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2006.
|
| [11] |
张翔飞.活性干酵母对肉牛瘤胃发酵、纤维降解及微生物菌群的影响[D].硕士学位论文.雅安: 四川农业大学, 2014.
|
| [12] |
邓露芳.日粮添加纳豆枯草芽孢杆菌对奶牛生产性能、瘤胃发酵及功能微生物的影响[D].博士学位论文.北京: 中国农业科学院, 2009.
|
| [13] |
SPICER L A, THEURER C B, SOWE J, et al. Ruminal and post-ruminal utilization of nitrogen and starch from sorghum grain-, corn-and barley-based diets by beef steers[J]. Journal of Animal Science, 1986, 62(2): 521-530. DOI:10.2527/jas1986.622521x |
| [14] |
李睿, 崔曦, 汪新星, 等. 枯草芽孢杆菌微生态制剂的研究与应用进展[J]. 预防医学论坛, 2018, 24(12): 959-960, 969-970. |
| [15] |
仲伟光.羊草不同加工方式对杂交羊生产性能、肉品质及营养物质消化吸收的影响[D].硕士学位论文.长春: 吉林农业大学, 2017.
|
| [16] |
惠朝俭, 王文波, 许德华, 等. 南阳黄牛血清总胆固醇的测定[J]. 中国良种黄牛, 1985(2): 45-48. |
| [17] |
李胜开.南方农副产品混合青贮饲料的营养价值评定及对肉牛生长性能和血液生化指标的影响[D].硕士学位论文.南宁: 广西大学, 2017.
|
| [18] |
孟庆翔, 周振明, 吴浩. 肉牛营养需要[M]. 北京: 科学出版社, 2018: 71-72.
|
| [19] |
CALLAWAY E S, MARTIN S A. Effects of a Saccharomyces cerevisiae culture on ruminal bacteria that utilize lactate and digest cellulose[J]. Journal of Dairy Science, 1997, 80(9): 2035-2044. DOI:10.3168/jds.S0022-0302(97)76148-4 |




