养猪生产在国民经济、社会稳定及人民生活水平等方面具有十分重要的作用。然而,长期以来,生猪养殖饱受疾病的困惑,生产水平和产品安全难以提升。常见生猪疾病包括传染性胃肠炎、流行性腹泻、蓝耳病、伪狂犬病、轮状病毒病、圆环病毒病等。近年来,非洲猪瘟的爆发更是对行业带来了巨大冲击。如何克服疾病的危害,保障产业持续健康发展是行业面临的重大课题。
免疫是动物抵抗疾病的根本机制,是机体识别并消灭病原体、抵御病原体感染的重要生理功能,动物抗病力高低取决于免疫机能的强弱。现代医学和营养学研究发现,营养对机体免疫反应具有重要的调节作用。免疫系统的发育和免疫功能的发挥有赖于机体的长期营养状况和短期营养供给,良好的营养状况和合理的营养物质供给可以提高机体免疫力,增强抗病能力。本综述将结合本团队长期开展抗病营养研究的结果,对猪的免疫机制、抗病营养研究的疾病模型以及营养与免疫关系的研究进展进行总结,旨在为抗病营养和其在生产实践中的应用提供参考。
1 猪免疫机制免疫是动物机体免疫系统识别自身和非自身物质,并通过免疫应答,破坏和排除抗原性异物,包括病原微生物或机体本身的损伤细胞,以维持正常生理稳态的功能。免疫是动物抗病的最根本机制,在漫长的进化过程中,其作用方式在不同种类动物(如哺乳动物)中非常保守且稳定。对于猪的抗病能力,免疫具有2个基本功能:1)免疫防御,即帮助机体抵御病原微生物,包括病毒、细菌、真菌等感染,消灭并排斥已入侵的病原体;2)免疫自稳,即帮助机体清除病原体感染造成的损伤细胞和新陈代谢过程中产生的大量衰老坏死细胞,促进机体恢复和维持生理稳态。因此,通过营养干预来调节免疫,可以提高动物的抗病能力以及恢复力,对生猪疾病防御及病后恢复生产具有重要意义。
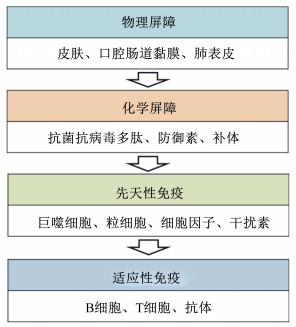
广义的免疫包括物理屏障、化学屏障、先天性免疫和适应性免疫(图 1)[1]。物理屏障和化学屏障构成机体抵御感染的第1道防线。皮肤、呼吸道和肠道表皮黏膜阻止机体内部组织暴露在病原微生物下。同时黏膜表面产生抗菌蛋白(如防御素),作为天然抗生素防止微生物进入体内。当物理屏障和化学屏障出现缺口,先天性免疫迅速介入。
|
图 1 机体抵御病原体感染的防线 Fig. 1 Defense against body pathogen infection[1] |
先天性免疫对病原体感染反应迅速,其持续时间短且不具有特异性(图 2)。由先天性免疫感受细胞,主要是巨噬细胞和树突细胞,通过表面模式识别受体(pattern recognition receptors,PRRs),识别微生物病原体被称为病原相关分子模式(pathogen-associated molecular patterns,PAMPs)的分子结构。Toll样受体(Toll-like receptors,TLRs)是巨噬细胞表面常见的跨膜PRRs,可以识别微生物PAMPs,如细菌细胞壁中的脂多糖(lipopolysaccharide,LPS)和病原体中常见的未甲基化CpG核糖核酸。巨噬细胞内也存在PRRs,如NOD样受体(NOD-like receptors,NLRs),可以识别细胞内入侵的细菌。其他胞内PRRs可以识别病毒RNA和自身损伤细胞[1]。

|
图 2 免疫应答时间线 Fig. 2 Timeline of immune response[1] |
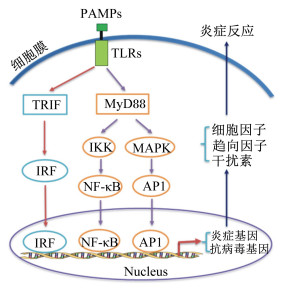
巨噬细胞、树突细胞和其他先天性免疫细胞不仅是感受细胞,同时也是效应细胞,继续通过炎症反应和吞噬作用,抵御和清除病原微生物感染。其中巨噬细胞广泛存在于不同组织(如肠道、肺脏、肝脏、神经),可迅速对病原体入侵做出应答。巨噬细胞和其他先天性免疫细胞识别病原微生物、释放细胞因子和趋向因子的过程被称为炎症反应。当病原体被PRRs(如TLRs和NLRs)识别,便激活下游炎性相关信号通路,产生炎症细胞因子、趋向因子、抗菌肽和抗病毒干扰素。大多数TLRs响应不同的病原体配体激活核因子-κB(NF-κB)转录因子,也可以通过丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)激活蛋白1(activator protein 1,AP1)转录因子,最终促进炎症因子和趋向因子表达。TLRs同时可以激活干扰素调节因子(interferon regulatory factor,IRF)转录因子,促进抗病毒Ⅰ型干扰素(interferon,IFN)表达(图 3)。TLRs识别细胞外病原微生物,NLRs识别细胞内微生物产物。与TLRs相似,大多数NLRs(NLRP3、NLRP1、NLRC4)识别并结合不同的病原体配体,与ASC和pro-caspase-1形成炎症小体,触发细胞凋亡蛋白酶-1(caspase-1)自激活。caspase-1促使细胞因子,如白细胞介素(interleukin,IL)-1β和IL-18激活,并导致被感染细胞焦亡,从而释放大量细胞因子。细胞因子根据功能和结构不同分为不同的家族蛋白,协同来实现抗病能力,包括集落刺激因子(colony-stimulating factor,CSF)促进免疫细胞增殖和分化;IFN促进T细胞识别和抗病毒;ILs导致机体发热、促进免疫细胞增殖和转运、促进细胞因子表达,某些ILs,如IL-10等具有抗炎症作用,帮助机体感染后恢复免疫稳态;肿瘤坏死因子(tumor necrosis factors,TNFs)具有促进炎症反应、促使感染细胞凋亡、增强淋巴细胞增殖等功能。趋向因子[如单核细胞趋向吸引蛋白(monocyte chemoattractant proteins,MCPs)]引导免疫细胞转运至目标位点发挥抗病作用。除去炎症作用,吞噬作用也是先天性免疫重要组成。主要的吞噬细胞包括巨噬细胞和树突细胞,进入组织的病原体微生物被识别,然后被吞噬细胞吞噬并在溶酶体中被消化,其中抗原决定簇通过组织相容性复合体(major histocompatibility complex,MHC)Ⅰ和MHC Ⅱ传递至细胞表面,用于T细胞识别和适应性免疫激活。
|
PAMPs:病原相关分子模式pathogen-associated molecular patterns;TLRs:Toll样受体Toll-like receptors;TRIF:β干扰素TIR结构域衔接蛋白TIR domain containing adaptor protein inducing interferon-β;IRF:干扰素调节因子interferon regulatory factor;MyD88:髓样分化因子88 myeloid differential factor 88;IKK:κB抑制蛋白激酶inhibitor kappa B protein kinase;MAPK:丝裂原活化蛋白激酶mitogen-activated protein kinases;NF-κB:核因子-κB nuclear factor kappa B;AP1:激活蛋白1 activator protein 1;Nucleus:细胞核。 图 3 先天性免疫炎性反应激活 Fig. 3 Innate immune related inflammation activation |
先天性免疫细胞将抗原呈递给特异性淋巴细胞,协同细胞因子作用,促进淋巴细胞增殖分化,对病原体进行特异性清除,即适应性免疫应答。适应性免疫应答通过T、B淋巴细胞来实现功能,具有响应速度较慢但通常持续时间长的特点(图 2)。T淋巴细胞有2类:CD8+细胞毒性T细胞和CD4+辅助T细胞。CD8+T细胞识别由MHC Ⅰ呈现的微生物多肽,并直接杀死病毒感染细胞,避免病毒复制和释放。CD4+辅助T细胞识别由MHC Ⅱ呈现的抗原,分化并产生大量细胞因子,增强先天性免疫细胞能力,如巨噬细胞对微生物的杀伤作用,也促进B淋巴细胞激活。B淋巴细胞主要参与体液免疫,合成能与靶抗原结合的免疫球蛋白(immunoglobulin,Ig),即为抗体。哺乳动物中有5类Ig,分别为IgG、IgM、IgA、IgD和IgE。在猪中,IgG、IgM、IgA为主要的Ig。IgG是血清中含量最高的Ig,具有抗菌、抗病毒、抗毒素等作用。IgM是体液免疫最早应答的Ig,具有比IgG更强的杀菌作用,但持续时间短且含量少。IgA分血清型和分泌型,其中分泌型IgA主要存在于消化道、呼吸道等,对机体黏膜免疫起重要作用[1]。
以上主要介绍免疫系统对疾病感染的应答,并列出相关免疫指标。下面将主要通过综述营养物质对免疫相关指标的调节作用,来揭示抗病营养的最新研究进展。
2 建立抗病营养研究的疾病模型为了研究病原微生物的治病机制,以及寻找提高动物抗病力的方法,通过化学药品诱导或者人为病原微生物侵袭的方式,建立了不同病原微生物攻毒疾病模型。本节将简要介绍常用攻毒模型。
2.1 化学药品攻毒构建疾病模型病原体感染总伴随着严重的炎症反应,大量炎性细胞因子累积导致的细胞凋亡也是病原体致病的主要原因。细菌细胞壁中的LPS或病原体中常见的未甲基化的CpG常被用来激活炎症反应。LPS或者未甲基化的CpG可以通过腹腔注射攻毒,通过分别激活巨噬细胞中TLR4或TLR9介导的炎症信号通路,释放炎性细胞因子[IL-1β、IL-6及肿瘤坏死因子-α(TNF-α)等],激活先天性免疫,后续导致全身性炎症反应,被广泛作为研究感染和炎症的体内模型(图 3)。LPS和未甲基化的CpG可直接作用于细胞,也可以作为体外攻毒试剂,如体外诱导巨噬细胞发生炎症应答。
口服葡聚糖硫酸钠(dextran sulfate sodium,DSS)攻毒构建炎症性肠病模型,被普遍用来研究继发性感染导致的肠道炎性损伤。DSS攻毒导致肠道机械屏障损坏,肠道通透性增大,引起肠道有害菌(如大肠杆菌)继发性感染,导致肠道出血、腹泻等症状[2]。DSS诱导炎性肠病主要通过引发继发性感染,通常不用做体外试验。化学药品攻毒具有安全、稳定性好、简便易操作等优点,然而并不能反映猪在实际感染情况下的免疫反应。
2.2 病原微生物攻毒构建疾病模型为了更真实地模拟甚至重现动物对病原微生物感染、致病和自愈的全过程,以及准确评估营养对猪抗病能力的调节作用,通过人为将病原微生物直接接种或灌服给动物(如仔猪)或细胞(肠上表皮细胞、巨噬细胞等),构建了病原微生物攻毒的体内外模型。病原微生物攻毒构建疾病模型是本课题组最主要的猪抗病营养研究手段,涉及的病原微生物包括大肠杆菌(Escherichia coli,E. coli)、轮状病毒(rotavirus,RV)、猪传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)、猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)和猪2型圆环病毒(porcine circovirus 2,PCV2)等。建立攻毒模型,首先将病原微生物(如病毒)从病猪体内分离并鉴定。其次将病毒进行体外培养和增殖,通常采取体外易感细胞培养,收取病毒液。对病毒滴度进行测定,通常采用Reed和Muench法,测定半数组织培养感染剂量(median tissue culture infective dose,TCID50)。病毒的病毒滴度以TCID50/mL表示,也可采用空斑形成单位(plaque forming unit,PFU)或感染复数(multiplicity of infection,MOI)表示。病毒培养液在仔猪中攻毒常采取直接灌服攻毒,在2~3 d仔猪出现症状,如腹泻、采食量降低,4~5 d达到高峰,由于通常选用毒力较弱病原体,攻毒仔猪并不致死,大约在攻毒1周后缓慢恢复,攻毒试验期一般在4~14 d。根据攻毒仔猪的疾病活跃指数,可观察病毒初期感染、症状爆发、痊愈不同阶段免疫应答变化,为精准研究营养物质在各个阶段如何调控免疫及改善抗病能力提供基础。病原体可以直接作用于不同类型的细胞,因此也常被用做体外试验模型,如攻毒猪肠上皮细胞(IPEC-J2细胞)。由于病原微生物来源于病猪且具有传染力,通常选用感染力、致病力较弱的病毒,试验过程中生物安全需要严格把控,以防散播。需要注意,病毒通过体外培养,毒力将逐渐变弱消退[3-10]。
3 营养与免疫研究进展前文介绍了病原微生物如何激活免疫,又是如何逃避免疫。本节将在疾病模型的基础上,通过综述目前抗病营养研究进展,探讨如何通过营养手段缓解疾病的发生,提高机体免疫力及抗病能力。
3.1 饲粮蛋白质和氨基酸对免疫功能的调节饲粮蛋白质水平对维持动物的免疫功能起到重要作用。目前,基于“理想蛋白质模型”的低蛋白质饲粮研究显示,适度降低饲粮蛋白质水平,并添加合成氨基酸,并不显著影响猪的生长性能,同时节约成本和减少氮排放造成的环境污染。那么,低蛋白质水平饲粮是否会影响机体免疫功能?彭燮[11]研究报道,在饲粮蛋白质水平降低不影响生长性能的范围内(< 5%),血液中Ig含量、T淋巴细胞数量,肠道中TLR-NF-κB信号通路及炎性细胞因子表达均不受影响;然而,当饲粮蛋白质水平下降到影响生长的程度(>6%),血液IgG含量和CD3+T细胞数量均显著降低,TLR-NF-κB信号通路相关分子表达降低;进一步研究发现,在低蛋白质水平饲粮中添加酪蛋白,可以恢复其免疫功能。因此,低蛋白质水平饲粮需要满足机体生长及免疫功能所需的蛋白质。
疾病引起的免疫应答导致机体氨基酸代谢不平衡,在饲粮中添加氨基酸可以增强机体免疫力,加速清除病原体,并可以缓解免疫应激。赖翔[12]报道,在PRV攻毒断奶仔猪模型中,饲粮额外添加5%的苏氨酸可以提高血清PRV抗体50%,血液中CD3+T细胞数量增多、IgA、IgG、IgM和补体3(C3)含量均有提高;同时,添加苏氨酸可以缓解机体炎症反应,如促炎因子IL-1β、TNF-α含量降低,抗炎因子IL-10含量增高,有助于缓解免疫应激,加速感染后恢复。古长松[8]报道,在RV攻毒仔猪模型中,饲粮添加异亮氨酸可以缓解病毒感染导致的腹泻和生长性能下降,提高血清和肠道中RV抗体含量、Ig含量、炎性细胞因子表达量和血液中CD4+T细胞数量,促进病毒清除。杨平[13]报道,在感染猪繁殖与呼吸综合征病毒的母猪中,妊娠期(30~114 d)饲粮添加1%精氨酸可显著提高产子数和活仔重,提高母猪血清猪繁殖与呼吸综合征病毒抗体、IgG和IgM含量,提高母猪抗病毒能力。其他氨基酸,如亮氨酸,可以用于缓解RV和TGEV感染;通过利用IPEC-J2细胞发现,亮氨酸可以通过激活哺乳动物雷帕霉素靶蛋白(mTOR)信号,抑制NF-κB信号,抑制病毒复制,缓解炎症反应[14]。由此可见,饲粮中添加氨基酸可以缓解病原体感染,增强机体免疫力,缓解免疫应激,提高机体抗病能力。
3.2 饲粮脂质对免疫功能的调节脂质在饲粮中主要作为能量物质添加,但是其也具有多种生理作用。刘忠臣[15]报道了不同来源脂质(猪油、椰子油和鱼油)对毒性大肠杆菌感染仔猪的缓解作用。相较于饲粮添加猪油,添加椰子油和鱼油可显著提高断奶仔猪的平均日增重和饲料转化率,降低IL-1β在血清中含量和肠道中表达,缓解大肠杆菌攻毒导致的生长性能下降和免疫应激。然而,关于饲粮中添加不同脂质对猪抗病能力的影响及其深入机制的研究依旧不清楚。
3.3 饲粮维生素对免疫功能的调节维生素参与诸多生理功能的调节也是在动物生产中必不可少的添加剂。大量研究表明,饲粮中添加超过NRC推荐量的维生素,包括维生素D、叶酸、生物素、尼克酸、泛酸等,可以显著改善猪的免疫应激,提高生产力。本节将以本团队研究为主,介绍维生素对动物抗病能力和免疫调节的作用。
维生素D的主要功能是调节机体钙、磷代谢,维持钙、磷平衡,促进骨骼发育。近年研究发现,维生素D具有免疫调节作用。研究报道,饲粮高水平维生素D显著缓解了RV攻毒导致的生产性能下降、肠道黏膜损伤以及血清IL-6、IL-2含量升高,显示维生素D可以提高抗病力,缓解免疫应激[16-17]。进一步研究显示,维生素D通过调节肠黏膜维甲酸诱导基因蛋白-I(RIG-I)信号和miRNA-155-5p/TANK结合激酶1(TBK1)/干扰素调节因子3(IRF3)信号通路,调节先天性免疫应答和干扰素-β(IFN-β)释放,来控制RV复制[10]。
生物素在机体内作为羧化酶辅酶,参与碳水化合物、脂肪和蛋白质代谢,是机体不可缺少的水溶性维生素。陈宏[18]报道,饲粮添加生物素可缓解猪圆环病毒2型攻毒对仔猪生长性能和免疫功能的影响。饲粮添加0.3 mg/kg生物素可缓解猪圆环病毒2型攻毒引起的日增重、采食量和饲料转化率下降,同时降低组织损伤。饲粮添加生物素可促进仔猪血清中(病毒)抗体产生、增加IgG和干扰素-γ(IFN-γ)含量,提高脾脏和淋巴组织中IL-2和IFN-γ的mRNA表达量[18]。
叶酸主要介导机体一碳代谢,广泛参与遗传物质、蛋白质等代谢过程,维持机体正常功能,如免疫功能。叶酸缺乏会导致T淋巴细胞增殖降低,免疫应答减弱,机体抗病能力下降。高庆[19]报道,饲粮中添加叶酸可以缓解LPS攻毒导致的淋巴细胞凋亡、外周淋巴CD3+和CD8+T细胞数量减少。同时,添加叶酸可降低血清TNF-α含量,提升IL-10含量,缓解LPS导致的免疫应激。
维生素参与机体物质代谢和功能调节的各个方面。病原微生物感染引起的免疫稳态和代谢稳态的改变,对维生素的需要也随之改变,适当添加某些维生素将有助于提高机体抗病能力。
3.4 饲粮微量矿物质元素对免疫功能的调节微量矿物元素是动物体内多种酶的重要辅基,在维持酶活性和生命活动方面起到重要作用。饲粮中添加铜和锌对促进动物生长、抑制肠道有害菌、缓解免疫应激、增强抗病能力具有显著效果。因此,在生产中饲粮添加高铜、高锌以提高猪的生长性能;但是,饲粮添加高铜、高锌却对环境、肉质及动物健康带来了负面效果。目前已有规范,严格限制高铜、高锌在饲粮中的添加量,本节对此不做赘述,主要讨论微量元素硒对动物免疫的作用。人和小鼠的研究表明,硒对免疫的不同阶段,包括先天性免疫、细胞免疫和体液免疫均有影响。补充硒可以增强动物感染或者接种疫苗后产生抗体的能力,增加血液IgG含量;可以促进淋巴细胞增殖和分化能力;缺乏硒会导致巨噬细胞和白细胞对病原微生物的吞噬能力下降[20]。黎文彬[21]研究显示,在仔猪饲粮中添加硒对LPS诱导的免疫应激,如炎性细胞因子、Ig含量具有调节作用,但关于硒的抗病促免疫作用还需要深入研究。此外,添加过量硒会导致动物硒中毒。综上所述,过量添加微量矿物质元素应该受到限制,应继续探索提高矿物质元素利用率,降低排放和增强免疫力的替代方案。
3.5 其他功能性添加剂的免疫调节作用随着抗生素在动物生产中禁用,越来越多的研究致力于寻找抗生素替代品,因此出现了许多功能性添加剂,如糖类物质、酸化剂、植物提取物、益生菌、动物制品等,被证明具有维持动物生长,调节免疫应答等功效。本节将列举具有免疫调节功能的添加剂。
3.5.1 糖类物质糖类物质是一类由单糖以共价键结合所形成的化合物,包括单糖、寡糖、多糖。目前研究发现,某些植物中的寡糖、多糖具有免疫调节等多种生理作用,对仔猪肠道健康具有保护作用,可作为抗生素替代品。陈浩[22]报道,果胶寡糖可以缓解RV导致的生长性能下降、腹泻、肠道损伤,提高血清中IgG和RV抗体含量,提高空肠分泌型IgA和IFN-γ含量。Wan等[23]和Zhang等[24]报道,低聚壳聚糖缓解大肠杆菌攻毒引起的仔猪生长性能下降、肠道和血清炎性因子(IL-6和TNF-α)含量升高,其通过抑制NF-κB信号通路缓解炎症反应和肠上皮细胞凋亡。秦林林[25]报道,银耳孢子多糖可缓解LPS攻毒导致的血清炎性细胞因子(IL-1β、TNF-α)含量升高和肝脏损伤,改善仔猪腹泻。其他糖类物质,如甘露寡糖、低聚木糖、褐藻酸寡糖、香菇多糖等,在仔猪研究中均有报道具有免疫调节功能,可以缓解病原微生物攻毒导致的生长性能下降、腹泻、肠道损伤。但由于其结构和组成复杂,在体内消化代谢不完全清楚,因此其调控免疫应答的机制也有待深入研究。
3.5.2 酸化剂饲料酸化剂主要用途是调节肠道pH,提高消化酶活性。近期研究发现,一些酸化剂(丁酸、苯甲酸)具有增加动物抗病能力的作用。王纯刚等[26]报道,饲粮添加0.3%的丁酸钠可缓解RV攻毒导致的仔猪生长性能下降、腹泻和肠道损伤,同时可提高血清中RV抗体和IL-4含量,表现出抗炎症作用。然而,Yan等[27]报道,丁酸钠可以直接保护肠上皮细胞紧密连接,维持肠细胞间隙完整性。因此,丁酸是否可直接调控免疫,还需要深入研究。
3.5.3 植物提取物大量研究证明,植物提取物具有抑菌抗病毒作用,具有促进动物生产性能、增强机体免疫力、改善肠道健康和产品品质等多种功效。中国中草药资源丰富,在抗生素被禁的今天,中草药添加剂和植物提取物有望成为抗生素最佳替代品,增强动物抗病能力。植物提取物主要由糖类、生物碱、多酚和黄酮组成。上文已单独列举糖类对免疫的调节作用。王俊文[28]报道,饲粮中添加50 mg/kg白藜芦醇可以有效缓解蓝耳病弱毒苗攻毒导致猪的采食量和日增重降低、体温升高,降低血清IL-1β含量和提高血清病毒特异性抗体含量,显示其增强免疫和缓解炎症的作用。贾淋雁[29]研究发现,饲粮中添加复合精油(主要有萜烯和苯基甲烷衍生物组成)可以改善猪机体免疫功能,保护肠道屏障功能,提高抗病毒能力。饲粮添加复合精油可缓解猪流行性腹泻病毒攻毒导致的日增重下降和腹泻率增高;降低血清炎性细胞因子(TNF-α和IL-6)含量,提高血清抗炎细胞因子(IL-10和IL-4)含量,显示其抗炎症作用;显著提高血清IFN-γ含量和肠道IFN-β和IFN-γ表达,提高抗病毒能力。同时研究发现,添加复合植物精油相较单一植物精油(牛至油)效果更好[29]。其他一些植物提取物,如大豆异黄酮、皂苷、百里香酚等在小鼠研究中都报道具有抗菌抗病毒作用,也体现出植物提取物作为抗生素替代品的潜力[30-31]。
3.5.4 益生菌研究发现,动物微生物菌群与免疫功能相关,也因此通过在饲粮中添加益生菌来调节机体免疫力和抗病力。徐琴[32]报道,饲粮添加酵母菌可缓解大肠杆菌攻毒引起的仔猪腹泻和肠道损伤,降低大肠杆菌在肠道的数量,显著降低血液中IL-6含量,并下调TLRs信号通路相关基因在肠道和淋巴结的表达,表现出抑制病原菌增殖和抗炎症作用,但其对血液中淋巴细胞数量和Ig含量并没有显著影响。汤俊[33]报道,饲粮添加鼠李糖乳酸杆菌可缓解RV攻毒造成的仔猪腹泻和料重比升高,提高血清中CD4+T细胞数量、IgG和IL-4含量,提高肠道中RV抗体、分泌型IgA、IFN-γ和IL-4含量。因此,研究表明鼠李糖乳酸杆菌可以增强机体免疫力和抗病毒能力。
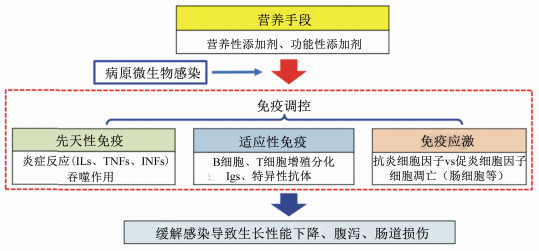
4 小结在生猪养殖业中,确保动物健康和保证生产水平是永恒的主题。在无抗条件下,如何通过提高生猪自身抗病能力是抗病营养的重要目标。免疫是动物抗病的根本,抗病营养理论核心是对机体免疫的调控。本文通过对生猪常见疾病和免疫应答的介绍,以及列举营养措施在不同疾病模型下对猪免疫能力的调控作用,显示营养手段调节猪免疫功能、提高抗病能力的可行性。总结营养调控免疫促进抗病能力,主要从以下3个方面发挥作用(图 4):1)促进先天性免疫应答,加速先天性免疫细胞(如巨噬细胞)对病原体的清除和促进抗菌抗病毒细胞因子释放。2)激活获得性免疫,促进B、T淋巴细胞增殖分化,促进Ig合成和特异性抗体产生。3)感染恢复期,缓解免疫应激,抑制炎症反应,加速机体恢复。在未来,进一步完善抗病营养理论基础、开发高效精准的无抗营养技术和产品,需要精确研究不同营养素的作用机制和阶段,同时结合机体自身代谢和微生物菌群,对机体免疫调控达到精确化、规避免疫应激的负面效果,使抗病性能发挥最大效能,最终寻求抗病营养优化平衡点。
|
ILs:白细胞介素interleukin;TNFs:肿瘤坏死因子tumor necrosis factors;IFNs:干扰素interferons;Igs:免疫球蛋白immunoglobulin。 图 4 营养调控机体免疫方式 Fig. 4 Nutritional regulation on immunity |
| [1] |
MURPHY M, WEAVER C. Janeway's immunobiology[M]. 9th ed. New York, NY: Garland Science, 2016.
|
| [2] |
XIAO Y, YAN H L, DIAO H, et al. Early gut microbiota intervention suppresses DSS-induced inflammatory responses by deactivating TLR/NLR signalling in pigs[J]. Scientific Reports, 2017, 7: 3224. DOI:10.1038/s41598-017-03161-6 |
| [3] |
单虎. 兽医传染病学[M]. 北京: 中国农业大学出版社, 2017.
|
| [4] |
陈谊, 郑明. 人猪共患疾病与感染[M]. 北京: 中国农业出版社, 2017.
|
| [5] |
MA Y L, WANG C L, XUE M, et al. The coronavirus transmissible gastroenteritis virus evades the type Ⅰ interferon response through IRE1α-mediated manipulation of the microRNA miR-30a-5p/SOCS1/3 axis[J]. Journal of Virology, 2018, 92(22): e00728-18. DOI:10.1128/JVI.00728-18 |
| [6] |
WU A M, YU B, ZHANG K Y, et al. Transmissible gastroenteritis virus targets Paneth cells to inhibit the self-renewal and differentiation of Lgr5 intestinal stem cells via Notch signaling[J]. Cell Death & Disease, 2020, 11: 40. |
| [7] |
孙东波, 武瑞, 孔凡志. 猪流行性腹泻病毒研究进展[M]. 北京: 科学出版社, 2018.
|
| [8] |
古长松.饲粮添加异亮氨酸对轮状病毒攻毒仔猪生长性能和免疫功能的影响[D].硕士学位论文.成都: 四川农业大学, 2018.
|
| [9] |
MAO X B, GU C S, REN M, et al. L-isoleucine administration alleviates rotavirus infection and immune response in the weaned piglet model[J]. Frontiers in Immunology, 2018, 9: 1654. DOI:10.3389/fimmu.2018.01654 |
| [10] |
ZHAO Y, RAN Z M, JIANG Q, et al. Vitamin D alleviates rotavirus infection through a microRNA-155-5p mediated regulation of the TBK1/IRF3 signaling pathway in vivo and in vitro[J]. International Journal of Molecular Sciences, 2019, 20(14): 3562. DOI:10.3390/ijms20143562 |
| [11] |
彭燮.低蛋白日粮添加合成氨基酸或完整蛋白对仔猪生长性能、氮代谢和免疫功能的影响[D].硕士学位论文.雅安: 四川农业大学, 2016.
|
| [12] |
赖翔.饲粮添加苏氨酸对PRV诱导的免疫应激仔猪生长性能和免疫功能的影响[D].硕士学位论文.雅安: 四川农业大学, 2012.
|
| [13] |
杨平.饲粮添加L-精氨酸或N-氨甲酰谷氨酸对感染PRRSV妊娠母猪繁殖性能及免疫功能的影响[D].硕士学位论文.雅安: 四川农业大学, 2011.
|
| [14] |
王岚.猪传染性胃肠炎病毒(TGEV)感染IPEC-J2细胞的炎症反应及亮氨酸的调控作用[D].硕士学位论文.成都: 四川农业大学, 2019.
|
| [15] |
刘忠臣.不同来源脂肪对仔猪的营养效应及对E. coli攻毒的保护作用研究[D].博士学位论文.雅安: 四川农业大学, 2011.
|
| [16] |
赵叶.不同猪种抗病毒相关模式识别受体基因表达差异及维生素D的抗病毒作用与机制[D].博士学位论文.雅安: 四川农业大学, 2013.
|
| [17] |
ZHAO Y, YU B, MAO X B, et al. Dietary vitamin D supplementation attenuates immune responses of pigs challenged with rotavirus potentially through the retinoic acid-inducible gene Ⅰ signalling pathway[J]. British Journal of Nutrition, 2014, 112(3): 381-389. DOI:10.1017/S000711451400097X |
| [18] |
陈宏.生物素对断奶仔猪生产性能及免疫功能影响的研究[D].博士学位论文.雅安: 四川农业大学, 2008.
|
| [19] |
高庆.饲粮添加叶酸对断奶仔猪生产性能和免疫功能的影响研究[D].博士学位论文.雅安: 四川农业大学, 2011.
|
| [20] |
龚伟, 王哲, 张乃生, 等. 硒对免疫功能影响的研究进展[J]. 动物医学进展, 1998, 19(4): 16-18. |
| [21] |
黎文彬.酵母硒对脂多糖(LPS)诱导的免疫应激早期断奶仔猪的影响[D].硕士学位论文.雅安: 四川农业大学, 2009.
|
| [22] |
陈浩.饲粮添加果胶寡糖对轮状病毒攻毒仔猪生产性能、免疫功能和肠道健康的影响[D].硕士学位论文.雅安: 四川农业大学, 2016.
|
| [23] |
WAN J, ZHANG J, WU G Z, et al. Amelioration of enterotoxigenic Escherichia coli-induced intestinal barrier disruption by low-molecular-weight chitosan in weaned pigs is related to suppressed intestinal inflammation and apoptosis[J]. International Journal of Molecular Sciences, 2019, 20(14): 3485. DOI:10.3390/ijms20143485 |
| [24] |
ZHANG J, WAN J, WU G Z, et al. Low-molecular-weight chitosan relieves enterotoxigenic Escherichia coli-induced growth retardation in weaned pigs[J]. International Immunopharmacology, 2020, 78: 105798. DOI:10.1016/j.intimp.2019.105798 |
| [25] |
秦林林.银耳孢子多糖对母猪繁殖性能及后代生产性能和免疫功能的影响[D].硕士学位论文.成都: 四川农业大学, 2018.
|
| [26] |
王纯刚, 张克英, 丁雪梅. 丁酸钠对轮状病毒攻毒和未攻毒断奶仔猪生长性能和肠道发育的影响[J]. 动物营养学报, 2009, 21(5): 711-718. |
| [27] |
YAN H, AJUWON K M. Butyrate modifies intestinal barrier function in IPEC-J2 cells through a selective upregulation of tight junction proteins and activation of the Akt signaling pathway[J]. PLoS One, 2017, 12(6): e0179586. DOI:10.1371/journal.pone.0179586 |
| [28] |
王俊文.饲粮添加白藜芦醇对接种蓝耳病弱毒苗育肥猪生产性能和免疫功能及肉品质的影响[D].硕士学位论文.雅安: 四川农业大学, 2012.
|
| [29] |
贾淋雁.饲粮添加铜和植物精油对猪流行性腹泻病毒攻毒仔猪生长性能和免疫功能的影响[D].硕士学位论文.成都: 四川农业大学, 2019.
|
| [30] |
SMITH B N, DILGER R N. Immunomodulatory potential of dietary soybean-derived isoflavones and saponins in pigs[J]. Journal of Animal Science, 2018, 96(4): 1288-1304. DOI:10.1093/jas/sky036 |
| [31] |
WATTANASATCHA A, RENGPIPAT S, WANICHWECHARUNGRUANG S. Thymol nanospheres as an effective anti-bacterial agent[J]. International Journal of Pharmaceutics, 2012, 434(1/2): 360-365. |
| [32] |
徐琴.饲粮中添加活性酵母对断奶仔猪生长性能和ETEC攻毒后肠道及免疫功能的影响[D].硕士学位论文.成都: 四川农业大学, 2017.
|
| [33] |
汤俊.饲粮添加鼠李糖乳酸杆菌GG对轮状病毒攻毒仔猪免疫功能和肠道健康的影响[D].硕士学位论文.雅安: 四川农业大学, 2015.
|




