2. 中国科学院亚热带农业生态研究所, 畜禽养殖污染控制与资源化技术国家工程实验室, 动物营养生理与代谢过程湖南省重点实验室, 长沙 410125
2. Key Laboratory of Animal Nutrition Physiology and Metabolic Process of Hunan Province, National Engineering Laboratory for Poultry Breeding Pollution Control and Resource Technology, Institute of Subtropical Agriculture Ecology, Chinese Academy of Sciences, Changsha 410125, China
丝氨酸是组成蛋白质的常见20种氨基酸中的一种,是哺乳动物的非必需氨基酸,也是生酮氨基酸,在自然界中存在D-丝氨酸和L-丝氨酸2种形式。传统上认为L-丝氨酸是非必需氨基酸,是机体内甘氨酸和半胱氨酸的前体,具有许多重要的生物学功能和作用,比如在糖酵解、嘌呤合成、一碳代谢、蛋氨酸循环和谷胱甘肽合成等方面发挥着重要作用,同时在哺乳动物中枢神经系统中也起重要的保护作用[1]。1992年以前普遍认为D-丝氨酸在真核生物中并不大量的存在,但Hashimoto等[2]研究表明,大鼠的脑内存在游离的D-丝氨酸,也有研究表明一些抗生素中存在D-丝氨酸。Wolosker等[3]从大鼠的脑中纯化了一种可催化L-丝氨酸直接外消旋变成D-丝氨酸的可溶酶,同时发现D-丝氨酸可作为谷氨酸N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体甘氨酸位点的内源性配体,在中枢神经系统和调节外周组织生理过程中起着保护作用[4-5]。由于丝氨酸这些特殊的生物学功能,近年来丝氨酸及其代谢产物在动物机体健康中的功能研究也越来越受到关注。另外,由于多组学技术的普遍应用,挖掘到丝氨酸代谢在动物各组织器官和疾病发生发展过程中发生了显著变化,导致关于丝氨酸代谢的研究推向前沿领域。目前,丝氨酸在医药、食品、饲料以及人体运行等方面都有着广泛的应用,同时因它有助于免疫血球素和抗体等生物活性物质的产生,在开发新型药物方面也有良好的发展前景。本文主要总结了近20年来国内外研究学者在丝氨酸对动物机体健康影响研究方面的成果,特别是针对丝氨酸生物学功能、代谢和转运,以及丝氨酸对氧化应激、免疫、疾病的发生及其在畜禽饲料中应用方面的最新研究进展进行了论述,以期为丝氨酸在畜禽生产实践方面提供理论依据,为改善畜禽健康提供新思路,为未来治疗癌症、肿瘤等疾病提供新的靶点。
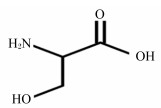
1 丝氨酸生物化学功能、代谢及其应用 1.1 丝氨酸分子结构特性丝氨酸分子式为C3H7NO3,因最早来源于蚕丝而得名,也称为β羟基丙氨酸。丝氨酸是中性脂肪族含羟基氨基酸,结构式如图 1。相对分子质量105.09,易溶于水,几乎不溶于非极性溶剂。丝氨酸有左旋体(L-丝氨酸)和右旋体(D-丝氨酸)2种,L-丝氨酸可以直接用来合成蛋白质,D-丝氨酸一般不能直接合成蛋白质。
|
图 1 丝氨酸的结构式 Fig. 1 Structural formula of serine |
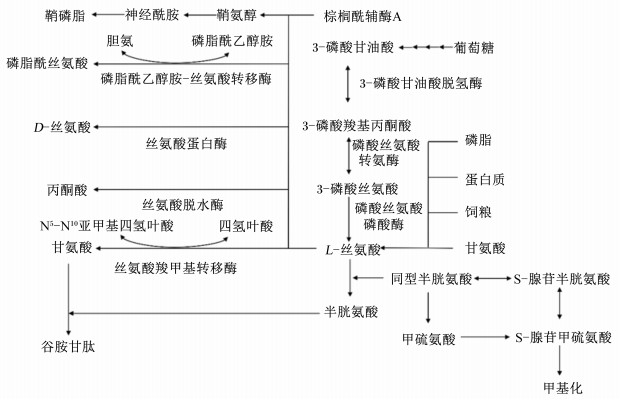
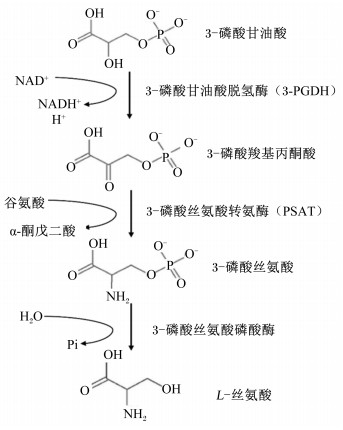
L-丝氨酸主要来源于动物体内糖酵解产生的中间产物3-磷酸甘油酸和甘氨酸合成。D-丝氨酸来源包括由3-磷酸甘油酸从头合成、饲粮中的D-丝氨酸、蛋白质和磷脂周转以及直接由甘氨酸合成。丝氨酸合成和代谢的主要途径如图 2所示。机体内丝氨酸从头合成的底物是3-磷酸甘油酸,需要经过3个主要步骤。首先,3-磷酸甘油酸通过3-磷酸甘油酸脱氢酶(phosphoglycerate dehydrogenase,PHGDH)转化为3-磷酸羟基丙酮酸;然后,在磷酸丝氨酸转氨酶(phosphoserine aminotransferase,PSAT)的作用下将3-磷酸羟基丙酮酸转化为3-磷酸丝氨酸;最后,3-磷酸丝氨酸通过磷酸丝氨酸磷酸酶(phosphoserine phosphatase,PSPH)的作用转化为丝氨酸[6]。尽管L-丝氨酸也可以来自其他物质代谢或外源供给,包括饮食、蛋白质和磷脂的降解以及甘氨酸的直接合成,但是从头生物合成途径仍然是L-丝氨酸的主要来源,因为这些替代来源通常不够补偿L-丝氨酸生物合成途径中的缺失[6]。丝氨酸主要代谢途径包括:1)与同型半胱氨酸结合生成半胱氨酸,同时丝氨酸还可以在丝氨酸羟甲基转移酶(serine hydroxymethyltransferase,SHMT)作用下生成甘氨酸。甘氨酸、半胱氨酸和谷氨酸结合生成谷胱甘肽;2)与四氢叶酸(N10-亚甲基-氢叶酸,THF)反应提供甲基生成5-甲基四氢叶酸,进一步与同型半胱氨酸反应生成蛋氨酸,进而生成直接甲基供体S-腺苷蛋氨酸(S-adenosine methionine,SAM);3)通过生成甘氨酸及与四氢叶酸反应从头合成嘌呤,进一步生成ATP;4)通过脱氨基作用生成丙酮酸和氨气。丝氨酸是机体中重要的小分子极性物质,不能自由通过细胞膜,需要依靠细胞膜上相应转运蛋白的协助才能完成各组织或细胞间的转运[7]。许多研究表明,游离丝氨酸主要是通过钠离子(Na+)依赖性氨基酸转运丙氨酸-丝氨酸-半胱氨酸(alanine-serine-cysteine preferring,ASC)系统[包括丙氨酸-丝氨酸-半胱氨酸转运载体1(alanine-serine-cysteine transporter 1,ASCT1)和丙氨酸-丝氨酸-半胱氨酸转运载体2(alanine-serine-cysteine transporter 2,ASCT2)]、Na+依赖性中性氨基酸转运A系统[包括钠离子依赖的中性氨基酸转运载体1(sodium-dependent neutral amino acid transporter 1,SAT1)和钠离子依赖的中性氨基酸转运载体2(sodium-dependent neutral amino acid transporter 2,SAT2)]以及Na+非依赖性ASC型氨基酸转运载体1系统(ASC type amino acid transporter 1,Asc-1)这3种中性氨基酸转运系统转运至各组织器官或细胞参与相关的代谢活动[8-9]。例如,ASCT2在大脑中不表达,ASCT1则在大脑中高度表达,SAT1和SAT2对丙氨酸具有更高的亲和力,这就导致ASCT1成为了丝氨酸在中枢神经系统中的主要转运载体,它可将丝氨酸从星形胶质细胞运输到细胞外空间以及从细胞外空间运输到神经元[8, 10-12]。
L-丝氨酸作为甘氨酸、半胱氨酸、嘌呤、胸腺嘧啶、胆碱、磷脂酰丝氨酸、鞘磷脂和四氢叶酸的合成前体,除了在蛋白质合成和核苷酸代谢中起作用之外,还可促进脂肪和脂肪酸的新陈代谢、肌肉的生长、细胞膜的制造加工以及神经细胞鞘的合成。此外,L-丝氨酸也是重要的自然保湿因子,具有特殊的润湿性和保湿性。磷脂酰丝氨酸是由磷脂酰乙醇胺通过碱基交换游离丝氨酸合成的,磷脂酰丝氨酸可促进脑中各种酶的活性;能延缓神经递质寿命;有助于修复、更新大脑受损细胞和清除有害物质;提高动物大脑机能以及缓解压力。鞘磷脂是神经组织髓鞘膜中的主要成分,富含于神经胶质细胞和红细胞中,是通过棕榈酰辅酶A与丝氨酸缩合生成鞘氨醇,而鞘氨醇随后转化为鞘磷脂的直接前体神经酰胺。神经酰胺是一种内源性调节剂,具有高效保湿、抗衰老、增强屏障功能及防过敏等功效。丝氨酸可以通过SHMT转化为甘氨酸,该反应还可作为甘氨酸的从头合成途径。甘氨酸是一种抑制性神经递质,也是内源性抗氧化剂还原性谷胱甘肽的组成氨基酸,在神经信号的传递以及参与各种生理和病理反应中起着重要的基础作用。四氢叶酸是一种重要的一碳供体,丝氨酸可以通过将其甲基单元转移到5-甲基四氢叶酸,进一步为同型半胱氨酸向蛋氨酸转化提供甲基,从而缓解同型半胱氨酸聚集和促进嘌呤和胸苷的合成[13]。此外,L-丝氨酸可通过转化为甘氨酸或通过丝氨酸脱水酶降解为丙酮酸,从而进入三羧酸循环,为机体提供大量的能量。
1.3 丝氨酸的应用和生产方法目前,丝氨酸在医药、食品、化妆品、饲料等行业得到了广泛地应用和开发。例如,L-丝氨酸广泛用于配制复方氨基酸输液和营养增补剂,并用于合成多种丝氨酸衍生物,如心血管、抗癌、艾滋病新药及基因工程用的保护氨基酸等;L-丝氨酸可用于研发运动饮料、氨基酸减肥饮料以及用于提高大脑机能和缓解压力的保健产品,亦可作为轻化工业的原料;L-丝氨酸具有强保湿能力,在国内外被大量用于高级化妆品中;丝氨酸也用于生产动物饲料,可促进动物生长发育,但目前在畜禽饲料中关注甚少。国内外丝氨酸生产方法通常有发酵法、蛋白质水解法、化学合成法、生物酶法等。
2 丝氨酸对动物机体健康的影响 2.1 丝氨酸对氧化应激的影响丝氨酸处于多个重要代谢过程的中间枢纽位置,可将糖酵解与嘌呤合成、一碳代谢和谷胱甘肽合成联系起来,从而参与嘌呤、嘧啶、谷胱甘肽和牛磺酸的合成,已被许多研究证实能够缓解机体氧化应激损伤和提高抗氧化防御能力[17]。许多癌细胞中的大部分丝氨酸进入经硫酸化途径,原因是新丝氨酸合成的增加与半胱氨酸代谢的增加有关,而这些丝氨酸代谢在维持癌细胞氧化还原状态中起到关键作用[18]。相关研究报道不论是癌细胞还是正常细胞,如果培养过程中丝氨酸缺失,细胞对过氧化氢诱导的应激反应显著增强,表现为细胞中活性氧自由基(reactive oxide species,ROS)含量显著增加[19]。Rodriguez等[20]研究发现,谷胱甘肽合成过程必需依赖丝氨酸代谢,丝氨酸代谢的正常进行也为上调巨噬细胞中白细胞介素-1β(IL-1β)mRNA的表达水平提供优先条件。Kim等[21]研究表明,L-丝氨酸能保护小鼠海马神经元HT22细胞免受氧化应激。众所周知,动物肝脏和肠道是机体中最容易受到各种有害物质损伤的部位,极易因摄入物质、环境变化或微生物病原体的入侵等引起ROS的过度产生,从而导致氧化损伤[22],进而破坏胃肠道屏障功能和肝脏的解毒功能,甚至引发各种肠道或肝脏疾病的发生,如腹泻、炎症性肠病、脂肪肝、肝硬化和恶性肿瘤等[23-24]。
本课题组在丝氨酸抗氧化功能方面开展了相关的一系列研究。He等[25]研究表明,母鼠饲粮丝氨酸缺乏不影响小鼠断奶后的基础氧化还原状态,但其断奶的子鼠更容易遭遇氧化应激,这也预示着母代抗氧化功能的强弱或许可通过母乳或胎盘传递给子代。在通过敌草快诱导小鼠或肝细胞建立体内或体外氧化应激模型中,探讨了补充不同水平丝氨酸对小鼠肝脏和肠道氧化损伤的影响,表明丝氨酸可有效维持机体内蛋氨酸循环,提高谷胱甘肽水平,从而缓解氧化损伤,这主要的作用机制是丝氨酸与同型半胱氨酸凝聚合成半胱氨酸,并为同型半胱氨酸再甲基化提供一碳单元[26]。在高脂饲粮诱导小鼠氧化应激模型中,也发现妊娠母鼠饲粮添加1%丝氨酸可使其断奶后小鼠肠道和肝脏中的ROS、同型半胱氨酸、丙二醛和过氧化脂等水平显著降低,且显著提高谷胱甘肽水平和谷胱甘肽合成相关基因的表达,但母鼠饲粮添加丝氨酸抑制了因高脂饲粮引起的DNA甲基化水平[27]。这表明母源丝氨酸可通过表观遗传调控断奶后子鼠谷胱甘肽的合成以及激活腺苷酸活化蛋白激酶(adenosine activated protein kinase,AMPK)信号通路来缓解因高脂饲粮引起的氧化应激[28]。
在早期断奶仔猪试验中也发现,饲粮中添加0.2%的丝氨酸可通过减轻早期断奶仔猪的氧化应激反应来改善仔猪生长性能和肠道健康[29-30]。本课题组利用断奶仔猪作为研究对象,通过探讨不同水平丝氨酸的试验和D-半乳糖诱导断奶仔猪建立慢性氧化应激模型的研究,进一步证明添加适量丝氨酸可有效改善断奶仔猪生长性能和提高仔猪抗氧化和免疫能力。此外,He等[31]利用过氧化氢诱导猪小肠上皮细胞(IPEC-J2)建立氧化损伤模型的试验结果中表明,内源丝氨酸缺失可加剧IPEC-J2的氧化应激反应和抑制细胞的增殖,促进细胞凋亡和造成线粒体功能紊乱;外源添加丝氨酸有助于谷胱甘肽合成和蛋氨酸循环,抑制同型半胱氨酸积聚,激活哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和AMPK-核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)信号通路,从而缓解氧化应激和促进细胞增殖分化。
2.2 丝氨酸对免疫功能的影响丝氨酸作为机体必不可少的功能性氨基酸,是促进免疫血球素和抗体产生的重要物质,对维持健康的免疫系统至关重要[15, 21]。目前已有许多研究表明,丝氨酸在调控机体免疫功能、炎症反应、微生态平衡等方面发挥着关键作用[15],尽管在各种动物上的试验结果不完全一致,但其对免疫机能的调节效应已得到广泛认同。目前,丝氨酸主要是作为增强人类运动水平的激动剂和治疗代谢疾病的辅助剂应用于运动学和医学领域。临床试验表明,丝氨酸对癌症、肿瘤、脂肪肝、糖尿病、心血管、血脑屏障等代谢病造成的免疫力低下具有改善作用,具体表现为调控细胞因子和抗体的分泌等[32]。
许多生理和病理条件下,丝氨酸在改善机体免疫功能方面主要是通过影响免疫发育与内稳态、炎症反应、上皮细胞介导的信号通路等过程来实现。最新研究表明,丝氨酸可作为一种关键的免疫代谢产物,在体内和体外均可调控机体内的免疫应激。Ma等[33]研究发现,丝氨酸是体内和体外T细胞增殖分化所必需的代谢物,它可通过介导嘌呤从头合成和一碳代谢控制T细胞的增殖,活化的T细胞又可上调丝氨酸-甘氨酸-一碳代谢通路(SGOC)中的关键酶(如PSAT、PHGDH、PSPH等)的表达,进而直接调节T细胞介导的适应性免疫。Rodriguez等[20]研究表明,丝氨酸代谢是谷胱甘肽合成所必需的,充足的谷胱甘肽是维持脂多糖(lipopolysaccharide,LPS)诱导巨噬细胞产生IL-1β的重要营养因子。在LPS驱动的脓毒症小鼠模型中,药物抑制新生丝氨酸的从头合成降低了LPS对IL-1β的诱导,提高了脓毒症小鼠的存活率。也有研究表明肿瘤抑制蛋白p53缓解细胞免疫应激的过程必须有充足的丝氨酸[34]。Gao等[35]研究报道,丝氨酸代谢可通过介导肝激酶B1(liver kinase B1,LKB1)/AMPK/mTOR信号通路将肿瘤抑制效果与表观遗传联系起来。He等[31]研究发现,丝氨酸水平在感染多杀巴斯德菌的小鼠肺部中显著减少,外源性添加丝氨酸可显著提高小鼠的存活率,降低多杀巴斯德菌的定植和因感染期间由巨噬细胞和中性粒细胞介导的炎症反应。Kitamoto等[36]研究发现,丝氨酸分解代谢对动物健康的肠道影响不大。但在肠道发生炎症时,敲除参与丝氨酸利用的L-丝氨酸/苏氨酸转运载体基因(threonine/serine transporter,tdcC)、丝氨酸转运载体基因(serine transporter,sdaC)、L-丝氨酸苏氨酸脱氢酶基因(threonine/serine dehydratase,tdcB/G)以及L-丝氨酸脱氨酶基因(L-serine ammonia-lyase,sdaA/B)会显著降低大肠杆菌和柠檬酸杆菌的竞争适应性。且当结肠炎小鼠饲粮中去除丝氨酸后,结肠食糜大肠杆菌LF82的繁殖力明显减弱。综上所述,丝氨酸具有改善动物机体免疫功能的作用,预示着丝氨酸代谢途径的关键基因可被视为未来治疗癌症、肠炎等疾病的新方向。
近年来,本课题组也开展了一系列关于丝氨酸提高动物机体免疫功能的研究。在脂多糖LPS诱导小鼠和猪小肠上皮细胞(IPEC-1)建立肠道炎症模型中,Zhou等[37]发现外源补充丝氨酸可有效维持肠道屏障功能和渗透性,并提高谷胱甘肽的合成和激活AMPK信号通路;但当用miRNAs干扰p53表达或抑制谷胱甘肽合成时,丝氨酸对IPEC-1的保护作用将消失,这些结果表明丝氨酸可通过p53依赖性的方式提高谷胱甘肽的合成和AMPK活性来预防LPS引起的肠道损伤。同理,利用葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导小鼠建立结肠炎模型,结果表明饲粮添加丝氨酸降低了小鼠疾病活性指数和结肠组织中的髓过氧化物酶、嗜酸性粒细胞过氧化物酶和促炎细胞因子的水平或活性,改善了结肠炎小鼠的结肠形态结构,抑制了细胞凋亡[29]。经16S rRNA微生物测序显示,添加丝氨酸后结肠内细菌群落组成和功能谱发生了显著变化。这就进一步说明外源补充丝氨酸有助于提高机体的免疫功能,改善肠道微生物种群区系,反转因DSS造成的结肠炎。在长期饲喂D-半乳糖诱导小鼠衰老模型中,也发现饲粮丝氨酸缺失可加剧小鼠的炎症和氧化应激反应,并显著降低肠道微生物种群区系,下调有益菌的比值,降低粪便中的丁酸含量和脑中短链脂肪酸转运载体的表达。这其中的分子机制或许是归因于丝氨酸缺乏可介导AMPK/核因子-κB(NF-κB)p65信号通路实现对微生物-肠-脑轴的调控,从而加剧炎症和氧化应激损伤[38]。
随着相关研究的深入,本课题组也对丝氨酸在畜禽养殖业中的应用倍受关注。先前有研究探索性地发现,丝氨酸分解代谢通路中sdaA的活性对鸡空肠弯曲杆菌的定植和生长至关重要[39]。近期,本课题组首次在母猪妊娠期和哺乳期饲粮中添加不同水平丝氨酸,发现母猪饲粮丝氨酸的添加可显著提高母猪和仔猪(母子)血清抗体水平,改善哺乳仔猪的生长性能和母猪的繁殖性能,以及提高母猪和仔猪的免疫功能。同时,最新研究结果也进一步证实了Kitamoto等[36]关于膳食添加丝氨酸降低结肠炎小鼠肠道中肠杆菌科竞争性的观点,进一步表明妊娠母猪或断奶仔猪饲粮添加丝氨酸后,可有效促进母子猪有益菌垂直传递的效果和断奶仔猪肠道菌群-宿主免疫互作和重塑,进而调控母体代谢稳态及子代健康,促进仔猪的生长发育和改善机体免疫功能。这预示着丝氨酸有潜力作为一种新型的饲料添加剂来改善生猪的免疫力。
2.3 丝氨酸对相关疾病的影响在灵长和非灵长类动物神经细胞中,L-丝氨酸具有保护神经的作用,通过多种生化和分子机制发挥作用。随着对饮食中L-丝氨酸的依赖越来越受到关注,丝氨酸可能在神经发育和其他代谢疾病发生发展过程中所扮演的角色比历史上认识到的更重要。从生理学角度看,L-丝氨酸有多种作用,从初级蛋白质结构到细胞信号,其中最重要的是作为蛋白质的磷酸化位点。因此,合成丝氨酸代谢酶的突变与多种人类疾病(如神经性疾病、癌症、肿瘤、癫痫、脂肪肝和衰老)有关。
在神经性疾病方面,丝氨酸能对神经毒性非蛋白氨基酸、β-N-甲氨基-L-丙氨酸以及神经退行性疾病产生影响,特别是对肌萎缩侧索硬化症/帕金森症痴呆复合体(amyotrophic lateral sclerosis/Parkinson’s disease dementia complex,ALS/PDC)。ALS/PDC是一种神经退行性疾病,由帕金森病、肌萎缩性侧索硬化症和阿尔茨海默氏症合并而成,与由高磷酸化的微管相关蛋白Tau组成的神经纤维缠结(neurofibrillary tangles,NFTs)相关[40-42]。Bradley等[43]研究表明,在患者的食物中补充L-丝氨酸可缓解ALS/PDC的恶化。Mothet等[44]研究发现,胶质细胞能够释放D-丝氨酸,NMDA受体的激活需要谷氨酸和D-丝氨酸的共同作用,而L-丝氨酸则作为胶质细胞的强效营养因子,能强有力地促进培养神经元的存活、生长、分化、树突伸长、分枝和突触形成。也有研究表明,在机体中D-丝氨酸能够作用于NMDA受体的“甘氨酸位点”,进而激活该受体,引起细胞的去极化和钙离子(Ca2+)内流[4]。在培养海马元代细胞时,移除D-丝氨酸后,NMDA受体的活性降低,当在培养基中重新加入D-丝氨酸后,NMDA受体的活性恢复正常。有趣的是,外源L-丝氨酸以浓度依赖性的方式提高了培养神经元的存活率,增加了细胞的延伸和分支[12]。这种L-丝氨酸支持神经元的能力被归因于它是维持磷脂酰丝氨酸和鞘磷脂合成和功能所必需的物质;这些结果表明丝氨酸的2种异构体在中枢神经系统中发挥着不同的功能。尽管L-丝氨酸是神经元正常功能所必需的,但血脑屏障对丝氨酸的渗透性差,而成熟的神经元缺乏丝氨酸从头合成所需的PHGDH[10, 45]。那么,神经元如何获得充足的L-丝氨酸?PHGDH是丝氨酸生物合成的关键酶,在胚胎发生过程中在神经元祖细胞中表达。然后其表达在致力于神经元分化的细胞中被下调,并且在它们的最终分化后,神经元失去了合成丝氨酸的能力。但是星形胶质细胞保留了合成丝氨酸的能力,一旦分化,神经元就依赖于星形胶质细胞提供丝氨酸[12, 46]。这些研究充分地说明丝氨酸在维持神经系统中的重要性。
在癌症或肿瘤疾病方面,一碳代谢对癌细胞的存活至关重要。丝氨酸是一碳单元的主要来源,在癌细胞增殖中发挥关键作用,表现为癌细胞主要依赖于细胞外丝氨酸或丝氨酸从头合成途径生存。同时,丝氨酸衍生的一碳单元为核苷酸合成提供了关键的基石,以支持高水平的癌细胞增殖。一碳代谢也支持甲基化途径和功能代谢物的产生,这些均有助于癌细胞的新陈代谢和生存。早期研究表明,编码丝氨酸生物合成酶的基因在部分癌症中被扩增,有助于肿瘤细胞的生长,且丝氨酸生物合成缺陷将造成婴幼儿宫内发育迟缓和头小畸形,这就预示着丝氨酸的生物合成与幼龄动物正常生长发育有关[14]。体外癌细胞模型的研究表明,L-丝氨酸缺乏的培养基培养癌细胞可显著上调与细胞丝氨酸从头合成相关酶的表达[47],而快速增殖的细胞需要外源提供L-丝氨酸,这是因为癌细胞需要利用丝氨酸进行一碳代谢和叶酸循环[16]。在不同的啮齿类动物体内试验和不同细胞体外试验模型中也进一步证实,剥夺细胞对L-丝氨酸的接触可以抑制一些肿瘤细胞的生长和发育[19]。一些癌细胞在从头合成L-丝氨酸过程中还能参与Nrf2和激活转录因子4(activate transcription factor 4,ATF4)介导的氧化应激[48]。一种与癌症相关的转录因子(cMyc)可诱导3种丝氨酸从头合成的关键酶参与L-丝氨酸的从头合成(图 3)。这些揭示了营养剥夺的肿瘤细胞依赖于内源性丝氨酸生物合成途径进行增殖[49]。然而,近期研究表明,在能量供应不足时,一些癌细胞分泌甲酸盐,理论上消耗1个碳单元。在这种情况下,癌细胞分解丝氨酸来产生能量,而不是将其用于合成代谢途径。此时,虽然丝氨酸可以被代谢成丙酮酸(丙酮酸可以通过三羧酸循环和氧化磷酸化产生ATP),但这似乎不是丝氨酸分解代谢的主要途径[15, 50]。相反,丝氨酸被SHMT2代谢产生甘氨酸和亚甲基-四氢叶酸,然后亚甲基-四氢叶酸脱氢酶2(methylenetetrahydrofolate dehydrogenase 2,MTHFD2)将其转化为甲酰基-四氢叶酸,同时烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)产生还原型烟酰胺腺嘌呤二核苷酸(reduced nicotinamide adenine dinucleotide,NADH)[51]。此外,最新的研究表明,丝氨酸和一碳代谢可作为连接mTOR信号通路和DNA甲基化的桥梁促进肿瘤的生长[52], 这为未来治疗癌症提供了新思路。
|
NAD+:烟酰胺腺嘌呤二核苷酸nicotinamide adenine dinucleotide;NADH+:还原型烟酰胺腺嘌呤二核苷酸reduced nicotinamide adenine dinucleotide;H+:氢离子;H2O:水water;Pi:磷phosphorus。 图 3 参与L-丝氨酸合成的酶 Fig. 3 Enzymes involved in synthesis of L-serine[1, 15, 51] |
在酒精性脂肪肝等肝功能疾病方面,有研究学者使用乙醇诱导小鼠建立脂肪肝模型中发现,小鼠肝脏中同型半胱氨酸和甘油三酯都增加了5倍[53]。通过在饲粮中补充L-丝氨酸(200 mg/kg),可以显著降低肝脏中同型半胱氨酸和甘油三酯的聚集,从而降低肝脏中性脂质积累,增加谷胱甘肽和SAM水平[49]。在其他疾病方面,Furuya等[54]研究表明,敲除小鼠中的PHGDH基因具有胚胎致命性,但患有PHGDH基因缺陷的人类患者只是表现出髓鞘不足、小头畸形、癫痫以及严重的精神和精神运动发育迟缓等现象[55]。额外补充丝氨酸和甘氨酸可适度改善患者症状,减少癫痫发作的频率。然而,也有研究表明,对婴儿进行L-丝氨酸治疗对其精神运动和智力低下并没有影响[56]。这很可能与中枢神经系统强烈发展和细胞增殖期间中枢神经系统L-丝氨酸浓度恢复到足够高的水平有关。此外,丝氨酸缺乏可能对从胚胎到老年健康都有深远的影响。Zhou等[57]研究证实,长期适量补充L-丝氨酸可缓解衰老性小鼠下丘脑的氧化应激和炎症反应,其作用机制可能是通过沉默信息调节因子1(silent information regulator 1,Sirt1)/NF-κB信号通路实现的,并且发现,L-丝氨酸可以减少小鼠采食量和与年龄相关的体重增加,这或许是丝氨酸通过调控瘦素和促进食欲的神经肽Y(neuropeptide Y,NPY)和刺鼠相关蛋白(agouti-related protein,AgRP)来发挥作用的。因此,在饮食中补充丝氨酸可能是治疗退行性神经疾病、癌症、肿瘤、癫痫、衰老和脂肪肝等疾病的一种新方法,也可为这些疾病的治疗提供新的靶点。
2.4 丝氨酸在畜禽饲粮中的应用随着对必需氨基酸需求的深入研究,通过平衡必需氨基酸可使畜禽饲料粗蛋白质(CP)含量降低,并提高蛋白质和氨基酸的利用率,但是我们却忽略了畜禽对非必需氨基酸的需求。由于甘氨酸和丝氨酸被认为在机体代谢中可不受限制的相互转化,因此在确定饲粮的营养成分时,通常必须同时评估甘氨酸和丝氨酸的含量。大多数研究都使用甘氨酸和丝氨酸浓度之和(Gly+Ser)作为评估标准。但是这也忽略了很重要的前提,就是只有在相同的摩尔分子量下,饲粮中的丝氨酸与甘氨酸才具有相同的作用,因此这个公式并不完美[58-59]。于是Dean等[60]进一步研究并建议,通过将甘氨酸当量(Glyequi)作为评估标准,具体公式为Glyequi(g/kg)=Gly(g/kg)+[0.714 3×Ser(g/kg)],式中Gly(g/kg)为甘氨酸浓度,Ser(g/kg)为丝氨酸的浓度,0.714 3是甘氨酸的摩尔分子量与丝氨酸的摩尔分子量的比值。这种方法可更精确地描述甘氨酸和丝氨酸的比值。据许多饲粮营养成分测定,证实Glyequi比Gly+Ser确实更适用,并可更准确地反映饲粮的营养价值。相关研究结果表明,21日龄以下肉鸡饲粮中Glyequi的需求量在11~20 g/kg,并且饲粮中内在的前体(苏氨酸和胆碱)浓度高时,可以达到此范围的下限[60]。
先前有研究表明,当肉鸡饲粮的CP含量降低到20%以下并且平衡必需氨基酸的情况下,如果饲粮中非必需氨基酸甘氨酸和丝氨酸的供应不足或甘氨酸和丝氨酸比值不佳,则将显著降低肉鸡的生长性能,但补充丝氨酸则可提高肉鸡的生长性能[60-61]。这一结果就预示着饲粮中非必需氨基酸丝氨酸和甘氨酸的平衡也同样重要。另有研究显示,畜禽饲粮中的甘氨酸和丝氨酸浓度相对比值随着CP含量的增加反而降低,但是当食用这些动物副产品,特别是肉和骨,甘氨酸和丝氨酸浓度却不一定随饲粮CP含量的增加而降低[62]。也有研究证实,有针对性地调整饮食中必需氨基酸和丝氨酸的水平可以降低肉鸡饲粮中的CP含量,而不会影响生长性能,从而提高蛋白质和氨基酸的利用效率,但肉鸡对丝氨酸的需求随不同饲粮成分的变化而变化[62-63]。本课题组也开展了一系列在低蛋白质饲粮中添加丝氨酸对畜禽机体健康的研究。刘永辉等[64]探讨了低蛋白质饲粮中丝氨酸和甘氨酸的比例对肥育猪背最长肌氧化应激状态的影响,发现猪育肥阶段饲喂丝氨酸和甘氨酸比例为1 : 2的低蛋白质饲粮可有效提高宰后背最长肌的抗氧化功能。此外,硒半胱氨酸的生物合成及其与硒蛋白的结合过程是由丝氨酸-tRNA-合成酶的催化作用下完成的,但这一个过程必须要有充足的丝氨酸作为催化底物。为了证明添加丝氨酸是否有利于硒蛋白的合成,Long等[65]利用21日龄断奶仔猪作为研究对象,探讨了低蛋白质饲粮中添加不同水平的丝氨酸对断奶仔猪各组织中硒的浓度、硒蛋白的表达和硒酶活性的影响。发现低蛋白质饲粮添加丝氨酸可以显著改善断奶仔猪肌肉和肝脏中硒蛋白的转录和硒酶的活性,同时显著提高组织抗氧化能力,从而改善断奶仔猪的生长性能。这些结果表明,在低蛋白质饲粮配制过程中控制甘氨酸和丝氨酸的水平显得尤为重要。
3 小结与展望丝氨酸作为机体必不可少的功能性氨基酸,参与机体各种代谢活动,在癌症、肿瘤、酒精性脂肪肝、衰老、神经性疾病、氧化应激、免疫、表观遗传和ATP合成等过程中均发挥着重要的生物学功能。近年来,丝氨酸及其代谢作为一个重要调控位点可通过提高动物机体抗氧化功能和调节免疫系统来改善动物机体健康的观点已经得到广大学者的认可。但是,目前的研究主要集中于用小鼠和细胞模型探讨丝氨酸对人类机体健康的作用机制,对于丝氨酸在畜禽养殖业中的研究则鲜有报道。自2017年以来,本课题组将丝氨酸应用于生猪养殖业,选取母猪、哺乳仔猪、断奶仔猪、生长猪和肥育猪作为研究对象,探讨了不同水平丝氨酸对不同阶段生猪生长和繁殖性能、抗氧化功能、免疫功能、微生态平衡和肉品质方面的影响及作用机制[25, 30-31, 57, 65],这些数据表明丝氨酸有潜力作为一种新型的饲料添加剂应用到畜禽养殖生产实践中,为畜禽的功能性氨基酸营养需要研究与饲养管理提供新的理论依据。但是关于丝氨酸及其代谢产物在畜禽各组织器官的代谢,外源性丝氨酸对畜禽组织内丝氨酸的影响,丝氨酸及其代谢对畜禽肠道微生物与宿主免疫互作的调控机制,丝氨酸对畜禽肉品质形成的影响及干预机制,外源添加或内源缺失丝氨酸对畜禽机体健康的影响,丝氨酸与其他物质(甘氨酸、半胱氨酸、维生素、微量元素、中草药等)协同作用效果及机制以及畜禽健康高效丝氨酸营养供给和调控技术研发等都还需要我们进一步研究。
| [1] |
METCALF J S, DUNLOP R A, POWELL J T, et al. L-serine:a naturally-occurring amino acid with therapeutic potential[J]. Neurotoxicity Research, 2018, 33(1): 213-221. DOI:10.1007/s12640-017-9814-x |
| [2] |
HASHIMOTO A, NISHIKAWA T, HAYASHI T, et al. The presence of free D-serine in rat brain[J]. Febs Letters, 1992, 296(1): 33-36. DOI:10.1016/0014-5793(92)80397-Y |
| [3] |
WOLOSKER H, BLACKSHAW S, SNYDER S H. Serine racemase:a glial enzyme synthesizing D-serine to regulate glutamate-N-methyl-D-aspartate neurotransmission[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(23): 13409-13414. DOI:10.1073/pnas.96.23.13409 |
| [4] |
MOTHET J P, PARENT A T, WOLOSKER H, et al. D-serine is an endogenous ligand for the glycine site of the N-methyl-D-aspartate receptor[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(9): 4926-4931. DOI:10.1073/pnas.97.9.4926 |
| [5] |
GILL S S, PULIDO O M. Review article:glutamate receptors in peripheral tissues:current knowledge, future research, and implications for toxicology[J]. Toxicologic Pathology, 2001, 29(2): 208-223. |
| [6] |
VAN DER CRABBEN S N, VERHOEVEN-DUIF N M, BRILSTRA E H, et al. An update on serine deficiency disorders[J]. Journal of Inherited Metabolic Disease, 2013, 36(4): 613-619. DOI:10.1007/s10545-013-9592-4 |
| [7] |
HE L Q, YANG H S, HOU Y Q, et al. Effects of dietary L-lysine intake on the intestinal mucosa and expression of CAT genes in weaned piglets[J]. Amino Acids, 2013, 45(2): 383-391. DOI:10.1007/s00726-013-1514-0 |
| [8] |
FURUYA S, WATANABE M. Novel neuroglial and glioglial relationships mediated by L-serine metabolism[J]. Archives of Histology and Cytology, 2003, 66(2): 109-121. DOI:10.1679/aohc.66.109 |
| [9] |
KANAI Y, CLÉMENÇON B, SIMONIN A, et al. The SLC1 high-affinity glutamate and neutral amino acid transporter family[J]. Molecular Aspects of Medicine, 2013, 34(2/3): 108-120. |
| [10] |
YAMASAKI M, YAMADA K, FURUYA S, et al. 3-phosphoglycerate dehydrogenase, a key enzyme for L-serine biosynthesis, is preferentially expressed in the radial glia/astrocyte lineage and olfactory ensheathing glia in the mouse brain[J]. Journal of Neuroscience, 2001, 21(19): 7691-7704. DOI:10.1523/JNEUROSCI.21-19-07691.2001 |
| [11] |
SAKAI K, SHIMIZU H, KOIKE T, et al. Neutral amino acid transporter ASCT1 is preferentially expressed in L-Ser-synthetic/storing glial cells in the mouse brain with transient expression in developing capillaries[J]. Journal of Neuroscience, 2003, 23(2): 550-560. DOI:10.1523/JNEUROSCI.23-02-00550.2003 |
| [12] |
YAMAMOTO T, NISHIZAKI I, FURUYA S, et al. Characterization of rapid and high-affinity uptake of L-serine in neurons and astrocytes in primary culture[J]. Febs Letters, 2003, 548(1/2/3): 69-73. |
| [13] |
JAEKEN J.Disorders of proline and serine metabolism[M]//SAUDUBRAY J M, VAN DEN BERGHE G, WALTER J H.Inborn metabolic diseases.Berlin: Springer, 2012: 357-362.
|
| [14] |
EL-HATTAB A W. Serine biosynthesis and transport defects[J]. Molecular Genetics and Metabolism, 2016, 118(3): 153-159. DOI:10.1016/j.ymgme.2016.04.010 |
| [15] |
NEWMAN A C, MADDOCKS O D K. Serine and functional metabolites in cancer[J]. Trends in Cell Biology, 2017, 27(9): 645-657. DOI:10.1016/j.tcb.2017.05.001 |
| [16] |
YANG M, VOUSDEN K H. Serine and one-carbon metabolism in cancer[J]. Nature Reviews Cancer, 2016, 16(10): 650-662. DOI:10.1038/nrc.2016.81 |
| [17] |
PARKER S J, METALLO C M. Chasing one-carbon units to understand the role of serine in epigenetics[J]. Molecular Cell, 2016, 61(2): 185-186. DOI:10.1016/j.molcel.2016.01.006 |
| [18] |
MEHRMOHAMADI M, LIU X J, SHESTOV A A, et al. Characterization of the usage of the serine metabolic network in human cancer[J]. Cell Reports, 2014, 9(4): 1507-1519. DOI:10.1016/j.celrep.2014.10.026 |
| [19] |
MADDOCKS O D K, BERKERS C R, MASON S M, et al. Serine starvation induces stress and p53-dependent metabolic remodelling in cancer cells[J]. Nature, 2013, 493(7433): 542-546. DOI:10.1038/nature11743 |
| [20] |
RODRIGUEZ A E, DUCKER G S, BILLINGHAM L K, et al. Serine metabolism supports macrophage IL-1β production[J]. Cell Metabolism, 2019, 29(4): 1003-1011. DOI:10.1016/j.cmet.2019.01.014 |
| [21] |
KIM K Y, HWANG S K, PARK S Y, et al. L-serine protects mouse hippocampal neuronal HT22 cells against oxidative stress-mediated mitochondrial damage and apoptotic cell death[J]. Free Radical Biology and Medicine, 2019, 141: 447-460. DOI:10.1016/j.freeradbiomed.2019.07.018 |
| [22] |
CIRCU M L, AW T Y. Intestinal redox biology and oxidative stress[J]. Seminars in Cell & Developmental Biology, 2012, 23(7): 729-737. |
| [23] |
BHATTACHARYYA A, CHATTOPADHYAY R, MITRA S, et al. Oxidative stress:an essential factor in the pathogenesis of gastrointestinal mucosal diseases[J]. Physiological Reviews, 2014, 94(2): 329-354. DOI:10.1152/physrev.00040.2012 |
| [24] |
REZAIE A, PARKER R D, ABDOLLAHI M. Oxidative stress and pathogenesis of inflammatory bowel disease:an epiphenomenon or the cause?[J]. Digestive Diseases and Sciences, 2007, 52(9): 2015-2021. DOI:10.1007/s10620-006-9622-2 |
| [25] |
HE L Q, ZHANG H W, ZHOU X H. Weanling offspring of dams maintained on serine-deficient diet are vulnerable to oxidative stress[J]. Oxidative Medicine and Cellular Longevity, 2018, 2018: 8026496. |
| [26] |
ZHOU X H, HE L Q, WU C R, et al. Serine alleviates oxidative stress via supporting glutathione synthesis and methionine cycle in mice[J]. Molecular Nutrition & Food Research, 2017, 61(11): 1700262. |
| [27] |
CAO G T, TAO F, XIN L, et al. Effects of maternal serine supplementation on high-fat diet-induced oxidative stress and epigenetic changes in promoters of glutathione synthesis-related genes in offspring[J]. Journal of Functional Foods, 2018, 47: 316-324. DOI:10.1016/j.jff.2018.05.067 |
| [28] |
ZHOU X H, HE L Q, ZUO S N, et al. Serine prevented high-fat diet-induced oxidative stress by activating AMPK and epigenetically modulating the expression of glutathione synthesis-related genes[J]. Biochimica et Biophysica Acta:Molecular Basis of Disease, 2018, 1864(2): 488-498. DOI:10.1016/j.bbadis.2017.11.009 |
| [29] |
ZHANG H W, HUA R, ZHANG B X, et al. Serine alleviates dextran sulfate sodium-induced colitis and regulates the gut microbiota in mice[J]. Frontiers in Microbiology, 2018, 9: 3062. DOI:10.3389/fmicb.2018.03062 |
| [30] |
ZHOU X, ZHANG Y, WU X, et al. Effects of dietary serine supplementation on intestinal integrity, inflammation and oxidative status in early-weaned piglets[J]. Cellular Physiology and Biochemistry, 2018, 48(3): 993-1002. DOI:10.1159/000491967 |
| [31] |
HE L Q, LONG J, ZHOU X H, et al. Serine is required for the maintenance of redox balance and proliferation in the intestine under oxidative stress[J]. The FASEB Journal, 2020, 34(3): 4702-4717. DOI:10.1096/fj.201902690R |
| [32] |
HOLM L J, BUSCHARD K. L-serine:a neglected amino acid with a potential therapeutic role in diabetes[J]. Apmis, 2019, 127(10): 655-659. DOI:10.1111/apm.12987 |
| [33] |
MA E H, BANTUG G, GRISS T, et al. Serine is an essential metabolite for effector T cell expansion[J]. Cell Metabolism, 2017, 25(2): 345-357. DOI:10.1016/j.cmet.2016.12.011 |
| [34] |
STIUSO P, BAGAROLO M L, ILISSO C P, et al. Protective effect of tyrosol and S-adenosylmethionine against ethanol-induced oxidative stress of HEPG2 cells involves sirtuin 1, p53 and ERK1/2 signaling[J]. International Journal of Molecular Sciences, 2016, 17(5): 622. DOI:10.3390/ijms17050622 |
| [35] |
GAO X, LOCASALE J W. Serine metabolism links tumor suppression to the epigenetic landscape[J]. Cell Metabolism, 2016, 24(6): 777-779. DOI:10.1016/j.cmet.2016.11.012 |
| [36] |
KITAMOTO S, ALTERI C J, RODRIGUES M, et al. Dietary L-serine confers a competitive fitness advantage to Enterobacteriaceae in the inflamed gut[J]. Nature Microbiology, 2020, 5(1): 116-125. DOI:10.1038/s41564-019-0591-6 |
| [37] |
ZHOU X H, ZHANG Y M, HE L Q, et al. Serine prevents LPS-induced intestinal inflammation and barrier damage via p53-dependent glutathione synthesis and AMPK activation[J]. Journal of Functional Foods, 2017, 39: 225-232. DOI:10.1016/j.jff.2017.10.026 |
| [38] |
WANG F G, ZHOU H B, DENG L G, et al. Serine deficiency exacerbates inflammation and oxidative stress via microbiota-gut-brain axis in D-galactose-induced aging mice[J]. Mediators of Inflammation, 2020, 2020: 5821428. |
| [39] |
VELAYUDHAN J, JONES M A, BARROW P A, et al. L-serine catabolism via an oxygen-labile L-serine dehydratase is essential for colonization of the avian gut by Campylobacter jejuni[J]. Infection and Immunity, 2004, 72(1): 260-268. DOI:10.1128/IAI.72.1.260-268.2004 |
| [40] |
HIRANO A, MALAMUD N, KURLAND L T. Parkinsonism-dementia complex, an endemic disease on the island of Guam.Ⅱ.Pathological features[J]. Brain, 1961, 84(4): 662-679. DOI:10.1093/brain/84.4.662 |
| [41] |
HIRANO A, ZIMMERMAN H M. Alzheimer's neurofibrillary changes.A topographic study[J]. Archives of Neurology, 1962, 7(3): 227-242. |
| [42] |
TROJANOWSKI J Q, ISHIHARA T, HIGUCHI M, et al. Amyotrophic lateral sclerosis/parkinsonism dementia complex:transgenic mice provide insights into mechanisms underlying a common tauopathy in an ethnic minority on Guam[J]. Experimental Neurology, 2002, 176(1): 1-11. |
| [43] |
BRADLEY W G, MILLER R X, LEVINE T D, et al. Studies of environmental risk factors in amyotrophic lateral sclerosis (ALS) and a phase I clinical trial of L-serine[J]. Neurotoxicity Research, 2018, 33(1): 192-198. DOI:10.1007/s12640-017-9741-x |
| [44] |
MOTHET J P, POLLEGIONI L, OUANOUNOU G, et al. Glutamate receptor activation triggers a calcium-dependent and SNARE protein-dependent release of the gliotransmitter D-serine[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(15): 5606-5611. DOI:10.1073/pnas.0408483102 |
| [45] |
SMITH Q R. Transport of glutamate and other amino acids at the blood-brain barrier[J]. The Journal of Nutrition, 2000, 130(4S Suppl): 1016S-1022S. |
| [46] |
FURUYA S. An essential role for de novo biosynthesis of L-serine in CNS development[J]. Asia Pacific Journal of Clinical Nutrition, 2008, 17(Suppl.1): 312-315. |
| [47] |
LOCKART JR R Z, EAGLE H. Requirements for growth of single human cells[J]. Science, 1959, 129(3344): 252-254. DOI:10.1126/science.129.3344.252 |
| [48] |
DENICOLA G M, CHEN P H, MULLARKY E, et al. NRF2 regulates serine biosynthesis in non-small cell lung cancer[J]. Nature Genetics, 2015, 47(12): 1475-1481. DOI:10.1038/ng.3421 |
| [49] |
SIM W C, YIN H Q, CHOI H S, et al. L-serine supplementation attenuates alcoholic fatty liver by enhancing homocysteine metabolism in mice and rats[J]. The Journal of Nutrition, 2015, 145(2): 260-267. DOI:10.3945/jn.114.199711 |
| [50] |
NEWMAN A C, MADDOCKS O D K. One-carbon metabolism in cancer[J]. British Journal of Cancer, 2017, 116(12): 1499-1504. DOI:10.1038/bjc.2017.118 |
| [51] |
MEISER J, TUMANOV S, MADDOCKS O, et al. Serine one-carbon catabolism with formate overflow[J]. Science Advances, 2016, 2(10): e1601273. DOI:10.1126/sciadv.1601273 |
| [52] |
ZENG J D, WU W K K, WANG H Y, et al. Serine and one-carbon metabolism, a bridge that links mTOR signaling and DNA methylation in cancer[J]. Pharmacological Research, 2019, 149: 104352. DOI:10.1016/j.phrs.2019.104352 |
| [53] |
TOSHIKUNI N, TSUTSUMI M, ARISAWA T. Clinical differences between alcoholic liver disease and nonalcoholic fatty liver disease[J]. World Journal of Gastroenterology, 2014, 20(26): 8393-8406. DOI:10.3748/wjg.v20.i26.8393 |
| [54] |
FURUYA S, YOSHIDA K, KAWAKAMI Y, et al. Inactivation of the 3-phosphoglycerate dehydrogenase gene in mice:changes in gene expression and associated regulatory networks resulting from serine deficiency[J]. Functional & Integrative Genomics, 2008, 8(3): 235-249. |
| [55] |
JAEKEN J, DETHEUX M, VAN MALDERGEM L, et al. 3-phosphoglycerate dehydrogenase deficiency:an inborn error of serine biosynthesis[J]. Archives of Disease in Childhood, 1996, 74(6): 542-545. DOI:10.1136/adc.74.6.542 |
| [56] |
JAEKEN J, DETHEUX M, VAN MALDERGEM L, et al. 3-phosphoglycerate dehydrogenase deficiency and 3-phosphoserine phosphatase deficiency:inborn errors of serine biosynthesis[J]. Journal of Inherited Metabolic Disease, 1996, 19(2): 223-226. DOI:10.1007/BF01799435 |
| [57] |
ZHOU X H, ZHANG H W, HE L Q, et al. Long-term L-serine administration reduces food intake and improves oxidative stress and Sirt1/NFκB signaling in the hypothalamus of aging mice[J]. Frontiers in Endocrinology, 2018, 9: 476. DOI:10.3389/fendo.2018.00476 |
| [58] |
AKRABAWI S S, KRATZER F H. Effects of arginine or serine on the requirement for glycine by the chick[J]. The Journal of Nutrition, 1968, 95(1): 41-48. DOI:10.1093/jn/95.1.41 |
| [59] |
SUGAHARA M, KANDATSU M. Glycine serine interconversion in the rooster[J]. Agricultural and Biological Chemistry, 1976, 40(5): 833-837. |
| [60] |
DEAN D W, BIDNER T D, SOUTHERN L L. Glycine supplementation to low protein, amino acid-supplemented diets supports optimal performance of broiler chicks[J]. Poultry Science, 2006, 85(2): 288-296. DOI:10.1093/ps/85.2.288 |
| [61] |
CORZO A, FRITTS C A, KIDD M T, et al. Response of broiler chicks to essential and non-essential amino acid supplementation of low crude protein diets[J]. Animal Feed Science and Technology, 2005, 118(3/4): 319-327. |
| [62] |
SIEGERT W, WILD K J, SCHOLLENBERGER M, et al. Effect of glycine supplementation in low protein diets with amino acids from soy protein isolate or free amino acids on broiler growth and nitrogen utilisation[J]. British Poultry Science, 2016, 57(3): 424-434. DOI:10.1080/00071668.2016.1163523 |
| [63] |
SIEGERT W, RODEHUTSCORD M. The relevance of glycine and serine in poultry nutrition:a review[J]. British Poultry Science, 2019, 60(5): 579-588. DOI:10.1080/00071668.2019.1622081 |
| [64] |
刘永辉, 李响, 周锡红, 等. 低蛋白质饲粮中丝氨酸和甘氨酸比例对育肥猪背最长肌氧化应激状态的影响[J]. 动物营养学报, 2020, 32(7): 3109-3117. |
| [65] |
LONG J, LIU Y H, ZHOU X H, et al. Dietary serine supplementation regulates selenoprotein transcription and selenoenzyme activity in pigs[J]. Biological Trace Element Research, 2020. DOI:10.1007/s12011-020-02117-8 |