2. 生猪健康养殖协同中心, 武汉 430070
2. The Cooperative Innovation Center for Sustainable Pig Production, Wuhan 430070, China
现代化养猪生产中,猪应用人工授精越来越普遍。因此,公猪的繁殖力不但会对商业化公猪站的经济效益造成直接影响,而且间接影响着与配母猪的繁殖性能。公猪的繁殖力可以用公猪性欲、精液品质、精子体外受精能力和母猪受胎率等指标度量[1-2]。其中,精液品质是评价公猪繁殖力的重要性状[3-4]。评价精液品质的指标一般包括:精液量、精子密度、精子活力和精子形态[5]。精液量和精子密度一起决定了一次射精的总精子数。公猪每次射精的总精子数主要反映了睾丸的精子生成能力[6],其会影响人工授精时母猪的配种数量和受胎率。而精液品质主要是由精子活力和精子形态这2个核心指标决定的,在常规指标中最能反映精液质量及受精潜力,并影响母猪的受胎率[7]。精子体外受精能力和母猪受胎率可更直接地反映精液质量,但由于研究条件的限制,仅有少量研究评价了相关指标。精子活力作为精子受精能力的中心指标,是精子膜结构和功能完整的体现[8]。正常形态精子的比例与母猪受胎率呈显著正相关,这是由于形态正常的精子其膜结构和功能趋于完整[9]。在生产中,新鲜精液中精子活力低、畸形率高、常温保存后活力下降是公猪繁殖力降低的重要原因[10]。尽管可以在人工授精时增加输入精子数来补偿由精子活力低或畸形率高造成的母猪受胎率降低等问题[11],但提升精液品质的首要目标仍是提高公猪个体的精子活力和有效精子数[12],这也是通过营养手段改善公猪繁殖力的研究热点[13]。
精液品质与精子的发生过程密切相关,受遗传、环境和营养管理的共同影响。本文将首先分析当前公猪精液品质营养调控研究的现状和发展趋势,在简要介绍精子发生过程和结构特点的基础上,重点阐述营养水平、饲喂模式、特定营养素以及毒性元素对公猪精液品质的影响。
1 公猪精液品质营养调控研究概貌近40年来,研究者们在公猪营养研究方面所发表文章数量逐步提高,2001年后中、英文文章总发表篇数(平均发表量:10.6篇/年)相较于2000年以前(平均发表量:2.7篇/年)有整体提升(图 1)。
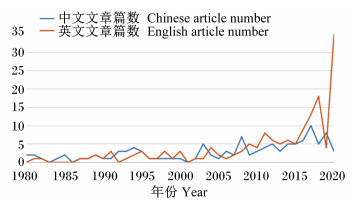
|
图 1 1979—2020年公猪营养研究文献数量变化趋势图 Fig. 1 Changing trend diagram of reference number for nutrition research of boars in 1979 to 2020 |
在公猪营养研究中,营养对精液品质和繁殖性能影响的研究是重中之重,占总研究的80%(215篇vs.269篇),其余研究围绕生长性能、胴体品质等方向开展。在公猪精液品质或繁殖性能营养研究中,主要关注的营养因素是植物提取物、矿物元素、复合物(矿物元素、氨基酸、维生素等2种或2种以上营养物质复合)、氨基酸、维生素、脂肪酸等。
近5年来,公猪精液品质或繁殖性能的生物标记物研究报道开始出现,植物提取物、益生菌、氨基酸、脂肪酸、维生素等在公猪精液品质方面的作用研究广泛,而蛋白质营养研究热度相对有所下降(图 2)。
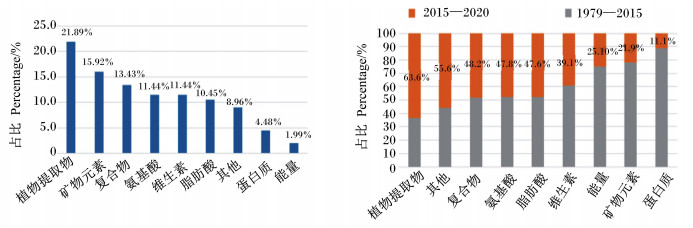
|
植物提取物:plant extracts;矿物元素:mineral elements;复合物:compounds;氨基酸:amino acids;维生素:vitamins;脂肪酸:fatty acids;蛋白质:protein;能量;energy;其他:others。 图 2 1979—2020年与公猪精液品质或繁殖性能相关的营养研究文献热点方向 Fig. 2 Hotspot directions of nutrition research references about semen quality or reproductive performance for boars in 1979 to 2020 |
值得注意的是,由于公猪群体往往较小,在很多研究中公猪的重复数不足6头,这大大降低了试验的统计力度。事实上,由于精液品质可获得重复测量数据,通过合理统计方法的应用,可提高统计分析的敏感性和准确性。本文接下来将围绕2015—2020年发表的论文,适当结合2015年前发表的论文,主要选取研究重复数≥6头且有重复测量的研究展开综述。
2 精子生成特点、膜结构特征及与精液品质调控的关系精子发生是一个发生在睾丸曲细精管内的复杂和精确调控的过程[14]。曲精管中各处精子发生的过程是呈周期性的、连续不断的。在射精过程中,精子与附睾、前列腺、精囊、尿道球腺和尿道周围腺的分泌物混合而成的精浆共同组成精液,精子占总精液的约5%[15]。精液的碱性稍强(pH:7.2~8.0),富含脂类、糖类、多糖、无机离子、免疫成分、酶、核酸、蛋白质和肽,其中精囊产生的果糖是精子代谢能量的主要来源[16]。值得指出的是,公猪的睾丸中,从A型精原细胞到形成精子大约需要45 d的时间[17-18]。因此,营养对精液品质的影响往往在6~7周之后才能表现出来,这也为研究营养调控公猪精液品质提供了采样时间的重要参考。
精子膜结构和功能对精子活力和精子形态及精子受精能力的获得异常重要[19-20]。在公猪精子膜磷脂中,60%~70%的脂肪酸是n-6多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)和n-3 PUFAs,它们在精子膜结构和功能及精子受精能力发挥中扮演重要角色[21]。因此,通过改变饲粮脂肪酸组成可以调控精子膜结构和功能,从而改善精子活力。值得注意的是,由于精子膜成分中富含PUFAs,使得其对氧化损伤特别敏感。精子活力和精子受精能力下降的一个重要原因就是精子膜、精子核DNA和线粒体功能受到氧化应激引起的损伤。因此,控制各种条件下精子的氧化损伤是保障精液品质优良的重要措施。
3 n-3 PUFAs对公猪精液品质的调控如前所述,公猪精子膜中含有丰富的长链多不饱和脂肪酸(long chain polyunsaturated fatty acids,Lc-PUFAs),主要是二十二碳六烯酸(docosahexaenoic acid,DHA,C22 : 6n-3)和二十碳五烯酸(eicosapentaenoic acid,EPA, C20 : 5n-3)。非常特别的是,在所有的物种中,公猪精子中DHA的含量是最丰富的,公猪精子中DHA含量占总脂肪含量的38.1%,进入附睾后成熟的精子的这一比例会进一步增加到56.8%[22]。DHA对于精子膜结构和功能的完整性、流动性至关重要,其在精子膜磷脂中的合理分布也使精子在运动时更具有柔韧性[23-24]。一般认为,由于哺乳动物体内缺乏从头合成Lc-PUFAs所需的特定去饱和酶,因此,必须从饲粮中获取相应的Lc-PUFAs或其前体物[主要是α-十八碳三烯酸、α-亚麻酸(C20 : 6n-3)],以满足机体对该类营养物质的需求。另外,由于猪的脂肪消化吸收过程中不存在氢化过程,脂肪会直接沉积到组织中,因此使得通过饲粮添加Lc-PUFA或其前体物来调控公猪精子膜脂肪酸组成,进而改善公猪的精液品质成为可能。需要指出的是,在猪体内通过α-亚麻酸为前体来合成更长链的脂肪酸时,大多只能合成EPA。而由EPA进一步延长碳链的酶活性低,猪体内合成的DHA是非常有限的,因此DHA需要直接从饲粮中添加。
在生产条件下公猪饲粮以玉米-豆粕型饲粮为主,饲粮n-6与n-3比值一般大于10[25],与精子膜脂肪酸组成中n-6与n-3比值相距较大。近20年来,有众多通过饲粮添加亚麻籽、鱼油、海藻油等富含n-3 PUFAs的原料,调控精子脂肪酸组成和精液品质的研究。从调控精子脂肪酸组成的结果上看,连续饲喂富含n-3 PUFAs的饲粮6周以上,一般均会显著改变精子的脂肪酸组成,显著提高n-3 PUFAs的比例。但饲粮n-3 PUFAs对精液品质的影响在不同的研究中却表现出不一致的结果。有些研究发现饲粮n-3 PUFAs对公猪精子数有提高作用[26];但也有些研究发现饲粮n-3 PUFAs对公猪繁殖力无显著改善作用[27];甚至有研究指出,连续75 d饲喂含120 g/kg微藻粉(富含n-3 PUFAs)的饲粮后,公猪的精液品质参数有所下降[28]。
之所以会产生调控结果上的差异,可能与精子脂肪酸的氧化状态有关。当摄入较多的n-3 PUFAs,而同时机体由于多种原因处于氧化还原状态失衡时,会导致精子脂质过氧化发生,损伤精子膜结构和功能,使精子活力及受精能力受到影响[29-30]。本课题组研究发现,饲喂n-6与n-3比值分别为14.4、6.6和2.2的饲粮8周后,仅有n-6与n-3比值为6.6的饲粮组长白公猪的精子活力显著提高;而n-6与n-3比值为2.2的饲粮组精子的超氧化物歧化酶活性显著降低,丙二醛含量显著增加[31]。并且,在n-6与n-3比值为6.6时,将饲粮维生素E水平从200 mg/kg提高到400 mg/kg能进一步提高精子活力,并降低精子氧化损伤[32]。此外,在此脂肪酸比例下,添加12.5 mg/kg的止痢草油也降低了精子的氧化损伤,并提高了精子活力[33]。这意味着,在利用提高饲粮n-3 PUFAs的方式调控精子脂肪酸组成时,应提高饲粮中抗氧化剂的添加水平,以防止脂质过氧化发生,从而保证饲粮n-3 PUFAs对精子活力的调控效果[34]。
n-3 PUFAs调控精子活力的机制主要与膜完整性和流动性有关。细胞膜中的PUFAs对精子膜流动性和伸缩性起重要作用,是维持精子活力的关键[35]。Strzeżek等[36]报道,给公猪补喂18.7 g/d n-3 PUFAs,改善了精子膜的完整性并提高了精子低温保存过程中的存活率。本课题组也报道,饲喂大白公猪n-6与n-3比值为6.6的饲粮12周后,显著提高了精子的膜结构和功能的完整性、膜流动性和线粒体膜电位[37]。而PUFAs发生脂质过氧化后,使精子膜流动性、完整性受到破坏,是造成精子活力降低和精子形态畸形的重要原因[38]。
4 氨基酸对公猪精液品质的调控以往的研究表明,在严格限制饲粮蛋白质水平(总赖氨酸水平为6 g/d)时,公猪的精液产量会显著下降;而提高蛋白质或赖氨酸水平时,则对公猪的精液产量无显著影响[39],但会显著影响精子密度和活力[40]。Dong等[40]通过分别饲喂总赖氨酸水平为0.64%和0.96%(其他限制性氨基酸与赖氨酸的比值一致)的饲粮28周,研究了饲粮氨基酸水平对杜洛克公猪精液品质和繁殖力的影响,结果发现,饲喂含0.96%赖氨酸饲粮13周后,精子密度和总精子数显著提高,精子的活力和形态参数显著改善,而且配种后母猪的产活仔数也显著提高。值得注意的是,饲粮蛋白质水平对精液品质的影响与公猪的采精频率有关。在采精频率较低时,饲粮蛋白质水平提高(粗蛋白质水平:507 g/d vs. 744 g/d;赖氨酸水平:42 g/d vs. 57 g/d;蛋氨酸+半胱氨酸水平:21 g/d vs. 38 g/d)对公猪射精的总精子数没有显著影响;但是在高采精频率(每周3~4次)下,提高公猪饲粮中赖氨酸和蛋氨酸水平,尤其是蛋氨酸水平,能够显著增加公猪射精总精子数,表明采精强度高时,公猪对于赖氨酸和蛋氨酸的需要量增加[39]。
精氨酸是精子生成所必需的营养物质。饲喂成年公猪添加1%精氨酸盐酸盐(Arg-HCl)的饲粮30 d后,公猪的射精量无显著变化,但精子数却显著提高了18%,精子活率显著提高8%[41]。在夏季高温条件下,饲喂成年公猪含有不同水平精氨酸的饲粮,可线性提高公猪的精液品质和抗氧化参数,并二次曲线提高公猪性欲,获得最佳精液品质和性欲对应的最适精氨酸水平分别为0.8%~1.0%和0.8%[42]。精氨酸对精液品质的调控可能与其增加多胺和精氨酸富集的基质蛋白的合成有关;另外,调控一氧化氮的生成可能也是精氨酸提高精子活率的可能途径[43]。N-氨甲基谷氨酸(N-carbamylglutamate,NCG)可促进精氨酸的内源生成,目前已在仔猪和母猪饲粮中作为精氨酸的内源性生成剂使用。近年来,有学者研究了饲粮添加NCG对公猪精液品质的影响。在连续31 d的试验期中,每天额外饲喂公猪2 g/d NCG,结果显著提高了公猪精液量,降低了精子畸形率。在基础饲粮中添加0.1%的NCG(含量为95%),虽然没有提高精液的产量、精子密度、总精子数,但却显著提高了有效精子数、精子活力和精子活率,显著降低了畸形率[44]。由于NCG可促进内源精氨酸的合成,因此NCG调控公猪精液品质的机制可能与精氨酸类似。
机体的氧化还原状态与精子活力密切相关。在过氧化氢(H2O2)诱导的公猪氧化应激模型中,在基础饲粮中添加2%天冬氨酸或谷氨酸能显著提高睾丸中抗氧化酶的活性,并降低炎症细胞因子的产生[45]。牛磺酸是蛋氨酸的代谢产物,具有一定的抗氧化作用。饲喂成年大约克夏公猪含有6 g/kg牛磺酸的饲粮46~90 d,显著提高了公猪的性欲,改善了精子密度和精子畸形率,显著降低了精子的氧化损伤,表现为丙二醛含量显著降低,同时超氧化氢歧化酶和谷胱甘肽过氧化物酶活性显著提高[46]。朱宇旌等[47]也发现,饲喂含0.6%牛磺酸的饲粮7周后,成年大约克夏公猪精子活力显著提高,同时精浆中超氧化氢歧化酶活性显著提高。
5 微量元素对公猪精液品质的调控必需微量元素作为机体组织结构成分、体液成分和主要代谢途径中的各种酶的组成部分,是哺乳动物生理生殖功能所不可缺少的[48]。目前,在公猪营养研究中,研究者主要关注到了硒、锌等元素的抗氧化作用在公猪精液品质中的贡献,并调研了其他微量元素及毒性元素含量与公猪精液品质的关系。
硒作为动物生产中不可缺少的微量元素之一,能够参与合成谷胱甘肽过氧化物酶,对于机体活性氧自由基的清除非常重要。并且硒还与雄性动物精液品质有关[49]。研究发现,添加0.3或0.5 mg/kg的酵母硒均可以显著提高杜洛克公猪射精量和精子密度,其中射精量以0.5 mg/kg酵母硒组公猪最高,精子密度以0.3 mg/kg酵母硒组公猪最高[50]。Horky等[51]通过对杜洛克公猪饲喂含0.5 mg/kg有机硒(硒代蛋氨酸)、350 mg/kg维生素C和70 mg/kg维生素E的饲粮,提高了公猪试验第45~90天时的精子活力和形态,降低了公猪试验第90天后精液中脂质过氧化水平。Martins等[52]研究发现,饲粮中补充0.5 mg/kg有机硒(Sel-Plex®)组的公猪相较于补充0.5 mg/kg无机硒(亚硒酸钠)组的公猪射精量增加23%,使每剂量精液的饲料成本降低了37%,精液产品总收入高出26%,表明有机硒的饲养增加了总精子数,降低了饲料的平均成本,具有成本效益。以上研究结果表明,饲粮中0.5 mg/kg有机硒的添加能够显著提高公猪精液品质,且同剂量条件下,有机硒的补充效果优于无机硒。
锌能够参与抗氧化活性等多种关键酶反应[53],调控金属硫蛋白、谷胱甘肽过氧化物酶等抗氧化基因的表达[54],在细胞增殖、分化和代谢激活中发挥重要作用[55]。另外,锌也被发现在睾丸间质细胞中合成和分泌睾酮是必不可少的[56]。通过调查小肽螯合锌对杜洛克公猪精液品质及血液理化指标的影响发现,饲粮补充25.0 mg/kg小肽螯合锌相较于补充12.5和50.0 mg/kg小肽螯合锌能够提高公猪精子密度和精子质量,增加红细胞分布宽度和丙氨酸转氨酶活性,在一定程度上降低贫血症状的发生[57]。在高温暴露条件下,基础饲粮中补充1 500 mg/kg无机锌[一水合硫酸锌(ZnSO4·H2O)]能够保护巴马小型猪免受40 ℃热暴露导致的附睾结构损伤,减轻附睾氧化应激,恢复顶部上皮完整性,降低主细胞和基底细胞核内糖皮质激素受体的应激反应[58]。结合以上2项研究发现,饲粮中无机锌或有机锌的补充均能够提高公猪的繁殖性能和正常生理机能,但在饲粮中无机锌的添加量远高于有机锌。
除了硒和锌元素外,铜、铁、锰等微量元素在碳水化合物、蛋白质和脂类的代谢中也发挥着关键作用,参与对精子正常发生和精子功能的维持[59-60]。它们对哺乳动物雄性生殖功能的影响取决于它们的平衡程度。另外,体内非必需的潜在毒性元素的积累也会对哺乳动物的雄性生殖系统产生不利影响[61-62]。本课题组通过连续度量166头杜洛克公猪、112头大白公猪和107头长白公猪在13周内的精液品质,探讨了公猪血清及精浆中微量元素含量对精液品质的影响,结果发现,在杜洛克和大白公猪中,高猪精利用率组公猪(猪精利用率≥80%)相较于低猪精利用率组公猪(猪精利用率<60%)的血清铁含量增加。在3个品种公猪中,高猪精利用率组公猪的精浆铅含量均呈现降低趋势[63-65]。通过运用Logistic回归模型对3个不同品种公猪机体元素含量与精液品质的关系进行分析,结果发现,血清铜含量≥2.5 mg/L的公猪精子活力低于而精子畸形率高于血清铜含量≤2.0 mg/L的公猪;血清铁含量≥1.5 mg/L的公猪精子畸形率低于血清铁含量≤1.0 mg/L的公猪;精浆中铅存在增加精子畸形率,在杜洛克、长白和大白公猪中,精浆铅存在的公猪精子畸形率>20%的发生概率比精浆中不含铅的公猪高出5.78%~15.30%。需要特别注意的是,微量元素,尤其是痕量的毒性元素在精子中的浓度往往不符合正态分布,因此在分析数据时必须首先进行适当的数据转换,或选择适合非正态分布的统计方法。总的来说,血清铜含量过高、血清铁缺乏、精浆中铅存在是造成公猪精液质量差的危险因素[66]。因此,必需微量元素的合理添加,避免摄入有毒微量元素,对维持公猪优良的精液品质具有重要意义。
6 维生素对公猪精液品质的调控在有关营养物质对公猪精液品质和精子储存期质量影响的研究中,抗氧化剂类营养物质一直占据重要地位。维生素E是经典的具有抗氧化功能的维生素。在NRC(2012)中,成年公猪的维生素E需要量为44 IU/kg(约30 mg/kg)。与饲喂满足NRC(2012)维生素E推荐量(38 mg/kg)的饲粮相比,饲喂维生素E不足(10 mg/kg)的饲粮90 d后,不同品种公猪射精的总精子数、精子密度、精子活率显著降低,而畸形精子数则显著增加[67]。值得注意的是,种公猪饲粮适宜的维生素E水平可能与环境条件和饲粮PUFAs水平关系密切。一般认为,在高温环境下,应在NRC推荐量的基础上提高饲粮维生素E水平1倍,以保护精子细胞膜免受氧化损伤[39]。在饲喂添加鱼油的饲粮时发现,400 mg/kg维生素E相比200 mg/kg维生素E能显著提高精子活力,并降低精子氧化损伤[32]。
除维生素E外,近年的研究发现维生素D对公猪的精液品质也具有调控作用。将饲粮中的维生素D水平从NRC(2012)推荐的200 IU/kg提高到2 000 IU/kg时,血浆和精浆中的25羟基维生素D3(25-OH-D3)的含量显著提升,精子活率和有效精子数显著增加[68]。值得注意的是,与同等水平维生素D3(50 μg/kg)相比,种公猪饲粮中添加25-OH-D3能更有效增加血浆维生素D含量,从而改善精子的形态和运动能力,提高繁殖性能[69]。维生素D对精液品质的调控作用可能与其提高血浆睾丸酮含量,增加精浆钙离子和果糖含量以及酸性磷酸酶活性有关[68]。在已满足PIC推荐的维生素水平(0.1 mg/kg维生素C、3 284 IU/kg维生素D和81 mg/kg维生素E)的基础上,再额外添加560 mg/d维生素C、125 mg/d 25-OH-D3或275 mg/d维生素E并不能显著改善夏季人工授精站公猪的精液品质。由此可见,在实际生产中,使用NRC(2012)推荐的维生素水平可能不足以获得最优的精液品质。
7 植物提取物对公猪精液品质的调控含有香芹酚和百里香酚、绿原酸和咖啡酸、寡聚原花青素、迷迭香酸、白藜芦醇等物质的植物提取物是研究者关注的重点。止痢草油是天然的植物提取物,富含香芹酚和百里香酚,具有与维生素E效果相当的抗氧化能力。本课题组研究了鱼油饲粮中添加止痢草油对公猪精子形态、精子膜及抗氧化作用的影响,发现鱼油饲粮添加止痢草油可增强公猪血清和精清抗氧化能力,添加500 mg/kg止痢草油有利于保持精子膜完整性,从而改善精子形态[70]。
除了抗氧化类植物提取物外,甜菜碱也对公猪精液品质有一定的调控作用。当动物受到疾病、代谢挑战或环境条件的压力时,甜菜碱可以作为一种渗透保护剂[71]。Cabezón等[72]研究发现,相较于饲喂添加0.63%甜菜碱饲粮的公猪,饲喂添加1.26%甜菜碱饲粮的公猪具有更高的中末端反射异常和尾部异常的精子比例;当甜菜碱的添加量为0.63%和1.26%时,精液中精子密度分别增加了6%和13%。因此,当饲粮中甜菜碱的添加量为0.63%时,能够增加精子密度,且对精液质量没有负面影响。
8 培育模式对公猪精液品质的调控营养水平对公猪日增重、精液品质、性欲和跛行发病率具有显著影响[39]。提高后备公猪[73]和成年公猪[74]饲粮营养水平能够增加公猪射精量和精液总精子数,对精液密度、精子活力和畸形率无显著影响[73, 75]。
然而,公猪饲粮营养水平不能过高。饲粮营养水平高的公猪增重较快,增加了四肢的承重,因此易跛行,从而性欲降低,种用年限缩短[75-76]。目前对于公猪饲粮营养水平或公猪日增重还存在争议,特别是公猪性成熟(150 kg;7~9月龄)到体成熟阶段(250 kg;15~18月龄)备受关注,因为该阶段公猪还在不断生长,此阶段饲粮的营养水平对公猪后续繁殖能力的表现至关重要[74, 77]。
本实验室前期研究了营养水平对性成熟到体成熟阶段杜洛克公猪生长性能和精液品质的影响[78]。试验按照公猪体重分为170~200 kg和200~250 kg 2个阶段。选取61头杜洛克公猪,在170~200 kg阶段饲喂低(代谢能摄入量30.56 MJ/d,n=20)、中(代谢能摄入量32.23 MJ/d,n=20)和高(代谢能摄入量34.74 MJ/d,n=21)3个营养水平的饲粮;同样的分组在200~250 kg阶段饲喂低(代谢能摄入量31.81 MJ/d,n=20)、中(代谢能摄入量34.32 MJ/d,n=20)和高(代谢能摄入量36.00 MJ/d,n=21)3个营养水平的饲粮。结果表明,在170~200 kg阶段低营养水平组公猪日增重显著低于高营养水平组;在200~250 kg阶段以及整个试验阶段(170~250 kg),公猪日增重随营养水平的升高显著增加,低营养水平组公猪的射精量、总精子数和有效精子数相较于中营养水平组和高营养水平组显著降低;而与低营养水平组和中营养水平组公猪相比,高营养水平组公猪各阶段爬跨速度和开始射精速度显著减慢,跛行发病率显著升高,公猪淘汰率显著提高至9.5%。总之,在170~200 kg和200~250 kg阶段,公猪日均能量摄入水平分别为32.23和34.32 MJ/d、日增重分别为454.5和375.3 g/d时,能够提升杜洛克公猪生长性能,增加射精量、总精子数和有效精子数。此外,这种饲喂方案对于维持公猪正常性欲、降低肢蹄病发病率和淘汰率也有显著作用。
9 小结公猪优良的精液品质是保障母猪繁殖性能的关键。公猪的精液品质受多种因素影响,在营养方面,严格的营养缺乏对精液品质有显著影响,但只有在较高的采精频率下才有提高能量和蛋白质水平的需求。对于青年公猪而言,应选择适宜的培育模式保障精液品质,避免因过快增重导致肢蹄损伤和性欲下降。从功能性调控作用上来看,营养素对精液品质的调控主要通过对细胞膜结构和功能的改善和对氧化应激的控制来实现。近年来的研究发现通过优化饲粮的脂肪酸和氨基酸组成,可以改善公猪的精液品质。但需要特别注意的是,氧化应激对精子膜、核DNA和线粒体功能的损伤是造成精子活力及受精能力降低的重要原因。由于PUFAs自身具有易发生脂质过氧化的特点,因此应用PUFAs调控公猪精液品质时,应特别注意需适当增加饲粮中抗氧化剂的水平。维生素E和硒等具有抗氧化功能的营养素是维持精子正常活力的必需营养素。此外,一些具有抗氧化作用的植物提取物也被证实具有提高公猪精液品质的作用。另外,饲粮中痕量的毒性元素可能也是损害公猪精液品质的重要因素。但需要注意的是,由于公猪群体一般较小,这限制了一些试验中的样品数,因此,为了能更准确地评估营养调控效果,还需要更多的大样本研究,并注重选择适宜的数据统计方法,以提高研究的准确性。同时,需要进一步从分子和细胞水平阐明特定营养素调控精液品质的活性,为建立精准得公猪精液品质营养调控方案提供理论依据。
| [1] |
KEMP B, GROOTEN H J G, DEN HARTOG L A, et al. The effect of a high protein intake on sperm production in boars at two semen collection frequencies[J]. Animal Reproduction Science, 1988, 17(1/2): 103-113. |
| [2] |
SCHULZE M, BUDER S, RVDIGER K, et al. Influences on semen traits used for selection of young AI boars[J]. Animal Reproduction Science, 2014, 148(3/4): 164-170. |
| [3] |
BERNDTSON W E. Comparative reliability and sensitivity of different methods for assessing treatment effects on sperm production[J]. Animal Reproduction Science, 2008, 105(1/2): 5-22. |
| [4] |
BROEKHUIJSE M L W J, ŠOŠTARIĆ E, FEITSMA H, et al. The value of microscopic semen motility assessment at collection for a commercial artificial insemination center, a retrospective study on factors explaining variation in pig fertility[J]. Theriogenology, 2012, 77(7): 1466-1479.e3. DOI:10.1016/j.theriogenology.2011.11.016 |
| [5] |
GADEA J, SELLÉS E, MARCO M A. The predictive value of porcine seminal parameters on fertility outcome under commercial conditions[J]. Reproduction in Domestic Animals, 2004, 39(5): 303-308. DOI:10.1111/j.1439-0531.2004.00513.x |
| [6] |
FLOWERS W L. Management of boars for efficient semen production[J]. Journal of Reproduction and Fertility, 1997, 52: 67-78. |
| [7] |
HOLT C, HOLT W V, MOORE H D M, et al. Objectively measured boar sperm motility parameters correlate with the outcomes of on-farm inseminations:results of two fertility trials[J]. Journal of Andrology, 1997, 18(3): 312-323. |
| [8] |
GIL M C, GARCÍA-HERREROS M, BARÓN F J, et al. Morphometry of porcine spermatozoa and its functional significance in relation with the motility parameters in fresh semen[J]. Theriogenology, 2009, 71(2): 254-263. DOI:10.1016/j.theriogenology.2008.07.007 |
| [9] |
O'CONNELL M, MCCLURE N, LEWIS S E M. The effects of cryopreservation on sperm morphology, motility and mitochondrial function[J]. Human Reproduction, 2002, 17(3): 704-709. DOI:10.1093/humrep/17.3.704 |
| [10] |
KNOX R, LEVIS D, SAFRANSKI T, et al. An update on North American boar stud practices[J]. Theriogenology, 2008, 70(8): 1202-1208. DOI:10.1016/j.theriogenology.2008.06.036 |
| [11] |
SAACKE R G. Sperm morphology:its relevance to compensable and uncompensable traits in semen[J]. Theriogenology, 2008, 70(3): 473-478. DOI:10.1016/j.theriogenology.2008.04.012 |
| [12] |
JUNG M, RVDIGER K, SCHULZE M. In vitro measures for assessing boar semen fertility[J]. Reproduction in Domestic Animals, 2015, 50(Suppl.2): 20-24. |
| [13] |
KUNAVONGKRIT A, SURIYASOMBOON A, LUNDEHEIM N, et al. Management and sperm production of boars under differing environmental conditions[J]. Theriogenology, 2005, 63(2): 657-667. DOI:10.1016/j.theriogenology.2004.09.039 |
| [14] |
PARRISH J J, WILLENBURG K L, GIBBS K M, et al. Scrotal insulation and sperm production in the boar[J]. Molecular Reproduction and Development, 2017, 84(8): 969-978. |
| [15] |
CASTILLO J, JODAR M, OLIVA R. The contribution of human sperm proteins to the development and epigenome of the preimplantation embryo[J]. Human Reproduction Update, 2018, 24(5): 535-555. DOI:10.1093/humupd/dmy017 |
| [16] |
DRABOVICH A P, SARAON P, JARVI K, et al. Seminal plasma as a diagnostic fluid for male reproductive system disorders[J]. Nature Reviews Urology, 2014, 11(5): 278-288. DOI:10.1038/nrurol.2014.74 |
| [17] |
COSTA D S, FARIA F J C, FERNANDES C A C, et al. Testis morphometry and kinetics of spermatogenesis in the feral pig (Sus scrofa)[J]. Animal Reproduction Science, 2013, 142(1/2): 63-70. |
| [18] |
FRANKENHUIS M T, KRAMER M F, DE ROOIJ D G. Spermatogenesis in the boar[J]. Veterinary Quarterly, 1982, 4(2): 57-61. DOI:10.1080/01652176.1982.9693840 |
| [19] |
BLESBOIS E, GRASSEAU I, SEIGNEURIN F. Membrane fluidity and the ability of domestic bird spermatozoa to survive cryopreservation[J]. Reproduction, 2005, 129(3): 371-378. DOI:10.1530/rep.1.00454 |
| [20] |
GUTHRIE H D, WELCH G R. Effects of reactive oxygen species on sperm function[J]. Theriogenology, 2012, 78(8): 1700-1708. DOI:10.1016/j.theriogenology.2012.05.002 |
| [21] |
WATHES D C, ABAYASEKARA D R, AITKEN R J. Polyunsaturated fatty acids in male and female reproduction[J]. Biology of Reproduction, 2007, 77(2): 190-201. DOI:10.1095/biolreprod.107.060558 |
| [22] |
EVANS R W, SETCHELL B P. Lipid changes in boar spermatozoa during epididymal maturation with some observations on the flow and composition of boar rete testis fluid[J]. Reproduction, 1979, 57(1): 189-196. DOI:10.1530/jrf.0.0570189 |
| [23] |
JAMES P S, WOLFE C A, LADHA S, et al. Lipid diffusion in the plasma membrane of ram and boar spermatozoa during maturation in the epididymis measured by fluorescence recovery after photobleaching[J]. Molecular Reproduction and Development, 1999, 52(2): 207-215. DOI:10.1002/(SICI)1098-2795(199902)52:2<207::AID-MRD12>3.0.CO;2-W |
| [24] |
JAMES P S, WOLFE C A, MACKIE A, et al. Lipid dynamics in the plasma membrane of fresh and cryopreserved human spermatozoa[J]. Human Reproduction, 1999, 14(7): 1827-1832. DOI:10.1093/humrep/14.7.1827 |
| [25] |
ALLEN K G D, HARRIS M A. The role of n-3 fatty acids in gestation and parturition[J]. Experimental Biology and Medicine, 2001, 226(6): 498-506. DOI:10.1177/153537020122600602 |
| [26] |
ESTIENNE M J, HARPER A F, CRAWFORD R J. Dietary supplementation with a source of omega-3 fatty acids increases sperm number and the duration of ejaculation in boars[J]. Theriogenology, 2008, 70(1): 70-76. DOI:10.1016/j.theriogenology.2008.02.007 |
| [27] |
CASTELLANO C A, AUDET I, BAILEY J L, et al. Effect of dietary n-3 fatty acids (fish oils) on boar reproduction and semen quality[J]. Journal of Animal Science, 2010, 88(7): 2346-2355. DOI:10.2527/jas.2009-2779 |
| [28] |
ANDRIOLA Y T, MOREIRA F, ANASTÁCIO E, et al. Boar sperm quality after supplementation of diets with omega-3 polyunsaturated fatty acids extracted from microalgae[J]. Andrologia, 2018, 50(1): e12825. DOI:10.1111/and.12825 |
| [29] |
SURAI P F, NOBLE R C, SPARKS N H, et al. Effect of long-term supplementation with arachidonic or docosahexaenoic acids on sperm production in the broiler chicken[J]. Reproduction, 2000, 120(2): 257-264. DOI:10.1530/jrf.0.1200257 |
| [30] |
CEROLINI S, ZANIBONI L, MALDJIAN A, et al. Effect of docosahexaenoic acid and α-tocopherol enrichment in chicken sperm on semen quality, sperm lipid composition and susceptibility to peroxidation[J]. Theriogenology, 2006, 66(4): 877-886. DOI:10.1016/j.theriogenology.2006.02.022 |
| [31] |
LIU Q, ZHOU Y F, DUAN R J, et al. Effects of dietary n-6 : n-3 fatty acid ratio and vitamin E on semen quality, fatty acid composition and antioxidant status in boars[J]. Animal Reproduction Science, 2015, 162: 11-19. DOI:10.1016/j.anireprosci.2015.08.012 |
| [32] |
LIU Q, ZHOU Y F, DUAN R J, et al. Lower dietary n-6 : n-3 ratio and high-dose vitamin E supplementation improve sperm morphology and oxidative stress in boars[J]. Reproduction, Fertility and Development, 2017, 29(5): 940-949. DOI:10.1071/RD15424 |
| [33] |
LIU Q, DUAN R J, ZHOU Y F, et al. Supplementing oregano essential oil to boar diet with strengthened fish oil:effects on semen antioxidant status and semen quality parameters[J]. Andrologia, 2017, 49(10): e12764. DOI:10.1111/and.12764 |
| [34] |
ROOKE J A, SHAO C C, SPEAKE B K. Effects of feeding tuna oil on the lipid composition of pig spermatozoa and in vitro characteristics of semen[J]. Reproduction, 2001, 121(2): 315-322. DOI:10.1530/rep.0.1210315 |
| [35] |
FLESCH F M, GADELLA B M. Dynamics of the mammalian sperm plasma membrane in the process of fertilization[J]. Biochimica et Biophysica Acta (BBA)-Reviews on Biomembranes, 2000, 1469(3): 197-235. DOI:10.1016/S0304-4157(00)00018-6 |
| [36] |
STRZEŻEK J, FRASER L, KUKLIŃSKA M, et al. Effects of dietary supplementation with polyunsaturated fatty acids and antioxidants on biochemical characteristics of boar semen[J]. Reproductive Biology, 2004, 4(3): 271-287. |
| [37] |
LIU Q, ZHOU Y F, DUAN R J, et al. Dietary n-6 : n-3 ratio and vitamin E improve motility characteristics in association with membrane properties of boar spermatozoa[J]. Asian Journal of Andrology, 2017, 19(2): 223-229. DOI:10.4103/1008-682X.170446 |
| [38] |
AITKEN R J, BAKER M A. Oxidative stress and male reproductive biology[J]. Reproduction, Fertility and Development, 2004, 16(5): 581-588. DOI:10.1071/RD03089 |
| [39] |
WILSON M E, ROZEBOOM K J, CRENSHAW T D. Boar nutrition for optimum sperm production[J]. Advances in Pork Production, 2004, 15: 295-306. |
| [40] |
DONG H J, WU D, XU S Y, et al. Effect of dietary supplementation with amino acids on boar sperm quality and fertility[J]. Animal Reproduction Science, 2016, 172: 182-189. DOI:10.1016/j.anireprosci.2016.08.003 |
| [41] |
WU G, BAZER F W, KIM S, et al. New developments in amino acid research[M]. Animal Production and Animal Science Worldwide: WAAP Book of the Year, 2006: 299-315.
|
| [42] |
CHEN J Q, LI Y S, LI Z J, et al. Dietary L-arginine supplementation improves semen quality and libido of boars under high ambient temperature[J]. Animal, 2018, 12(8): 1611-1620. DOI:10.1017/S1751731117003147 |
| [43] |
BALERCIA G, MORETTI S, VIGNINI A, et al. Role of nitric oxide concentrations on human sperm motility[J]. Journal of Andrology, 2004, 25(2): 245-249. DOI:10.1002/j.1939-4640.2004.tb02784.x |
| [44] |
任波, 万海峰, 苏祥, 等. 日粮中添加NCG对公猪精液品质的影响[J]. 今日养猪业, 2017(增刊): 93-95. |
| [45] |
TANG W J, WU J, JIN S S, et al. Glutamate and aspartate alleviate testicular/epididymal oxidative stress by supporting antioxidant enzymes and immune defense systems in boars[J]. Science China Life Sciences, 2020, 63(1): 116-124. DOI:10.1007/s11427-018-9492-8 |
| [46] |
李方方, 蒋超群, 朱宇旌, 等. 牛磺酸对种公猪精液品质、血清激素含量及精浆抗氧化能力的影响[J]. 动物营养学报, 2016, 28(4): 1122-1128. |
| [47] |
朱宇旌, 朱广楠, 李方方, 等. N-氨甲酰谷氨酸与牛磺酸对公猪精液品质、血清激素指标及精浆抗氧化能力的影响[J]. 动物营养学报, 2015, 27(10): 3125-3133. |
| [48] |
MERTZ W. The essential trace elements[J]. Science, 1981, 213(4514): 1332-1338. DOI:10.1126/science.7022654 |
| [49] |
HORK P. Effect of selenium on its content in milk and performance of dairy cows in ecological farming[J]. Potravinarstvo, 2015, 9(1): 324-329. |
| [50] |
侯佳妮. 硒对杜洛克种公猪繁殖性能的影响[J]. 河南农业, 2016(23): 87. |
| [51] |
HORKY P, SOCHOR J, SKLADANKA J, et al. Effect of selenium, vitamins E and C on antioxidant potential and quality of boar ejaculate[J]. Journal of Animal and Feed Ences, 2016, 25(1): 29-36. DOI:10.22358/jafs/65584/2016 |
| [52] |
MARTINS S M M K, AFONSO E R, PARAZZI L J, et al. Organic selenium supplementation is cost-effective for increasing the number of seminal doses produced by sexually mature boars[J]. Revista Brasileira De Zootecnia, 2018, 47: e20160328. DOI:10.1590/rbz4720160328 |
| [53] |
TUPE R S, TUPE S G, TARWADI K V, et al. Effect of different dietary zinc levels on hepatic antioxidant and micronutrients indices under oxidative stress conditions[J]. Metabolism, 2010, 59(11): 1603-1611. DOI:10.1016/j.metabol.2010.02.020 |
| [54] |
ZHENG J J, ZHANG Y, XU W T, et al. Zinc protects HepG2 cells against the oxidative damage and DNA damage induced by ochratoxin A[J]. Toxicology and Applied Pharmacology, 2013, 268(2): 123-131. DOI:10.1016/j.taap.2013.01.021 |
| [55] |
TAYLOR K M, VICHOVA P, JORDAN N, et al. ZIP7-mediated intracellular zinc transport contributes to aberrant growth factor signaling in antihormone-resistant breast cancer cells[J]. Endocrinology, 2008, 149(10): 4912-4920. DOI:10.1210/en.2008-0351 |
| [56] |
MCCLAIN C J, GAVALER J S, VAN THIEL D H. Hypogonadism in the zinc-deficient rat:localization of the functional abnormalities[J]. Journal of Laboratory & Clinical Medicine, 1984, 104(6): 1007-1015. |
| [57] |
乔月建, 蒋万春, 谈春季, 等. 小肽螯合锌对种公猪精液品质及血液理化指标的影响[J]. 黑龙江畜牧兽医, 2017(12): 64-67. |
| [58] |
LI Z J, LI Y S, ZHOU X, et al. Preventive effects of supplemental dietary zinc on heat-induced damage in the epididymis of boars[J]. Journal of Thermal Biology, 2017, 64: 58-66. DOI:10.1016/j.jtherbio.2017.01.002 |
| [59] |
EGHBALI M, ALAVI-SHOUSHTARI S M, ASRI-REZAEI S, et al. Effects of the seminal plasma iron and lead content on semen quality of water buffalo (Bubalus bubalis) bulls[J]. Veterinary Research Forum, 2010, 1(3): 142-148. |
| [60] |
PESCH S, BERGMANN M, BOSTEDT H. Determination of some enzymes and macro- and microelements in stallion seminal plasma and their correlations to semen quality[J]. Theriogenology, 2006, 66(2): 307-313. DOI:10.1016/j.theriogenology.2005.11.015 |
| [61] |
MONSEFI M, ALAEE S, MORADSHAHI A, et al. Cadmium-induced infertility in male mice[J]. Environmental Toxicology, 2010, 25(1): 94-102. |
| [62] |
WADI S A, AHMAD G. Effects of lead on the male reproductive system in mice[J]. Journal of Toxicology and Environmental Health, Part A, 1999, 56(7): 513-521. DOI:10.1080/009841099157953 |
| [63] |
WU Y H, GUO L L, LIU Z H, et al. Microelements in seminal and serum plasma are associated with fresh semen quality in Yorkshire boars[J]. Theriogenology, 2019, 132: 88-94. DOI:10.1016/j.theriogenology.2019.04.002 |
| [64] |
WU Y H, LAI W, LIU Z H, et al. Serum and seminal plasma element concentrations in relation to semen quality in Duroc boars[J]. Biological Trace Element Research, 2019, 189(1): 85-94. DOI:10.1007/s12011-018-1459-y |
| [65] |
吴英慧, 王超, 谭家健, 等. 长白公猪血清和精浆中元素含量对精液品质的影响[J]. 动物营养学报, 2020, 32(2): 596-604. |
| [66] |
WU T H, WANG C, PENG J. Ordered logistic regression analyze the effect of elements in serum and seminal plasma on abnormal sperm rate in boars[J]. Journal of Animal Science, 2019, 97(Suppl.3): 117. |
| [67] |
梅军四, 江中良, 袁勤科, 等. 维生素E对不同品种的种公猪精液品质的影响[J]. 黑龙江畜牧兽医, 2016(7): 87-90. |
| [68] |
LIN Y, LV G, DONG H J, et al. Effects of the different levels of dietary vitamin D on boar performance and semen quality[J]. Livestock Science, 2017, 203: 63-68. DOI:10.1016/j.livsci.2017.07.003 |
| [69] |
魏冬芹, 董洪俊, 吕刚, 等. 饲粮维生素D添加形式对公猪繁殖性能的影响[J]. 动物营养学报, 2017, 29(12): 4323-4333. |
| [70] |
刘庆, 段润甲, 周远飞, 等. 止痢草油对公猪精子形态、精子膜及抗氧化作用的影响[J]. 中国畜牧杂志, 2017, 53(1): 85-91. |
| [71] |
LIPIŃSKI K, SZRAMKO E, JEROCH H, et al. Effects of betaine on energy utilization in growing pigs-a review[J]. Annals of Animal Science, 2012, 12(3): 291-300. DOI:10.2478/v10220-012-0024-4 |
| [72] |
CABEZÓN F A, STEWART K R, SCHINCKEL A P, et al. Effect of natural betaine on estimates of semen quality in mature AI boars during summer heat stress[J]. Animal Reproduction Science, 2016, 170: 25-37. DOI:10.1016/j.anireprosci.2016.03.009 |
| [73] |
DUTT R H, BARNHART C E. Effect of plane of nutrition upon reproductive performance of boars[J]. Journal of Animal Science, 1959, 18(1): 3-13. |
| [74] |
KEMP B, DEN HARTOG L A, GROOTEN H J G. The effect of feeding level on semen quantity and quality of breeding boars[J]. Animal Reproduction Science, 1989, 20(4): 245-254. DOI:10.1016/0378-4320(89)90073-0 |
| [75] |
HACKER R R, DU Z, D'ARCY C J. Influence of penning type and feeding level on sexual behavior and feet and leg soundness in boars[J]. Journal of Animal Science, 1994, 72(10): 2531-2537. DOI:10.2527/1994.72102531x |
| [76] |
KOKETSU Y, SASAKI Y. Boar culling and mortality in commercial swine breeding herds[J]. Theriogenology, 2009, 71(7): 1186-1191. DOI:10.1016/j.theriogenology.2008.12.018 |
| [77] |
CLOSE W H, COLE D J A. Nutrition of sows and boars[M]. Nottingham, UK: Nottingham University Press, 2000.
|
| [78] |
WANG C, LI J L, WEI H K, et al. Effects of feeding regimen on weight gain, semen characteristics, libido, and lameness in 170- to 250-kilogram Duroc boars[J]. Journal of Animal Science, 2016, 94(11): 4666-4676. DOI:10.2527/jas.2016-0803 |




