2. 东阿阿胶股份有限公司, 国家胶类中药工程技术研究中心, 东阿 252201
2. Engineering Research Center of Gelatin-Based Traditional Chinese Medicine, Dong-E-E-Jiao Co., Ltd., Dong'e 252201, China
驴属脊索动物门,哺乳纲,奇蹄目,马科,马属,具有耐粗饲、抗病力强、用途广等特点[1]。作为特色畜牧业,驴产业在促进我国部分地区农民增收、带动脱贫致富等方面起到了重要的作用。然而,驴产业的发展也存在着一些问题,例如规模化饲养水平低、疫病防控工作不足等,导致驴驹发病率、死亡率增高,造成严重的经济损失。王仁虎[2]研究表明,幼龄驴驹腹泻发病率为31.8%,死亡率高达12.4%。由于驴驹免疫系统和消化器官发育不成熟,抵抗力差,加之病原体毒力强,抗生素治疗效果不佳。
随着全面禁抗的实施,微生态制剂作为抗生素替代品的研究越来越受到国内外学者的关注。枯草芽孢杆菌(Bacillus subtilis)作为新型饲料添加剂,具有安全、高效、耐高温、耐酸碱和抗逆性强等特点[3]。枯草芽孢杆菌已在猪、禽、牛、羊等家畜中广泛应用,能调节肠道微生态平衡,促进营养物质消化,提高机体的抗病力,促进动物生长[4-7]。然而有关枯草芽孢杆菌在驴驹上的应用研究鲜有报道。本试验旨在研究驴源枯草芽孢杆菌对断奶驴驹生长性能、营养物质表观消化率及肠道菌群的影响,为驴源枯草芽孢杆菌微生态制剂的开发、利用提供物质材料和理论依据。
1 材料与方法 1.1 试验菌株从健康成年驴消化道中分离、筛选、鉴定后得到枯草芽孢杆菌(编号LY-5),由中国农业科学院特产研究所特种动物营养与饲养科技创新团队保存。取复苏的受试菌株接种到LB固体斜面培养基,37 ℃培养48 h取出,刮取菌泥,用15%脱脂乳粉做保护剂冻干,平板计数法测出有效活菌数。
1.2 试验动物与饲养管理选择5~6月龄雌性断奶驴驹[平均体重为(113.40±17.52) kg]10头,随机分成2组,分别饲喂基础饲粮(A组)和基础饲粮+枯草芽孢杆菌(B组,枯草芽孢杆菌按1011 CFU/kg添加于精饲料中,精饲料按照驴驹体重的1.3%定量饲喂),每组5个重复,每个重复1头。预试期7 d,试验期60 d。每组试验驴驹饲养于1间圈舍,每天早晚饲喂2次,自由采食粗饲料并保证充足的饮水。以正试期开始时空腹称重为始重,之后每隔15 d称重1次,以计算平均日增重。记录每头驴驹精饲料和粗饲料投食量和剩食量,以计算平均日采食量。
以玉米、豆粕、棉籽粕、花生仁粕、干酒糟及其可溶物(DDGS)为主要原料,同时添加由矿物质、维生素等组成的营养性添加剂制成精饲料,精饲料组成及营养水平见表 1,以豆秸为粗饲料,营养水平如下:粗蛋白质(CP)8.75%,粗脂肪(EE)1.17%,有机物(OM)90.03%,中性洗涤纤维(NDF)72.75%,酸性洗涤纤维(ADF)54.63%,钙(Ca)1.26%,磷(P)0.17%,总能(GE)15.71 MJ/kg。
|
|
表 1 精饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the concentrate (DM basis) |
于试验第30~32天,每天14:00开始收集每头驴驹刚刚排出的新鲜粪便200 g。粪样的收集严格避免驴毛、沙粒等污染。将每头驴驹3 d的粪便混合,按收集鲜粪重的5%加入10%硫酸溶液进行固氮,先在80 ℃下杀菌2 h,然后降到65 ℃烘干24~48 h至恒重,粉碎过40目筛,制成样品。在试验第45天,采用直肠取样法采集每头驴驹直肠内容物于10 mL冻存管,液氮速冻后,-80 ℃保存。
1.4 样品测定干物质(DM)含量采用GB/T 6435—1986方法测定;CP含量采用凯氏定氮法测定,参照GB/T 6432—1994;EE含量采用索氏抽提法测定,参照GB/T 6433—1994;ADF和NDF含量采用范氏(Van Soest)洗涤纤维分析法测定,参照GB/T 20806—2006;Ca含量采用乙二胺四乙酸(EDTA)络合滴定法测定,参照GB/T 6436—1992;P含量采用钒钼酸铵比色法测定,参照GB/T 6437—1992;GE使用热量测定仪(C2000, IKA, 德国)进行测定。赖氨酸(Lys)含量采用氨基酸分析仪(L-8900, Hitachi, 日本)进行测定。营养物质表观消化率采用2 mol/L盐酸不溶灰分(acid insoluble ash,AIA)法测定,计算公式如下:

|
粪便样品中微生物基因组DNA提取按照Fast DNA RSPIN Kit for Feces说明书进行。提取的基因组DNA经1%的琼脂糖凝胶电泳检测,电压120 V,电泳23 min,Marker为λ-Hind Ⅲ DNA Maker,DNA产物在14 000 bp左右,并且DNA条带亮度较高,无明显降解、无杂质,可进行下一步试验。将目的DNA送至北京诺禾致源科技股份有限公司,测序平台为Illumina Miseq。微生物测序结果通过Flash软件(FLASH v1.2.7)融合双末端序列。采用PRINSEQ软件(PRINSEQ-lite 0.19.5)截掉质量低的数据,按照97%相似性将序列聚类为操作分类单元(OTU)。OTU聚类采用的软件为Uclust版本(Uclust v1.1.579),采用软件RDP classifier进行物种分类。通过QIIME 1.9.0计算菌群α多样性指数(ACE指数、Chao1指数、Simpson指数、Shannon指数)[8]。
1.5 数据统计与分析试验结果以平均值±标准差表示,数据用Excel 2007进行整理,通过SPSS 9.0软件进行t检验,P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果与分析 2.1 枯草芽孢杆菌对断奶驴驹生长性能的影响由表 3可知,1~30 d时,饲粮添加枯草芽孢杆菌可显著提高断奶驴驹平均日增重(P < 0.05),31~60 d时,2组驴驹各项生长性能指标差异均不显著(P>0.05)。
|
|
表 3 枯草芽孢杆菌对断奶驴驹生长性能的影响 Table 3 Effects of Bacillus subtilis on growth performance of weaned donkey foals |
由表 4可知,饲粮添加枯草芽孢杆菌可显著提高断奶驴驹粗脂肪表观消化率(P<0.05),干物质、粗蛋白质、中性洗涤纤维和酸性洗涤纤维表观消化率2组之间差异不显著(P>0.05)。
|
|
表 4 枯草芽孢杆菌对断奶驴驹营养物质表观消化率的影响 Table 4 Effects of Bacillus subtilis on apparent nutrient digestibility of weaned donkey foals |
由表 5可知,2组覆盖率均高于0.995,说明测序深度足够,结果可呈现99.5%以上的菌群组成。B组的Shannon指数、Simpson指数、Chao1指数和ACE指数均高于A组,但差异不显著(P>0.05)。
|
|
表 5 断奶驴驹直肠内容物菌群多样性 Table 5 Microbial diversity in rectal contents of weaned donkey foals |
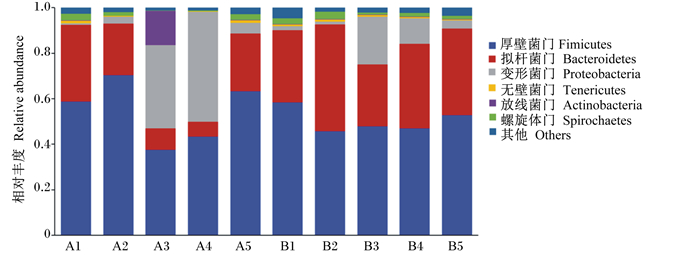
添加枯草芽孢杆菌对断奶驴驹直肠微生物组成门水平相对丰度影响如图 1所示,2组中相对丰度较高的前3种细菌门分别为厚壁菌门(Fimicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)。其中,B组拟杆菌门相对丰度显著高于A组(P<0.05)。A组中A3和A4 2头驴驹变形菌门相对丰度较高,达到36.46%~48.45%。
|
图 1 直肠内容物细菌门水平相对丰度 Fig. 1 Relative abundance of bacteria in rectal contents at phylum level |
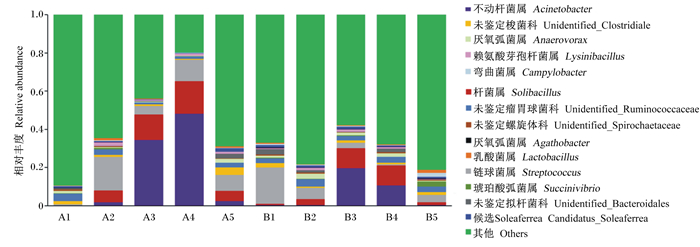
在细菌属水平上,2组菌群相对丰度并无显著差异(P>0.05)。2组中相对丰度较高的细菌分别为杆菌属(Solibacillus)、链球菌属(Streptococcus)、未鉴定梭菌科(unidentified_Clostridiales)、未鉴定瘤胃球菌科(unidentified_Ruminococcaceae)。A组中两头变形菌门相对丰度较高的驴驹,其不动杆菌属(Acinetobacter)相对丰度较高,达到34.35%~48.12%。
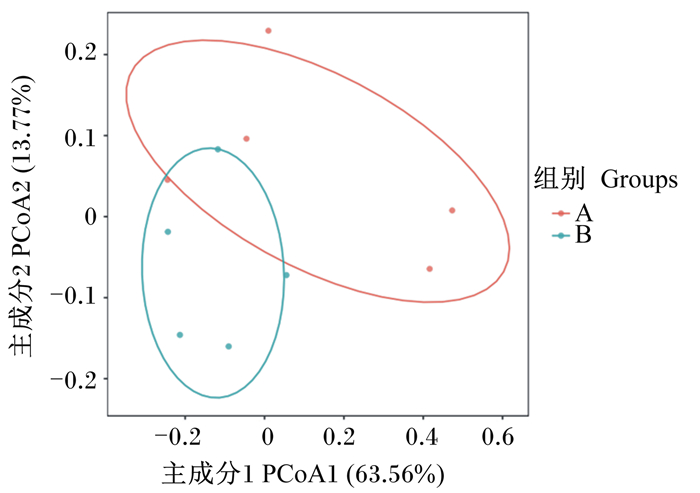
主坐标轴分析(PCoA)结果如图 2所示,2坐标轴相加已解释77.33%的变量组成。A组与B组部分样本细菌组成类似,但仍有小部分相异,这说明添加芽孢杆菌对断奶驴驹直肠内容物细菌组成具有有限的影响,这可能与A组中A3、A4 2头驴驹有关。
|
图 2 断奶驴驹直肠内容物细菌属水平相对丰度 Fig. 2 Relative abundance of bacteria in rectal contents at genus level |
|
图 3 主坐标轴分析 Fig. 3 Principal co-ordinates analysis |
大量研究表明,饲粮中添加枯草芽孢杆菌可以显著提高畜禽的生长性能。薛云等[9]研究报道,在基础饲粮中添加0.2%枯草芽孢杆菌制剂可提高断奶仔兔平均日增重,降低料重比。苏勇华等[5]研究表明,饲粮中添加3.2×109 CFU/g枯草芽孢杆菌可提高多浪羊平均日增重。郑雪等[10]研究发现,在饲粮中添加0.1%枯草芽孢杆菌制剂能促进杂交断奶仔鹿的生长性能。本试验研究结果表明,1~30 d时,饲粮添加枯草芽孢杆菌可显著提断奶驴驹的平均日增重。采食量是影响动物体重增长的主要因素之一[11]。虽然2组驴驹采食量统计结果差异不显著,但是添加枯草芽孢杆菌组驴驹采食量略高于对照组,可能导致驴驹日增重产生差异。同时,枯草芽孢杆菌可以产生多种酶类,有利于饲粮中营养物质的吸收和利用,提高生长性能[12]。但31~60 d时,饲粮中添加枯草芽孢杆菌对驴驹生长性能无显著性影响。这表明在断奶早期添加枯草芽孢杆菌对驴驹生长有促进作用,但在后期促生长效果不明显。这可能是由于在断奶早期,驴驹消化系统发育不够完善,肠道需要一定的时间应对由食物结构变化造成营养性应激,在此时添加益生菌的效果显著。但对于这一点仍需进一步研究确定。
营养物质消化率是影响动物生长的主要因素之一。苏勇华等[5]研究表明,添加枯草芽孢杆菌可提高多浪羊对饲料干物质、粗蛋白质、中性洗涤纤维和酸性洗涤纤维表观消化率。张海涛[13]研究发现,饲喂纳豆枯草芽孢杆菌有利于营养物质消化,促进犊牛生长。本研究结果表明,饲粮添加枯草芽孢杆菌可显著提高断奶驴驹粗脂肪表观消化率。这主要是由于枯草芽孢杆菌在生长过程中可合成脂肪酶等生物活性物质,与动物体消化道内的消化酶共同发挥作用,提高饲料消化率[14]。但是Booth等[15]研究报道,饲喂运动马含有芽孢杆菌的饲粮并没有显著提高营养物质消化率,这可能与动物品种、菌种来源、添加量及动物所处生理阶段不同有关。
肠道菌群对宿主物质代谢、营养吸收、免疫调节和保护屏障等方面有重要作用。前人的研究结果表明,添加枯草芽孢杆菌可提高兔[16]、仔猪[17]和雪山鸡[18]肠道内容物菌群多样性。本试验结果显示,2组试验驴直肠内容物微生物中相对丰度较高的前3种细菌门分别为拟杆菌门、厚壁菌门和变形菌门,这与在斑马[19]上的研究结果相一致。朱沛霁[20]研究发现,枯草芽孢杆菌进入驴驹肠道,消耗氧气,抑制肠道中某些需氧有害菌的繁殖,促进肠道有益厌氧菌的生长。在本试验条件下,与A组相比,B组驴驹拟杆菌门相对丰度显著上升。这说明添加枯草芽孢杆菌可提高驴驹直肠拟杆菌门相对丰度。A组中,A3和A4 2头驴驹变形菌门相对丰度较高,达到36.46%~48.45%,说明拟杆菌门相对丰度增加可能会抑制变形菌门的相对丰度,但不排除这2头驴驹异常的可能。拟杆菌门是饲料碳水化合物和蛋白质的重要降解菌,可促进胃肠道免疫系统的发育[21]。变形菌的异常扩增常作为肠道微生物失调的微生物信号[22]。本试验结果表明,饲粮添加枯草芽孢杆菌有调节断奶驴驹直肠微生态平衡的趋势,辅助动物建立健康的消化道微生物菌群,进而减少驴驹患肠道菌群异常等疾病的风险。
4 结论饲粮中添加枯草芽孢杆菌有利于提高断奶早期驴驹日增重,提高粗脂肪表观消化率,增加拟杆菌门相对丰度,对提高驴驹生长性能具有一定的益生作用。
| [1] |
李沐森, 郭文场, 刘佳贺, 等. 中国驴的起源、类别、特征特性及品种简介[J]. 特种经济动植物, 2019, 22(1): 2-7. |
| [2] |
王仁虎.引起驴驹腹泻的致病性大肠杆菌分离鉴定及复合疫苗研制[D].硕士学位论文.聊城: 聊城大学, 2018.
|
| [3] |
BAE S R, PARK C, CHOI J C, et al. Effects of ultra high molecular weight poly-gamma-glutamic acid from Bacillus subtilis (chungkookjang) on corneal wound healing[J]. Journal of Microbiology & Biotechnology, 2010, 20(4): 803-808. |
| [4] |
邢帅兵, 陈代文, 余冰, 等. 枯草芽孢杆菌对断奶仔猪生长性能和肠道形态、黏膜免疫及菌群数量的影响[J]. 动物营养学报, 2020, 32(5): 2066-2073. |
| [5] |
苏勇华, 方雷, 应璐, 等. 枯草芽孢杆菌对多浪羊消化率、瘤胃发酵参数及血液指标的影响[J]. 江苏农业科学, 2018, 46(8): 162-166. |
| [6] |
彭豫东, 康克浪, 曲湘勇, 等. 枯草芽孢杆菌对石门土鸡生长性能、屠宰性能、血清抗氧化指标和肠道形态的影响[J]. 动物营养学报, 2019, 31(5): 2119-2126. |
| [7] |
李靖.枯草芽孢杆菌对荷斯坦育成牛生长性能和瘤胃微生物区系的影响[D].硕士学位论文.泰安: 山东农业大学, 2019.
|
| [8] |
LI Z P, WRIGHT A D G, LIU H L, et al. Bacterial community composition and fermentation patterns in the rumen of sika deer (Cervus nippon) fed three different diets[J]. Microbial Ecology, 2015, 69(2): 307-318. DOI:10.1007/s00248-014-0497-z |
| [9] |
薛云, 周锋, 王乐伟. 枯草芽孢杆菌在断奶仔兔生长和预防腹泻中的应用研究[J]. 中国饲料, 2018(14): 84-87. |
| [10] |
郑雪, 刘建博, 宋百军, 等. 枯草芽孢杆菌对花马杂交F1代断奶仔鹿生长性能和血清生化指标的影响[J]. 黑龙江畜牧兽医, 2015(11): 230-232. |
| [11] |
KHAMPA S, CHAOWARAT P, CHUMPAWADEE S, et al. Effects of malate and cassava hay in high-quality feed block on ruminal fermentation efficiency and digestibility of nutrients in dairy steers[J]. Asian Journal of Animal Sciences, 2009, 3(1): 33-38. |
| [12] |
LIU Y F, CHEN Z Y, NG T B, et al. Bacisubin, an antifungal protein with ribonuclease and hemagglutinating activities from Bacillus subtilis strain B-916[J]. Peptides, 2007, 28(3): 553-559. DOI:10.1016/j.peptides.2006.10.009 |
| [13] |
张海涛.纳豆枯草芽孢杆菌对犊牛生长发育以及瘤胃组织形态学发育的影响[D].硕士学位论文.北京: 中国农业科学院, 2009.
|
| [14] |
黄雪泉. 添加枯草芽孢杆菌制剂对仔猪生产性能的影响[J]. 中国畜牧兽医, 2010, 37(7): 212-214. |
| [15] |
BOOTH J A, MILLER-AUWERDA P A, RASMUSSEN M A.The effect of horse-Bac liquid on nutrient digestibility, gut physiology, and the physical response to exercise in horses[C]//Proceedings of the 17th Equine Nutr Physiol Soc Symp.[s.l]: [s.n.], 2001: 259-260.
|
| [16] |
郭梦娇.枯草芽孢杆菌的筛选及其诱导兔抗大肠杆菌感染先天性免疫应答机制研究[D].硕士学位论文.泰安: 山东农业大学, 2018.
|
| [17] |
陈丽梅, 徐岳松, 陈峰. 枯草芽孢杆菌YK-1R对断奶仔猪肠道菌群的影响[J]. 基因组学与应用生物学, 2018, 37(9): 3852-3858. |
| [18] |
VEPACHEDU V R, SETLOW P. Localization of SpoVAD to the inner membrane of spores of Bacillus subtilis[J]. Journal of Bacteriology, 2005, 187(16): 5677-5682. DOI:10.1128/JB.187.16.5677-5682.2005 |
| [19] |
陈茂金.南昌地区圈养野生动物肠道微生物多样性分析[D].硕士学位论文.南昌: 江西农业大学, 2018.
|
| [20] |
朱沛霁.枯草芽孢杆菌对雪山鸡生产性能、肠道健康和免疫机能的影响及机制[D].博士学位论文.扬州: 扬州大学, 2017.
|
| [21] |
SPENCE C, WELLS W G, SMITH C J. Characterization of the primary starch utilization operon in the obligate anaero Bebacteroides fragilis:regulation by carbon source and oxygen[J]. Journal of Bacteriology, 2006, 188(13): 4663-4672. DOI:10.1128/JB.00125-06 |
| [22] |
SHIN N R, WHON T W, BAE J W. Proteobacteria:microbial signature of dysbiosis in gut microbiota[J]. Trends in Biotechnology, 2015, 33(9): 496-503. DOI:10.1016/j.tibtech.2015.06.011 |




