2. 省部共建农产品质量安全危害因子与风险防控国家重点实验室, 杭州 310021;
3. 浙江农业科学院农产品质量标准研究所, 杭州 310021
2. State Key Laboratory for Managing Biotic and Chemical Threats to the Quality and Safety of Agro-Products, Hangzhou 310021, China;
3. Institute of Quality and Standard for Agro-Products, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China
动物肠道既是消化和吸收营养物质的重要场所,又是保持机体内环境稳定的先天性屏障。家禽肠道屏障包括机械屏障、化学屏障、微生物屏障和免疫屏障,其完整性与肠道功能和机体健康密切相关[1]。其中,肠黏膜上皮细胞及其紧密连接蛋白构成的机械屏障在肠道屏障中尤为重要[2]。紧密连接蛋白具有多种功能,不仅能维持上皮屏障功能,阻碍有毒大分子和微生物入侵,还能选择性调节小分子物质和离子进入体内[3-4];同时,紧密连接蛋白还参与基因转录、细胞增殖和分化状态的调节[5]。有多种蛋白参与肠上皮细胞紧密连接的形成,其中闭合蛋白(Claudin)、咬合蛋白(Occludin)及闭合小环蛋白(ZO)家族蛋白是最为重要的紧密连接蛋白,也是典型的紧密连接蛋白家族成员[6-7],其对维护上皮细胞两侧物质的差异和保持细胞极性起着重要的作用。Claudin作为细胞间紧密连接的主要功能蛋白,能够保证紧密连接的渗透性[1]。Occludin的功能涉及细胞间黏附、移动和通透性,一旦其发生变异、减少或缺失可引起肠上皮细胞间隙通透性增加[8];ZO-1与维持和调节肠道上皮栅栏与屏障功能有关,参与细胞物质转运与维持上皮极性等重要过程[9]。研究发现家禽肠道的紧密连接蛋白表达受到营养素、益生菌、微生物结构以及生长发育阶段的影响[1, 10-12]。尽管紧密连接蛋白对于肉鸡的生长发育异常重要,但是对于Claudin-1、Claudin-2、Occludin、ZO-1和ZO-2等紧密连接蛋白基因在肉鸡各肠段中表达的发育性变化尚未见报道。本试验旨在对肉鸡不同肠段中紧密连接蛋白基因表达的发育性变化进行研究,以阐明禽类肠道紧密连接蛋白发育表达情况,为禽类肠道紧密连接蛋白表达的调控作用研究提供参考。
1 材料与方法 1.1 试验动物60只1日龄的罗斯(Ross)308肉鸡,购自江苏镇江腾达孵化厂。
1.2 试验设计与饲养管理将60只雏鸡随机分为6笼,每笼10只。饲养于浙江省农业科学院动物实验房中,试验期间自由饮水和采食,未使用任何抗生素和商业疫苗。在试验过程中,用白炽灯和空调控制实验房温度。
1.3 样品采集分别于1、3、7、14和28日龄采集6只(每笼1只)肉鸡的十二指肠、空肠、回肠、盲肠和结肠组织,用玻片刮取肠道黏膜分装于冻存管中,液氮速冻后于-80 ℃保存。
1.4 总RNA提取和实时荧光定量(RT-qPCR)分析 1.4.1 总RNA提取和cDNA合成按TRIzol® Plus RNA Purification Kit(Invitrogen公司)说明书提取组织中总RNA,紫外分光光度计和电泳测定其含量、纯度及质量,采用SuperScriptTM Ⅲ First-Strand Synthesis SuperMix for qRT-PCR(Invitrogen公司)将RNA反转录合成cDNA第1链。
1.4.2 RT-qPCR分析采用Primer Premier 6.0和Beacon designer 7.8软件进行PCR引物设计,引物均由生工生物工程(上海)股份有限公司合成,引物序列见表 1。
|
|
表 1 PCR引物序列与参数 Table 1 Sequences and parameters of primers for PCR |
以甘油醛-3-磷酸脱氢酶(GAPDH)基因为内参基因进行PCR测定,采用Power SYBR® Green PCR Master Mix (Applied Biosystems公司)和CFX384多重RT-qPCR仪(美国Bio-Rad)进行RT-qPCR检测,PCR反应体系具体组成如下:无菌蒸馏水(SDW)8.0 μL,Power SYBR® Green Master Mix 10.0 μL,上游引物(10 μmol/L) 0.5 μL,Reverse Primer (10 μmol/L) 0.5 μL,cDNA 1.0 μL。反应条件为95 ℃预变性1 min;40个循环(95 ℃变性15 s,60 ℃退火25 s,收集荧光)。采用2-ΔΔCt法计算各个紧密连接蛋白基因的相对表达量。每个样品重复测定3次。
1.5 数据统计分析采用SPSS 17.0统计软件进行单因素方差分析和双因素方差分析,以P<0.05为差异显著,P<0.01为差异极显著。
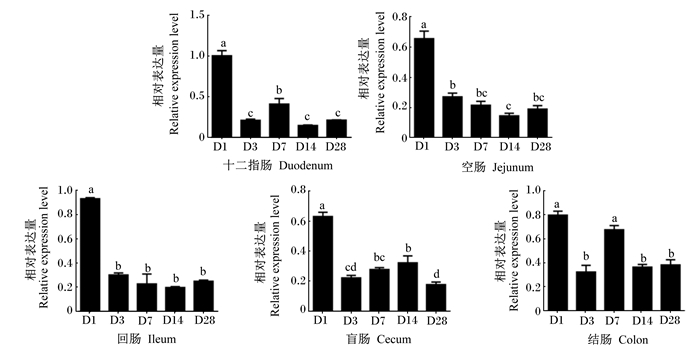
2 结果与分析 2.1 不同肠段Claudin-1基因表达的发育性变化将1日龄十二指肠中Claudin-1基因的相对表达量设定为1作图 1。由图 1可知,1日龄Claudin-1基因在十二指肠、空肠、回肠和盲肠中的相对表达量均显著高于其他日龄(P<0.05)。1日龄后,十二指肠和结肠中Claudin-1基因的相对表达量先升高后降低,在7日龄最高,显著高于3、14、28日龄(P<0.05),随后趋于稳定。1日龄后,空肠中Claudin-1基因的相对表达量在14日龄时最低,显著低于其他日龄(P<0.05),盲肠则相反。回肠中Claudin-1基因的相对表达量在除1日龄外的各个日龄均差异不显著(P>0.05)。
|
D1:1日龄;D3:3日龄;D7:7日龄;D14:14日龄;D28:28日龄。数据柱形标注不同小写字母表示差异显著(P < 0.05)。下图同。 D1: 1 day of age; D3: 3 days of age; D7: 7 days of age; D14: 14 days of age; D28: 28 days of age. Value columns with different small letters mean significant difference (P < 0.05). The same as below. 图 1 不同肠段Claudin-1基因表达的发育性变化 Fig. 1 Developmental changes of Claudin-1 gene expression in different intestinal segments |
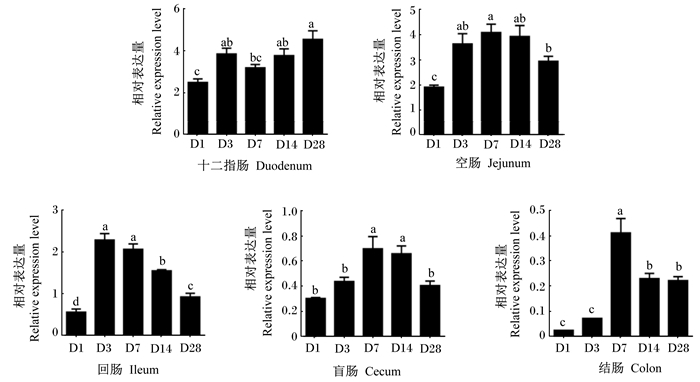
图 2为不同日龄肉鸡各肠段中Claudin-2基因的相对表达量。各肠段中Claudin-2基因的相对表达量均以1日龄最低,其中十二指肠、空肠和回肠中的相对表达量显著低于其他日龄(P<0.05)。盲肠和结肠中Claudin-2基因的相对表达量均随日龄的增长先升高后降低,以7日龄时最高,显著高于其他日龄(14日龄时盲肠除外)(P<0.05)。各日龄肠道前段(十二指肠和空肠)中Claudin-2基因的相对表达量均高于肠道后段(回肠、盲肠和结肠)。
|
图 2 不同肠段Claudin-2基因表达的发育性变化 Fig. 2 Developmental changes of Claudin-2 gene expression in different intestinal segments |
|
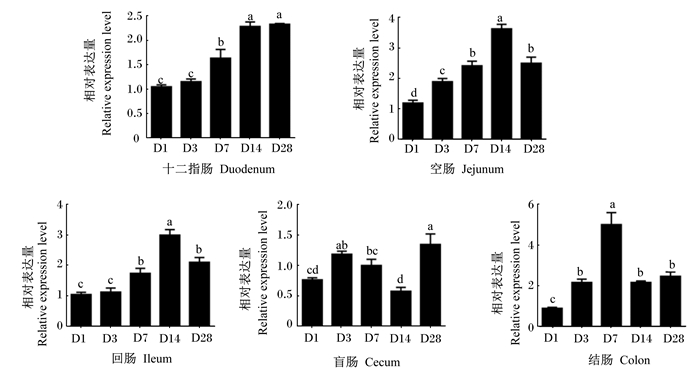
图 3 不同肠段Occludin基因表达的发育性变化 Fig. 3 Developmental changes of Occludin genes in different intestinal segments |
图 4为不同日龄肉鸡各肠段Occludin基因的相对表达量。1日龄时十二指肠、空肠、回肠和结肠中Occludin基因的相对表达量均显著低于其他日龄(P<0.05)。十二指肠、空肠和回肠中Occludin基因的相对表达量在14日龄前均随日龄的增长逐渐升高,空肠和回肠中在14日龄到达高峰,28日龄下降。然而盲肠中Occludin基因的相对表达量在14日龄时最低。结肠中Occludin基因的相对表达量随日龄的增长先升高后下降,7日龄显著高于其他日龄(P<0.05)。
|
图 4 不同肠段ZO-1基因的发育性变化 Fig. 4 Developmental changes of ZO-1 gene expression in different intestinal segments |
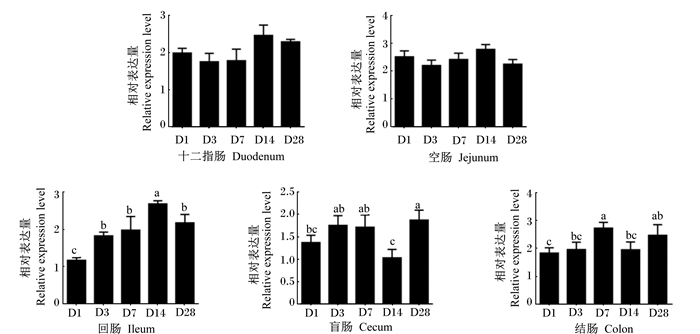
图 4为不同日龄肉鸡各肠段ZO-1基因的相对表达量。1日龄时各肠段中ZO-1基因的相对表达量均显著低于其他日龄(P<0.05)。十二指肠中ZO-1基因的相对表达量随日龄的增长逐渐增加,空肠和结肠中ZO-1基因的相对表达量除1日龄外的其余日龄间均差异不显著(P>0.05),空肠和回肠中ZO-1基因的相对表达量随日龄的增长变化趋势相似。
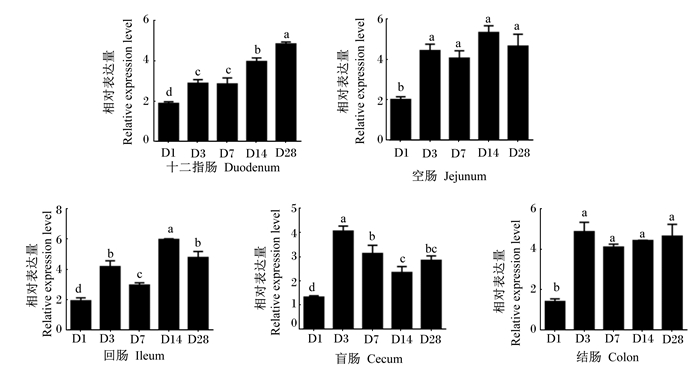
2.5 不同肠段ZO-2基因表达的发育性变化图 5为不同日龄肉鸡各肠段ZO-2基因的相对表达量。十二指肠和空肠中ZO-2基因的相对表达量随日龄的增长无显著变化(P>0.05),回肠中ZO-2基因的相对表达量随日龄的增长逐渐升高,14日龄到达顶峰,28日龄下降。盲肠中ZO-2基因的相对表达量在14日龄时最低,显著低于3、7、8日龄(P<0.05)。结肠中ZO-2基因的相对表达量以7日龄最高,显著高于1、3、14日龄(P<0.05)。
|
图 5 不同肠段ZO-2基因表达的发育性变化 Fig. 5 Developmental changes of ZO-2 gene expression in different intestinal segments |
将各紧密连接蛋白基因的相对表达量设为因变量,将日龄与肠段设为固定因子,对日龄和肠段分别进行主效应分析,且对日龄和肠段进行交互作用分析,结果如表 2所示。通过双因子方差分析可知日龄和肠段对各紧密连接蛋白基因的相对表达量均有极显著影响(P<0.01),且日龄和肠段对各紧密连接蛋白基因相对表达量的影响具有极显著的交互作用(P<0.01)。
|
|
表 2 日龄与肠段对各紧密连接蛋白基因相对表达量影响的双因素分析 Table 2 Two-way ANOVA for effects of age and intestinal segment on relative expression levels of tight junction protein genes |
肠道细胞间紧密连接是构成肠道屏障功能的重要结构基础,在调节肠道通透性和维持上皮细胞屏障中发挥着重要作用。肉鸡养殖中许多疾病的产生发展均与肠黏膜屏障功能有关[1]。作为上皮细胞间连接的一种主要形式,紧密连接是由一系列跨膜蛋白和外周蛋白相互作用而形成的一个复杂的蛋白质体系,由多个不同的膜相关蛋白组成,包括Claudin、Occludin和ZO家族,目前认为起主要作用的是前两者,尤以Claudin的功能最为重要,它是构成紧密连接的主要骨架蛋白[13-14]。Merga等[15]研究发现紧密连接蛋白对维护上皮细胞两侧物质的差异和保持细胞极性起着重要的作用,并能被多种方式所调控。De Medina等[16]研究发现紧密连接蛋白常被视作观察肠道紧密连接屏障功能和通透性功能的指标。Rosenthal等[17]研究发现Claudin-2在肠上皮细胞表面形成阳离子选择通道和水通道,从而增加细胞旁通透性。Chang等[18]研究发现沙门氏菌感染使空肠中Occludin和ZO-1基因表达下调,回肠中Occludin和Claudin基因表达下调。本试验结果表明,Claudin-2基因的相对表达量从十二指肠至结肠表现为逐渐降低,且十二指肠和空肠显著高于回肠、盲肠和结肠,表明肉鸡肠道前段(十二指肠、空肠和回肠)通透性高于肠道后段(盲肠和结肠),Claudin-2基因可能为不同肠段发育性变化的关键基因。Occludin、ZO-1和ZO-2基因在盲肠中的相对表达量均最低,这可能与不同肠段的形态、生理功能和菌群结构等不同相关。
有证据表明Claudin-1的下调通过激活核转录因子-κB(NF-κB)增加肠道通透性,并导致肠易激综合征患者腹泻[19]。Claudin-2增加了细胞旁通透性,在炎症性肠病(IBD)组和结肠炎相关性大肠癌(CAC)组中均呈整体上调,与Claudin-1相反[20]。本研究发现,1日龄时Claudin-1基因在十二指肠、空肠、回肠和盲肠中的相对表达量均显著高于其他日龄;而1日龄时Claudin-2基因在各肠段中的相对表达量均最低,随着日龄的增长而升高,在7日龄时达到最高,Claudin-1与Claudin-2基因表达情况相反,1日龄肉鸡各肠段肠道通透性较其他日龄低,可能与肉鸡刚出壳,卵黄未吸收完全,营养物质主要不是从肠道吸收,肠道菌群还未竞争定植等有关。Roberts等[21]研究发现,肉鸡空肠中Occludin基因的表达量随着日龄的增长而线性增加, 直至出壳后14 d。本研究结果显示,1日龄时十二指肠、空肠、回肠和结肠中Occludin基因的相对表达量均低于其他日龄。小肠段(十二指肠、空肠和回肠)Occludin基因相对表达量随日龄的增长逐渐升高,14日龄时到达高峰。结肠中Occludin基因的相对表达量先升高后下降,7日龄极显著高于其他日龄。与之前研究结果相符,且进一步了阐明肉鸡各肠段Occludin基因表达的发育性变化。Zhao等[22]研究发现酪酸梭菌能提高肠和肠上皮细胞中ZO-1基因的表达,减轻细菌诱导的肠损伤。还有研究表明高脂饮食会导致紧密连接蛋白ZO-1表达的下调而显著降低肠道通透性[23]。本研究结果显示,各个肠段1日龄时ZO-1基因的相对表达量均显著低于其他日龄,且随着日龄的增长呈升高趋势,也表明了肉鸡1日龄时肠道通透性最低;而ZO-2基因在十二指肠与空肠中的相对表达量随日龄的增长变化不显著,可能是因为ZO-2主要调控细胞增殖、细胞大小和凋亡[5],对肠道通透性调控作用有限,是生物进化的结果。
由本研究结果可知,日龄和肠段对各紧密连接蛋白基因的相对表达量均有极显著影响,且日龄和肠段对各紧密连接蛋白基因相对表达量的影响具有极显著的交互作用。Gong等[24]研究发现菌群的代谢产物短链脂肪酸含量也处于变化中,短链脂肪酸含量对于紧密连接蛋白的表达具有调控作用。雏鸡肠道的紧密连接蛋白基因表达的变化可能与肠道微生物的定植和代谢也存在一定的关系。
4 结论① Claudin-1基因在各肠段中的相对表达量在1日龄时最高,Claudin-2、Occludin和ZO-1基因则相反,肉鸡肠道通透性在1日龄时最低,随后升高。
② Claudin-2基因的相对表达量从十二指肠至结肠表现为逐渐降低,肉鸡各日龄肠道前段(十二指肠、空肠和回肠)通透性高于肠道后段(盲肠和结肠)。
③ 不同紧密连接蛋白的发育性变化模式存在一定差异,日龄和肠段对各紧密连接蛋白基因相对表达量的影响具有极显著的交互作用。
| [1] |
ANDERSON R C, DALZIEL J E, GOPAL P K, et al. The role of intestinal barrier function in early life in the development of colitis[J]. InTech, 2012. DOI:10.5772/25753 |
| [2] |
陈继发, 曲湘勇. 家禽肠道屏障功能及其影响因素[J]. 广东饲料, 2018, 27(6): 41-43. |
| [3] |
MADARA J L. Intestinal absorptive cell tight junctions are linked to cytoskeleton[J]. American Journal of Physiology:Cell Physiology, 2005, 253(1): C171-C175. |
| [4] |
DOKLADNY K, ZUHL M N, MOSELEY P L. Intestinal epithelial barrier function and tight junction proteins with heat and exercise[J]. Journal of Applied Physiology, 2016, 120(6): 692-701. DOI:10.1152/japplphysiol.00536.2015 |
| [5] |
GONZÁLEZ-MARISCAL L, MIRANDA J, RAYA-SANDINO A, et al. ZO-2, a tight junction protein involved in gene expression, proliferation, apoptosis, and cell size regulation[J]. Annals of the New York Academy of Sciences, 2017, 1397(1): 35-53. DOI:10.1111/nyas.13334 |
| [6] |
SUZUKI T. Regulation of the intestinal barrier by nutrients:the role of tight junctions[J]. Animal Science Journa, 2020, 91(1): e13357. |
| [7] |
CAPALDO C T, POWELL D N, KALMAN D. Layered defense:how mucus and tight junctions seal the intestinal barrier[J]. Journal of Molecular Medicine, 2017, 95(9): 927-934. DOI:10.1007/s00109-017-1557-x |
| [8] |
邢晓辉, 李力仙, 郭天林, 等. Occludin蛋白与细胞间紧密连接关系及其临床意义[J]. 现代生物医学进展, 2015, 15(8): 1553-1555, 1405. |
| [9] |
甘元涛. 肠黏膜屏障损伤与紧密连接蛋白ZO-1的关系研究进展[J]. 现代医药卫生, 2016, 32(7): 1027-1029. |
| [10] |
SCHNEIDERS G H, FOUTZ J C, MILFORT M C, et al. Heat stress reduces sexual development and affects pathogenesis of Eimeria maxima in meat-type chickens[J]. Scientific Reports, 2020, 10(1): 10736. DOI:10.1038/s41598-020-67330-w |
| [11] |
BROOM L J. Gut barrier function:effects of (antibiotic) growth promoters on key barrier components and associations with growth performance[J]. Poultry Science, 2018, 97(5): 1572-1578. DOI:10.3382/ps/pey021 |
| [12] |
MORAN E T JR. Nutrients central to maintaining intestinal absorptive efficiency and barrier integrity with fowl[J]. Poultry Science, 2017, 96(5): 1348-1363. DOI:10.3382/ps/pew337 |
| [13] |
马军宏, 于向阳, 张楠, 等. 紧密连接蛋白与肠黏膜屏障损伤研究进展[J]. 中国中西医结合外科杂志, 2015, 21(1): 104-105. |
| [14] |
马怡然, 尚德淑, 方文刚, 等. 细胞紧密连接的结构组成及其调控的研究进展[J]. 解剖科学进展, 2010, 16(1): 71-74. |
| [15] |
MERGA Y, CAMPBELL B J, RHODES J M. Mucosal barrier, bacteria and inflammatory bowel disease:possibilities for therapy[J]. Digestive Diseases, 2014, 32(4): 475-483. DOI:10.1159/000358156 |
| [16] |
DE MEDINA F S, ROMERO-CALVO I, MASCARAQUE C, et al. Intestinal inflammation and mucosal barrier function[J]. Inflammatory Bowel Diseases, 2014, 20(12): 2394-2404. DOI:10.1097/MIB.0000000000000204 |
| [17] |
ROSENTHAL R, MILATZ S, KRUG S M, et al. Claudin-2, a component of the tight junction, forms a paracellular water channel[J]. Journal of Cell Science, 2010, 123(11): 1913-1921. DOI:10.1242/jcs.060665 |
| [18] |
CHANG C H, TENG P Y, LEE T T, et al. Effects of multi-strain probiotic supplementation on intestinal microbiota, tight junctions, and inflammation in young broiler chickens challenged with Salmonella enterica subsp. enterica[J]. Asian-Australasian Journal of Animal Sciences, 2019. DOI:10.5713/ajas.19.0427 |
| [19] |
ZHOU Q Q, COSTINEAN S, CROCE C M, et al. MicroRNA 29 targets nuclear factor-κB-repressing factor and Claudin 1 to increase intestinal permeability[J]. Gastroenterology, 2015, 148(1): 158-169.e8. DOI:10.1053/j.gastro.2014.09.037 |
| [20] |
ZHU L G, HAN J, LI L, et al. Claudin family participates in the pathogenesis of inflammatory bowel diseases and colitis-associated colorectal cancer[J]. Frontiers in Immunology, 2019, 10: 1441. DOI:10.3389/fimmu.2019.01441 |
| [21] |
ROBERTS S, PEREZ-GARCIA M, NEAL M, et al. Development of the small intestinal epithelial barrier function in broiler[J]. Poultry Science, 2005, 84: 74-75. |
| [22] |
ZHAO X N, YANG J, JU Z J, et al. Clostridium butyricum ameliorates Salmonella enteritis induced inflammation by enhancing and improving immunity of the intestinal epithelial barrier at the intestinal mucosal level[J]. Frontiers in Microbiology, 2020, 11: 299. DOI:10.3389/fmicb.2020.00299 |
| [23] |
SATO J, KANAZAWA A, WATADA H. Type 2 diabetes and bacteremia[J]. Annals of Nutrition and Metabolism, 2017, 71(Suppl.1): 17-22. |
| [24] |
GONG Y J, YANG H, WANG X, et al. Early intervention with cecal fermentation broth regulates the colonization and development of gut microbiota in broiler chickens[J]. Frontiers in Microbiology, 2019, 10: 1422. DOI:10.3389/fmicb.2019.01422 |




