2. 华南农业大学兽医学院, 广州 510642
2. College of Veterinary Medicine, South China Agricultural University, Guangzhou 510642, China
B族维生素作为多种辅酶的重要组成成分,参与脂肪、蛋白质、碳水化合物等代谢过程,在维持动物健康生长中具有重要作用[1-5]。B族维生素一般不能由动物机体合成,除了饲粮摄入,肠道微生物合成是机体B族维生素的主要来源[6]。作为肠道微生物的重要代谢产物,B族维生素是肠道微生物与宿主肠道互作的重要载体,在肠道发育、免疫调控及营养代谢中发挥着重要作用。因此,准确掌握B族维生素含量在肠道内的动态变化具有重要意义[7]。B族维生素含量的测定方法如高效液相色谱法(HPLC)[8-9]、高效毛细管电泳法[10]、微生物法[11-12]、分光光度法[13]等,这些方法大多是单项或少数几项B族维生素含量的检测方法,存在耗时长、前处理繁杂、检出限高、特异性低等问题。目前,这些方法主要应用于检测B族维生素含量较高的食品、保健品及饲料预混料。然而,肠道内容物及粪便的成分复杂且部分B族维生素含量极低,传统检测方法难以准确定量肠道中B族维生素含量,导致B族维生素含量动态变化调控肠道健康的研究受到严重限制。最新研究发现,超高效液相色谱-串联质谱(UPLC-MS/MS)结合多选择反应监测(multiple reaction monitoring, MRM)技术开展靶向代谢组学研究,可以对低含量生物样品进行高效定量测定[12-13]。同时,梁敏慧等[14]建立了UPLC-MS/MS-MRM技术测定食品中叶酸、烟酸、生物素和泛酸含量的方法,王任等[15]通过试验建立了UPLC-MS/MS-MRM技术分析复合维生素片中叶酸和生物素含量的方法。但是,关于高效定量测定猪肠道内容物和粪便中多种B族维生素含量的方法尚缺乏。因此,本研究利用UPLC-MS/MS-MRM技术开展靶向代谢组学分析,通过优化样品前处理步骤和试验条件,高效、定量地检测猪盲肠内容物和粪便中8种B族维生素含量,以期为畜禽肠道B族维生素功能研究提供技术基础。
1 材料与方法 1.1 试剂与仪器甲酸(Sigma-Aldrich, 94318, 美国)、甲醇(Fisher Chemical, A452-4, 美国)、乙腈(Sigma-Aldrich, 34851-4L, 美国)、异丙醇(Fisher Chemical, A461-4, 美国)、B族维生素标准品(Sigma-Aldrich, 美国),试验用水均为超纯水。
5500 QTRAP质谱仪(AB SCIEX, 美国)、超高效液相色谱系统(Waters ACQUITY UPLC I-Class, 美国)、色谱柱(HSS T3 2.5 μm, 2.1 mm×100 mm, 美国)、低温高速离心机(Eppendorf, 5430R, 美国)。
1.2 仪器条件 1.2.1 超高效液相色谱条件样品采用Waters ACQUITY UPLCI-Class系统进行分离。色谱柱:Waters,HSS T3(2.5 μm, 2.1 mm×100 mm);柱温:45 ℃;流动相:A液为0.3%甲酸水溶液,B液为甲醇。样品置于8 ℃自动进样器中,流速为300 μL/min,进样量为5 μL。相关液相梯度如下:0~2.0 min,B液为0;2.0~3.0 min,B液从0线性变化到50%;3.0~4.5 min,B液从50%线性变化到100%;4.5~5.5 min,B液从100%线性变化到0;6~11 min,B液为0。
1.2.2 质谱分析条件采用5500 QTRAP质谱仪(AB SCIEX)在正离子模式下进行质谱分析。离子化模式:ESI+,离子喷雾电压:+4 500 V,离子源温度:550 ℃,气帘气(CUR)40.00 psi,雾化气(GS1)55.00 psi,辅助气(GS2)55.00 psi,采用MRM模式检测待测离子对,MRM条件见表 1。
|
|
表 1 MRM条件 Table 1 Conditions of MRM |
取标准品,用水溶液稀释为系列梯度含量的标准工作溶液。维生素B1、维生素B2、维生素B6、维生素B9标准品配制含量依次为0.10、0.25、0.50、1.00、2.50、5.00、10.00、25.00、100.00 ng/mL;烟酰胺和烟酸标准品配制含量依次为5.0、12.5、25.0、50.0、125.0、250.0、500.0、1 250.0、5 000.0 ng/mL;维生素B12标准品配制含量依次为0.50、1.25、2.50、5.00、12.50、25.00、50.00、125.00、500.00 ng/mL;烟酰胺-13C6含量为500 ng/mL。吡哆醛-D3、叶酸-13C5含量均为20 ng/mL。
1.3.2 标准曲线的制作取150 μL标准品工作溶液于1.5 mL离心管中,600 μL甲醇/乙腈(体积比1 : 1)溶液,10 μL内标液,涡旋混匀制备成标准曲线溶液,用同位素内标法建立标准曲线。
1.4 样品采集及处理 1.4.1 样品采集在广东省农业科学院动物科学研究所试验基地,选择24头35日龄断奶仔猪采集粪便样本和盲肠内容物各24份,选择24头63日龄猪采集盲肠内容物样本和粪便样本各24份,样本具体信息见表 2。本试验中所有仔猪21日龄断奶,所有仔猪饲喂猪场统一饲粮。
|
|
表 2 样本基本信息 Table 2 Sample basic information |
称取盲肠内容物和粪便样本200 mg,750 μL甲醇/乙腈/水(体积比2 : 2 : 1)溶液,10 μL内标液,匀浆涡旋混合。
1.5 样品检测将经前处理得的样品溶液利用Eppendorf-5430R低温高速离心机14 000 r/min,4 ℃离心15 min;取500 μL上清液过Ostro板后,37 ℃氮气吹干;加入100 μL 0.3%甲酸水溶液进行复溶,14 000 r/min,4 ℃离心10 min;取上清液至进样小瓶中按上述色谱条件进行分析。样本队列中每间隔一定数量的试验样本设置1个质控样本,用于检测和评价系统的稳定性及重复性。
1.6 数据处理采用Multiquant软件提取色谱峰面积及保留时间。根据标准曲线,计算样品中B族维生素的含量。
2 结果与分析 2.1 B族维生素标准品的提取离子流色谱图(extracted ion chromatogram, XIC)B族维生素的标准品XIC图见图 1,从图中可见各B族维生素的色谱分离较好,峰形尖锐对称,能够对各代谢物进行质谱定量。
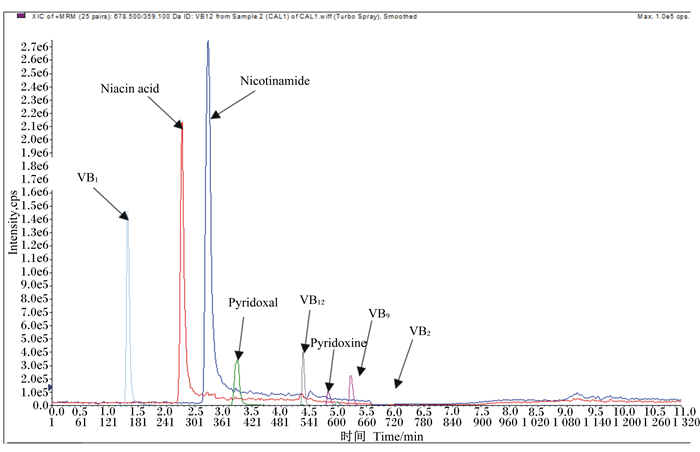
|
VB1:维生素B1 vitamin B1; Niacin acid:烟酸; Nicotinamide:烟酰胺; Pyridoxal:吡哆醛; VB12:维生素B12 vitamin B12; Pyridoxine:吡哆醇; VB9:维生素B9 vitamin B9; VB2:维生素B2 vitamin B2。 图 1 标准品混合物XIC图谱 Fig. 1 XIC spectrum of standard mixture |
以B族维生素各标准含量为横坐标(X),以峰面积为纵坐标(Y)做标准曲线后,得到线性回归方程。各待测物含量在线性范围内的线性良好,相关系数r均大于0.995,满足检测需要。方法的线性回归方程、相关系数及线性范围见表 3。
|
|
表 3 8种B族维生素的线性回归方程、相关系数及线性范围 Table 3 Linear regression equation, correlation coefficient and linear ranges of 8 kinds of B vitamins |
维生素B1、维生素B2、维生素B6、维生素B9添加0.4、2.0、20.0 ng/mL标准品溶液进行回收率试验,维生素B3添加80、400、4 000 ng/mL标准品溶液进行回收率试验,维生素B12添加1.6、8.0、80.0 ng/mL标准品溶液进行回收率试验。将所有样品等量混合制备成为质控样本,采用质控样本对检测过程的稳定性进行考察。由表 4可以看出,其平均回收率>89%,RSD值< 18%,说明试验数据稳定可靠。
|
|
表 4 回收率和精密度 Table 4 Recovery rate and precision (n=8) |
将24份35日龄仔猪的粪便样本、24份63日龄仔猪的粪便样本用此方法进行B族维生素含量的测定,样品检出结果如表 5。由表可知,仔猪粪便中烟酸的含量最高,平均值为19 619.99 ng/g,35日龄仔猪粪便中烟酸含量测得的平均值为20 315.60 ng/g,最大值为58 093.78 ng/g,最小值为6 268.05 ng/g;63日龄仔猪粪便中烟酸含量测得的平均值为18 924.38 ng/g,最大值为55 388.18 ng/g,最小值为8 222.01 ng/g。仔猪粪便中维生素B12含量最低,平均值为18.37 ng/g,35日龄仔猪粪便中维生素B12含量测得的平均值为10.92 ng/g,最大值为17.06 ng/g,最小值为8.95 ng/g。63日龄仔猪粪便中维生素B12含量测得的平均值为24.46 ng/g,最大值为82.59 ng/g,最小值为9.17 ng/g。随着日龄的增长,仔猪粪便中的B族维生素除维生素B12外测得的含量均有不同程度的减少。
|
|
表 5 粪便样品检出结果 Table 5 Results of feces samples |
将18份35日龄仔猪的盲肠内容物样本、24份63日龄仔猪的盲肠内容物样本等用此方法进行B族维生素含量的测定,样品检出结果如表 6。由表可知,仔猪盲肠内容物中烟酸含量最高,平均值为15 058.25 ng/g,35日龄仔猪盲肠内容物中烟酸含量测得的平均值为12 095.51 ng/g,最大值为27 791.28 ng/g,最小值为7 158.77 ng/g;63日龄仔猪盲肠内容物中的烟酸含量测得平均值为17 280.31 ng/g,最大值为43 840.81 ng/g,最小值为3 608.92 ng/g。仔猪盲肠内容物中维生素B12含量最低,平均值为13.40 ng/g,35日龄仔猪盲肠内容物中维生素B12含量测得的平均值为12.55 ng/g,最大值为30.11 ng/g,最小值为9.40 ng/g;63日龄仔猪盲肠内容物中维生素B12含量测得的平均值为14.00 ng/g,最大值为38.12 ng/g,最小值为9.30 ng/g。随着日龄的增长,仔猪盲肠内容物中的B族维生素除维生素B1、维生素B6外测得的含量均有不同程度的增加;仔猪粪便中的维生素B1、维生素B6含量随着日龄的增加而减少。
|
|
表 6 盲肠内容物检出结果 Table 6 Results of cecal contents |
B族维生素是肠道微生物的重要代谢产物,也是动物必需的微量营养物质,在维持肠道菌群平衡及肠道免疫稳态中发挥重要作用[16-21]。猪肠道内容物及粪便中B族维生素含量动态检测是研究B族维生素与肠道免疫及肠道微生物互作的必要步骤。目前B族维生素含量检测方法主要应用于B族维生素含量较高的食品、饮料、药品、复合维生素片等[22-24]。食品、饲料中B族维生素含量的标准方法一般首选微生物法,因为微生物法具有干扰小、灵敏度较高、仪器设备要求低等优点,所以被广泛应用,但操作过程繁琐、检测周期较长[25-26]。UPLC-MS/MS-MRM技术具有特异性强、灵敏度高、准确性高等优势,广泛应用于蛋白质组学及代谢组学的研究[27-29],在食品B族维生素含量检测中也有应用。本研究利用UPLC-MS/MS-MRM技术高效定量地检测出猪肠道内容物及粪便中8种B族维生素的含量。董爽等[30]利用微生物法检测饲料中的烟酸含量,平均回收率98.75%,RSD < 10%,测定结果有效范围为25~500 ng,检测周期1~2 d。本研究测得烟酸的平均回收率为104%,RSD < 5%,回收率、准确度与微生物法基本一致,但检出限更低(0.01~0.10 ng/mL),检测周期缩短至40 min。Fan等[31]利用HPLC-FLD技术检测茶叶中维生素B3和维生素B7的含量,检测限为2.22~2.56 ng/mL,检测周期2 h。Schmidt等[32]使用HPLC法检测牛奶中维生素B6和维生素B2的含量,平均回收率为91.1%~111.2%,RSD≤6.7%,样本分离时间6 min,检测周期45 min,而本方法维生素B6平均回收率97%~108%,RSD<9.6%,维生素B2平均回收率为108%,RSD < 17.5%。梁敏慧[14]利用UPLC-MS/MS技术分别检测食品中叶酸、烟酸的含量,平均回收率为92.1%~118.1%,RSD为1.49%~5.99%,检测限为0.04~0.40 ng/mL。王任等[15]使用HPLC-MS法测定复合维生素片中维生素B9的平均回收率为99.9%~108.7%,RSD为1.0%,检出限为0.33 μg/g。本方法测得维生素B9平均回收率为103%,RSD为6.81%。目前已报道的B族维生素含量检测方法,多为单项或少数几项B族维生素含量的检测[31-34]。本方法能够高通量检测8种B族维生素含量,回收率与微生物法或液相法回收率基本一致,检出下限较其他方法低。然而,该方法较其他B族维生素含量检测方法对试验仪器设备的要求较高,且部分B族维生素(维生素B1和维生素B2)质控样本RSD略高于其他方法,可能是粪便和肠道内容物中的小分子代谢产物多、成分复杂以及B族维生素衍生物干扰影响了检测结果的准确性。
4 结论本研究采用超高效液相色谱法,以0.3%甲酸水溶液-甲醇为流动相进行梯度洗脱,结合MS在正离子模式下进行质谱分析,MRM模式检测离子对,建立了一种高效、定量检测猪肠道内容物和粪便中8种B族维生素含量的方法,分析时间小于7 min,整个样本检测过程可在40 min内完成,检出下限低(0.01~0.10 ng/mL),回收率为88.0%~110.0%,质控样本RSD < 18%。本试验建立的猪肠道内容物和粪便中B族维生素含量的检测方法,有利于B族维生素与肠道微生物的互作研究,为畜禽生产中合理应用B族维生素提供技术基础。
| [1] |
姚志浩, 梅文晴, 冯宇妍, 等. 复合维生素B对山羊生长性能及肠道微生物区系的影响[J]. 畜牧与兽医, 2020, 52(7): 47-53. |
| [2] |
KENNEDY D O. B vitamins and the brain:mechanisms, dose and efficacy—a review[J]. Nutrients, 2016, 8(2): 68. DOI:10.3390/nu8020068 |
| [3] |
张吉梅. 仔猪常见维生素缺乏症的诊治[J]. 江西饲料, 2018(5): 36-39. |
| [4] |
PARRA M, STAHL S, HELLMANN H. Vitamin B6 and its role in cell metabolism and physiology[J]. Cells, 2018, 7(7): 84. DOI:10.3390/cells7070084 |
| [5] |
BORAN P, BARIS H E, KEPENEKLI E, et al. The impact of vitamin B12 deficiency on infant gut microbiota[J]. European Journal of Pediatrics, 2020, 179(3): 385-393. DOI:10.1007/s00431-019-03517-2 |
| [6] |
MAGNUSDOTTIR S, RAVCHEEV D, DE CRÉCY-LAGARD V, et al. Systematic genome assessment of B-vitamin biosynthesis suggests co-operation among gut microbes[J]. Frontiers in Genetics, 2015, 6: 148. |
| [7] |
黄沧海.仔猪复合益生乳酸杆菌制剂及其作用机理的研究[D].博士学位论文.北京: 中国农业大学, 2003.
|
| [8] |
王敏, 李晓龙, 许莲华, 等. HPLC法测定不同饲草料中8种维生素的含量[J]. 饲料研究, 2019, 42(10): 62-65. |
| [9] |
HUANG M, WINTERS D, CROWLEY R, et al. Measurement of water-soluble B vitamins in infant formula by liquid chromatography/tandem mass spectrometry[J]. Journal of AOAC International, 2009, 92(6): 1728-1738. DOI:10.1093/jaoac/92.6.1728 |
| [10] |
司雄元, 檀华蓉, 施婷婷, 等. 高效毛细管电泳对复合B药片中水溶性维生素含量的快速测定[J]. 中国农学通报, 2008(6): 112-119. |
| [11] |
ZHANG H, LAN F, SHI Y P, et al. A "three-in-one" sample preparation method for simultaneous determination of B-group water-soluble vitamins in infant formula using VitaFast kits[J]. Food Chemistry, 2014, 153: 371-377. DOI:10.1016/j.foodchem.2013.12.088 |
| [12] |
GUGGISBERG D, RISSE M C, HADORN R. Determination of vitamin B12 in meat products by RP-HPLC after enrichment and purification on an immunoaffinity column[J]. Meat Science, 2012, 90(2): 279-283. DOI:10.1016/j.meatsci.2011.07.009 |
| [13] |
吴秀生, 张爽, 张丽媛, 等. 紫外可见分光光度法测定维生素B1含量[J]. 黑龙江医药, 2011, 24(2): 170-171. |
| [14] |
梁敏慧.食品中叶酸、烟酸、生物素及泛酸的UPLC-MS/MS检测方法研究[D].硕士学位论文.北京: 北京工业大学, 2015.
|
| [15] |
王任, 吴鸳鸯, 程巧鸳, 等. 高效液相色谱-串联质谱法同时测定复合维生素片中的叶酸和生物素[J]. 中国食品卫生杂志, 2018, 30(1): 42-46. |
| [16] |
HOSOMI K, KUNISAWA J. The specific roles of vitamins in the regulation of immunosurveillance and maintenance of immunologic homeostasis in the gut[J]. Immune Network, 2017, 17(1): 13-19. |
| [17] |
MILLER K L, TRIFAN G, TESTAI F D. Neurology of nutritional deficiencies[J]. Current Neurology and Neuroscience Reports, 2019, 19(12): 101. DOI:10.1007/s11910-019-1011-2 |
| [18] |
ALMEIDA L, LOCHNER M, BEROD L, et al. Metabolic pathways in T cell activation and lineage differentiation[J]. Seminars in Immunology, 2016, 28(5): 514-524. DOI:10.1016/j.smim.2016.10.009 |
| [19] |
BUCK M D, SOWELL R T, KAECH S M, et al. Metabolic instruction of immunity[J]. Cell, 2017, 169(4): 570-586. DOI:10.1016/j.cell.2017.04.004 |
| [20] |
HUANG Q Q, LIN H Z, WANG R X, et al. Effect of dietary vitamin B6 supplementation on growth and intestinal microflora of juvenile golden pompano (Trachinotus ovatus)[J]. Aquaculture Research, 2019, 50(9): 2359-2370. DOI:10.1111/are.14117 |
| [21] |
龙建华, 王宝维, 孔敏, 等. 饲粮中维生素B12添加水平对5~15周龄五龙鹅生长性能、肠道发育和盲肠菌群结构的影响[J]. 动物营养学报, 2018, 30(10): 3930-3940. |
| [22] |
边丽娜. 液质联用仪同步检测婴幼儿配方食品中11种水溶性维生素[J]. 轻工标准与质量, 2018(5): 47-48. |
| [23] |
梁瑞强, 王聪, 曹进, 等. 高效液相色谱串联质谱法测定保健食品中10种水溶性维生素[J]. 食品安全质量检测学报, 2016, 7(3): 966-974. |
| [24] |
徐萍蔚, 徐海燕, 潘澄, 等. 注射用复合维生素冻干粉针中10种维生素的含量测定[J]. 沈阳药科大学学报, 2011, 28(6): 442-447. |
| [25] |
王博伦, 顾丰颖, 刘子毅, 等. 食品中叶酸测定方法的研究进展[J]. 食品科学, 2020, 41(9): 294-300. |
| [26] |
祖新, 李潇玲, 焦成瑾. 维生素B12检测方法研究进展[J]. 食品研究与开发, 2019, 40(17): 200-206. |
| [27] |
廖明, 李彦, 舒伟. 质谱MRM技术在生物标志物研究中的应用[J]. 分子诊断与治疗杂志, 2010, 2(4): 275-279. |
| [28] |
ZUBAIDI F A, CHOO Y M, TAN G H, et al. A novel liquid chromatography tandem mass spectrometry technique using multi-period-multi-experiment of MRM-EPI-MRM3 with library matching for simultaneous determination of amphetamine type stimula-nts related drugs in whole blood, urine and dried blood stain(DBS)-application to forensic toxicology cases in malaysia[J]. Journal of Analytical Toxicology, 2019, 43(7): 528-535. DOI:10.1093/jat/bkz017 |
| [29] |
CHEN M, LIU J, WRIGHT B. A sensitive and cost-effective HPLC/MS/MS (MRM) method for the clinical measurement of serum hepcidin[J]. Rapid Commun Mass Spectrom, 2019. |
| [30] |
董爽, 马秋刚, 贾如, 等. 微生物法测定饲料中烟酸含量[J]. 中国畜牧杂志, 2012, 48(15): 66-69. |
| [31] |
FAN B, YOU J, SUO Y, et al. A novel and sensitive method for determining vitamin B3 and B7 by pre-column derivatization and high-performance liquid chromatography method with fluorescence detection[J]. PLoS One, 2018, 13(6): e198102. |
| [32] |
SCHMIDT A, SCHREINER M G, MAYER H K. Rapid determination of the various native forms of vitamin B6 and B2 in cow's milk using ultra-high performance liquid chromatography[J]. Journal of Chromatogr A, 2017, 1500: 89-95. DOI:10.1016/j.chroma.2017.04.009 |
| [33] |
ZIRONI E, GAZZOTTI T, BARBAROSSA A, et al. Determination of vitamin B12 in dairy products by ultra performance liquid chromatography-tandem mass spectrometry[J]. Italian Journal of Food Science, 2014, 3(4): 4513. |
| [34] |
WENZEL R, MAJOR D, HESP K, et al. Determination of vitamin B12 in equine urine by liquid chromatography-inductively coupled plasma-mass spectrometry[J]. Journal of Trace Elements in Medicine and Biology, 2018, 50: 634-639. DOI:10.1016/j.jtemb.2018.05.005 |




