2. 湖南省畜牧兽医研究所, 长沙 410131
2. Hunan Institute of Animal and Veterinary Science, Changsha 410131, China
抗生素用于畜禽饲料生产已有70多年历史,对集约化养殖模式下畜禽生长、饲料利用和疫病防控起到了重要作用。但由于抗生素的长期滥用,导致耐药性菌株产生,使得人畜疾病防治难度加大。2006年欧美国家相继在饲料中禁用抗生素,我国也从2020年7月开始实行饲料全面禁抗政策。在此背景下,研究开发具有促进畜禽生长并能替代抗生素的新型饲料添加剂产品将成为饲料和动物营养研究的新热点。阿魏酸(ferulic acid,FEA)是一种天然活性物质,具有抑菌、消炎、抗氧化、减肥、降胆固醇、降血压、抗肿瘤、改善血液循环等多种功效,已广泛应用于食品、医药、保健、化妆品生产等行业。本文结合近年来国内外研究进展,就FEA理化性质、生物学功能及其在畜禽生产上的应用进行综述,旨在为FEA作为新型饲料添加剂开发提供参考依据。
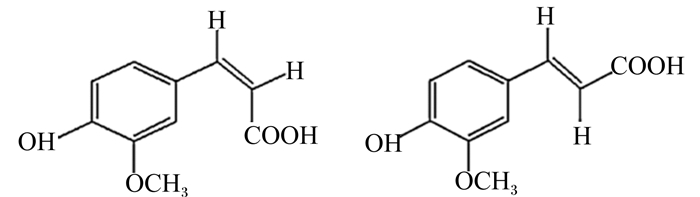
1 FEA 1.1 FEA的结构FEA分子式为C10H10O4,分子质量为194.18 ku,化学名称为4-羟基-3甲氧基苯丙烯酸或4-羟基-3甲氧基肉桂酸,属于酚酸,是羟基肉桂酸的衍生物。FEA存在顺式和反式2种同分异构体(图 1)。丁明玉等[1]通过高效液相色谱法、液相色谱-质谱联用等方法证实FEA反式结构热稳定性强于顺式结构。在常规保存条件下,2种结构的FEA可相互转变,且在动态平衡状态时反式FEA与顺式FEA的比例约为10:1。
|
图 1 FEA的2种同分异构体:顺式FEA(左)和反式FEA(右) Fig. 1 Two isomeric forms of ferulic acid: cis conformation FEA (left) and trans conformation FEA (right) |
FEA广泛存在于各种植物细胞壁中,与多糖、长链醇等长链高分子以共价键连接[2]。表 1列举了FEA的来源及含量。FEA是阿魏、当归、川芎等中药材的有效成分之一,其含量是判断这些中药质量的重要指标[3]。FEA主要由植物提取、化学合成和生物酶解3种途径获得[4],其中,生物酶解法通过微生物发酵分解细胞壁得到FEA[5],因其清洁高效的优点受到化工企业的极大关注。
|
|
表 1 FEA的来源及含量 Table 1 Sources and contents of FEA[6] |
FEA熔点为170.0~171.5 ℃,可溶于热水、乙醇和乙酸乙酯,易溶于乙醚,微溶于石油醚和苯,见光易分解,且在不同pH条件下比较稳定[7]。研究表明,植物体中FEA是由苯基丙氨酸和酪氨酸合成香豆酸后[8],再通过羟基化和甲基化反应形成[9]。虽然FEA在多种植物中广泛存在,但因其多与碳水化合物紧密结合形成糖苷、酯和酰胺物质,组成植物细胞壁,或是被还原成为二氢FEA形成木质纤维素,因此较难被人和动物直接利用[6]。
FEA具有酚羟基,不饱和双键和羧基3个功能团。当自由基靠近时,酚羟基可以提供1个氢离子,并在苯环和双键共同效应下形成具有共振稳定性的酚自由基,从而终止自由基链式反应。同时,不饱和C—C双键还能成为自由基的结合位点。因此,FEA具有较强的消除自由基的能力[10]。Maurya等[11]通过试验证明,FEA比同为羟基肉桂酸衍生物的咖啡酸对一氧化氮(NO)和2, 2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)自由基具有更强的清除能力。Mathew等[12]证明,FEA比某些含苯甲酸酚类物质,如香草酸和原儿茶酸,具有更好的清除自由基效果。另外,FEA分子中的羧基可以与多糖物质发生酯化反应,使其能够与其他大分子物质形成稳定聚合物[10]。
2 FEA的生物学功能从1866年FEA首次被分离,研究人员陆续发现了FEA具有抑菌、消炎、抗氧化、减肥、降胆固醇、降血压、抗肿瘤、改善血液循环等生物学功能[13]。因此,FEA被广泛用于食品保存、化妆品生产、日化、医药等行业[14-15]。
2.1 抑菌作用FEA属于多酚类酚酸。多酚类物质拥有较广的抗菌谱,其抑菌作用与结构有很大关系[16]。FEA对大肠杆菌和蜡状芽胞杆菌产组胺有明显抑制作用,在食品加工行业被用于发酵香肠的添加剂,抑制组胺生成[17]。Zhang等[18]研究发现,1 mg/mL的FEA对嗜麦芽寡养单胞菌增殖具有非常显著的抑制作用。FEA抑菌作用机制可能是降低细菌细胞内pH,破坏细胞膜功能,从而导致细菌死亡[19]。除了对细菌的抑制作用,Sanna等[20]研究发现FEA能够抑制人类免疫缺陷病毒1型(HIV-1)整合酶活性,从而影响HIV-1复制。Sonar等[21]研究发现,FEA衍生物——FEA长链烷基酯化物可以通过抑制HIV-1核糖核酸酶活性,影响HIV-1反转录过程,实现抑制病毒的效果。
2.2 抗氧化作用FEA抗氧化功能最早在日本被发现[22],逐渐受到营养学、食品科学和医学界学者广泛关注。前文提到了FEA分子结构能清理自由基,这正是FEA抗氧化作用基础之一[10, 12-13]。细胞核因子E2相关因子2(Nrf2)是调节氧化应激的重要因子,正常状态下Nrf2在细胞质中被Kelch样ECH相关蛋白1(KEAP1)和cullin-3蛋白泛素化;而在应激条件下,KEAP1-cullin-3系统被破坏,Nrf2转移到细胞核与Maf家族蛋白形成异源二聚物,并与抗氧化反应序列原件(ARE)结合,激活了氧化应激相关基因表达。FEA可能通过激活Nrf2上调抗氧化酶表达,降低氧化酶活性,达到抗氧化效果[23]。Mahmoud等[24]发现,甲氨蝶呤(MTX)处理小鼠连续口服15 d FEA后,与未饲喂FEA小鼠相比,肝脏损伤明显减轻,肝脏活性氧(ROS)、丙二醛(MDA)和一氧化氮(NO)等氧化应激因子含量显著降低,谷胱甘肽(GSH)含量和超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPX)等抗氧化酶活性显著提高。Perez-Ternero等[25]证明FEA显著改善了小鼠线粒体功能,降低了小鼠动脉和上皮细胞氧化应激。林秋珊等[26]利用FEA对过氧化氢处理PC12细胞进行干预,发现FEA使细胞上清液中乳酸脱氢酶(LDH)活性和MDA含量显著降低,SOD活性显著升高,证明FEA缓解了PC12细胞的氧化应激。
2.3 消炎作用炎症反应是机体免疫系统对于应激的防御反应,同时也是一些慢性病,如动脉粥样硬化、溃疡性结肠炎的病理基础[13]。免疫应激条件下,机体内促炎症因子如白细胞介素(IL)-6、肿瘤坏死因子-α(TNF-α)含量显著提高[24]。FEA可以通过干扰转录因子中核因子-κB(NF-κB)蛋白移位,改变促炎因子表达量,从而实现抗炎症效果[27]。Chowdhury等[28]发现,糖尿病小鼠服用50 mg/kg BW的FEA 8周后,小鼠肾脏组织中促炎因子TNF-α、IL-1β、IL-6的表达量显著降低,肾脏炎症和防御性自噬反应明显得到改善。Cao等[29]发现,相比过氧化氢处理,FEA处理下调了血管平滑肌细胞(VSMCs)中NF-κB表达,降低了TNF-α、IL-1β和IL-6等炎症因子含量。Mahmoud等[24]也证明FEA降低了MTX处理小鼠肝细胞中NF-κB的表达量和血清中TNF-α、IL-1β含量。NF-κB是炎症反应中起重要作用的转录因子。在免疫应激条件下,核因子κB抑制蛋白激酶(IKK)被磷酸化,使NF-κB与核因子κB抑制蛋白(I-κB)分离并移位至细胞核,诱导促炎症因子和相关酶表达[30]。FEA可以防止IKK磷酸化从而抑制NF-κB的移位,实现消炎作用[31]。
2.4 减肥、降血脂和抗糖尿病作用随着人们生活水平不断提高,肥胖已成为全球化问题。肥胖属于代谢紊乱症状,其原因是机体摄入大量脂肪和果糖,导致能量过剩,造成脂肪组织堆积[32]。肥胖可以引发一系列其他疾病,包括二型糖尿病、心血管疾病和血脂异常等[33]。FEA作为天然植物提取物,可以有效调节糖类和脂类代谢,改善肥胖和由肥胖引发的健康问题。高脂高糖(HFFD)小鼠饲粮中添加2.6 mmol/kg FEA可以显著降低体增重和脂肪组织重量;同时,FEA显著降低了血清中总甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和游离脂肪酸(FFA)等含量;另外,FEA还降低了HFFD小鼠血糖和胰岛素含量,改善了小鼠耐糖能力和胰岛素抗性[34]。De Melo等[35]认为FEA调节代谢作用机理可能是:1)通过减少瘦蛋白水平影响机体对食物和能量的摄入;2)通过影响淀粉酶和脂肪酶活性改善糖类和脂类代谢。有研究表明,FEA通过提高HFFD小鼠腺苷酸活化蛋白激酶(AMPK)和蛋白激酶B(AKT)磷酸化水平,增强了胰岛素活性和机体对糖类和脂类物质分解代谢;同时FEA通过下调二酰甘油酰基转移酶1(DGAT1)表达,抑制脂肪合成,改善糖类和脂类物质代谢,从而实现减肥和抗糖尿病作用[36-37]。最新研究显示,FEA还可以通过维持HFFD小鼠胚胎干细胞(ESCs)和脂肪来源间充质干细胞(ADMSCs)的自我更新,达到减肥及维持糖类与脂类代谢平衡效果[38]。
2.5 抗肿瘤作用癌症是世界上死亡率最高的疾病[39]。人类与癌症的博弈从未间断,而FEA及其衍生物的抗肿瘤功效使其成为研究和开发抗癌药物的热点对象。FEA抗肿瘤作用机制可能有以下几方面:1)抑制肿瘤细胞生长和增殖;2)诱导肿瘤细胞凋亡;3)消除过量NO及其他ROS[40]。Gao等[41]发现FEA可破坏宫颈癌细胞膜结构,阻滞癌细胞周期于G0/G1期,诱导癌细胞自噬,从而显著抑制宫颈癌细胞增殖和扩散。大量研究表明,FEA衍生物也表现出抗肿瘤作用。Sawata等[42]发现,白藜芦醇分子与2个FEA分子结合生成的化合物对大肠癌细胞和乳腺癌细胞增殖有很好抑制效果。Yue等[43]分析了合成FEA衍生物FXS-3有很好的抗肺癌效果,认为FXS-3通过上调c-Jun氨基末端激酶(JNK)表达,抑制细胞外信号调节蛋白激酶(ERK)/p38、蛋白激酶B(AKT)/雷帕霉素靶蛋白(mTOR)和丝裂原活化细胞外信号调节蛋白激酶(MEK)/ERK信号通路,从而抑制肺癌细胞增殖和扩散。
2.6 改善心脑血管作用心脑血管疾病包括动脉粥样硬化、心力衰竭、高血压、冠心病等,是严重威胁中老年人的全球性健康问题。因吸烟、酗酒、暴饮暴食等不良生活习惯使血管长期处于氧化应激环境是心脑血管疾病的元凶之一[13]。在应激环境下,血管内皮细胞功能受损,产生过量ROS,破坏了NO正常功能,使心脑血管疾病发生几率增加[44]。FEA能够有效清除ROS,协调动脉组织和血管细胞中氧化酶及抗氧化酶活性[23]。Suzuki等[45]证明FEA改善了自发性高血压小鼠血管内皮功能,使NO含量提高,起到舒张血管的功效。Perez-Ternero等[25]发现FEA能够减少高脂饲粮小鼠动脉氧化应激,维持线粒体结构和功能,有效预防动脉粥样硬化,说明了FEA血管保护功能可能是通过上调AMPK表达实现。另外,Zhou等[46]发现FEA在小鼠大动脉、肠系膜小动脉和冠状动脉中具有舒张血管效果,其可能机制是FEA调控ERK1/2和Rho激酶(ROCK)信号通路,抑制钙离子通道,从而缓解了钙离子诱导的血管紧缩。一项主动脉缩窄手术小鼠试验表明,FEA钠减轻了手术造成的心肌肥大症状,其机理可能是FEA钠抑制了蛋白激酶C(PKC)和MAPK信号通路[47]。另外,上文提到FEA具有抗糖尿病和清除ROS作用,也是其改善心脑血管功能的重要机制之一。糖尿病会使心肌细胞和心脏内皮细胞产生过量ROS,破坏DNA和蛋白质结构,引发细胞凋亡,导致心室肿大等心脑血管疾病[48]。Chowdhury等[49]发现,FEA有效降低了链脲佐菌素(STZ)诱发糖尿病小鼠的血液葡萄糖、脂肪和胰岛素含量,同时恢复了小鼠肌酸激酶和乳酸脱氢酶活性,缓解了STZ引起的心脏畸形。
3 FEA在畜禽生产上的应用我国2020年7月在饲料中全面禁用抗生素,FEA及其衍生物作为具有多项生物学功效的植物多酚,在畜禽养殖和饲料生产中拥有很好的应用潜力[50]。FEA作为饲料添加剂直接添加至畜禽饲粮中是最简便的应用方法,另外将FEA含量较高的物质如蜂胶[51]、高粱[52]、小麦酒糟[53]等直接或通过微生物、酶解发酵后饲喂畜禽也是其常用的应用方法[54-55]。表 2中列举了部分将FEA应用于畜禽生产的研究。
|
|
表 2 FEA应用于畜禽生产的部分研究 Table 2 Some studies regarding to application of FEA in livestock production |
以上动物试验表明,FEA作为饲料添加剂对动物生产性能和肉品质均有一定改善,但不同试验结果存在差异,其原因可能是:1)FEA添加量不够或饲喂时间太短,其促生长和抗应激的作用没有显现;2)试验动物没有处于应激状态,FEA抗应激作用没有很好发挥。对于富含FEA类饲料原料直接饲喂畜禽或经发酵处理饲喂畜禽所表现出的饲喂效果,由于还存在其他物质的干扰,目前还难以就此得出是FEA的作用所致,今后有必要进行深入研究。
4 小结大量研究表明,FEA具有多种生物学功能。目前对FEA应用的研究主要集中于食品加工、化妆品生产和临床医学等领域,畜禽生产领域的应用研究相对较少。在2020中国饲料全面禁用抗生素的大背景下,FEA作为植物酚类物质,在畜牧养殖和生产中具有巨大的应用潜力。但仍有些问题限制了FEA的广泛应用,例如:1)不同来源FEA(植物提取或化学合成)在畜禽饲料加工过程中是否能保持稳定性,其对畜禽生长性能的影响效果是否一致;2)不同畜禽饲料中FEA的适宜添加剂量尚无定论;3)FEA影响畜禽生长性能的内在机制仍不清楚。因此,今后应运用现代生物学技术对上述问题进行系统研究,为FEA作为一种新型饲料添加剂在畜禽生产中科学合理应用提供理论依据。
| [1] |
丁明玉, 马帅武, 刘德麟. 阿魏酸的稳定性及其在川芎和当归药材中的存在形式[J]. 中草药, 2004, 35(1): 28-30. |
| [2] |
MATHEW S, ABRAHAM T E. Ferulic acid:an antioxidant found naturally in plant cell walls and feruloyl esterases involved in its release and their applications[J]. Critical Reviews in Biotechnology, 2004, 24(2/3): 59-83. |
| [3] |
李海刚, 胡晒平, 周意, 等. 川芎主要药理活性成分药理研究进展[J]. 中国临床药理学与治疗学, 2018, 23(11): 1302-1308. |
| [4] |
赵琳, 张英锋, 马子川. 阿魏酸的合成和应用[J]. 化学教育, 2009, 30(7): 5-7. |
| [5] |
吴嘉仪.生物法生产阿魏酸的技术研究[D].硕士学位论文.武汉: 华中科技大学, 2015.
|
| [6] |
KUMAR N, PRUTHI V. Potential applications of ferulic acid from natural sources[J]. Biotechnology Reports, 2014, 4: 86-93. DOI:10.1016/j.btre.2014.09.002 |
| [7] |
胡益勇, 徐晓玉. 阿魏酸的化学和药理研究进展[J]. 中成药, 2006, 28(2): 253-255. |
| [8] |
GRAF E. Antioxidant potential of ferulic acid[J]. Free Radical Biology and Medicine, 1992, 13(4): 435-448. DOI:10.1016/0891-5849(92)90184-I |
| [9] |
GOWRI G, BUGOS R C, CAMPBELL W H, et al. Stress responses in alfalfa (Medicago sativa L.):Ⅹ.Molecular cloning and expression of s-adenosyl-L-methionine:caffeic acid 3-O-methyltransferase, a key enzyme of lignin biosynthesis[J]. Plant Physiology, 1997, 97(1): 7-14. |
| [10] |
SRINIVASAN M, SUDHEER A R, MENON V P. Ferulic acid:therapeutic potential through its antioxidant property[J]. Journal of Clinical Biochemistry and Nutrition, 2007, 40(2): 92-100. |
| [11] |
MAURYA D K, DEVASAGAYAM T P A. Antioxidant and prooxidant nature of hydroxycinnamic acid derivatives ferulic and caffeic acids[J]. Food and Chemical Toxicology, 2010, 48(12): 3369-3373. DOI:10.1016/j.fct.2010.09.006 |
| [12] |
MATHEW S, ABRAHAM T E, ZAKARIA Z A. Reactivity of phenolic compounds towards free radicals under in vitro conditions[J]. Journal of Food Science and Technology, 2015, 52(9): 5790-5798. DOI:10.1007/s13197-014-1704-0 |
| [13] |
ALAM M A. Anti-hypertensive effect of cereal antioxidant ferulic acid and its mechanism of action[J]. Frontiers in Nutrition, 2019, 6: 121. DOI:10.3389/fnut.2019.00121 |
| [14] |
赵东平, 杨文钰, 陈兴福. 阿魏酸的研究进展[J]. 时珍国医国药, 2008, 19(8): 1839-1841. |
| [15] |
张国治, 杨徐宁, 张雨. 阿魏酸在食品和农业领域的研究进展[J]. 粮食加工, 2019, 44(4): 41-43. |
| [16] |
DAGLIA M. Polyphenols as antimicrobial agents[J]. Current Opinion in Biotechnology, 2012, 23(2): 174-181. DOI:10.1016/j.copbio.2011.08.007 |
| [17] |
赵利利, 李志田, 李彬彬, 等. 阿魏酸对大肠杆菌和蜡状芽孢杆菌产组胺的影响[J]. 食品工业科技, 2018, 39(8): 113-118. |
| [18] |
ZHANG Y X, WEI J P, QIU Y, et al. Structure-dependent inhibition of Stenotrophomonas maltophilia by polyphenol and its impact on cell membrane[J]. Frontiers in Microbiology, 2019, 10: 2646. DOI:10.3389/fmicb.2019.02646 |
| [19] |
SHI C, ZHANG X R, SUN Y, et al. Antimicrobial activity of ferulic acid against Cronobacter sakazakii and possible mechanism of action[J]. Foodborne Pathogens and Disease, 2016, 13(4): 196-204. DOI:10.1089/fpd.2015.1992 |
| [20] |
SANNA C, RIGANO D, CORONA A, et al. Dual HIV-1 reverse transcriptase and integrase inhibitors from Limonium morisianum Arrigoni, an endemic species of Sardinia (Italy)[J]. Natural Product Research, 2018, 33(12): 1798-1803. |
| [21] |
SONAR V P, CORONA A, DISTINTO S, et al. Natural product-inspired esters and amides of ferulic and caffeic acid as dual inhibitors of HIV-1 reverse transcriptase[J]. European Journal of Medicinal Chemistry, 2017, 130: 248-260. DOI:10.1016/j.ejmech.2017.02.054 |
| [22] |
YAGI K, OHISHI N. Action of ferulic acid and its derivatives as antioxidants[J]. Journal of Nutritional Science and Vitaminology, 1979, 25(2): 127-130. DOI:10.3177/jnsv.25.127 |
| [23] |
KRAJKA-KUŻNIAK V, PALUSZCZAK J, SZAEFER H, et al. The activation of the Nrf2/ARE pathway in HepG2 hepatoma cells by phytochemicals and subsequent modulation of phase Ⅱ and antioxidant enzyme expression[J]. Journal of Physiology and Biochemistry, 2015, 71(2): 227-238. DOI:10.1007/s13105-015-0401-4 |
| [24] |
MAHMOUD A M, HUSSEIN O E, HOZAYEN W G, et al. Ferulic acid prevents oxidative stress, inflammation, and liver injury via upregulation of Nrf2/HO-1 signaling in methotrexate-induced rats[J]. Environmental Science and Pollution Research, 2020, 27(10): 7910-7921. |
| [25] |
PEREZ-TERNERO C, WERNER C M, NICKEL A G, et al. Ferulic acid, a bioactive component of rice bran, improves oxidative stress and mitochondrial biogenesis and dynamics in mice and in human mononuclear cells[J]. The Journal of Nutritional Biochemistry, 2017, 48: 51-61. DOI:10.1016/j.jnutbio.2017.06.011 |
| [26] |
林秋珊, 杨佩芬, 尹曼雪, 等. 阿魏酸对H2O2致PC12细胞氧化损伤的保护作用[J]. 中国实验方剂学杂志, 2019, 25(13): 66-72. |
| [27] |
LAMPIASI N, MONTANA G. The molecular events behind ferulic acid mediated modulation of IL-6 expression in LPS-activated Raw 264.7 cells[J]. Immunobiology, 2016, 221(3): 486-493. |
| [28] |
CHOWDHURY S, GHOSH S, DAS A K, et al. Ferulic acid protects hyperglycemia-induced kidney damage by regulating oxidative insult, inflammation and autophagy[J]. Frontiers in Pharmacology, 2019, 10: 27. DOI:10.3389/fphar.2019.00027 |
| [29] |
CAO Y J, ZHANG Y M, QI J P, et al. Ferulic acid inhibits H2O2-induced oxidative stress and inflammation in rat vascular smooth muscle cells via inhibition of the NADPH oxidase and NF-κB pathway[J]. International Immunopharmacology, 2015, 28(2): 1018-1025. |
| [30] |
SHIN J S, BAEK S R, SOHN S I, et al. Anti-inflammatory effect of pelubiprofen, 2-[J]. Journal of Cellular Biochemistry, 2011, 112(12): 3594-3603. DOI:10.1002/jcb.23290 |
| [31] |
LAMPIASI N, MONTANA G. An in vitro inflammation model to study the Nrf2 and NF-κB crosstalk in presence of ferulic acid as modulator[J]. Immunobiology, 2018, 223(4/5): 349-355. |
| [32] |
杨艳丽. 肥胖研究进展[J]. 济宁医学院学报, 2012, 35(1): 64-66. |
| [33] |
贾伟平. 肥胖与糖尿病及心血管事件:流行现状及研究新进展[J]. 临床内科杂志, 2012, 29(3): 149-151. |
| [34] |
WANG O, LIU J, CHENG Q, et al. Effects of ferulic acid and γ-oryzanol on high-fat and high-fructose diet-induced metabolic syndrome in rats[J]. PLoS One, 2015, 10(2): e0118135. DOI:10.1371/journal.pone.0118135 |
| [35] |
DE MELO T S, LIMA P R, CARVALHO K M M B, et al. Ferulic acid lowers body weight and visceral fat accumulation via modulation of enzymatic, hormonal and inflammatory changes in a mouse model of high-fat diet-induced obesity[J]. Brazilian Journal of Medical and Biological Research, 2017, 50(1): e5630. DOI:10.1590/1414-431x20165630 |
| [36] |
GUO X X, ZENG Z, QIAN Y Z, et al. Wheat flour, enriched with γ-oryzanol, phytosterol, and ferulic acid, alleviates lipid and glucose metabolism in high-fat-fructose-fed rats[J]. Nutrients, 2019, 11(7): 1697. DOI:10.3390/nu11071697 |
| [37] |
NARASIMHAN A, CHINNAIYAN M, KARUNDEVI B. Ferulic acid exerts its antidiabetic effect by modulating insulin-signalling molecules in the liver of high-fat diet and fructose-induced type-2 diabetic adult male rat[J]. Applied Physiology, Nutrition, and Metabolism, 2015, 40(8): 769-781. DOI:10.1139/apnm-2015-0002 |
| [38] |
CHO J, PARK E. Ferulic acid maintains the self-renewal capacity of embryo stem cells and adipose-derived mesenchymal stem cells in high fat diet-induced obese mice[J]. The Journal of Nutritional Biochemistry, 2019, 77: 108327. |
| [39] |
JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics[J]. A Cancer Journal for Clinicians, 2011, 61(2): 69-90. DOI:10.3322/caac.20107 |
| [40] |
AL-ISHAQ R K, OVERY A J, BUSSELBERG D. Phytochemicals and gastrointestinal cancer:cellular mechanisms and effects to change cancer progression[J]. Biomolecules, 2020, 10(1): 105. DOI:10.3390/biom10010105 |
| [41] |
GAO J H, YU H, GUO W K, et al. The anticancer effects of ferulic acid is associated with induction of cell cycle arrest and autophagy in cervical cancer cells[J]. Cancer Cell International, 2018, 18: 102. DOI:10.1186/s12935-018-0595-y |
| [42] |
SAWATA Y, MATSUKAWA T, DOI S, et al. A novel compound, ferulic acid-bound resveratrol, induces the tumor suppressor gene p15 and inhibits the three-dimensional proliferation of colorectal cancer cells[J]. Molecular and Cellular Biochemistry, 2019, 462(1/2): 25-31. |
| [43] |
YUE S J, ZHANG P X, ZHU Y, et al. A ferulic acid derivative FXS-3 inhibits proliferation and metastasis of human lung cancer A549 cells via positive JNK signaling pathway and negative ERK/p38, AKT/mTOR and MEK/ERK signaling pathways[J]. Molecules, 2019, 24(11): 2165. DOI:10.3390/molecules24112165 |
| [44] |
黄湘壹. 气体信号分子一氧化氮与心血管疾病研究进展[J]. 社区医学杂志, 2014, 12(3): 14-16. |
| [45] |
SUZUKI A, YAMAMOTO M, JOKURA H, et al. Ferulic acid restores endothelium-dependent vasodilation in aortas of spontaneously hypertensive rats[J]. American Journal of Hypertension, 2007, 20(5): 508-513. DOI:10.1016/j.amjhyper.2006.11.008 |
| [46] |
ZHOU Z Y, XU J Q, ZHAO W R, et al. Ferulic acid relaxed rat aortic, small mesenteric and coronary arteries by blocking voltage-gated calcium channel and calcium desensitization via dephosphorylation of ERK1/2 and MYPT1[J]. European Journal of Pharmacology, 2017, 815: 26-32. DOI:10.1016/j.ejphar.2017.10.008 |
| [47] |
LUO M, CHEN P P, YANG L, et al. Sodium ferulate inhibits myocardial hypertrophy induced by abdominal coarctation in rats:involvement of cardiac PKC and MAPK signaling pathways[J]. Biomedicine & Pharmacotherapy, 2019, 112: 108735. |
| [48] |
GHOSH S, BASAK P, DUTTA S, et al. New insights into the ameliorative effects of ferulic acid in pathophysiological conditions[J]. Food and Chemical Toxicology, 2017, 103: 41-55. DOI:10.1016/j.fct.2017.02.028 |
| [49] |
CHOWDHURY S, GHOSH S, RASHID K, et al. Deciphering the role of ferulic acid against streptozotocin-induced cellular stress in the cardiac tissue of diabetic rats[J]. Food and Chemical Toxicology, 2016, 97: 187-198. DOI:10.1016/j.fct.2016.09.011 |
| [50] |
SAEED M, ALAGAWANY M, FAZLANI S A, et al. Health promoting and pharmaceutical potential of ferulic acid for the poultry industry[J]. World's Poultry Science Journal, 2019, 75(1): 83-92. DOI:10.1017/S0043933918000740 |
| [51] |
SAEED M, ARAIN M A, KAMBOH A A, et al. Raw propolis as a promising feed additive in poultry nutrition:trends and advances[J]. Journal of Animal Health and Production, 2017, 5(4): 132-142. |
| [52] |
VAN HUNG P, PHAT N H, PHI N T L. Physicochemical properties and antioxidant capacity of debranched starch-ferulic acid complexes[J]. Starch, 2013, 65(5/6): 382-389. |
| [53] |
IZYDORCZYK M S, BILIADERIS C G. Cereal arabinoxylans:advances in structure and physicochemical properties[J]. Carbohydrate Polymers, 1995, 28(1): 33-48. DOI:10.1016/0144-8617(95)00077-1 |
| [54] |
李夏兰, 程珊影, 杨道秀, 等. 阿魏酸酯酶和木聚糖酶协同降解麦糟[J]. 化工进展, 2012, 31(5): 1096-1102, 1108. |
| [55] |
LEI Z, SHAO Y X, YIN X N, et al. Combination of xylanase and debranching enzymes specific to wheat arabinoxylan improve the growth performance and gut health of broilers[J]. Journal of Agricultural and Food Chemistry, 2016, 64(24): 4932-4942. DOI:10.1021/acs.jafc.6b01272 |
| [56] |
LI Y J, LI L Y, LI J L, et al. Effects of dietary supplementation with ferulic acid or vitamin E individually or in combination on meat quality and antioxidant capacity of finishing pigs[J]. Asian Australasian Journal of Animal Sciences, 2015, 28(3): 374-381. DOI:10.5713/ajas.14.0432 |
| [57] |
杨东, 刁其玉, 马涛, 等. 阿魏酸和壳寡糖对蒙古杂交羊生长性能及脂肪沉积的影响[J]. 粮食与饲料工业, 2018(9): 43-48. |
| [58] |
WANG Y, WANG W W, WANG R F, et al. Dietary supplementation of ferulic acid improves performance and alleviates oxidative stress of lambs in a cold environment[J]. Canadian Journal of Animal Science, 2018, 99(4): 705-712. |
| [59] |
GONZALEZ-RÍOS H, DÁVILA-RAMIREZ J L, PEÑA-RAMOS E A, et al. Dietary supplementation of ferulic acid to steers under commercial feedlot feeding conditions improves meat quality and shelf life[J]. Animal Feed Science and Technology, 2016, 222: 111-121. DOI:10.1016/j.anifeedsci.2016.10.011 |
| [60] |
ABDEL-RAHMAN M A, MOSAAD G M. Effect of propolis as additive on some behavioural patterns, performance and blood parameters in Muscovy broiler ducks[J]. Journal of Advanced Veterinary Research, 2013, 3(2): 64-68. |
| [61] |
ABDULLA T A, HASSAN M G. The effect of propolis feed supplementation on hygiene and performance of broiler chickens[J]. Iraqi Journal of Veterinary Sciences, 2011, 25(2): 77-82. DOI:10.33899/ijvs.2011.5647 |
| [62] |
SEVEN P T. The effects of dietary Turkish propolis and vitamin C on performance, digestibility, egg production and egg quality in laying hens under different environmental temperatures[J]. Asian-Australasian Journal of Animal Science, 2008, 21(8): 1164-1170. DOI:10.5713/ajas.2008.70605 |




