2. 华中农业大学动物科学技术学院, 武汉 430070
2. College of Animal Science and Technology, Huazhong Agricultural University, Wuhan 430070, China
脲酶在反刍动物瘤胃中由产脲酶菌合成,催化尿素水解为二氧化碳和氨。其中一部分氨被瘤胃细菌利用进而合成微生物蛋白,为动物自身的生长提供氮源。剩余的氨经血液进入肝脏,参与鸟氨酸循环后重新合成尿素,然后经唾液和瘤胃壁循环至瘤胃被重新利用。低氮饲养时,这种尿素循环可以缓解瘤胃内氮素的缺乏,维持反刍动物的营养平衡。然而,由于细菌脲酶过高的催化作用,尿素被快速地水解为氨,当大量的氨进入血液后极易引起动物氨中毒。因此,合理调控瘤胃细菌脲酶和产脲酶菌的活性是充分利用尿素的基础。
1 脲酶的结构特征脲酶蛋白主要包括结构蛋白(UreA、UreB、UreC等)和辅助蛋白(UreD、UreF、UreG、UreE等)。结构蛋白组成的尿素酶原一般以多聚体的形式存在,如产气克雷伯氏菌(Klebsiella aerogenes)脲酶[1]和巴氏芽孢杆菌(Sporosarcina)脲酶[2]形成的典型的(UreABC)3三聚体。幽门螺杆菌(Helicobacter)脲酶主要由UreA和UreB形成[(UreAB)3]4的四聚体[3-4],而像刀豆(Canavalia ensiformis)[5]、木豆(Cajanus cajan)[6]等的高等植物的脲酶可由单个结构蛋白组成多聚体。虽然不同来源的脲酶具有多样性,其在结构蛋白的数目和类型上均有不同,但其UreC的氨基酸序列高度保守,且具有活性中心和镍结合位点,所以UreC的基因通常被用作脲酶扩增的标志基因[7]。脲酶是一种金属蛋白酶,其尿素酶原在体内不具有催化活性,需要接受辅助蛋白传递过来的镍离子,活性才被激活。在这个过程中,位于活性中心的赖氨酸发生氨基甲酰化,然后以氨基甲酸酯基为桥键连接2个镍离子,使传递来的镍离子固定在活性中心。脲酶的每个活性中心均含有2个镍离子,其中一个镍离子与2个组氨酸连接,另一个镍离子除与2个组氨酸连接外,还与1个天冬氨酸连接[1, 8]。
2 细菌脲酶在反刍动物尿素代谢中的作用脲酶广泛存在于细菌、真菌、植物、动物及人体中,关于其在植物和人体方面的研究较多,而在反刍动物方面的认识比较有限。在瘤胃中,细菌脲酶催化尿素水解为氨,对于反刍动物维持体内氮的平衡和营养代谢具有重要意义。瘤胃细菌脲酶及产脲酶菌在反刍动物中的尿素代谢[9-12]如图 1所示:1)体内氨基酸/氨在肝脏内经鸟氨酸循环形成尿素后进入血液(内源尿素),其中肝脏中形成的尿素占摄入氮的27%~143%。2)一部分内源尿素进入肾脏,经过滤后,其中40%~60%会重新返回到血液,剩余部分以尿液排出体外,占内源尿素的1%~71%。3)内源尿素的29%~99%返回瘤胃,在细菌脲酶的催化作用下,几乎全部水解为氨和二氧化碳。其中,瘤胃壁和唾液是尿素进入瘤胃的主要方式,15%~94%的内源尿素经唾液重新返回至瘤胃。4)经血液吸收进入肝脏的氨,占瘤胃尿素的15%~86%。5)用来合成微生物蛋白的氨, 占瘤胃尿素的6%~72%。6)以粪便形式排除体外的氨,占瘤胃尿素的0.03%~21.00%。总的来说,循环返回至瘤胃的尿素氮远远大于摄入氮,并且瘤胃尿素的11%~75%被用来参与机体的营养代谢,其中大部分是以微生物蛋白的形式被吸收利用。
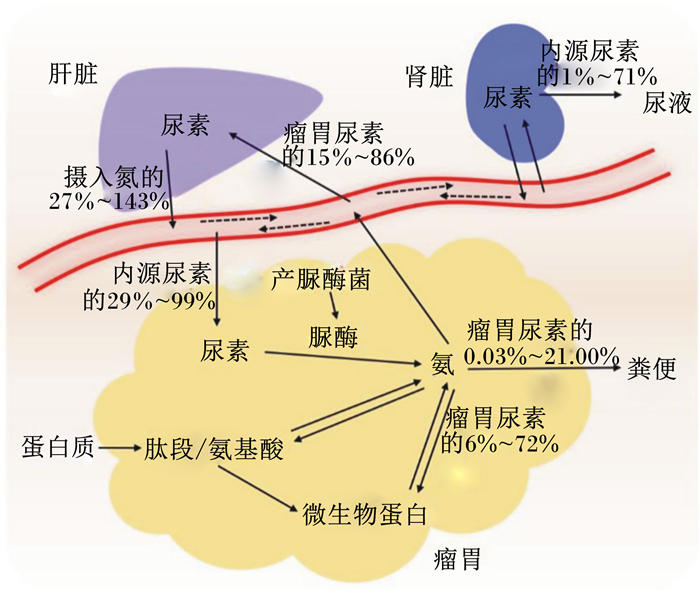
|
图 1 细菌脲酶和产脲酶菌在反刍动物的尿素代谢中的作用 Fig. 1 Schematic presentation of role of urease and urease-producing bacteria in urea metabolism of ruminant[9-12] |
反刍动物通过利用瘤胃中的氨,尽可能多地合成微生物蛋白可以有效地提高尿素的利用率。体外研究表明,当氨的浓度为50~60 mg/L时,可以最大限度地合成微生物蛋白[13],而在体内的研究中,氨的适宜浓度为88~133 mg/L[14]或27~100 mg/L[15],浓度的差异可能与饲粮有关。正常情况下,由于脲酶的催化作用,瘤胃内产生氨的速度要大于其合成微生物蛋白的速度,剩余的氨经血液会重新返回至肝脏,然后以尿液排出体外,或者经唾液和瘤胃壁再次返回至瘤胃,如此循环往复。然而,由于脲酶过高的催化活性,当瘤胃内产生氨的速度大于肝脏从血液中吸收氨的速度时,过量的氨被滞留在血液中,极易引起动物的氨中毒。其原因一方面来源于铵离子对机体的直接毒性作用;另一方面是由于血液中高浓度的氨导致的机体酸碱平衡紊乱和电解质失衡[16]。因此,合理调控细菌脲酶活性是提高尿素利用率的关键。
3 瘤胃细菌脲酶和产脲酶菌的多样性 3.1 瘤胃细菌脲酶的活性Pearson等[17]首先确定了瘤胃细菌脲酶活性的适宜pH为7~9和最适温度为49 ℃,并推测在饲喂尿素后脲酶活性最高。Rekib等[18]进一步证实了在尿素进入瘤胃后的0.5~2.0 h内,脲酶活性最高。脲酶的活性与瘤胃微生物密切相关。在体外瘤胃发酵系统中,当微生物松散地附着在固体颗粒饲粮时,其脲酶活性比微生物紧密地附着在饲粮时高[19]。在体内绵羊瘤胃中,当饲喂低蛋白质饲粮(23 g/d)时,不同位置的微生物产生的脲酶活性高低依次是瘤胃壁>瘤胃液>瘤胃固体基质。然而,当绵羊饲喂高蛋白质饲粮(137 g/d)时,其瘤胃壁和瘤胃液的微生物有相同的脲酶活性,且均高于瘤胃固体基质,但都低于低蛋白质饲粮饲喂时的尿酶活性[20]。这种饲喂低蛋白质饲粮时的高脲酶活性有助于血液中的尿素转运至瘤胃,被认为是瘤胃缓解机体氮素缺乏的一种积极调控。
3.2 瘤胃产脲酶菌的脲酶活性瘤胃微生物主要由细菌、真菌、古菌、原虫和噬菌体组成,这些微生物与宿主之间可以进行信息交流、能量物质交换,具有发酵代谢功能[21],其中,瘤胃中的产脲酶菌, 通过合成脲酶参与氮的代谢。根据文献[22-34]归纳了具有尿素分解能力或脲酶活性的瘤胃产脲酶菌, 详见表 1。早期通过纯培养技术得到一些产脲酶菌。最早分离出的产脲酶菌被认为来自双歧杆菌属[Bifidobacterium (Lactobacillus) bifidum],但其活性未知[22]。John等[29]从绵羊的瘤胃中分离出1 000多种产脲酶菌,主要分布于葡萄球菌属(Staphylococcus sp.)、链球菌属(Streptococcus sp.)、产气克雷伯氏菌和乳酸杆菌属(Lactobacillus sp.),其中粪链球菌(Streptococcus faecium)的脲酶活性最高。Van Wyk等[30]发现所有能分离的具有脲酶活性的微生物主要分布于革兰氏阳性球菌、兼性厌氧球菌和过氧化氢酶阳性球菌,而革兰氏阳性球菌可能是瘤胃脲酶活性的主要来源。
|
|
表 1 具有尿素分解能力或脲酶活性的瘤胃产脲酶菌 Table 1 Bacteria from rumen showing ureolytic or urease activity |
不同的菌株具有高低不同的脲酶活性。Lauková等[32]对分离出的产脲酶菌进行脲酶活性评定,发现56.7%的反刍兽新月形单胞菌(Selenomonas ruminantium)和18.5%的乳酸杆菌(Lactobacilli)具有中等脲酶活性,62.5%的粪渣肠球菌(Enterococcus faecium)和全部粪肠球菌(Enterococcus faecalis)的脲酶活性很低,所有的葡萄球菌(Staphylococci)表现出中底等的脲酶活性,而乳房链球菌(Streptococcus uberis)和牛链球菌(Streptococcus bovis)却没有任何脲酶活性。一些非选择性分离出的瘤胃菌株也表现出脲酶活性,包括溶糊精琥珀酸弧菌(Succinivibrio dextrinosolvens)、布氏瘤胃球菌(Ruminococcus bromii)、丁酸弧菌属(Butyrivibrio sp.)、密螺旋体属(Treponema)、拟杆菌属(Bacteroides)等[23]。
3.3 瘤胃产脲酶菌的多样性瘤胃微生物种类繁多且数量巨大,并且微生物之间形成紧密复杂的共生关系,使微生物难以分离和纯培养,目前世界上99%以上的微生物都无法进行分离培养,即使分离培养出菌株,也很难维持菌株本身的状态和功能,这可能也是分离出的产脲酶菌的活性很低或者没有活性的原因。赵圣国等[25]绕过纯培养技术,运用宏基因组学技术,发现奶牛瘤胃产脲酶菌具有多样性,不仅分布于厚壁菌门(Firmicutes)、ε-变形菌门(ε-Proteobacteria)、β-变形菌门(β-proteobacteria)和放线菌门(Actinobacteria),还分布于不动杆菌属(Acinetobacter)、志贺氏杆菌属(Shigella)、无色杆菌属(Achromobacter)、芽孢杆菌属(Bacillus)和某些未培养的微生物。另外,他们还运用质谱技术直接从瘤胃中鉴定出3种活性脲酶,除了嗜热链球菌(Streptococcus thermophilus)和唾液链球菌(Streptococcus salivarius)外,还发现嗜碱芽孢杆菌(Bacillus halodurans)也可以合成脲酶[26]。
Jin等[27]以ureC为脲酶标志基因,运用高通量测序技术,发现奶牛瘤胃不同位点的产脲酶菌具有不同的多样性。瘤胃壁中分布着独特的产脲酶菌,其多样性低于瘤胃液和瘤胃固体基质。奶牛瘤胃中高丰度产脲酶菌主要分布于甲球菌科(Methylococcaceae)、梭菌科(Clostridiaceae)、芽胞杆菌科(Paenibacillaceae)、螺旋杆菌科(Helicobacteraceae)和甲藻科(Methylophilaceae)。存在瘤胃壁中的嗜甲基菌属(Methylophilus)和海杆菌属(Marinobacter)的丰度显著高于瘤胃液和瘤胃固体基质。瘤胃壁是大部分尿素进入瘤胃的必经之路,其独特的和高丰度的产脲酶菌可能有助于尿素转运至瘤胃。另外,作者还发现奶牛瘤胃中超过55%的ureC基因序列与任何已知的脲酶基因无关,说明瘤胃中还包含有很多未被分类的新的产脲酶菌。如果能从中鉴定出优势产脲酶菌,以其为靶标来调控尿素代谢将更有意义。
4 影响瘤胃脲酶和产脲酶菌的因素 4.1 饲粮氮和氨在一定范围内,细菌脲酶的活性随着氮或者氨的浓度的增加而增加,但是过高的浓度会抑制某些产脲酶菌和细菌脲酶的活性。饲粮蛋白质含量在64~235 g/kg时,牛和耗牛瘤胃液中的细菌脲酶活性与之呈正比线性关系,即使当瘤胃氨的浓度升至5.1~105.0 mg/L时,也不足以抑制产脲酶菌的活性[35]。谷氨酰胺合成酶可以调控反刍兽新月形单胞菌的脲酶活性,当氨量被限制时,脲酶及谷氨酰胺合成酶的活性最高;但当加入过量的氨时,脲酶活性被抑制[28]。虽然过量的氨或者氮在一定程度上会抑制脲酶活性,但不同的菌株,其表现也不同。Wozny等[23]发现,在体外培养产脲酶菌时,添加相同浓度的氮,有11株产脲酶菌的活性未检测到,有5株不受氮的影响,有7株其脲酶活性被抑制。
4.2 尿素瘤胃的尿素浓度对细菌脲酶和产脲酶菌有直接的影响。在Rusitec系统中,饲喂的牧草在10~170 mg/d,浓缩饲料在40~170 mg/d时,细菌脲酶活性随着尿素浓度的增加而增加[19]。Jin等[34]利用瘤胃模拟系统,发现在瘤胃中添加尿素(5 g/kg饲粮)可以显著增加氨的浓度;尿素浓度的增加不会影响瘤胃微生物的群落组成,但可以改变某些产脲酶菌的比例和相对丰度。在门水平上,与其他组相比,尿素组的变形菌门(Proteobacteria)和放线菌门的比例最高,拟杆菌门(Bacteroidetes)的丰度最低。另外,添加尿素后,芽孢杆菌和未分类的琥珀弧菌(Succinivibrionaceae)的丰度显著增加,假单胞菌(Pseudomonas)、嗜血杆菌(Haemophilus)、奈瑟氏菌(Neisseria)、链球菌(Streptococcus)和放线菌(Actinomyces)丰度与尿素浓度呈正相关。Zhou等[36]在育肥牛的瘤胃中发现,添加尿素(0.8%~2.0%)后,丁酸弧菌属、粪球菌属(Coprococcus)等的比例也发生变化。Jin等[27]以奶牛为研究对象,发现添加尿素(160 g/d)后,奶牛瘤胃产脲酶菌的组成没有发生变化;在早晨饲喂后的2~4 h,尿素组的氨的浓度显著增高,且在2 h时,达到峰值,而此时尿素组和未添加尿素组的细菌脲酶活性均最高,但没有差异。氨的浓度升高但细菌脲酶活性无差异,这种现象可能与内源尿素浓度有关。尽管添加了尿素,但是并没有对内源尿素造成影响,因此,细菌脲酶和产脲酶菌的活性没有发生变化。这可能也是体外培养的细菌脲酶或者产脲酶菌的活性因尿素浓度的添加而升高,但在体内却检测不到变化的原因之一[27]。
4.3 其他细菌脲酶和产脲酶菌的活性还受其他因素的影响,如pH、无机离子、生态位点等。每种酶都有其最适的pH,大于或者小于最适pH,均会降低酶的活性。唾液链球菌的脲酶活性,在pH 5.5时比在pH 7.0时高100倍,且其脲酶含量与pH呈反比关系[37]。一些二价阳离子(Mn2+、Cu2+、Zn2+、Cd2+、Ni2+、Mg2+、Ba2+、Hg2+和Co2+)在体外会抑制纯化脲酶的活性[38]。然而,Spears等[39]发现,对于培养在瘤胃液中的产脲酶菌而言,Mn2+、Ni2+和Ba2+可以诱导脲酶活性,而Cu2+、Zn2+和Cd2+会抑制脲酶活性。Bunting等[40]发现,在用低蛋白质饲粮饲喂犊牛时,瘤胃壁或靠近瘤胃壁的产脲酶菌会优先利用尿素,其脲酶活性也高于瘤胃液或其他位置的活性。Moharrery等[41]的研究表明,瘤胃产脲酶菌的胞内脲酶活性要高于胞外,在分解尿素时,产脲酶菌可能先将胞外尿素摄入胞内,然后再由脲酶进一步将其催化水解利用。
5 瘤胃细菌脲酶抑制剂在细菌脲酶的催化作用下,尿素快速水解为氨,其水解的速度极易超过瘤胃微生物吸收利用的速度,进而引起动物的氨中毒和氮素的浪费。利用脲酶抑制剂来降低脲酶活性,可以减缓尿素的水解,从而有效地减少氨的损失,提高尿素利用率。在体外试验中,一些脲酶抑制剂[如乙酰氧肟酸(AHA)、苯基磷酸二胺(PPD)、N-丁基硫代磷酸三酰胺(NBPT)、氢醌、硼酸、铋化合物等]可以很好地抑制脲酶活性,但是,在体内试验中,其抑制作用通常只呈现短期的效果,可能与瘤胃微生物的适应性有关[42-44]。另外,考虑到一些化合物对于动物和人类的健康存在未知的风险,这些抑制剂并没有被广泛地应用在动物饲养上。
天然产物(主要是次级代谢产物)是目前最有潜力的脲酶抑制剂的来源[45],其在缓解幽门螺杆菌导致的胃溃疡方面的研究较多,关于其对瘤胃细菌脲酶和产脲酶菌影响的研究较少。单宁可以抑制瘤胃细菌脲酶和产脲酶菌。如栗子和白坚木中的单宁可以降低牛粪便中的细菌脲酶活性,这可能是由于单宁和细菌脲酶或产脲酶菌发生了某种相互作用[46]。另一研究将栗子和白坚木中的单宁以1:2(w/w)的比例混合,然后加入荷斯坦奶牛的饲粮中(2 g/kg),结果发现瘤胃液中细菌脲酶活性降低,一些代表性的产脲酶菌丁酸弧菌属和密螺旋体属的比例减少[47]。鹰嘴豆素A广泛存在于红三叶、紫花苜蓿胚芽,以及一些豆科植物中,是一种天然活性化合物。Liu等[48]的体外试验表明,鹰嘴豆素A显著降低了氨的浓度和产脲酶菌新月形单胞菌的丰度,并降低了细菌脲酶的活性。
免疫接种可以有效地激发动物自身的免疫应答。对于羔羊和犊牛,免疫接种刀豆脲酶(Canavalia ensiformis L.)显著降低了瘤胃液细菌脲酶活性和氨的浓度[49-50],但是,对于高蛋白质饲粮(164 g/kg)饲喂的绵羊,免疫接种后并没有降低其分解尿素的能力[51]。分析原因之一可能与刀豆脲酶和细菌脲酶的免疫同源性较差有关,导致抗体无法进入瘤胃发挥作用[51],具体原因还应进一步调查分析。脲酶结构蛋白UreC高度保守,且大多与幽门螺杆菌的UreC高度相似,因此,用幽门螺杆菌的UreC作为疫苗来免疫奶牛,发现免疫4次后,瘤胃细菌脲酶活性降低17%;在体外的试验中也证实,此疫苗抗体可以降低尿素的分解和氨的浓度。所以,以幽门螺杆菌的UreC为疫苗免疫反刍动物,是一种有效的抑制脲酶活性的方法,推测如果将多种瘤胃脲酶的UreC结合在一起制作疫苗,其抑制效果会比单一的幽门螺杆菌更好[52]。
6 小结用尿素代替部分植物和动物蛋白质饲喂反刍动物,能够部分缓解我国蛋白质饲料资源短缺的状况。对尿素的高效利用,不仅有助于节约饲粮蛋白质,增加微生物蛋白的产量,还可以减少氮排放,其中,瘤胃细菌脲酶是尿素分解的关键限速酶,其过高的催化活性是导致尿素利用偏低的重要原因。随着尿素在反刍动物饲养上的应用,瘤胃产脲酶菌逐渐被人们认识,但由于瘤胃独特的环境以及瘤胃微生物间错综复杂的关系,为体外纯培养产脲酶菌造成了困难,因此,利用新的技术和方法,如宏蛋白组学、宏基因组学等来全面认识细菌脲酶和产脲酶菌是调控尿素的基础。
细菌脲酶具有基因多样性,瘤胃中超过55%的ureC基因序列与任何已知的脲酶基因无关,鉴于此,找到瘤胃中高丰度或者高脲酶活性的优势产脲酶菌群,以其为研究对象,深入了解其分子机制是调控尿素的关键。另外,关于脲酶抑制剂开发的相关研究很多,但由于试验结果不充分,且存在微生物适应性和潜在毒性的问题,实际应用并不明显。利用不同的瘤胃细菌脲酶结合在一起制作疫苗,进行大范围覆盖的免疫,以及针对瘤胃高丰度或者高活性的优势产脲酶菌,用天然活性化合物作为新型脲酶抑制剂进行靶向性的调节值得尝试。
| [1] |
MARONEY M J, CIURLI S. Nonredox nickel enzymes[J]. Chemical Reviews, 2014, 114(8): 4206-4228. DOI:10.1021/cr4004488 |
| [2] |
ZAMBELLI B, MUSIANI F, BENINI S, et al. Chemistry of Ni2+ in urease:sensing, trafficking, and catalysis[J]. Accounts of Chemical Research, 2011, 44(7): 520-530. DOI:10.1021/ar200041k |
| [3] |
CARLINI C R, LIGABUE-BRAUN R. Ureases as multifunctional toxic proteins:a review[J]. Toxicon, 2016, 110: 90-109. DOI:10.1016/j.toxicon.2015.11.020 |
| [4] |
ZAMBLE D B, ROWIŃSKA-ŻYREK M, KOZLOWSKI H, et al.The biological chemistry of nickel[M]//ZAMBLE D, ROWIŃSKA-ŻYREK M, KOZLOWSKI H.The biological chemistry of nickel.London, UK: Royal Society of Chemistry, 2017: 60-97.
|
| [5] |
BALASUBRAMANIAN A, PONNURAJ K. Crystal structure of the first plant urease from jack bean:83 years of journey from its first crystal to molecular structure[J]. Journal of Molecular Biology, 2010, 400(3): 274-283. |
| [6] |
BALASUBRAMANIAN A, DURAIRAJPANDIAN V, ELUMALAI S, et al. Structural and functional studies on urease from pigeon pea (Cajanus cajan)[J]. International Journal of Biological Macromolecules, 2013, 58: 301-309. DOI:10.1016/j.ijbiomac.2013.04.055 |
| [7] |
COLLIER J L, BAKER K M, BELL S L. Diversity of urea-degrading microorganisms in open-ocean and estuarine planktonic communities[J]. Environmental Microbiology, 2010, 11(12): 3118-3131. |
| [8] |
KAPPAUN K, PIOVESAN A R, CARLINI C R, et al. Ureases:historical aspects, catalytic, and non-catalytic properties-a review[J]. Journal of Advanced Research, 2018, 13: 3-17. DOI:10.1016/j.jare.2018.05.010 |
| [9] |
PATRA A K, ASCHENBACH J R. Ureases in the gastrointestinal tracts of ruminant and monogastric animals and their implication in urea-N/ammonia metabolism:a review[J]. Journal of Advanced Research, 2018, 13: 39-50. DOI:10.1016/j.jare.2018.02.005 |
| [10] |
BATISTA E D, DETMANN E, FILHO S C V, et al. The effect of CP concentration in the diet on urea kinetics and microbial usage of recycled urea in cattle:a meta-analysis[J]. Animal, 2017, 11(8): 1303-1311. DOI:10.1017/S1751731116002822 |
| [11] |
STEWART G S, SMITH C P. Urea nitrogen salvage mechanisms and their relevance to ruminants, non-ruminants and man[J]. Nutrition Research Reviews, 2005, 18(1): 49-62. |
| [12] |
GAO W, GAO X, CHEN A, et al. Effect of dietary dry matter intake on endogenous nitrogen flows in growing lambs[J]. Journal of Animal Physiology and Animal Nutrition, 2017, 101(5): e383-e393. DOI:10.1111/jpn.12618 |
| [13] |
SATTER L D, SLYTER L L. Effect of ammonia concentration on rumen microbial protein production in vitro[J]. British Journal of Nutrition, 1974, 32(2): 199-208. DOI:10.1079/BJN19740073 |
| [14] |
HUME I D, MOIR R J, SOMERS M. Synthesis of microbial protein in the rumen.Ⅰ.Influence of the level of nitrogen intake[J]. Australian Journal of Agricultural Research, 1970, 21(2): 283-296. DOI:10.1071/AR9700283 |
| [15] |
PISULEWSKI P M, OKORIE A U, BUTTERY P J, et al. Ammonia concentration and protein synthesis in the rumen[J]. Journal of the Science of Food and Agriculture, 1981, 32(8): 759-766. DOI:10.1002/jsfa.2740320803 |
| [16] |
PATRA A K.Urea/ammonia metabolism in the rumen and toxicity in ruminants[M]//PUNIYA A K, SINGH R, KAMRA D N.Rumen microbiology: from evolution to revolution.New Delhi: Springer, 2015: 329-341.
|
| [17] |
PEARSON R M, SMITH J A B. The utilization of urea in the bovine rumen.2.The conversion of urea to ammonia[J]. Biochemical Journal, 1943, 37(1): 148-153. |
| [18] |
REKIB A, SADHU D P. Effect of feeding higher doses of urea on the rumen metabolism in goat[J]. Indian Veterinary Journal, 1968, 45(9): 735-739. |
| [19] |
CZERKAWSKI J W, BRECKENRIDGE G. Distribution and changes in urease (EC 3.5.1.5) activity in rumen simulation technique (rusitec)[J]. British Journal of Nutrition, 1982, 47(2): 331-348. DOI:10.1079/BJN19820042 |
| [20] |
JAVORSKÝ P, RYBOSOVÁ E, HAVASSY I, et al. Urease activity of adherent bacteria and rumen fluid bacteria[J]. Physiologia Bohemoslovaca, 1987, 36(1): 75-81. |
| [21] |
MORAÏS S, MIZRAHI I. The road not taken:the rumen microbiome, functional groups, and community states[J]. Trends in Microbiology, 2019, 27(6): 538-549. DOI:10.1016/j.tim.2018.12.011 |
| [22] |
GIBBONS R J, DOETSCH R N. Physiological study of an obligately anaerobic ureolytic bacterium[J]. Journal of Bacteriology, 1959, 77(4): 417-428. DOI:10.1128/JB.77.4.417-428.1959 |
| [23] |
WOZNY M A, BRYANT M P, HOLDEMAN L V, et al. Urease assay and urease-producing species of anaerobes in the bovine rumen and human feces[J]. Applied and Environmental Microbiology, 1977, 33(5): 1097-1104. DOI:10.1128/AEM.33.5.1097-1104.1977 |
| [24] |
SLYTER L L, OLTJEN R R, KERN D L, et al. Microbial species including ureolytic bacteria from the rumen of cattle fed purified diets[J]. The Journal of Nutrition, 1968, 94(2): 185-192. DOI:10.1093/jn/94.2.185 |
| [25] |
赵圣国, 王加启, 刘开朗, 等. 宏基因组学方法分析奶牛瘤胃尿素分解菌的多样性[J]. 中国农业大学学报, 2010, 15(1): 55-61. |
| [26] |
赵圣国, 王加启, 刘开朗, 等. 荷斯坦奶牛瘤胃微生物脲酶的分离与鉴定[J]. 畜牧兽医学报, 2010, 41(6): 692-696. |
| [27] |
JIN D, ZHAO S G, ZHENG N, et al. Differences in ureolytic bacterial composition between the rumen digesta and rumen wall based on ureC gene classification[J]. Frontiers in Microbiology, 2017, 8: 385. |
| [28] |
SMITH C J, HESPELL R B, BRYANT M P. Regulation of urease and ammonia assimilatory enzymes in Selenomonas ruminantium[J]. Applied and Environmental Microbiology, 1981, 42(1): 89-96. |
| [29] |
JOHN A, ISAACSON H R, BRYANT M P. Isolation and characteristics of a ureolytic strain of Selenomonas ruminantium[J]. Journal of Dairy Science, 1974, 57(9): 1003-1014. DOI:10.3168/jds.S0022-0302(74)85001-0 |
| [30] |
VAN WYK L, STEYN P L. Ureolytic bacteria in sheep rumen[J]. Journal of General Microbiology, 1975, 91(2): 225-232. DOI:10.1099/00221287-91-2-225 |
| [31] |
COOK A R. The elimination of urease activity in Streptococcus faecium as evidence for plasmid-coded urease[J]. Journal of General Microbiology, 1976, 92(1): 49-58. DOI:10.1099/00221287-92-1-49 |
| [32] |
LAUKOVÁ A, KONIAROVÁ I. Survey of urease activity in ruminal bacteria isolated from domestic and wild ruminants[J]. Microbios, 1995, 84(338): 7-11. |
| [33] |
KIM J N, HENRIKSEN E D, CANN I K O, et al. Nitrogen utilization and metabolism in Ruminococcus albus 8[J]. Applied and Environmental Microbiology, 2014, 80(10): 3095-3102. DOI:10.1128/AEM.00029-14 |
| [34] |
JIN D, ZHAO S G, WANG P P, et al. Insights into abundant rumen ureolytic bacterial community using rumen simulation system[J]. Frontiers in Microbiology, 2016, 7: 1006. |
| [35] |
ZHOU J W, LIU H, ZHONG C L, et al. Apparent digestibility, rumen fermentation, digestive enzymes and urinary purine derivatives in yaks and Qaidam cattle offered forage-concentrate diets differing in nitrogen concentration[J]. Livestock Science, 2018, 208: 14-21. DOI:10.1016/j.livsci.2017.11.020 |
| [36] |
ZHOU Z M, MENG Q X, LI S L, et al. Effect of urea-supplemented diets on the ruminal bacterial and archaeal community composition of finishing bulls[J]. Applied Microbiology and Biotechnology, 2017, 101(15): 6205-6216. DOI:10.1007/s00253-017-8323-4 |
| [37] |
YOUNG G M, AMID D, MILLER V L. A bifunctional urease enhances survival of pathogenic Yersinia enterocolitica and Morganella morganii at low pH[J]. Journal of Bacteriology, 1996, 178(22): 6487-6495. DOI:10.1128/JB.178.22.6487-6495.1996 |
| [38] |
MAHADEVAN S, SAUER F, ERFLE J D. Studies on bovine rumen bacterial urease[J]. Journal of Animal Science, 1976, 42(3): 745-753. |
| [39] |
SPEARS J W, HATFIELD E E. Nickel for ruminants Ⅰ.Influence of dietary nickel on ruminal urease activity[J]. Journal of Animal Science, 1978, 47(6): 1345-1350. |
| [40] |
BUNTING L D, BOLING J A, MACKOWN C T, et al. Effect of dietary protein level on nitrogen metabolism in the growing bovine:Ⅱ.Diffusion into and utilization of endogenous urea nitrogen in the rumen[J]. Journal of Animal Science, 1989, 67(3): 820-826. DOI:10.2527/jas1989.673820x |
| [41] |
MOHARRERY A, DAS T K. Correlation between microbial enzyme activities in the rumen fluid of sheep under different treatments[J]. Reproduction Nutrition Development, 2001, 41(6): 513-529. DOI:10.1051/rnd:2001106 |
| [42] |
WHITELAW F G, MILNE J S, WRIGHT S A. Urease (EC 3.5.1.5) inhibition in the sheep rumen and its effect on urea and nitrogen metabolism[J]. British Journal of Nutrition, 1991, 66(2): 209-225. DOI:10.1079/BJN19910026 |
| [43] |
LUDDEN P A, HARMON D L, HUNTINGTON G B, et al. Influence of the novel urease inhibitor N-(n-butyl) thiophosphoric triamide on ruminant nitrogen metabolism:Ⅱ.Ruminal nitrogen metabolism, diet digestibility, and nitrogen balance in lambs[J]. Journal of Animal Science, 2000, 78(1): 188-198. |
| [44] |
MAZZEI L, CIANCI M, CONTALDO U, et al. Urease inhibition in the presence of N-(n-butyl)thiophosphoric triamide, a suicide substrate:structure and kinetics[J]. Biochemistry, 2017, 56(40): 5391-5404. DOI:10.1021/acs.biochem.7b00750 |
| [45] |
KAFARSKI P, TALMA M. Recent advances in design of new urease inhibitors:a review[J]. Journal of Advanced Research, 2018, 13: 101-112. DOI:10.1016/j.jare.2018.01.007 |
| [46] |
POWELL J M, AGUERRE M J, WATTIAUX M A. Tannin extracts abate ammonia emissions from simulated dairy barn floors[J]. Journal of Environmental Quality, 2011, 40(3): 907-914. |
| [47] |
CARRASCO J M D, CABRAL C, REDONDO L M, et al. Impact of chestnut and quebracho tannins on rumen microbiota of bovines[J]. BioMed Research International, 2017, 2017: 9610810. |
| [48] |
LIU S J, ZHANG Z Y, HAILEMARIAM S, et al. Biochanin a inhibits ruminal nitrogen-metabolizing bacteria and alleviates the decomposition of amino acids and urea in vitro[J]. Animals, 2020, 10(3): 368. DOI:10.3390/ani10030368 |
| [49] |
SIDHU K S, JONES E W, TILLMAN A D. Effect of urease immunity on growth, digestion and nitrogen metabolism in ruminant animals[J]. Journal of Animal Science, 1968, 27(6): 1703-1708. DOI:10.2527/jas1968.2761703x |
| [50] |
HARBERS L H, TILLMAN A D, VISEK W J, et al. Some effects of jackbean urease immunity in young calves[J]. Journal of Animal Science, 1965, 24(1): 102-104. |
| [51] |
MARINI J C, SIMPSON K W, GEROLD A, et al. The effect of immunization with jackbean urease on antibody response and nitrogen recycling in mature sheep[J]. Livestock Production Science, 2003, 81(2/3): 283-292. |
| [52] |
ZHAO S G, WANG J Q, ZHENG N, et al. Reducing microbial ureolytic activity in the rumen by immunization against urease therein[J]. BMC Veterinary Research, 2015, 11: 94. DOI:10.1186/s12917-015-0409-6 |




