三七[Panax notoginseng (Burk.) f. H. Chen]是五加科(Araliaceeae)人参属(Panax)的多年生草本植物。早在《本草纲目》中就有记载:此药气味温,甘微苦,乃阳时,厥阴血分之药,能够止血、散血、定痛。三七是一种生态幅窄的亚热带高山药用植物,对环境条件要求比较苛刻,我国三七产区分布在海拔400~1 800 m,北纬23°~24°、东经104°~107°区域,主产地为云南省文山,产量占全国总产量的95%以上[1-2]。现代医学研究发现,皂苷类是三七中的主要有效成分之一,具有抗病毒、增强免疫力、抗炎、抗氧化、促进血液循环等生物活性,具有很高的研究应用价值[3-5]。本文对三七皂苷及其单体的化学组分、动物体内代谢规律、生物活性、在畜禽生产中的研究现状做一综述,对其今后的研发方向做一展望,以期对三七皂苷在畜牧业中的研究和应用提供参考。
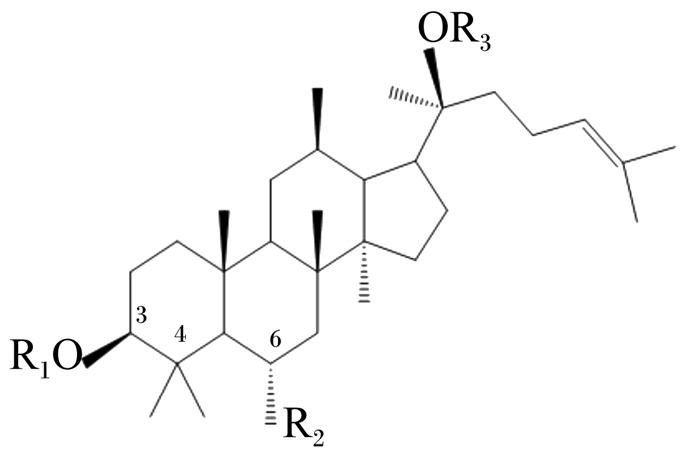
1 三七皂苷的化学组分 1.1 三七皂苷单体组分从三七中提取的皂苷类成分其实是三七总皂苷(Panax notoginseng saponins, PNS)。PNS是一类达玛烷型的四环三萜,其母核结构见图 1,通常按照C6位的羟基取代情况分为原人参二醇型(protopanaxadiol, PPD)和原人参三醇型(protopanaxatriol, PPT)。截止目前,已分离确定PPD组分55种,包括人参皂苷Rb1(ginsenoside Rb1,GSR1)、人参皂苷Rb2、三七皂苷Fa等;PPT组分37种,包括三七皂苷R1(notoginsenoside R1, SR1)、三七皂苷R2及人参皂苷Rg1(ginsenoside Rg1, GRg1)、人参皂苷Rg2等(表 1)[6-8]。其中GSR1、GRg1、SR1常见于三七皂苷单体生物活性研究。
|
图 1 PNS母核结构 Fig. 1 Nuclear structure of PNS |
|
|
表 1 PNS中部分皂苷单体汇总 Table 1 Summary of some saponin monomers in PNS |
研究PNS的代谢有助于探究其在动物体内的作用机制和治疗靶点,相较于其他植物提取物,PNS代谢途径较为清晰。目前已报道PNS体内代谢的次级苷73种,主要的代谢场所为肠道,代谢由肠道内的益生菌群完成[6]。Chao等[9]用超高效液相色谱串联四极杆飞行时间质谱联用(UPLC-Q-TOF-MS/MS)技术检测三七皂苷Fc灌胃SD大鼠血液中的代谢产物,只检测出次级苷成分,提示在体内PNS进入血液循环发挥药效前要进行脱糖链反应。次级代谢苷是该类中药发挥药效的物质基础。Ju等[10]用相同的方法检测三七皂苷Fc灌胃SD大鼠血液中的代谢产物,结果发现:在肠道细菌作用下,PNS的代谢发生葡萄糖醛酸化、脱糖、硫酸化、脱羟甲基化、支链丢失等。Yin等[11]总结了PNS在大鼠体内的代谢途径为PNS→人参皂苷F1→人参皂苷Rh2→人参皂苷CK→PPT,并指出PPD的代谢途径与之相似。肠道内的益生菌群在PNS的代谢中起着重要作用。PPD和PPT这2种类型的三七皂苷代谢产物入血液后,在C24和C25位点进一步发生氧化、侧链水合成环、葡萄糖醛酸化等Ⅰ相和Ⅱ相代谢。
2 三七皂苷的生物活性及作用机制 2.1 抗病毒活性 2.1.1 直接对病毒作用目前已有多项研究表明,PNS或三七皂苷单体具有抗病毒的作用。孙娜等[12]在感染猪繁殖与呼吸综合征病毒(PRRSV)的Marc-145细胞模型上,研究GSR1抑制PRRSV能力及其作用机制时发现:GSR1可以通过直接灭杀和阻断PRRSV复制达到抗病毒效果,对病毒抑制率为54.65%,阻断PRRSV复制率可达60.01%,表明GSR1阻断PRRSV的机制是抑制病毒N蛋白表达,从而阻断PRRSV的早中期复制。白景英等[13]用MTT法测定绞股蓝皂苷(GP)对鸭肝炎病毒(duck hepatitis A virus, DHAV)的体外抑制作用,GP对DHAV的抑制率为48.17%,而磷酸化绞股蓝皂苷(pGP)对DHAV的抑制率达到93.55%,这说明经过磷酸修饰的三七皂苷单体具有更显著的抗病毒活性。刘坤等[14]考察PNS对鸡新城疫强毒(F48E8)感染的单层鸡胚成纤维细胞(DF1)抗病毒能力时发现,PNS不但能够抑制F48E8感染DF1,而且能够减弱病毒的感染作用。以上研究结果阐明PNS及其单体均可作为抗病毒候选物。
2.1.2 作为免疫佐剂,提高免疫能力陈毓等[15]在研究从PNS分离出的组分S-3对小鼠体外T、B淋巴细胞的增殖作用时发现,S-3在浓度为10 μg/mL时极显著促进T淋巴细胞体外增殖,在浓度为25 μg/mL时促进T淋巴细胞中免疫因子白细胞介素-2(IL-2)分泌,这说明PNS及其分离出的单体成分具有促进免疫细胞增殖和促进免疫因子分泌的能力。苏菲等[16]将GRg1与重组大肠杆菌不耐热肠毒素(rLTB)联合滴鼻免疫小鼠,结果发现GRg1+rLTB能够促进小鼠体内中性粒细胞数量增加,显著提高血清和黏膜中模式抗原卵清白蛋白(OVA)的特异性抗体免疫球蛋白A(IgA)和免疫球蛋白G(IgG)水平。秦枫等[17]对PNS中分离的组分S-6进行了体外免疫活性检测,浓度为1 μg/mL的S-6显著促进小鼠脾脏淋巴细胞增殖,浓度为50 μg/mL的S-6极显著提高IL-2含量,说明PNS作为免疫佐剂,提高机体的免疫能力效果良好。
2.2 抵抗炎症作用炎症是机体为了抵御病原体而发生的必要的免疫应答反应。免疫因子的激活、释放标志着免疫应答的开始。但是过度的炎症反应对免疫反应器官或组织是有害的[18]。有研究证实,三七皂苷通过多种信号途径调节免疫因子的表达、释放,阻止炎症对机体的损害。Luo等[19]发现GRg1能够减弱脂多糖(LPS)诱导的细胞凋亡,降低Toll受体4(TLR4)、核转录因子-κB(NF-κB)和NOD样受体3(NLRP3)的基因表达,由此推断,GRg1是通过抑制TLR4/NF-κB/NLRP3信号通路中细胞因子表达来达到治疗炎症的效果。Ren等[20]通过研究小鼠血清中丙氨酸/天门冬氨酸氨基转移酶活性与肿瘤转化因子-α(TNF-α)、白细胞介素-1β(IL-1β)含量的变化规律,发现GSR1能够有效地保护由药物(对乙酰氨基酚)诱导的小鼠肝脏炎症反应,并提出GSR1是通过调控炎症反应信号通路丝裂原活化蛋白激酶(MAPK)、磷酸肌醇3酶(PI3K)、苏氨酸激酶(AKT)实现的。Shi等[21]探索GRg1治疗小鼠咪喹莫特诱导的皮炎时发现,GRg1可以明显降低皮炎发病区的细胞损害率,GRg1是通过下调炎症反应NF-κB信号通路中炎症因子的表达来实现治疗效果的。由此可见,三七皂苷类成分对于动物机体内各部分的炎症反应均有抑制作用。
2.3 调节氧化应激反应氧化应激是指体内氧化与抗氧化作用失衡的一种状态,即细胞内氧自由基的产生多于氧自由基的消除,是导致疾病和衰老的一个重要因素。体内的氧自由基可分为活性氧自由基(reactive oxygen species, ROS)和活性氮自由基(reactive nitrogen species, RNS),ROS包括羟自由基(·OH)和过氧化氢(H2O2)等;RNS包括一氧化氮(NO)、二氧化氮(NO2)等。机体存在2类可以消除氧自由基的抗氧化系统,一类是酶抗氧化系统,包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)等;另一类是非酶抗氧化系统,包括维生素C、维生素E以及微量元素铜、锌、硒等。多项研究证实三七皂苷具有调节动物体内氧化应激反应的作用。Bi等[22]发现先加入GRg1的仔鸡脾脏淋巴细胞再用过氧化氢诱导氧化应激反应时,细胞凋亡受到明显抑制。GRg1降低了过氧化氢诱导的氧化应激反应依赖标志物数量,如线粒体膜蛋白和反向钙离子流动等。此外,GRg1还促进禽类323个基因的表达以阻止细胞凋亡。Bi等[23]在研究GRg1对环磷酰胺(CY)诱导的鸡法氏囊病(IBD)的氧化应激反应时发现,口服GRg1增强了特异抗体干扰素-γ(IFN-γ)、白细胞介素-6(IL-6)表达,提高SOD、CAT、GSH-Px等抗氧化酶活性,最终降低CY对IBD的免疫抑制。由上可见,三七皂苷是理想的清除ROS,避免动物饲养中出现氧化应激的物质。
2.4 调节体内血液循环动物体内的血液循环是进行一切生命活动的保障。血液流动不畅会导致体内所需的各种营养物质无法循环,严重的导致组织器官坏死,甚至危及生命。血小板凝集是导致体内产生血栓等不利于血液循环的原因之一,三七皂苷对于防止血小板凝集,促进体内的血液循环有显著作用。Son等[24]研究人参皂苷Rp4(GRp4)对血小板凝集的影响机制时发现:GRp4主要在2个阶段抑制二磷酸腺苷(ADP)诱导的血小板凝集,第1个阶段是血小板被激活发生凝集的初始阶段,GRp4通过降低钙离子和P-选择素的浓度影响了MAPK、PI3K和AKT的磷酸化,以上三者的磷酸化是ADP结合G偶联受体(GPCR)的信号,因此GRp4阻止ADP与GPCR的识别结合;第2个阶段是在血小板整合蛋白(αⅡbβ3)与多种配体蛋白的结合时期,因为αⅡbβ3与配体结合后,会激活血小板使其发生凝集,而GRp4优先占据αⅡbβ3与配体的识别区域,从而抑制其与配体的结合。Ban等[25]发现人参皂苷Rg3(GRg3)不仅能阻止血栓的形成,还能增强血液流动性。Yang等[26]通过研究三七皂苷Rb1(notoginsenoside Rb1, NRb1)对于小鼠神经系统缺血性保护机制时发现:NRb1能够显著降低脑衍生营养因子前体(proBDNF)等蛋白的表达水平,能够增加血栓形成小鼠的活动能力,这主要是通过激活脑衍生营养因子(mBDNF)表达来实现的。
2.5 抗癌作用目前,三七皂苷提取物对多种癌症有抑制作用,其主要机制有:诱导癌细胞的凋亡,抑制癌细胞的增殖,抑制癌细胞的浸润转移,调节抗药基因表达。氧化应激反应和线粒体破坏标志着癌细胞凋亡。Gao等[27]发现人参皂苷20(S)-Rh2对多种癌细胞均有抑制作用。它的修饰物是经2-脱氧葡萄糖化的2-Deoxy-Rh2,它可以促进ROS产生,破坏线粒体膜蛋白,阻止葡萄糖对ATP结合能力。Li等[28]研究GRg3对肉骨瘤抑制作用时发现,GRg3抑制癌细胞的增殖。这种现象主要是通过减少Bcl2蛋白表达,影响PI3K-AKT-哺乳动物雷帕霉素靶蛋白(mTOR)信号通路起作用。Lyu等[29]通过研究人参皂苷Rh1对结肠癌细胞SW620的抑制作用发现,当人参皂苷Rh1浓度达到100 μmol/L时,能够有效地在体外抑制癌细胞的浸润转移。
3 三七皂苷在畜牧生产中的应用无论是PNS还是三七皂苷单体都展现出抗病毒、增强动物免疫力、抗炎、抗饲喂中产生的氧化应激、促进血液循环等生物活性。根据农业农村部公告第194号规定,2020年7月1日起,饲料生产企业停止生产含有促生长类药物饲料添加剂(中药类除外)的商品饲料。在我国动物源性食品安全和公共卫生安全越来越受到人们重视的情况下,具有多种生物活性的三七皂苷在饲料及饲料添加剂方面的应用前景十分广阔。
3.1 作为佐剂,增强免疫效果对于PNS的免疫佐剂活性,国内外已有不少报道。汪伟等[30]研究GSR1对猪圆环病毒2型(PCV2)的免疫增强效果时发现,将GSR1与疫苗混合使用后,产生特异性抗体时间早于对照组,且抗体效价远高于不添加GSR1组;同时,攻毒28 d后,未添加GSR1组血清中病毒载量较不添加GSR1组高得多,说明GSR1不但增强了细胞的免疫能力,还抑制了PCV2的复制。Babar[31]发现人参皂苷与硒联用可以增强疫苗对猪伪狂犬病(pseudorabies,Pr)的免疫效果,PNS不仅能够显著提高自然杀伤(NK)细胞的杀伤活性和IFN-γ的分泌水平,而且能够增强淋巴细胞增殖和细胞因子分泌水平。Zhai等[32]通过研究PNS对鸡IBD疫苗的免疫效果证实,PNS强化了鸡的体液免疫和消化道免疫水平,作为免疫佐剂提高了鸡对IBD疫苗的接种效果。Hu等[3]通过研究PNS及其单体SR1对感染PRRSV仔猪的治疗效果发现,PNS或SR1能够降低PRRSV的发病率或减轻由其引起的免疫系统被破坏的症状,如体温升高、体重降低、体内出现炎症等,表明三七皂苷类可以增强动物机体的免疫能力。Yu等[33]先用CY诱发仔鸡对鸡新城疫及禽流感疫苗的免疫抑制,再给免疫抑制仔鸡口服三七茎叶提取的皂苷,发现仔鸡的脾细胞增殖,免疫应答因子IgA和肠道上皮淋巴细胞含量均升高,说明三七皂苷能够显著改善免疫应答的效果。
3.2 抵抗炎症炎症反应是机体对致炎因素的自然反应。三七皂苷对牲畜抵抗炎症有积极作用。王越珉[34]在GRg1治疗LPS诱导的山羊大肠杆菌内毒素性乳房炎的治疗作用时发现,GRg1可干扰LPS与单核细胞的结合,通过下调TLR4-NF-κB信号通路来抑制炎性细胞因子表达,最终降低母羊体温,使泌乳量得以恢复。此外,GRg1不但能够促进3D4/2猪肺泡巨噬细胞的增殖和吞噬功能,还能恢复免疫抑制下的细胞增殖活力和吞噬活性的降低[35]。孙息涛[36]通过解剖发现,PNS对鸡在饲养中所患的腺肌胃炎有防治效果,长期饲喂有养胃的作用,可以增加体重。
3.3 调节动物的氧化应激水平在现代集约化养殖中,养殖动物容易受到温度、饲喂水、饲粮、传染性疾病等多种因素导致的氧化应激[37]。三七皂苷已被证实具有良好的降低氧化应激水平的作用。毕师诚等[38-39]发现,对于CY诱导的免疫抑制,口服GRg1可以直接保护鸡肠道黏膜免受IBD的感染。过氧化氢诱导淋巴细胞氧化应激后,90 μg/mL GRg1能够显著降低细胞ROS水平,降低细胞凋亡和缓解细胞内钙离子(Ca2+)过载。
3.4 对养殖动物的其他作用有研究发现,PNS对动物养殖还具有更广泛的作用。宋玉琴[40]将含有GRg1、人参皂苷Rb、人参皂苷Re的药渣按照0.53%饲喂家兔,兔肉中氨基酸、蛋白质、钙、锌含量上升,说明三七皂苷类成分饲喂家兔可以改善家兔肉质。金远铭[41]在黄牛饲粮中添加1%的人参提取物改善了牛胃中微生物对氮源物质的利用,提高了蛋白质合成效率,进而改善了瘤胃发酵;而且饲喂人参皂苷可以提高牛肉的氨基酸含量,提升牛肉品质。
4 小结在饲料和饲料添加剂全面禁药和全国兽用抗菌药减量化行动的大前提下,寻找能够代替抗菌药物的成分迫在眉睫。三七皂苷是从三七中分离得到的有效成分之一,已在多项研究中证实其在畜牧养殖有可以替代药物甚至作为营养型饲料和饲料添加剂的潜力。但是其单体成分较多,目前仍然有新的单体被分离出的报道,这对分离纯化技术提出了新要求,同时由于其作用机制还不十分明确,对进一步的应用研究是一个障碍。在今后的研究中应当注重三七皂苷作用机制的研究,并在畜牧业规模化养殖中制订具体的饲喂标准,充分开发其应用潜力。
| [1] |
张丹, 冯丽颖, 高立志. 三七生物资源研究与利用进展[J]. 生物资源, 2020, 42(1): 61-66. |
| [2] |
阙祖亮, 庞丹清, 陈勇, 等. 三七的种植及采收加工现状[J]. 江苏农业科学, 2020, 48(4): 41-45. |
| [3] |
HU Y Y, ZHANG B C, WANG W, et al. Therapeutic effects of saponin components on porcine reproductive and respiratory syndrome virus-infected piglets[J]. Journal of Animal Physiology and Animal Nutrition, 2020, 3(2): 637-644. |
| [4] |
GUO W Q, CHEN Y G, SHI R Z, et al. 20(S)-protopanaxdiol suppresses the abnormal granule-monocyte differentiation of hematopoietic stem cells in 4T1 breast cancer-bearing mouse[J]. Evidence-Based Complementary and Alternative Medicine, 2020, 2020: 8747023. |
| [5] |
LIANG W X, WANG S H, YAO L, et al. Quality evaluation of Panax ginseng adventitious roots based on ginsenoside constituents, functional genes, and ferric-reducing antioxidant power[J]. Journal of Food Biochemistry, 2019, 43(8): e12901. |
| [6] |
项昌培, 周瑞, 张毅, 等. 三七中皂苷类成分及其抗脑缺血分子机制研究进展[J]. 中国中药杂志, 2020(3): 1-11. |
| [7] |
YANG C K, XIONG J, SHEN Y. Two new dammarane-type triterpenoids from the stems and leaves of Panax notoginseng[J]. Journal of Asian Natural Products Research, 2020. DOI:10.1080/10286020.2020.1731801 |
| [8] |
LIU H, YANG J Q, YANG W Q, et al. Focus on notoginsenoside R1 in metabolism and prevention against human diseases[J]. Drug Design, Development and Therapy, 2020, 14: 551-565. DOI:10.2147/DDDT.S240511 |
| [9] |
MA C, GUAN H D, JU Z C, et al. Identification and characterization of forced degradation products and stability-indicating assay for notoginsenosidefc by using UHPLC-Q-TOF-MS and UHPLC-MS/MS:insights into stability profile and degradation pathways[J]. Journal of Separation Science, 2019, 48(2): 1550-1563. |
| [10] |
JU Z C, LI J, LU Q, et al. Identification and quantitative investigation of the effects of intestinal microflora on the metabolism and pharmacokinetics of notoginsenoside Fc assayed by liquid chromatography with electrospray ionization tandem mass spectrometry[J]. Journal of Separation Science, 2019, 42(2): 1740-1749. |
| [11] |
GUO Y P, CHEN M Y, SHAO L, et al. Quantification of Panax notoginseng saponins metabolites in rat plasma with in vivo gut microbiota-mediated biotransformation by HPLC-MS/MS[J]. Chinese Journal of Natural Medicines, 2019, 17(3): 231-240. DOI:10.1016/S1875-5364(19)30026-3 |
| [12] |
孙娜, 杨慧, 赵昕, 等. 人参皂苷Rb1对PRRSV的体外抑制作用及对病毒N蛋白表达的影响[J]. 中国兽医杂志, 2018, 54(11): 30-34. |
| [13] |
白景英, 韩开顺, 杜红旭, 等. 绞股蓝皂苷及其磷酸化修饰物体外抗DHAV作用的比较[J]. 中国兽医学报, 2018, 38(5): 978-985. |
| [14] |
刘坤, 邹海涛, 李燕荣, 等. 中药成分对新城疫强毒感染DF1能力的影响[J]. 中国兽医杂志, 2014, 50(8): 59-61. |
| [15] |
陈毓, 秦枫, 朱善元, 等. 三七总皂苷粗提物S-3溶血性及体外免疫活性的研究[J]. 扬州大学学报(农业与生命科学版), 2019, 40(4): 84-88. |
| [16] |
苏菲, 薛银, 李军星, 等. 人参皂苷Rg1联合重组大肠杆菌不耐热肠毒素rLTB作为滴鼻免疫佐剂在小鼠体内的作用研究[J]. 中国预防兽医学报, 2019, 41(7): 734-739. |
| [17] |
秦枫, 朱善元, 成大荣, 等. 三七皂苷S-6的溶血性及体外免疫活性研究[J]. 中国动物传染病学报, 2017, 25(4): 45-49. |
| [18] |
李鑫波, 谢晓丽. 中药皂苷类成分抗炎作用的研究进展[J]. 中药新药与临床药理, 2019, 30(8): 1008-1016. |
| [19] |
LUO M, YAN D S, SUN Q S, et al. Ginsenoside Rg1 attenuates cardiomyocyte apoptosis and inflammation via the TLR4/NF-kB/NLRP3 pathway[J]. Journal of Cellular Biochemistry, 2020, 121(4): 2994-3004. DOI:10.1002/jcb.29556 |
| [20] |
REN S, LENG J, XU X Y, et al. Ginsenoside Rb1, a major saponin from Panax ginseng, exerts protective effects against acetaminophen-induced hepatotoxicity in mice[J]. The American Journal of Chinese Medicine, 2019, 47(8): 1815-1831. DOI:10.1142/S0192415X19500927 |
| [21] |
SHI Q, HE Q, CHEN W M, et al. Ginsenoside Rg1 abolish imiquimod-induced psoriasis-like dermatitis in BALB/c mice via downregulating NF-κB signaling pathway[J]. Journal of Food Biochemistry, 2019, 43(11): e13032. |
| [22] |
BI S C, MA X D, WANG Y M, et al. Protective effect of ginsenoside Rg1 on oxidative damage induced by hydrogen peroxide in chicken splenic lymphocytes[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 8465030. |
| [23] |
BI S, CHI X, ZHANG Y, et al. Ginsenoside Rg1 enhanced immune responses to infectious bursal disease vaccine in chickens with oxidative stress induced by cyclophosphamide[J]. Poultry Science, 2018, 97(8): 2698-2707. DOI:10.3382/ps/pey132 |
| [24] |
SON Y M, JEONG D H, PARK H J, et al. The inhibitory activity of ginsenoside Rp4 in adenosine diphosphate-induced platelet aggregation[J]. Journal of Ginseng Research, 2017, 41(1): 96-102. DOI:10.1016/j.jgr.2016.01.003 |
| [25] |
BAN Y H, CHA Y, CHOI J, et al. Blood flow-improving activity of methyl jasmonate-treated adventitious roots of mountain ginseng[J]. Laboratory Animal Research, 2017, 33(2): 105-113. |
| [26] |
YANG C Y, YANG J Y, XIONG Y X, et al. Panax notoginsenoside Rb1 restores the neurotrophic imbalance following photothrombotic stroke in rats[J]. Neurotoxicity Research, 2019, 36(3): 441-451. DOI:10.1007/s12640-019-00058-2 |
| [27] |
GAO H, LIANG D, LI C C, et al. 2-Deoxy-Rh2:a novel ginsenoside derivative, as dual-targeting anti-cancer agent via regulating apoptosis and glycolysis[J]. Biomedicine & Pharmacotherapy, 2020, 124: 109891. |
| [28] |
LI Y, LU J Y, BAI F R, et al. Ginsenoside Rg3 suppresses proliferation and induces apoptosis in human osteosarcoma[J]. BioMed Research International, 2018, 2018: 4306579. |
| [29] |
LYU X, XU X D, SONG A L, et al. Ginsenoside Rh1 inhibits colorectal cancer cell migration and invasion in vitro and tumor growth in vivo[J]. Oncology Letters, 2019, 18(4): 4160-4166. |
| [30] |
汪伟, 何孔旺, 温立斌, 等. 人参皂苷Rb1对猪圆环病毒2型疫苗免疫的增强效果[J]. 江苏农业科学, 2018, 46(21): 180-182. |
| [31] |
MAQBOOL B.人参茎叶皂苷联合硒对伪狂犬疫苗免疫增强作用的研究[D].博士学位论文.杭州: 浙江大学, 2019: 80-102.
|
| [32] |
ZHAI L, WANG Y, YU J, et al. Enhanced immune responses of chickens to oral vaccination against infectious bursal disease by ginseng stem-leaf saponins[J]. Poultry Science, 2014, 93(10): 2473-2481. DOI:10.3382/ps.2014-04056 |
| [33] |
YU J, SHI F S, HU S. Improved immune responses to a bivalent vaccine of Newcastle disease and avian influenza in chickens by ginseng stem-leaf saponins[J]. Veterinary Immunology and Immunopathology, 2015, 167(3/4): 147-155. |
| [34] |
王越珉.人参皂苷Rg1对LPS诱导奶山羊乳房炎的治疗作用及机理研究[D].博士学位论文.杭州: 浙江大学, 2019: 54-108.
|
| [35] |
潘英芳.锌、硒和中草药提取物对3D4/2猪肺泡巨噬细胞功能的影响[D].硕士学位论文.太原: 山西农业大学, 2015: 33-72.
|
| [36] |
孙息涛. 人参皂苷对腺肌胃炎的作用[J]. 北方牧业, 2020(4): 25-26. |
| [37] |
ARUN K, PAND A, GITA C. Role of vitamin E in counteracting oxidative stress in poultry[J]. The Journal of Poultry Science, 2014(51): 109-117. |
| [38] |
毕师诚, 马晓丹, 吴烨, 等. 口服人参皂苷Rg1提高鸡的肠道黏膜免疫[J]. 中国兽医学报, 2019, 39(11): 2215-2221. |
| [39] |
毕师诚.人参皂苷Rg1提高氧化应激鸡对传染性法氏囊病疫苗的免疫应答的研究[D].博士学位论文.杭州: 浙江大学, 2019: 44-95.
|
| [40] |
宋玉琴.人参药渣添加到动物饲料调节动物抵抗力和肉质的实验研究[D].硕士学位论文.成都: 成都中医药大学, 2016: 19-26.
|
| [41] |
金远铭.不同处理的人参副产物对延边黄牛生产性能的影响[D].硕士学位论文.延吉: 延边大学, 2019: 20-63.
|



