2. 广东省脂类科学与应用工程技术研究中心, 广州 510006;
3. 中国农业大学农业部饲料工业中心, 北京 100193
2. Guangdong Provincial Research Center for Lipid Science and Applied Engineering Technology, Guangzhou 510006, China;
3. Ministry of Agriculture Feed Industry Centre, China Agricultural University, Beijing 100193, China
近年来,抗生素广泛应用于畜牧业来预防动物疾病和提高生产性能,使用抗生素是发展集约型、规模化生产的有效途径。但由于抗生素的过度使用,出现严重的药物依赖性,导致细菌产生耐药性和抗生素残留,严重威胁人类和动物的健康。因此,新型抗生素替代品的研究是近年来的研究热点,开发绿色、高效、安全的抗生素替代品是我国乃至全球畜牧业发展的首要任务。三丁酸甘油酯(tributyrin, TB)是丁酸和甘油的酯化产物,半衰期长,安全无毒副作用,可以被动物肠道中的胰脂肪酶分解产生3分子丁酸和1分子甘油,然后被血液运输至机体各组织器官发挥作用。饲粮添加TB可以改善动物的生长性能,促进动物肠道发育,提高动物的免疫力,保障动物机体的健康[1-3]。本文就TB的理化性质、代谢途径、生理功能、作用机制及在动物生产中的应用进行综述,旨在为TB作为新型饲料添加剂对动物肠道健康的调控及在动物生产中的研究提供理论参考。
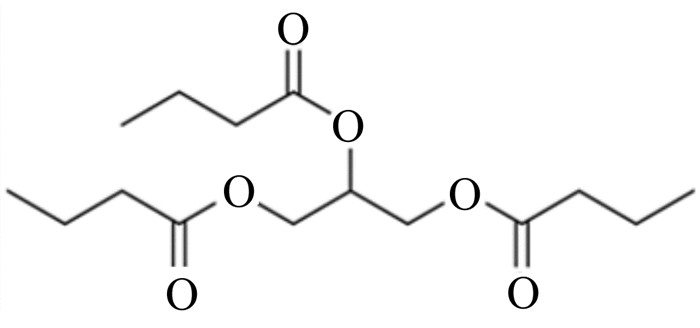
1 TB的特性及代谢途径 1.1 TB的理化特性TB,又名甘油三丁酸酯,是3分子丁酸和1分子甘油酯化后的产物,是典型的丁酸衍生物,属于短链脂肪酸酯,分子式为C15H26O6,相对分子质量为302.36,分子结构式见图 1。TB一般情况下为无色的油状液体,略有脂肪香气,味微苦,极难溶于水,易溶于乙醇、氯仿和乙醚等有机溶剂,熔点为-75 ℃,沸点为305~310 ℃,故其理化性质相对稳定。
|
图 1 TB的分子结构 Fig. 1 Molecular structure of TB |
TB作为脂类的一种,其代谢途径和脂类的代谢吸收机制密切相关。在动物机体内脂类的消化过程中,脂肪酶对甘油三酯活性最强,其次是甘油二酯,对单甘油酯尤其是2-单甘酯的活性最弱。而在脂肪吸收过程中,单甘油酯途径起主导作用,并且2-单甘酯是主要吸收途径,这是因为胰脂肪酶特异水解甘油三酯的1、3位酯键,生成2-单甘酯及游离脂肪酸[4]。1-单甘酯和2-单甘酯均能被肠道上皮细胞完整吸收并进入淋巴,部分进入血液,发挥相应的作用。微粒体中存在使单甘酯进一步酯化为甘油三酯的酶,这种酶优先利用2-单甘酯[5]。
TB是典型的短链脂肪酸衍生物。因动物口腔和胃部脂肪酶含量很少,且TB不易被胃酸分解,故TB的消化吸收主要在肠道中进行,经肠道胰脂肪酶和后肠微生物的作用,逐步缓释分解为甘油、丁酸和极少量单丁酸甘油酯[6]。产生的甘油可透过细胞膜进入胞内参与机体代谢,丁酸的吸收转运主要有2个途径:一是为肠道细胞提供能量。肠道优先选择丁酸来提供能量,丁酸进入细胞后经β-氧化作用分解为乙酰辅酶A,进入三羧酸循环为机体供能,或在肝脏中生成酮体,氧化酮体为肝外组织供能[7]。二是进入体内合成甘油三酯。当机体不再需要脂肪酸供能时,丁酸、甘油和单丁酸甘油酯再合成甘油三酯储存在脂肪细胞中。
2 TB的生理功能及作用机制 2.1 供能作用丁酸是肠道细胞重要的营养素,结肠细胞的首要能源物质是丁酸。TB通过肠道胰脂肪酶的分解作用产生丁酸,为肠黏膜细胞提供能量,可为肠道提供的能量高达75%[7]。研究发现,肠黏膜细胞的主要能量来源不是葡萄糖,而是以丁酸为主的短链脂肪酸或者谷氨酰胺、谷氨酸为主的氨基酸。前肠优先利用葡萄糖或者谷氨酰胺,而结肠首先利用丁酸,当能量不足时造成黏膜损伤甚至坏死,严重影响动物的健康[8-10]。为动物补充丁酸,可以缓解肠道能量不足造成的损伤,TB是一种性价比较高的肠道丁酸补充剂。
TB对肠道能量的调控主要是通过分解产生的丁酸来完成的。丁酸可为正常肠上皮细胞提供约70%的能量,低浓度的丁酸能够促进肠上皮细胞的增殖和生长,高浓度的丁酸可作为组蛋白乙酰酶抑制剂(histone deacetylase inhibitor,HDACi)抑制细胞增殖并促进凋亡[11]。丁酸还可在肿瘤细胞的细胞核中积累,作为HDACi抑制肿瘤细胞的增殖并诱导凋亡,这种丁酸浓度不同、细胞类型不同,其作用机制、效应不同的现象称为丁酸悖论[12]。
2.2 调控肠道屏障功能肠道是动物对营养物质消化、吸收和代谢的主要场所,也是机体抵御外界病原物质的重要屏障,肠道完整性在肠道内环境稳定中起着重要的作用。Piva等[13]研究发现,饲粮中添加TB和乳酸醇能显著增加仔猪的空肠绒毛高度和厚度,显著降低盲肠的隐窝深度,改善仔猪的肠道形态,提高营养的消化吸收,缓解仔猪的断奶应激。Dong等[14]在宫内发育迟缓(intrauterine growth restriction, IUGR)仔猪饲粮中添加TB可显著提高IUGR仔猪的肠道绒毛高度、绒毛高度/隐窝深度(V/C)值、黏膜厚度和绒毛表面积,小肠绒毛完整且发育良好,提高肠道消化酶活性。这说明TB可以提高IUGR仔猪的肠道发育,提高肠道消化酶活性,提高肠道机械屏障和化学屏障。Xiong等[15]运用脂多糖(lipopolysaccharide,LPS)攻毒肉鸡模型,结果表明添加TB能缓解LPS造成的肠道损伤,增加肠道二糖酶的活性,促进营养物质的消化吸收。Wang等[3]在氧化应激仔猪模型中研究发现,饲粮添加TB可以缓解断奶仔猪的氧化应激,显著降低血清二胺氧化酶(diamine oxidase, DAO)活性和D-乳酸的含量,显著增加紧密连接蛋白——闭合蛋白-1(claudin-1)、封闭蛋白(occludin)、紧密连接蛋白-1(ZO-1)的基因表达,提高断奶仔猪的肠道屏障功能。Gaudier等[16]研究表明,丁酸可以显著促进小鼠结肠黏膜黏蛋白(mucin, Muc)1、Muc2、Muc3、Muc4的表达,刺激Muc的分泌。而Muc能够阻止大分子物质进入上皮细胞层[17],增强机体的化学屏障能力。
综上所述,TB可作为肠黏膜上皮细胞的能源物质,促进胃肠道上皮细胞的增殖和成熟,改善动物肠道的形态结构,增加食物与肠道的接触面积,促进机体对营养物质的吸收能力。通过降低肠道通透性、促进肠道消化酶活性、促进Muc分泌及紧密连接蛋白的表达来加强动物的肠道屏障功能。
2.3 调节肠道菌群平衡肠道不仅是人类及动物对营养物质消化吸收的重要场所,也是机体最大的微生物库。肠道内栖息着庞大且复杂的各类细菌、真菌、酵母等微生物菌群,微生物的平衡及代谢产物对宿主的健康至关重要。宿主与微生物菌群共同维持着一个稳定的共生环境,健康的动物肠道菌群处于动态平衡状态,当外界环境的刺激打破这个动态平衡时,将会引发宿主产生疾病[18-19]。TB进入肠道后,通过胰脂肪酶的作用产生丁酸,丁酸可以降低消化道的酸性,进入细菌内分解产生氢离子(H+)和丁酸根离子,导致细胞内酸化,使大肠杆菌、沙门氏菌等不耐酸有害菌大量死亡,乳酸菌、双歧杆菌等耐酸有益菌大量增殖,维持动物肠道微生物的平衡。当肠道中的有益菌占优势时,可抑制有害菌在肠道内的定植,减少机体的消化道疾病[20]。研究表明,饲粮中添加TB可以显著增加仔猪肠道乳酸菌的数量,降低大肠杆菌、沙门氏菌的数量,缓解仔猪因断奶应激造成的腹泻[21-22]。Namkung等[23]体外研究发现,丁酸甘油酯对沙门氏菌和产气荚膜梭菌具有很好的抑制作用。Zhang等[1]对研究发现,在仔猪饲粮中添加牛至油和TB可显著增加粪便中乳酸菌的数量,相比对照组和抗生素组,添加水杨酸甲酯和TB可显著降低粪便中大肠杆菌的数量,其可作为一种潜在的抗生素替代品。
目前对于TB调节肠道微生物的机制尚不明确,笔者认为TB对肠道菌群的调节机制主要是通过胰脂肪酶在肠道中释放丁酸,且与丁酸释放H+有关:一方面通过降低肠道pH,酸性的肠道环境导致大肠杆菌、沙门氏菌等有害菌而死亡,乳酸菌等大量增殖,调节肠道菌群;另一方面,H+可通过扩散作用进入细胞内,降低细菌细胞内的pH,破坏细菌细胞膜,抑制细胞内某些大分子的代谢。此外,有机酸释放的阴离子可通过在细菌细胞内的积累,改变细胞内的渗透压,使细菌胞内糖酵解、核酸合成等反应受阻,导致细菌中毒,具有独特的杀菌功能[24-25]。
2.4 调节免疫功能TB对动物体的免疫系统具有一定的调节作用,参与机体免疫系统的调控。TB在肠道中分解产生丁酸可通过抑制活化核转录因子-κB(nuclear factor-kappa B, NF-κB)途径来起到抗炎作用,降低肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素(interleukin,IL)-1β、IL-2、IL-6、IL-8和IL-12等促炎细胞因子的基因表达[26]。Leonel等[27]对结肠炎小鼠模型研究发现,TB可以提高调节性T细胞(regulatory T cells,Treg)、转化生长因子-β(transforming growth factor-β,TGF-β)和IL-10的水平,并增加肠黏膜的嗜中性粒细胞和嗜酸性粒细胞的渗透,缓解结肠炎造成的肠道损伤,提高超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性。这表明TB可通过调节抗炎因子和Treg的表达来控制炎症和免疫应答反应,并提高抗氧化能力。Dong等[14]试验发现,饲粮中添加TB可以增加IUGR仔猪回肠分泌型免疫球蛋白A(secretory immunoglobulin A, sIgA)和免疫球蛋白G(immunoglobulin G, IgG)的含量,上调回肠IgG和G蛋白偶联受体(G-protein-coupled receptor,GPR)41的基因表达水平。由此可见,TB可通过激活GPR41的表达和提高黏膜免疫球蛋白的水平来增强IUGR仔猪的肠道发育和免疫功能。Wang等[3]通过对敌草快攻毒仔猪的研究发现,饲粮中添加TB可以降低肠道中TNF-α、干扰素-γ(interferon-γ,IFN-γ)、IL-6等促炎细胞因子的mRNA表达水平,降低线粒体中活性氧种类,增加线粒体膜电位、三磷酸腺苷(ATP)和线粒体自噬蛋白的表达。这表明TB可缓解仔猪的氧化应激和肠道炎症,可诱导线粒体自噬,改善线粒体功能。Li等[28]研究发现,TB可缓解LPS诱导肉鸡造成的肠道损伤,降低肠道中IL-1β、IL-6和前列腺素E2(prostaglandin E2, PGE2)的含量,降低肠道中丙二醛(malondialdehyde, MDA)的含量,调节小肠的炎症反应,缓解氧化应激反应。何进田[29]研究发现,TB降低肝脏TNF-α和IL-4的含量,降低肝脏MDA含量,提高肝脏抗氧化酶活力和线粒体功能,缓解IUGR的仔猪肝脏损伤,提高IUGR仔猪的抗氧化能力。
综上所述,TB可通过不同的途径来改善动物机体的免疫功能,通过增强机体免疫物质的活性和Treg增殖、提高抗炎细胞因子表达、降低促炎细胞因子表达和提高抗氧化能力来增强动物机体的免疫力。
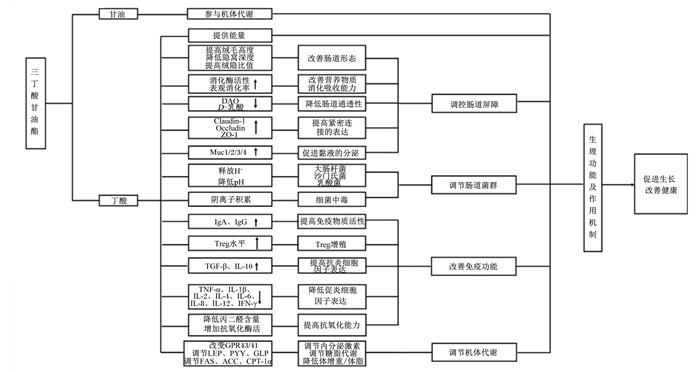
2.5 调节机体代谢大量研究表明,短链脂肪酸可通过刺激多种组织的激素和神经信号,对能量稳态和脂质代谢有重要作用,调节动物机体的代谢[30-31]。TB通过肠道胰脂肪酶的分解产生丁酸,参与机体的代谢健康调控。Lu等[32]研究表明,短链脂肪酸(含丁酸)导致小鼠GPR43和GPR41发生改变,增加机体对能量的消耗,提高葡萄糖耐受能力,降低体增重和体脂含量,抵抗高脂饲粮诱导的小鼠肥胖。短链脂肪酸可通过对GPR的调节来增加胃肠激素如瘦素(leptin, LEP)、酪酪肽(peptide tyrosine tyrosine, PYY)、胰高血糖素样肽(glucagon-like peptide, GLP)的表达,增加肌肉和脂肪对葡萄糖的吸收,增加胰岛素的分泌和减少胰高血糖素的产生,调节糖类和脂类代谢[33]。Jiao等[34]研究表明,短链脂肪酸可以降低断奶仔猪血清中甘油三酯、胆固醇、高密度脂蛋白和胰岛素含量,提高血清中LEP含量,降低脂肪酸合成相关的脂肪酸合成酶(fatty acid synthase, FAS)、乙酰辅酶A羧化酶(acetyl-CoA carboxylase, ACC)的mRNA表达,增加脂肪分解相关的肉毒碱棕榈酰转移酶1α(carnitine palmitoyltransferase-1α, CPT-1α)的mRNA表达水平,从而降低不同组织的脂质合成,降低机体的脂肪的沉积,通过调节内分泌激素、脂类代谢来减少断奶仔猪的脂肪沉积。总之,TB通过多种途径发挥着重要的生理功能(图 2),对促进动物生长、改善肠道、保障机体健康具有重要的作用。
|
DAO:二胺氧化酶diamine oxidase;Claudin-1:闭合蛋白-1;Occludin:封闭蛋白;ZO-1:紧密连接蛋白-1 zonula occludens-1;Muc:黏蛋白mucin;IgA:免疫球蛋白A immunoglobulin A;IgG:免疫球蛋白G immunoglobulin G;Treg:调节性T细胞regulatory T cells;TGF-β:转化生长因子-β transforming growth factor-β;IL:白细胞介素interleukin;TNF-α:肿瘤坏死因子-α tumor necrosis factor-α;IFN-γ:干扰素-γ interferon-γ;GPR:G蛋白偶联受体G-protein-coupled receptor;LEP:瘦素leptin;PYY:酪酪肽peptide tyrosine tyrosine;GLP:胰高血糖素样肽glucagon-like peptide;FAS:脂肪酸合成酶fatty acid synthase;ACC:乙酰辅酶A羧化酶acetyl-CoA carboxylase;CPT-1α:肉毒碱棕榈酰转移酶-1α carnitine palmitoyltransferase-1α。 图 2 TB的生理功能及作用机制 Fig. 2 Physiological function and mechanism of TB |
TB作为丁酸的前体物,是一种优良的丁酸补充剂,其理化性质稳定,安全无毒副作用,既解决了丁酸气味难闻易挥发的缺点,也解决了丁酸直接添加难以过胃入肠的问题,在动物营养领域具有广阔的应用前景。TB作为饲料添加剂可直接作用于动物的消化道,为动物肠道提供能量,改善动物的肠道健康,调节动物的生长性能和健康状况。
3.1 改善生长性能将TB添加到饲料中已广泛应用于各类动物生产中,在饲粮中添加适量的TB可提高试验动物的平均日增重、降低料重比,改善动物的生长性能,添加量在0.075%~0.250%,详见表 1。
|
|
表 1 饲粮中添加TB对不同动物生长性能的影响 Table 1 Effects of dietary TB on growth performance of different animals |
TB可通过改善肠道形态结构、调节肠道菌群平衡、提高肠道屏障和抗氧化能力对动物肠道的健康发挥积极的作用。研究发现,饲粮中添加TB能够增加肠道紧密连接蛋白表达[3]、促进肠道黏膜的发育[45]、提高饲料养分消化率[36]、增强抗氧化能力[28]、降低肠道有害菌含量并增加有益菌含量[21],促进动物肠道发育,改善动物的肠道健康。侯改凤等[36]研究表明,饲粮添加TB可显著提高断奶仔猪对粗蛋白质、粗脂肪和能量的表观消化率,而饲料养分消化率与动物肠道的健康状况紧密相关,可见TB促进肠道对营养物质的吸收和消化。Wang等[45]研究发现,添加TB可显著增加断奶仔猪肠道的绒毛高度和V/C值,降低空肠MDA和过氧化氢的含量,增强线粒体功能,缓解仔猪的氧化应激,促进肠道的发育。刘兵等[39]研究发现,添加微囊化TB可显著提高肉鸡十二指肠和空肠的绒毛高度,增加盲肠乳酸菌含量并降低大肠杆菌的含量,优化肉鸡的肠道菌群结构,并且微囊化TB的效果要优于液体TB。反刍动物由于瘤胃的特殊作用,目前关于TB对反刍动物影响的报道较少。Ren等[46]在山羊饲粮中添加TB结果发现,TB提高了干物质、粗蛋白质、中性洗涤纤维和酸性洗涤纤维的表观消化率,并且增强产甲烷作用,提高了瘤胃微生物氮的合成,对山羊的瘤胃微生物蛋白和瘤胃发酵具有积极的影响。Inabu等[47]研究发现,0.3%的TB代替乳脂可提高犊牛血浆中GLP-2的含量,可能会对改善犊牛的生长性能有一定的作用。Araujo等[48]对TB替代乳脂对犊牛代谢的研究发现,0.3%的TB可以调节犊牛体内的葡萄糖和胰岛素的血流动力学,但不会改变血浆中β-羟基丁酸(β-hydroxybutyric acid, BHBA)和GLP-1的含量,并且对犊牛的生长性能没有影响。Hou等[44]研究发现,添加TB能显著提高草鱼血清谷胱甘肽过氧化酶(glutathione peroxidase, GSH-Px)、胰蛋白酶和胃蛋白酶的活性,提高肠道的消化能力和抗氧化能力。TB作为肠道的能源物质,可以有效地改善和修复肠道形态结构,提高肠道的消化吸收能力,促进肠道有益菌的增殖,改善肠道的菌群结构,缓解动物的氧化应激反应,促进动物的肠道发育,保障机体的健康。
3.3 替代抗生素的使用目前国内外对于TB替代抗生素这方面的报道比较少。朱荣生等[2]在仔猪饲粮中添加杆菌肽锌和不同剂量TB的研究发现,添加量为1 000~1 500 mg/kg时可替代杆菌肽锌等抗生素的添加,并维持仔猪的生长性能、肠道组织形态和免疫功能;当添加量为2 000~2 500mg/kg时,不仅可替代抗生素的添加,而且显著改善仔猪的肠道形态、生长性能及免疫力,提升仔猪的健康水平。Zhang等[1]研究发现,在断奶仔猪饲粮中复配添加TB和牛至油或水杨酸甲酯可以提升肠道的V/C值,改善仔猪的肠道形态,显著提高厚壁菌门的丰度,降低变形菌门、防线杆菌属、埃希氏杆菌属等的丰度,改变了肠道菌群结构和代谢产物,有益于断奶仔猪的肠道健康,可以替代抗生素应用于断奶仔猪。Gu等[49]研究发现,饲粮中添加TB与添加抗生素对断奶仔猪有着相似的生长性能,并且TB与抗生素具有协同增效作用。TB还可通过调节炎症因子、回肠纤维母细胞生长因子19(fibroblast growth factor 19, FGE19)的表达和肠道乙酸的发酵,刺激LPS攻毒仔猪的食欲,缓解仔猪的肠道损伤和生长迟缓现象。抗生素可以改变动物的肠道菌群结构,长期的使用将会影响肠道内阴离子交换、丁酸转运受体及紧密连接蛋白的表达,从而影响动物的肠道健康,造成肠道损伤,添加TB可以缓解抗生素造成的肠道损伤[50],保障机体的肠道健康。然而,当前关于TB在替代抗生素方面的研究还比较少,更多的应用还有待进一步的研究。
4 小结总体来说,TB具有为机体提供能量、维持肠道完整性、调节肠道菌群结构、参与免疫和机体代谢反应等多种生物学功能,可以促进动物的肠道发育,改善动物的生长性能。TB可被肠道中胰脂肪酶分解产生丁酸和甘油,可作为动物肠道丁酸的有效来源,不仅解决丁酸因臭味且易挥发在饲料中难以添加的问题,还解决了丁酸难以过胃入肠的问题,是一种高效、安全、绿色的抗生素替代品。然而,当前对TB在动物营养中的应用研究相对较少,TB的添加量、添加时间、添加形式及与其他营养素的复配的研究相对缺乏,加强TB在动物生产中的应用,不仅可为动物保健和疾病预防提供新方法,而且在抗生素替代品的开发有极大的应用价值,具有广阔的应用前景。
| [1] |
ZHANG W X, ZHANG Y, ZHANG X W, et al. Effects of dietary supplementation with combination of tributyrin and essential oil on gut health and microbiota of weaned piglets[J]. Animals, 2020, 10(2): 180. DOI:10.3390/ani10020180 |
| [2] |
朱荣生, 徐伟, 王怀中, 等. 饲粮添加不同水平三丁酸甘油酯对断奶仔猪生长性能、血清生化指标、肠组织形态和养分消化率的影响[J]. 动物营养学报, 2020, 32(2): 664-673. |
| [3] |
WANG C C, CAO S T, ZHANG Q H, et al. Dietary tributyrin attenuates intestinal inflammation, enhances mitochondrial function, and induces mitophagy in piglets challenged with diquat[J]. Journal of Agricultural and Food Chemistry, 2019, 67(5): 1409-1417. DOI:10.1021/acs.jafc.8b06208 |
| [4] |
KAYDEN H J, SENIOR J R, MATTSON F H. The monoglyceride pathway of fat absorption in man[J]. Journal of Clinical Investigation, 1967, 46(11): 1695-1703. DOI:10.1172/JCI105660 |
| [5] |
BROWN J L, JOHNSTON J M. The utilization of 1-and 2-monoglycerides for intestinal triglceride biosynthesis[J]. Biochimica et Biophysica Acta:Specialized Section on Lipids and Related Subjects, 1964, 84(4): 448-457. |
| [6] |
JENSEN M S, JENSEN S K, JAKOBSEN K. Development of digestive enzymes in pigs with emphasis on lipolytic activity in the stomach and pancreas[J]. Journal of Animal Science, 1997, 75(2): 437-445. |
| [7] |
HAMER H M, JONKERS D, VENEMA K, et al. Review article:the role of butyrate on colonic function[J]. Alimentary Pharmacology and Therapeutics, 2008, 27(2): 104-119. |
| [8] |
TOMÉ D. The roles of dietary glutamate in the intestine[J]. Annals of Nutrition and Metabolism, 2018, 73(Suppl.5): 15-20. |
| [9] |
THIBAULT R, BLACHIER F, DARCY-VRILLON B, et al. Butyrate utilization by the colonic mucosa in inflammatory bowel diseases:a transport deficiency[J]. Inflammatory Bowel Diseases, 2010, 16(4): 684-695. DOI:10.1002/ibd.21108 |
| [10] |
TAN J, MCKENZIE C, POTAMITIS M, et al. The role of short-chain fatty acids in health and disease[J]. Advances in Immunology, 2014, 121: 91-119. DOI:10.1016/B978-0-12-800100-4.00003-9 |
| [11] |
LAZAROVA D L, BORDONARO M. Vimentin, colon cancer progression and resistance to butyrate and other HDACis[J]. Journal of Cellular and Molecular Medicine, 2016, 20(6): 989-993. DOI:10.1111/jcmm.12850 |
| [12] |
GONÇALVES P, MARTEL F. Butyrate and colorectal cancer:the role of butyrate transport[J]. Current Drug Metabolism, 2013, 14(9): 994-1008. DOI:10.2174/1389200211314090006 |
| [13] |
PIVA A, PRANDINI A, FIORENTINI L, et al. Tributyrin and lactitol synergistically enhanced the trophic status of the intestinal mucosa and reduced histamine levels in the gut of nursery pigs[J]. Journal of Animal Science, 2002, 80(3): 670-680. DOI:10.2527/2002.803670x |
| [14] |
DONG L, ZHONG X, HE J T, et al. Supplementation of tributyrin improves the growth and intestinal digestive and barrier functions in intrauterine growth-restricted piglets[J]. Clinical Nutrition, 2016, 35(2): 399-407. DOI:10.1016/j.clnu.2015.03.002 |
| [15] |
XIONG J, QIU H, BI Y, et al. Effects of dietary supplementation with tributyrin and coated sodium butyrate on intestinal morphology, disaccharidase activity and intramuscular fat of lipopolysaccharide-challenged broilers[J]. Brazilian Journal of Poultry Science, 2018, 20(4): 707-716. DOI:10.1590/1806-9061-2018-0787 |
| [16] |
GAUDIER E, RIVAL M, BUISINE M P, et al. Butyrate enemas upregulate Muc genes expression but decrease adherent mucus thickness in mice colon[J]. Physiological Research, 2009, 58(1): 111-119. |
| [17] |
HANSSON G C, JOHANSSON M E V. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria[J]. Gut Microbes, 2010, 1(1): 51-54. DOI:10.4161/gmic.1.1.10470 |
| [18] |
SÁNCHEZ-TAPIA M, TOVAR A R, TORRES N. Diet as regulator of gut microbiota and its role in health and disease[J]. Archives of Medical Research, 2019, 50(5): 259-268. DOI:10.1016/j.arcmed.2019.09.004 |
| [19] |
VON MARTELS J Z H, SADABAD M S, BOURGONJE A R, et al. The role of gut microbiota in health and disease:in vitro modeling of host-microbe interactions at the aerobe-anaerobe interphase of the human gut[J]. Anaerobe, 2017, 44: 3-12. DOI:10.1016/j.anaerobe.2017.01.001 |
| [20] |
SHEN T C D. Diet and gut microbiota in health and disease[J]. Nestle Nutrition Institute Workshop Series, 2017, 88: 117-126. |
| [21] |
刘兵, 马莲香, 侯川川, 等. 微囊化三丁酸甘油酯对仔猪生长性能、抗氧化能力及粪便菌群的影响[J]. 饲料研究, 2017(14): 18-22. |
| [22] |
王玥.三丁酸甘油酯对肉鸡生长效果及其安全性评价[D].硕士学位论文.杭州: 浙江大学, 2012.
|
| [23] |
NAMKUNG H, YU H, GONG J, et al. Antimicrobial activity of butyrate glycerides toward Salmonella Typhimurium and Clostridium perfringens[J]. Poultry Science, 2011, 90(10): 2217-2222. DOI:10.3382/ps.2011-01498 |
| [24] |
CANIBE N, MIKKELSEN L L, KNARREBORG A, et al.Organic acids and fermented liquid feed as alternatives to antibiotic growth promoters[C]//Beyond Antimicrobial Growth Promoters in Food Animal Production.Aarhus: Aarhus University, 2004: 135-142.
|
| [25] |
CANIBE N, ENGBERG R M, JENSEN B B.An overview of the effect of organic acids on gut flora and gut health[C]//Proceedings of the workshop: alternatives to feed antibiotics and coccidiostats in pigs and poultry.Oslo: Aarhus University, 2001: 5424-9974.
|
| [26] |
SOSSAI P. Butyric acid:what is the future for this old substance?[J]. Swiss Medical Weekly, 2012, 142: w13596. |
| [27] |
LEONEL A J, TEIXEIRA L G, OLIVEIRA R P, et al. Antioxidative and immunomodulatory effects of tributyrin supplementation on experimental colitis[J]. British Journal of Nutrition, 2013, 109(8): 1396-1407. DOI:10.1017/S000711451200342X |
| [28] |
LI J L, HOU Y Q, YI D, et al. Effects of tributyrin on intestinal energy status, antioxidative capacity and immune response to lipopolysaccharide challenge in broilers[J]. Asian-Australasian Journal of Animal Sciences, 2015, 28(12): 1784-1793. DOI:10.5713/ajas.15.0286 |
| [29] |
何进田.日粮添加三丁酸甘油酯对宫内发育迟缓哺乳仔猪肝脏功能及脂代谢的影响[D].硕士学位论文.南京: 南京农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10307-1017261605.htm
|
| [30] |
RÍOS-COVIÁN D, RUAS-MADIEDO P, MARGOLLES A, et al. Intestinal short chain fatty acids and their link with diet and human health[J]. Frontiers in Microbiology, 2016, 7: 185. |
| [31] |
GAO Z G, YIN J, ZHANG J, et al. Butyrate improves insulin sensitivity and increases energy expenditure in mice[J]. Diabetes, 2009, 58(7): 1509-1517. DOI:10.2337/db08-1637 |
| [32] |
LU Y Y, FAN C N, LI P, et al. Short chain fatty acids prevent high-fat-diet-induced obesity in mice by regulating g protein-coupled receptors and gut microbiota[J]. Scientific Report, 2016, 6: 37589. DOI:10.1038/srep37589 |
| [33] |
DEN BESTEN G, VAN EUNEN K, GROEN A K, et al. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism[J]. Journal of Lipid Research, 2013, 54(9): 2325-2340. DOI:10.1194/jlr.R036012 |
| [34] |
JIAO A R, DIAO H, YU B, et al. Oral administration of short chain fatty acids could attenuate fat deposition of pigs[J]. PLoS One, 2018, 13(5): e0196867. DOI:10.1371/journal.pone.0196867 |
| [35] |
杨玲. 三丁酸甘油酯对断奶仔猪生长性能、肠道结构和血液生化指标的影响[J]. 饲料工业, 2012, 增刊: 46-49. |
| [36] |
侯改凤, 李瑞, 枉侯军, 等. 三丁酸甘油酯对断奶仔猪生长性能及养分消化率的影响[J]. 养猪, 2014(5): 4-6. |
| [37] |
朱荣生, 王怀中, 齐波, 等. 饲粮添加三丁酸甘油酯和核苷酸对断奶仔猪生长性能、血清生化指标和肠组织形态的影响[J]. 动物营养学报, 2018, 30(2): 707-716. |
| [38] |
周建.三丁酸甘油酯在肉鸡饲料中的应用效果研究[D].硕士学位论文.武汉: 武汉轻工大学, 2015.
|
| [39] |
刘兵, 何俊娜, 郭阳, 等. 微囊化三丁酸甘油酯对肉鸡生长性能、肠道形态及菌群的影响[J]. 饲料研究, 2016(19): 18-22. |
| [40] |
乔丽红, 洑琴, 温超, 等. 三丁酸甘油酯对建鲤生长、体组成、肠道免疫功能的影响[J]. 江苏农业科学, 2014, 42(12): 275-278. |
| [41] |
翟秋玲, 张春晓, 孙云章, 等. 三丁酸甘油酯和甘露寡糖对菊黄东方鲀生长性能、体组成及肠道健康指标的影响[J]. 动物营养学报, 2014, 26(8): 2197-2208. |
| [42] |
唐启峰, 徐树德, 卢玉标, 等. 三丁酸甘油酯和包膜丁酸钠对南美白对虾生长性能和肠道微生物的影响[J]. 安徽农学通报, 2018, 24(2): 87-90. |
| [43] |
姜莺颖.三丁酸甘油酯对异育银鲫生长性能、抗病力的影响及其作用机理研究[D].硕士学位论文.上海: 上海海洋大学, 2019.
|
| [44] |
HOU Y B, HOU Y, YAO L, et al. Effects of chromium yeast, tributyrin and bile acid on growth performance, digestion and metabolism of Channa argus[J]. Aquaculture Research, 2019, 50(3): 836-846. DOI:10.1111/are.13954 |
| [45] |
WANG C C, CAO S T, SHEN Z J, et al. Effects of dietary tributyrin on intestinal mucosa development, mitochondrial function and AMPK-mTOR pathway in weaned pigs[J]. Journal of Animal Science and Biotechnology, 2019, 10: 93. DOI:10.1186/s40104-019-0394-x |
| [46] |
REN Q C, XUAN J J, WANG L K, et al. Effects of tributyrin supplementation on ruminal microbial protein yield, fermentation characteristics and nutrients degradability in adult Small Tail ewes[J]. Japanese Society of Animal Science, 2018, 89(9): 1271-1279. DOI:10.1111/asj.13033 |
| [47] |
INABU Y, MURAYAMA K, INOUCHI K, et al. The effect of tributyrin supplementation to milk replacer on plasma glucagon-like peptide 2 concentrations in pre-weaning calves[J]. Japanese Society of Animal Science, 2019, 90(9): 1185-1192. DOI:10.1111/asj.13262 |
| [48] |
ARAUJO G, TERRÉ M, MEREU A, et al. Effects of supplementing the milk replacer with tributyrin on the metabolism of Holstein calves[J]. Animal Production Science, 2014, 56(11): 1834-1841. |
| [49] |
GU Y, SONG Y, YIN H, et al. Dietary supplementation with tributyrin prevented weaned pigs from growth retardation and lethal infection via modulation of inflammatory cytokines production, ileal FGE19 expression, and intestinal acetate fermentation[J]. Journal of Animal Science, 2017, 95(1): 226-238. |
| [50] |
CRESCI G, NAGY L E, GANAPATHY V. Lactobacillus GG and tributyrin supplementation reduce antibiotic-induced intestinal injury[J]. Journal of Parenteral and Enteral Nutrition, 2013, 37(6): 763-774. DOI:10.1177/0148607113486809 |




