2. 石河子大学动物科技学院, 石河子 832000
2. College of Animal Science and Technology, Shihezi University, Shihezi 832000, China
热应激对乳品动物的健康有着直接和间接的影响,它可以扰乱动物的正常新陈代谢以及影响动物的生理、激素和免疫状态[1]。铬(Cr)是葡萄糖耐受因子(GTF)的活性成分,因此对维持碳水化合物和脂质的正常新陈代谢是必不可少的[2]。半胱胺(CS)是纯天然的生物活性物质,可以作为代谢调节剂,参与正常的代谢过程,具有调节内分泌、提高泌乳性能、缓解应激、抗氧化、增强免疫力、改善肠道微生物组成等生理功能[3-4]。研究表明,饲粮中添加铬改善了试验动物的日均采食量、繁殖性能、免疫功能和生长性能[5-6]。家畜对铬的需要量尚未确定,但在应激条件下,由于尿液排泄增加,对铬的需要量增加[7]。有研究表明,热应激加剧了组织中铬的动员,也增加了铬的排泄,降低了铬的存留量[8],这可能导致铬需要量增加[9]。饲粮中添加半胱胺能促进动物机体对营养物质的吸收和利用,提高机体的消化代谢水平,加速蛋白质沉积,提高氮利用率[10]。在动物繁殖性能和生产性能方面的研究表明,半胱胺可促进妊娠大鼠乳腺发育[11],提高鸡的产蛋性能[12]及奶牛产奶量[13]。在夏季高温条件下,饲粮中添加半胱胺和铬,尤其是二者联合添加,对水牛生产的影响鲜有报道。因此,本试验在夏季给水牛补饲半胱胺和烟酸铬,研究半胱胺、烟酸铬对水牛生理指标、养分表观消化率、泌乳性能、抗氧化性能、瘤胃发酵参数和微生物多样性等的影响,旨在为水牛生产中半胱胺与烟酸铬的联合使用提供理论依据。
1 材料与方法 1.1 试验材料烟酸铬产品由西安某生物技术公司提供,烟酸铬含量≥1.65%,铬含量≥0.2%;半胱胺酸盐酸盐产品由上海某集团提供,主要成分为β环糊精、硝酸硫胺、烟酸、半胱胺盐酸盐、硫酸铜等,半胱胺盐酸盐含量≥27%。
1.2 试验设计选取体重[(615±21) kg]、胎次(3~5胎)和产奶量(5~6 kg)相近的健康泌乳中期尼里-拉菲奶水牛20头,采用单因素随机区组设计分为4组,每组5头。Ⅰ组:作为对照组,饲喂基础饲粮;Ⅱ组:基础饲粮+22.5 g/(d·头)半胱胺;Ⅲ组:基础饲粮+24 mg/(d·头)铬(烟酸铬形式,下同);Ⅳ组:基础饲粮+22.5 g/(d·头)半胱胺+24 mg/(d·头)铬。基础饲粮组成及营养水平见表 1。预试期2周,正试期4周。饲养试验在2019年7—8月开展,试验地点广西水牛研究所水牛种畜场位于亚热带季风气候区,气候特点是夏长冬短,高热天气持续时间长。试验期间水牛自由采食,充足饮水,日常管理按牛场规定程序正常进行。运动场建有遮阴棚和喷淋设施,牛舍内墙壁安装有风扇。每日06:00和14:00牛只固定在栏位挤奶,在挤奶前水牛进入池塘游泳30 min,随后回到栏位后由挤奶工人对水牛喷水清洁,其他时间牛只自由活动,每周二和周四在挤奶结束后分别于08:00和14:30检测水牛各项生理指标及环境参数。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
根据文献[14]所述,采用实用型水牛舒适气候条件模型[实用型水牛舒适气候条件指数(BCCCIp)=0.057 1×RH+1.048 0×AT,式中RH为相对湿度,AT为空气温度]判断水牛所处生理状态。当BCCCIp≤34.65时水牛所处气候条件为舒适,BCCCIp在34.66~38.02范围内时水牛所处气候条件为轻度应激,BCCCIp在38.03~41.39范围内时水牛所处气候条件为中度应激,BCCCIp≥41.40时水牛所处气候条件为重度应激。根据图 1可知,试验期间BCCCIp均在37以上,水牛所处的气候条件为轻度和中度应激。
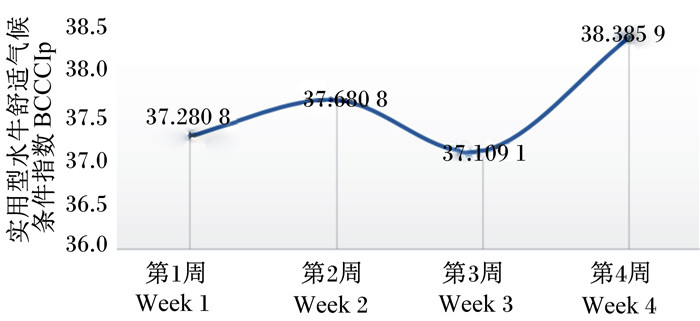
|
图 1 试验期间实用型水牛舒适气候条件指数 Fig. 1 BCCCIp during experiment period |
采用在线扬尘监测系统(深圳市格林福泽环境科技有限公司)实时记录气象数据,在08:00—09:00和14:30—15:30期间人工记录水牛舍环境参数,主要包括空气温度(AT,℃)和相对湿度(RH,%),间隔时间为30 min,仪器安装高度与动物背部高度相近;检测水牛生理指标——直肠温度(RT,℃)、体表温度(BST,℃)和呼吸频率(RR,次/min),在此期间,水牛集中在栏位。直肠温度采用动物直肠温度计检测,取短时最高温度作为直肠温度;体表温度采用动物红外测温仪检测,取额头、左胸、左腹3个部位的平均温度作为体表温度;呼吸频率采用人工计数方式,观察并记录2 min胸腹运动并取1 min的平均值作为呼吸频率。
1.3.2 采食量及养分表观消化率测定在正试期第4周连续3 d采集饲粮样并采用半收粪法采集粪样,同时记录每头水牛饲喂量和剩料量,计算干物质采食量(DMI)。饲粮和粪便样品于65 ℃烘干后粉碎过100目筛,采用常规分析方法[15]测定干物质(DM)、粗蛋白质(CP)、中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量。采用酸不溶灰分法计算养分表观消化率[16]。

|
试验期间记录每天每头水牛的产奶量,计算日均产奶量;在正试期内每周3上午、下午各取50 mL奶样,使用全自动乳成分分析仪进行乳成分测定,包括乳脂率、乳蛋白率、乳固形物含量等,并计算4%乳脂校正乳产量。将最后1周采集的奶样按上午30 mL、下午20 mL混匀置于-20 ℃保存,送往上海敏心生物科技有限公司检测中、长链脂肪酸组成及含量。

|
正试期最后1 d晨饲前,从每组试验牛中随机选取3头,共12头,通过胃管式瘤胃液采样器经口腔采集瘤胃液,装入瓶中置于冰盒中保存,迅速带回实验室,采用酸度计测定pH。对用于测定瘤胃发酵指标的瘤胃液进行如下分装处理:1)取1 mL瘤胃液,转移至含有1 mL 8.2%偏磷酸的2 mL离心管中,于-20 ℃冰箱内保存,备测挥发性脂肪酸(VFA)含量;2)取4 mL瘤胃液于离心管中,转移至含有4 mL 0.2 mol/L盐酸的离心管中,于-20 ℃冰箱内保存,备测氨态氮(NH3-N)含量;3)取10 mL瘤胃液于离心管中,于-20 ℃冰箱内保存,备测微生物蛋白(MCP)含量;4)取15 mL瘤胃液于离心管中,-20 ℃保存,用于提取总DNA。
瘤胃液挥发性脂肪酸含量采用气相色谱仪(Aglient 7890B, 美国)测定;氨态氮含量采用苯酚-次氯酸钠比色法[17]测定;微生物蛋白含量采用考马斯亮蓝法[18]测定。取1.0 mL瘤胃液,参照Wright等[19]的酚-氯仿-异戊醇方法抽提瘤胃液总DNA,DNA浓度用NanoDrop 2000微量分光光度计(Thermo Scientific公司)测定,吸光度(OD)值在1.8~2.0之间的送往美吉生物公司,用16S rDNA测序法分析瘤胃微生物多样性。
1.3.5 血清生化、抗氧化和激素指标测定正试期最后1 d晨饲前采集每头水牛血液样本。用真空采血管从颈静脉抽取20 mL血液样本于普通真空管(5 mL)中,采集血液样本后立即放置于冰盒中带至实验室。将血液样本以2 500 r/min离心15 min,收集血清。将血清送至广西壮医医院进行生化[总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿素氮(UN)、总胆固醇(TCHO)、葡萄糖(GLU)]、抗氧化[总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)与过氧化氢酶(CAT)活性以及总抗氧化能力(T-AOC)、丙二醛(MDA)含量]和激素指标[胰岛素(INS)、热应激蛋白70(HSP70)、生长激素(GH)、促肾上腺皮质激素(ACTH)、雌二醇(E2)、三碘甲状腺原氨酸(T3)、四碘甲状腺原氨酸(T4)含量],上述指标检测所用试剂盒购自南京建成生物工程研究所。
1.3.6 水牛瘤胃液微生物定量PCR检测实时荧光定量PCR(qRT-PCR)用于瘤胃液产甲烷菌、细菌和原虫数量测定,使用仪器为罗氏LightCycler® 480荧光定量PCR仪。16S rRNA引物对用于产甲烷菌和细菌的定量,18S rRNA引物对用于原虫的定量。PCR反应体积为20 μL,包含9.2 μL SYBR Green混合液,各物种正向和反向引物各1.0 μL(10 μmol/L),无核酸水8.0 μL,DNA 0.8 μL。所有引物对的PCR扩增图谱包括初始变性10 min,然后95 ℃ 15 s的40个循环,60 ℃ 60 s退火。通过常规PCR扩增后,每种微生物纯培养物的DNA进行10倍系列稀释产生标准曲线(95 ℃ 10 s,60 ℃ 60 s,40个循环)。用Nanodrop 2000微量分光光度计测定PCR产物浓度。根据PCR产物的长度及其相应的DNA浓度计算各标准的拷贝数。通过将阈值循环(Ct)值与标准曲线关联,计算每个未知样本的拷贝数。
1.3.7 水牛瘤胃微生物多样性检测对DNA样本进行16S rRNA基因测序,分析水牛瘤胃微生物多样性。测序结果来自商业公司(Majorbio,上海)。用Mothur程序(1.31.2版本)分析关于α多样性的16S rRNA基因序列数据以及菌群的相对丰度和丰富度。关于操作分类单元(OTU)的数据按分类(在门和属水平)分组,每种类型的饲粮有3个MOSO处理。将纯化后的序列与Silva数据库(Release 128)进行比对,使用0.97的同源性阈值将其分配到OTU中。通过使用核糖体数据库项目(RDP)分类器确定每个具有代表性的OTU的分类分配。使用Qiime 2软件(2017.6.0版本)对瘤胃细菌进行分类,用R软件(v2.3.2版本)绘制群落条形图。
1.4 数据统计与分析试验数据经Excel 2007初步整理,采用SPSS 19.0软件的单因素方差分析程序进行显著性分析,组间差异显著者再采用Duncan氏法进行多重比较,以P<0.05为差异显著性判断标准。数据均使用平均值±标准差表示。
2 结果 2.1 烟酸铬和半胱胺对水牛生理指标的影响由表 2可知,补饲烟酸铬和半胱胺对水牛体表温度和呼吸频率均无显著影响(P>0.05);与Ⅰ组比较,Ⅳ组直肠温度显著降低(P<0.05)。
|
|
表 2 烟酸铬和半胱胺对水牛生理指标的影响 Table 2 Effects of chromium nicotinate and cysteamine on physiological indexes of buffalo |
由表 3可知,Ⅰ组的DMI显著高于Ⅱ组和Ⅳ组(P < 0.05);Ⅳ组的粗蛋白质表观消化率显著高于Ⅰ组(P < 0.05);各组间酸性洗涤纤维表观消化率差异不显著(P>0.05);Ⅳ组的中性洗涤纤维表观消化率显著高于Ⅰ组(P < 0.05)。
|
|
表 3 烟酸铬和半胱胺对水牛采食量及养分表观消化率的影响 Table 3 Effects of chromium niacin and cysteamine on feed intake and nutrient apparent digestibility of buffalo |
由表 4可知,Ⅳ组的产奶量显著高于Ⅰ组、Ⅱ组和Ⅲ组(P<0.05),且Ⅲ组的产奶量显著高于Ⅰ组和Ⅱ组(P<0.05);Ⅲ组和Ⅳ组的4%乳脂校正乳产量显著高于Ⅰ组和Ⅱ组(P<0.05);Ⅲ组的乳蛋白率显著高于Ⅰ组和Ⅳ组(P<0.05),其中Ⅰ组最低;各组乳脂率无显著差异(P>0.05);Ⅲ组乳总固形物含量显著高于其他组(P<0.05),其中Ⅰ组最低。
|
|
表 4 烟酸铬和半胱胺对水牛泌乳性能的影响 Table 4 Effects of chromium niacin and cysteamine on lactation performance of buffalo |
由表 5可知,Ⅱ组和Ⅲ组的乙酸含量显著高于Ⅰ组(P<0.05);Ⅰ组的丙酸和异丁酸含量显著低于Ⅱ组、Ⅲ组和Ⅳ组(P<0.05);各组丁酸、氨态氮、异戊酸含量以及乙酸/丙酸、pH差异不显著(P>0.05);Ⅰ组的微生物蛋白含量显著低于Ⅱ组、Ⅲ组和Ⅳ组(P<0.05);Ⅳ组的戊酸含量显著高于Ⅰ组(P<0.05);Ⅰ组的总挥发性脂肪酸含量显著低于Ⅱ组、Ⅲ组和Ⅳ组(P < 0.05)。
|
|
表 5 烟酸铬和半胱胺对水牛瘤胃发酵参数的影响 Table 5 Effects of chromium niacin and cysteamine on rumen fermentation parameters of buffalo |
由表 6可知,Ⅰ组乳中C12 : 0、C14 : 0、C18 : 2[顺-9,反-11(cis-9, trans-11)]、C20 : 3n3显著高于Ⅳ组(P<0.05);Ⅰ组乳中C16 : 0含量显著高于Ⅲ组和Ⅳ组(P<0.05);Ⅰ组乳中C20 : 0含量显著高于Ⅲ组(P<0.05);Ⅲ组乳中C24 : 1n9含量显著低于Ⅱ组和Ⅳ组(P<0.05);Ⅲ组乳中饱和脂肪酸(SFA)含量显著高于Ⅰ组(P<0.05)。
|
|
表 6 烟酸铬和半胱胺对水牛乳中长链脂肪酸组成的影响 Table 6 Effects of chromium niacin and cysteamine on long chain fatty acid composition in buffalo milk |
由表 7可知,各组间血清过氧化氢酶、总超氧化物歧化酶和谷胱甘肽过氧化物酶活性差异不显著(P>0.05);Ⅰ组血清丙二醛含量显著高于Ⅱ组和Ⅳ组(P<0.05);Ⅰ组血清总抗氧化能力显著低于Ⅳ组(P<0.05)。各组间血清胰岛素、促肾上腺皮质激素、四碘甲状腺原氨酸和热应激蛋白70含量差异不显著(P>0.05);Ⅰ组血清生长激素含量显著低于Ⅱ组和Ⅳ组(P<0.05);Ⅲ组血清雌二醇含量显著高于Ⅰ组和Ⅱ组(P<0.05);Ⅳ组血清三碘甲状腺原氨酸含量显著高于Ⅰ组(P<0.05)。
|
|
表 7 半胱胺和烟酸铬对水牛血清抗氧化和激素指标的影响 Table 7 Effects of cysteamine and chromium nicotinate on serum antioxidant and hormone indexes of buffalo |
由表 8可知,各组间血清总蛋白、白蛋白、球蛋白、尿素氮、总胆固醇和葡萄糖含量以及谷丙转氨酶活性差异不显著(P>0.05);Ⅲ组血清谷草转氨酶活性较Ⅰ组显著提高(P<0.05)。
|
|
表 8 烟酸铬和半胱胺对水牛血清生化指标的影响 Table 8 Effects of chromium nicotinate and cysteamine on serum biochemical indexes of buffalo |
由表 9可知,补饲烟酸铬和半胱胺对瘤胃液原虫数量无显著影响(P>0.05);Ⅰ组瘤胃液细菌数量显著低于其他组(P<0.05);Ⅱ组瘤胃液产甲烷菌数量显著高于其他组(P<0.05)。
|
|
表 9 烟酸铬和半胱胺对水牛瘤胃液微生物数量的影响 Table 9 Effects of chromium nicotinate and cysteamine on microbial number in rumen fluid of buffalo |
利用细菌群落中共享和独有的细菌丰度对各组水牛瘤胃微生物多样性进行分析,如图 2所示。在86.73%相似性水平下,12只水牛的瘤胃液共产生2 755个OTU,其中Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组的OTU数目分别为2 338、1 930、2 110和1 907个,各组独有的OTU数目分别占OTU总数的9.33%、1.92%、3.38%和2.00%。与Ⅰ组相比,Ⅱ组、Ⅲ组和Ⅳ组的OTU数目降低。
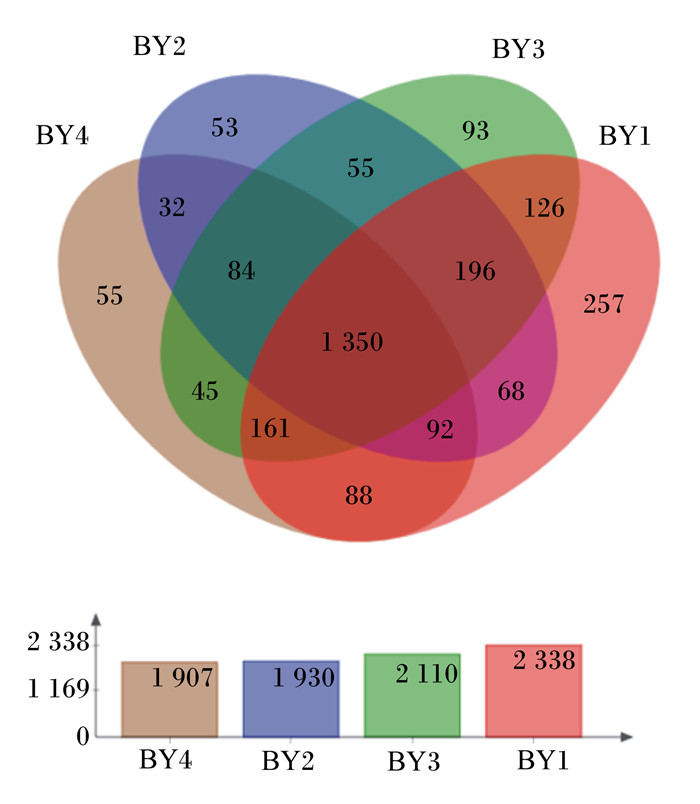
|
BY1:Ⅰ组;BY2:Ⅱ组;BY3:Ⅲ组;BY4:Ⅳ组。图 4同。 BY1: group Ⅰ; BY2: group Ⅱ; BY3: group Ⅲ; BY4: group Ⅳ. The same as Fig. 4 图 2 各组水牛瘤胃液菌群Venn图 Fig. 2 Venn diagram of bacterial flora in rumen fluid of buffalo in different groups |
门水平上的分布,将所有样本中相对丰度小于0.01的物种归为其他,如图 3所示,本研究中瘤胃液菌群主要属于10个菌门:拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、蓝藻菌门(Cyanobacteria)、螺旋体门(Spirochaetes)、Kiritimatiellaeota、放线菌门(Actinobacteria)、黏胶球形菌门(Lentisphaerae)、软壁菌门(Tenericutes)、Patescibacteria。各组的优势菌门均为拟杆菌门、厚壁菌门和变形菌门,这3个门占总细菌比例的90%左右。不同组之间菌群丰富度存在差异,其中Ⅱ组和Ⅲ组拟杆菌门的相对丰度较Ⅰ组有所提高,而厚壁菌门的相对丰度较Ⅰ组降低。
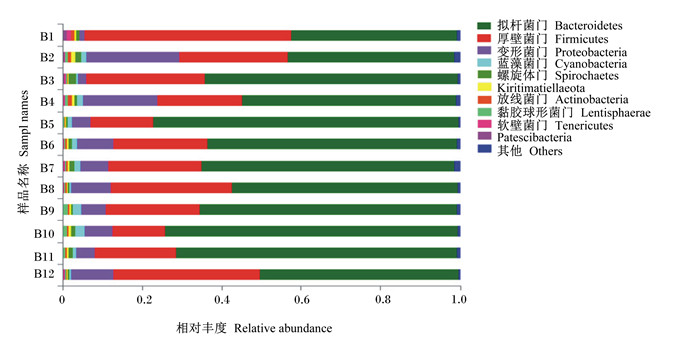
|
B1、B2、B3为Ⅰ组的3个样本;B4、B5、B6为Ⅱ组的3个样本;B7、B8、B9为Ⅲ组的3个样本;B10、B11、B12为Ⅳ组的3个样本。图 4同。 B1, B2 and B3 were 3 samples in group Ⅰ; B4, B5 and B6 were 3 samples in group Ⅱ; B7, B8 and B9 were 3 samples in group Ⅲ; B10, B11 and B12 were 3 samples in group Ⅳ. The same as Fig. 4. 图 3 门水平上瘤胃液菌群相对丰度 Fig. 3 Relative abundance of bacterial flora in rumen fluid on phylum level |
PCA图(图 4)中,纵轴和横轴分别代表主成分1(PC1)和主成分2(PC2),PC1、PC2代表样本中菌群组成发生偏移的疑似影响因素。PC1、PC2是造成4组样本的2个最大差异特征,贡献率分别为24.78%和16.34%。在PCA图上,试验组(Ⅱ、Ⅲ和Ⅳ组)的点都聚集在图的右下方,Ⅲ组和Ⅳ组点与点之间的差距相对较近,说明其物种组成有一定的相似性。由此可见,补饲烟酸铬和半胱胺对水牛瘤胃菌群组成有一定影响。
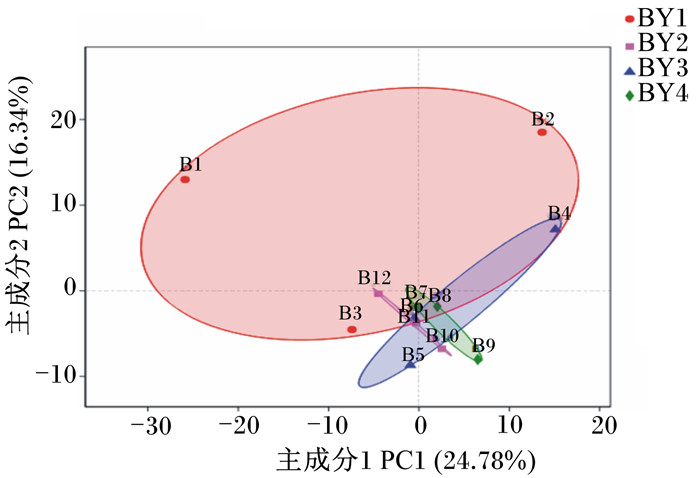
|
图 4 各组水牛瘤胃液菌群PCA图 Fig. 4 PCA diagram of bacterial flora in rumen fluid of buffalo in different groups |
由表 9可知,Ⅳ组的覆盖度与Ⅰ组相比差异显著(P<0.05);各试验组(Ⅱ、Ⅲ和Ⅳ组)的香农指数、辛普森指数、Chao指数、ACE指数和Sobs指数与对照组(Ⅰ组)相比差异均不显著(P>0.05)。
3 讨论 3.1 烟酸铬和半胱胺对水牛生理指标的影响夏季炎热环境一直是影响泌乳奶牛生产性能的重要因素,当动物产生的热量超过它们将额外热量散失到周围环境的能力时,就会产生热应激[20]。热应激主要有2类:慢性和急性热应激。因为慢性热应激是由长期高温引起的,所以动物可以适应环境。而急性热应激来自短期内环境温度的快速上升[21],可引发多种生理反应,其影响包括体温和直肠温度升高、饲粮消耗量减少、免疫力受损、血液电解质平衡和pH改变、饲料利用率低下、细胞能量生物利用率降低、生殖功能受损和内分泌功能受损等[22]。本试验采用实用型水牛舒适气候条件模型判断水牛在整个试验期所处的状态,测得试验期牛舍内BCCCIp均在37以上,水牛所处的气候条件为轻度和中度应激。因此,确定营养方法以改善热应激对动物健康和生产性能的影响越来越重要[21]。
铬可以通过降低直肠温度来缓解高温高湿环境对动物机体的影响[23]。在奶牛饲粮中,随半胱胺盐酸盐添加剂量的增加,呼吸频率和直肠温度显著降低[24]。本试验中,半胱胺和烟酸铬联用组(Ⅳ组)水牛直肠温度较对照组(Ⅰ组)显著降低,表明二者联用能够缓解水牛热应激。Mousavi等[25]发现铬-蛋氨酸对热应激犊牛的腹泻率、直肠温度没有影响。另外,Kumar等[26]发现补饲无机铬对热应激水牛犊牛的体表温度、直肠温度和呼吸频率没有显著影响。本试验中单独补饲烟酸铬和半胱胺对水牛体表温度、直肠温度和呼吸频率均没有产生显著影响,与前人研究结果一致。
3.2 烟酸铬和半胱胺对水牛采食量及养分表观消化率的影响热应激导致采食量、日增重、养分表观消化率、饲料转化效率和胴体质量下降[27]。环境温度逐渐升高对下丘脑的食欲中枢产生了不利影响,从而减少了饲粮的摄入量[28]。在泌乳奶牛中,在25~26 ℃的气候温度下采食量开始下降,在30 ℃时下降得更快,在40 ℃时下降约40%[29]。减少饲粮摄入量的目的是减少炎热环境中热量的产生[30]。因此,动物可能出现能量负平衡(NEB)[31]。为了应对这一问题,相关研究表明,补饲铬可以增加热应激动物的饲粮摄入量,从而提高生长性能[5-6]。根据Lai等[32]的研究,给热应激奶牛补饲3.6、7.2和10.8 mg/(d·头)铬可显著提高DMI。Kargar等[23]发现,补饲铬可改善高环境温度下荷斯坦犊牛的饲粮摄入量和生长速度。在荷斯坦犊牛断奶前和断奶后饲粮中添加0.05 mg/kg的铬,试验结束时DMI和平均日增重分别提高了11.85%和7.07%,铬可通过促进营养吸收和消化来改善生长速度[33-34]。但也有研究指出,水牛补饲铬超过120 d对饲料转化率(FCR)、日增重和DMI没有显著影响[26]。半胱胺可消耗体内生长抑素(SS),促进动物生长,提高饲料转化率[35]。夏伦志等[36]将半胱胺添加到泌乳奶牛饲粮中,发现半胱胺对奶牛的DMI无显著影响。Besong等[37]研究发现,在高脂饲粮中添加铬对肉牛DMI无显著影响。Chang等[38]观察到,当给应激较大的犊牛饲喂添加铬酵母的饲粮时,DMI增加。本试验发现,单独补饲半胱胺以及同时补饲半胱胺与烟酸铬均能显著提高水牛的DMI,而单独补饲烟酸铬对水牛的DMI没有显著影响。
氮是维持动物正常生长所需的营养元素,奶牛养殖过程中大量未被机体利用的氮流失到环境中,造成环境污染[39]。提高氮的表观消化率,可降低氮排泄对环境造成的污染。刘月琴等[40]研究显示,在绵羊饲粮中添加半胱胺提高了氮的表观消化率,促进了氮的吸收利用。常新耀等[10]给小尾寒羊补饲半胱胺后,粗脂肪和粗蛋白质的表观消化率显著提高,对中性洗涤纤维和酸性洗涤纤维的表观消化率影响较小,同时半胱胺能加快瘤胃液中原虫的生长率和数量。孙国强等[41]研究发现,补饲半胱胺和酵母培养物(YC)后,试验组奶牛的干物质和粗蛋白质表观消化率得到显著提高。本试验中,同时补饲烟酸铬和半胱胺能够有效提高水牛的粗蛋白质和中性洗涤纤维表观消化率,而单独补饲烟酸铬和半胱胺时对水牛养分表观消化率没有显著影响,表明在水牛生产中可以采用烟酸铬和半胱胺联用的方式。
|
|
表 10 烟酸铬和半胱胺对水牛瘤胃液菌群α多样性指数的影响 Table 10 Effects of chromium nicotinate and cysteamine on α diversity indexes of bacterial flora in rumen fluid of buffalo |
热应激会影响产奶量和乳成分组成[42-43],营养干预被认为是夏季增产的一种经济方法。饲喂半胱胺可改善奶牛的乳品质,提高产奶量[44]。王玲[45]研究表明,补饲20 g/(d·头)半胱胺(含量为30%)时有提高奶牛瘤胃微生物蛋白产量和产奶量、降低氮排泄的效果,试验组奶牛产奶量较对照组提高了19.58%。半胱胺对生长抑素具有抑制作用是由于半胱胺分子内含有巯基和氨基等活性基团,能与生长抑素分子直接作用,导致生长抑素分子构型改变,使其免疫活性和生物活性遭到破坏,因此减弱了对生长激素的抑制,促进了垂体前叶分泌生长激素,使血液内生长激素含量升高,从而提高奶牛产奶量[4]。适量的格可增加饲粮的摄入量,降低血液中胰岛素含量,增加乳汁分泌量[46]。此外,在热应激奶牛饲粮中添加吡啶甲酸铬后,产奶量显著增加,对奶牛乳成分(乳蛋白率、乳脂率和乳糖率)没有显著影响[32]。本试验中,单独补饲半胱胺对水牛的产奶量并未产生显著影响,与上述研究结果存在差异,可能是由于试验对象或添加剂量不同造成的。乳脂率、乳蛋白率、乳糖率和乳体细胞数是衡量乳品质的指标。Zhang等[47]研究发现,饲粮添加半胱胺的试验组乳蛋白率和乳脂率较对照组显著提高。给热应激奶牛补饲4 g/(d·头)螯合铬对乳脂率、乳蛋白率、乳糖率和乳非脂固形物含量没有显著影响[48]。散栏饲养条件下,补饲半胱胺能显著提高泌乳中期热应激奶牛的DMI、4%乳脂校正乳产量和能量校正乳产量,显著提高乳脂率和乳蛋白率[49]。本试验中,补饲烟酸铬和半胱胺对水牛乳脂率无显著影响,但显著提高了乳蛋白率和乳总固形物含量。
3.4 烟酸铬和半胱胺对水牛瘤胃发酵参数的影响微生物蛋白是反刍动物生命活动中氮的主要来源,能为反刍动物的生命活动提供大量蛋白质[50]。王玲[45]试验发现,饲粮添加半胱胺能增加奶牛瘤胃微生物蛋白产量。刘贵莲等[51]研究发现,半胱胺能增加瘤胃微生物活性,使瘤胃微生物蛋白的合成速度加快。黄雅莉等[52]研究发现,水牛补饲半胱胺后瘤胃微生物蛋白产量显著提高,同时,补饲半胱胺后可以加大进入瘤胃内的唾液量,唾液呈碱性可以更好地保持瘤胃内pH稳定性。Nonaka等[53]得出结论,由于瘤胃功能的改变,热应激动物的乙酸产量减少,丙酸和丁酸产量增加。Besong等[37]研究发现,饲粮中添加铬对肉牛瘤胃液总挥发性脂肪酸含量和乙酸、丙酸、丁酸、戊酸、异丁酸和异戊酸的摩尔比例均没有显著影响,可能是因为补铬对微生物活性未产生影响。本试验中,补饲半胱胺和烟酸铬均能显著提高水牛瘤胃液乙酸、丙酸和总挥发性脂肪酸含量,同时增加瘤胃液微生物蛋白含量。
3.5 烟酸铬和半胱胺对水牛乳中长链脂肪酸组成的影响牛奶中的脂肪酸一部分来自于饲粮,另一部由瘤胃微生物合成。梁贤威等[54]研究发现,饲粮添加半胱胺组水牛乳脂中长链脂肪酸特别是长链不饱和脂肪酸含量相比对照组均有不同程度的提高。但在本研究中补饲半胱胺并未显著增加水牛乳中多不饱和脂肪酸含量,可能与添加剂量不同有关。牛奶中存在的饱和脂肪酸约占总脂肪酸的70%[55]。从定量的观点来看,最重要的脂肪酸是C16 : 0,其约占总脂肪酸的30%;C14 : 0和C18 : 0分别约占总脂肪酸的11%和12%[56]。本研究中发现补饲烟酸铬显著降低了水牛乳中C16 : 0和C20 : 0含量。
3.6 烟酸铬和半胱胺对水牛抗氧化性能和激素分泌的影响半胱胺是一种安全的抗氧化剂,是辅酶A的降解产物。氧化应激过程可以在细胞中产生过多的活性氧,导致动物体细胞内氧化还原电位不平衡和细胞损伤[57]。半胱胺是巯醇类化合物,具有抗氧化作用,可通过自身巯基的氧化来保护其他生物大分子中的巯基免受氧化。Gu等[58]研究表明,饲粮中补充半胱胺可以减少小鼠消化过程中的氧化应激。半胱胺可以增加细胞中谷胱甘肽(GSH)含量[59]。半胱胺螯合锌通过提高血清总抗氧化能力及降低丙二醛含量来改善育肥猪的抗氧化性能[60]。Shin等[61]的研究表明,过氧化氢诱导的氧化应激导致角膜内皮细胞凋亡,半胱胺可降低氧化应激水平,从而阻止细胞凋亡。本试验中,补饲半胱胺显著降低了水牛血清丙二醛含量,表明半胱胺可有效降低氧化应激反应。
铬具有很强的抗氧化活性,可以防止热应激引起的脂质过氧化[62-63]。补饲铬对犊牛血清丙二醛含量和谷胱甘肽过氧化物酶活性没有显著影响,但断奶时饲喂添加0.05 mg/kg蛋氨酸铬饲粮的犊牛血清超氧化物歧化酶活性有升高的趋势;此外,断奶后饲喂添加蛋氨酸铬饲粮的犊牛血清过氧化氢酶活性显著高于对照组[64]。Qi等[65]研究表明,铬可通过促进热应激蛋白72(HSP72)的释放,促进白细胞介素-10(IL-10)的产生,抑制热应激条件下核因子κB抑制蛋白α(IκBα)的降解,从而抑制泌乳奶牛的炎症反应;此外,该研究发现在高温条件下补饲吡啶羧酸铬对泌乳奶牛血清总抗氧化能力、超氧化物歧化酶活性和丙二醛含量等抗氧化指标没有产生显著影响。本试验中同样发现补饲烟酸铬对水牛血清抗氧化指标没有显著影响,但在同时补饲烟酸铬和半胱胺的情况下能够显著增强水牛的抗氧化能力。
半胱胺可以影响激素分泌,从而提高畜禽机体的免疫力。血清总蛋白含量的高低反映动物机体免疫力的强弱,进而对动物营养物质的吸收利用率产生影响。热应激很大程度上是由增加胰岛素分泌来改变血糖含量[66]。饲粮中添加铬可改善热应激水牛犊牛的耐热性、免疫功能和胰岛素有效性,而对采食量、生长速度、血清甲状腺素和四碘甲状腺原氨酸含量没有显著影响[26]。研究发现,荷斯坦牛夏季饲粮摄入量的降低导致夏季血清中胰岛素含量低于冬季和春季[66]。此外,在高温下,应用纳米三甲酸铬导致育肥母猪血清中皮质醇含量降低25%,采食量增加6%[6]。
半胱胺在动物生产中作为生长抑素的特异性抑制剂来影响内分泌,使生长激素的分泌增加,提高动物的生长性能[51]。徐雪松[67]研究发现,添加120及200 mg/kg的半胱胺可显著降低45日龄仔猪血清生长抑素含量,显著提高血清生长激素、三碘甲状腺原氨酸和四碘甲状腺原氨酸含量。韩新燕等[68]研究发现,半胱胺能促进乳腺细胞增殖,促进动物体内生长激素含量上升。夏伦志等[36]研究发现,半胱胺通过提高动物体内生长激素,促进胰岛素分泌,从而增加体内胰岛素样生长因子-1(IGF-1)含量,进一步促进乳蛋白、乳糖和乳脂的合成。热应激环境下,为了降低产热量,奶牛甲状腺活动减弱,使血液三碘甲状腺原氨酸和四碘甲状腺原氨酸含量降低[69],说明添加半胱胺有缓解奶牛热应激的作用。补充铬可以改善蛋氨酸、甘氨酸和丝氨酸对心肌细胞的渗透,从而刺激这些细胞内的蛋白质合成[70]。
研究显示,补充铬对健康动物的胰岛素或血糖只有轻微的影响或没有影响[71-72],常规补充铬对胴体品质没有任何影响[73-74]。健康个体补充铬是否有利于糖代谢和胰岛素功能的改变仍有待确定。添加0.03 mg/kg BW铬会增加奶牛血清四碘甲状腺原氨酸含量,降低三碘甲状腺原氨酸与四碘甲状腺原氨酸的比率[33];提高铬的添加剂量(从0增加到0.02和0.04 mg/kg BW)会导致血清四碘甲状腺原氨酸含量呈二次曲线下降,而血清三碘甲状腺原氨酸含量只有在铬添加剂量较高时才会下降;当添加0.05 mg/kg BW铬时,血清胰岛素含量显著降低[7]。本试验中,补饲半胱胺显著升高了水牛血清生长激素含量,与前人研究结果基本一致。
3.7 烟酸铬和半胱胺对水牛血清生化指标的影响血清球蛋白含量能从侧面体现畜禽体内的抗体水平,也能体现机体免疫能力的高低。半胱氨酸的衍生物可调节脂质代谢,S-甲基-L-半胱氨酸含有亲水性L-半胱氨酸的化合物,通过降低空腹血浆葡萄糖和总胆固醇含量起到降血糖和降血脂的特性[75]。研究发现,随着铬添加剂量的增加,母猪血清胆固醇含量降低,甘油三酯和低密度脂蛋白胆固醇含量有降低趋势,高密度脂蛋白胆固醇含量升高,说明铬可以改善胆固醇的代谢[76]。研究表明,补充铬有潜在的好处,补充铬后,血液葡萄糖、糖化血红蛋白和胆固醇含量降低,胰岛素需求量减少[77-78]。给泌乳奶牛补饲酵母铬(4 mg/d)没有显示出对血清血凝(HA)、胆固醇、甘油三酯、尿素氮、和葡萄糖含量的任何影响[79],但血清总蛋白含量下降[80]。补饲铬的犊牛血清球蛋白含量增高[25]。补饲0.05 mg/kg BW铬的犊牛往往有更高的血清葡萄糖含量和胰岛素与葡萄糖比率[23]。Jin等[64]在热应激条件下给泌乳奶牛补饲3.5 mg/(d·头)吡啶羧酸铬,奶牛血液中葡萄糖、尿素氮、胆固醇和肌酐含量没有发生任何变化。也有研究发现补饲铬对热应激犊牛血液胰岛素和葡萄糖含量几乎没有影响[33],另有研究发现补饲铬对育肥猪血清高密度脂蛋白、甘油三酯和胆固醇含量没有显著影响[81]。本试验研究发现,补饲半胱胺和烟酸铬对水牛血清总蛋白、白蛋白、球蛋白、尿素氮、总胆固醇和葡萄糖含量均没有显著影响,与上述研究结果基本一致。
3.8 烟酸铬和半胱胺对水牛瘤胃微生物多样性的影响水牛主要依靠其强大的瘤胃微生物系统对粗饲料进行降解,为宿主动物提供能量和营养物质。瘤胃菌群中的优势菌门是厚壁菌门和拟杆菌门。厚壁菌门是革兰氏阳性细菌,产生丙酸和丁酸盐;拟杆菌门是革兰氏阴性细菌,发酵多糖和难消化的碳水化合物,产生短链脂肪酸(SCFA)。单样本的α多样性分析可反映微生物群落的丰富度和多样性。本试验发现,补饲半胱胺和烟酸铬对水牛瘤胃液菌群α多样性指数的影响不显著。于光辉等[60]研究发现,饲粮中添加半胱胺螯合锌后,厚壁菌门、拟杆菌门与变形菌门是育肥猪肠道菌群中的优势菌门,且添加120 mg/kg的半胱胺螯合锌能够增加肠道中有益菌厚壁菌门的相对丰度,降低有害菌变形菌门的相对丰度。林波等[82]发现,饲粮中添加烟酸的水牛瘤胃液菌群在门水平上主要以拟杆菌门、厚壁菌门和变形菌门为主,且显著降低了厚壁菌门的相对丰度。本研究结果显示水牛瘤胃液中优势菌门是拟杆菌门、厚壁菌门、变形杆菌门,与上述结果一致。侯宇[83]研究发现,火麻油、半胱胺及其组合对奶水牛瘤胃真菌、原虫、产甲烷菌的数量均没有显著影响。高雨飞[84]研究发现,在高精料饲粮中添加烟酸后能促进原虫的生长。本试验中,补饲烟酸铬和半胱胺均能显著提高水牛瘤胃液细菌数量,单独补饲半胱胺还可显著提高水牛瘤胃液产甲烷菌数量。
4 结论夏季单独补饲烟酸铬能够改善水牛的乳成分,单独补饲半胱胺能够增强水牛的抗氧化性能,同时补饲半胱胺和烟酸铬能够改善水牛的瘤胃发酵参数,提高养分表观消化率和泌乳性能。
| [1] |
SAEED M, ABBAS G, ALAGAWANY M, et al. Heat stress management in poultry farms:a comprehensive overview[J]. Journal of Thermal Biology, 2019, 84: 414-425. DOI:10.1016/j.jtherbio.2019.07.025 |
| [2] |
MERTZ W. Chromium in human nutrition:a review[J]. The Journal of Nutrition, 1993, 123(4): 626-633. DOI:10.1093/jn/123.4.626 |
| [3] |
曾李. 半胱胺生理功能概述[J]. 广东饲料, 2018, 27(8): 35-38. |
| [4] |
郭冬生, 司国利. 半胱胺的生物学功能与作用机制[J]. 养殖与饲料, 2010(8): 63-69. |
| [5] |
HAYIRLI A, BREMMER D R, BERTICS S J, et al. Effect of chromium supplementation on production and metabolic parameters in periparturient dairy cows[J]. Journal of Dairy Science, 2001, 84(5): 1218-1230. DOI:10.3168/jds.S0022-0302(01)74583-3 |
| [6] |
HUNG A T, LEURY B J, SABIN M A, et al. Dietary nano-chromium tripicolinate increases feed intake and decreases plasma cortisol in finisher gilts during summer[J]. Tropical Animal Health and Production, 2014, 46(8): 1483-1489. DOI:10.1007/s11250-014-0673-7 |
| [7] |
YARI M, NIKKHAH A, ALIKHANI M, et al. Physiological calf responses to increased chromium supply in summer[J]. Journal of Dairy Science, 2010, 93(9): 4111-4120. DOI:10.3168/jds.2009-2568 |
| [8] |
SAHIN K, SAHIN N, ONDERCI M, et al. Optimal dietary concentration of chromium for alleviating the effect of heat stress on growth, carcass qualities, and some serum metabolites of broiler chickens[J]. Biological Trace Element Research, 2002, 89(1): 53-64. DOI:10.1385/BTER:89:1:53 |
| [9] |
HAYIRLI A. Chromium nutrition of livestock species[J]. Nutrition Abstracts and Reviews, Series B:Livestock Feeds and Feeding, 2005, 75(5): 1N-14N. |
| [10] |
常新耀, 谢红兵, 魏刚才. 半胱胺对小尾寒羊瘤胃原虫和养分消化率及血清生化指标的影响[J]. 中国兽医学报, 2010, 30(9): 1257-1260, 1272. |
| [11] |
王艳玲, 韩正康. 半胱胺对妊娠大鼠乳腺发育及血液生长抑素生长激素含量的影响[J]. 南京农业大学学报, 1998, 21(1): 90-93. |
| [12] |
卞良勇, 陈丛亮, 王志东. 半胱胺盐酸盐对黄羽肉鸡产蛋性能和蛋壳品质的影响[J]. 饲料研究, 2010(3): 20-22. |
| [13] |
张荣飞.半胱胺盐酸盐对高温季节高产奶牛生产性能的影响[D].硕士学位论文.南京: 南京农业大学, 2004.
|
| [14] |
DA SILVA J A R, DE ARAÚJO A A, JÚNIOR J D B, et al. Thermal comfort indices of female Murrah buffaloes reared in the Eastern Amazon[J]. International Journal of Biometeorology, 2015, 59(9): 1261-1267. DOI:10.1007/s00484-014-0937-y |
| [15] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业大学出版社, 2007.
|
| [16] |
VAN KEULEN J, YOUNG B A. Evaluation of acid-insoluble ash as a natural marker in ruminant digestibility studies[J]. Journal of Animal Science, 1977, 44(2): 282-287. |
| [17] |
WEATHERBURN M W. Phenol-hypochlorite reaction for determination of ammonia[J]. Analytical Chemistry, 1967, 39(8): 971-974. DOI:10.1021/ac60252a045 |
| [18] |
MAKKAR H P S, SHARMA O P, DAWRA R K, et al. Simple determination of microbial protein in rumen liquor[J]. Journal of Dairy Science, 1982, 65(11): 2170-2173. DOI:10.3168/jds.S0022-0302(82)82477-6 |
| [19] |
WRIGHT A D G, WILLIAMS A J, WINDER B, et al. Molecular diversity of rumen methanogens from sheep in Western Australia[J]. Applied and Environmental Microbiology, 2004, 70(3): 1263-1270. |
| [20] |
EL-KHOLY M S, EL-HINDAWY M M, ALAGAWANY M, et al. Use of acetylsalicylic acid as an allostatic modulator in the diets of growing Japanese quails exposed to heat stress[J]. Journal of Thermal Biology, 2018, 74: 6-13. DOI:10.1016/j.jtherbio.2018.02.011 |
| [21] |
ALAGAWANY M, FARAG M, EL-HACK M E A, et al. Heat stress:effects on productive and reproductive performance of quail[J]. World's Poultry Science Journal, 2017, 73(4): 747-756. DOI:10.1017/S0043933917000782 |
| [22] |
LOYAU T, BEDRANI L, BERRI C, et al. Cyclic variations in incubation conditions induce adaptive responses to later heat exposure in chickens:a review[J]. Animal, 2015, 9(1): 76-85. DOI:10.1017/S1751731114001931 |
| [23] |
KARGAR S, MOUSAVI F, KARIMI-DEHKORDI S, et al. Growth performance, feeding behavior, health status, and blood metabolites of environmentally heat-loaded Holstein dairy calves fed diets supplemented with chromium[J]. Journal of Dairy Science, 2018, 101(11): 9876-9887. DOI:10.3168/jds.2017-14154 |
| [24] |
刘威.半胱胺盐酸盐饲喂泌乳中期奶牛的效果评价[D].硕士学位论文.兰州: 甘肃农业大学, 2014.
|
| [25] |
MOUSAVI F, KARIMI-DEHKORDI S, KARGAR S, et al. Effect of chromium supplementation on growth performance, meal pattern, metabolic and antioxidant status and insulin sensitivity of summer-exposed weaned dairy calves[J]. Animal, 2019, 13(5): 968-974. DOI:10.1017/S1751731118002318 |
| [26] |
KUMAR M, KAUR H, DEKA R S, et al. Dietary inorganic chromium in summer-exposed buffalo calves (Bubalus bubalis):effects on biomarkers of heat stress, immune status, and endocrine variables[J]. Biological Trace Element Research, 2015, 167(1): 18-27. DOI:10.1007/s12011-015-0272-0 |
| [27] |
HOWLIDER M A R, ROSE S P. Temperature and the growth of broilers[J]. World's Poultry Science Journal, 1987, 43(3): 228-237. DOI:10.1079/WPS19870015 |
| [28] |
BAILE C A, FORBES J M. Control of feed intake and regulation of energy balance in ruminants[J]. Physiological Reviews, 1974, 54(1): 160-214. |
| [29] |
RHOADS R P, BAUMGARD L H, SUAGEE J K, et al. Nutritional interventions to alleviate the negative consequences of heat stress[J]. Advances in Nutrition, 2013, 4(3): 267-276. |
| [30] |
KADZERE C T, MURPHY M R, SILANIKOVE N, et al. Heat stress in lactating dairy cows:a review[J]. Livestock Production Science, 2002, 77(1): 59-91. DOI:10.1016/S0301-6226(01)00330-X |
| [31] |
LACETERA N, BERNABUCCI U, RONCHI B, et al. Body condition score, metabolic status and milk production of early lactating dairy cows exposed to warm environment[J]. Review Agriculture of Subtropical and Tropical, 1996, 90(1): 43-55. |
| [32] |
LAI A Q, WANG Z S, ZHOU A G. Effect of chromium picolinate supplementation on early lactation performance, rectal temperatures, respiration rates and plasma biochemical response of Holstein cows under heat stress[J]. Pakistan Journal of Nutrition, 2009, 8(7): 940-945. |
| [33] |
GHORBANI A, SADRI H, ALIZADEH A R, et al. Performance and metabolic responses of Holstein calves to supplemental chromium in colostrum and milk[J]. Journal of Dairy Science, 2012, 95(10): 5760-5769. DOI:10.3168/jds.2012-5500 |
| [34] |
KARGAR S, MOUSAVI F, KARIMI-DEHKORDI S. Effects of chromium supplementation on weight gain, feeding behaviour, health and metabolic criteria of environmentally heat-loaded Holstein dairy calves from birth to weaning[J]. Archives of Animal Nutrition, 2018, 72(6): 443-457. DOI:10.1080/1745039X.2018.1510157 |
| [35] |
韩正康, 林玲. 生长抑素抑制剂——半胱胺促进肉用仔鸡生长的研究[J]. 畜牧兽医学报, 1992, 23(4): 314-318. |
| [36] |
夏伦志, 东蔡, 熊国远, 等. 半胱胺补饲模式对奶牛生产性能及血清胰岛素水平的影响[J]. 中国畜牧杂志, 2005, 41(2): 27-29. |
| [37] |
BESONG S, JACKSON J A, TRAMMELL D S, et al. Influence of supplemental chromium on concentrations of liver triglyceride, blood metabolites and rumen VFA profile in steers fed a moderately high fat diet[J]. Journal of Dairy Science, 2001, 84(7): 1679-1685. DOI:10.3168/jds.S0022-0302(01)74603-6 |
| [38] |
CHANG X, MOWAT D N. Supplemental chromium for stressed and growing feeder calves[J]. Journal of Animal Science, 1992, 70(2): 559-565. |
| [39] |
CHACHER B, ZHU W, YE J A, et al. Effect of dietary N-carbamoylglutamate on milk production and nitrogen utilization in high-yielding dairy cows[J]. Journal of Dairy Science, 2014, 97(4): 2338-2345. DOI:10.3168/jds.2013-7330 |
| [40] |
刘月琴, 张英杰, 杨庆华, 等. 不同剂量半胱胺对绵羊消化代谢和生长发育的影响[J]. 黑龙江畜牧兽医, 2006(10): 50-51. |
| [41] |
孙国强, 张成喜, 滕乐帮, 等. 半胱胺和酵母培养物对奶牛瘤胃微生物蛋白产量和养分消化率的影响[J]. 中国畜牧杂志, 2017, 53(8): 79-83. |
| [42] |
BOURAOUI R, LAHMAR M, MAJDOUB A, et al. The relationship of temperature-humidity index with milk production of dairy cows in a Mediterranean climate[J]. Animal Research, 2002, 51(6): 479-491. DOI:10.1051/animres:2002036 |
| [43] |
WHEELOCK J B, RHOADS R P, VANBAALE M J, et al. Effects of heat stress on energetic metabolism in lactating Holstein cows[J]. Journal of Dairy Science, 2010, 93(2): 644-655. DOI:10.3168/jds.2009-2295 |
| [44] |
沈赞明, 张荣飞, 陈峰, 等. 复合半胱胺盐酸盐对泌乳后期奶牛产奶性能的影响[J]. 中国畜牧兽医, 2004, 31(8): 9-10. |
| [45] |
王玲.半胱胺和酵母培养物对奶牛瘤胃微生物蛋白产量、产奶性能和氮排泄的影响[D].硕士学位论文.青岛: 青岛农业大学, 2016.
|
| [46] |
WINKELMAN L A, OVERTON T R. The effects of increasing doses of 2 preparations of long-acting insulin on short-term plasma profiles of glucose and insulin in lactating dairy cows[J]. Journal of Dairy Science, 2012, 95(12): 6974-6982. DOI:10.3168/jds.2011-5045 |
| [47] |
ZHANG Y N, BALA V, MAO Z H, et al. A concise review of quantification methods for determination of vitamin K in various biological matrices[J]. Journal of Pharmaceutical and Biomedical Analysis, 2019, 169: 133-141. DOI:10.1016/j.jpba.2019.03.006 |
| [48] |
AL-SAIADY M Y, AL-SHAIKH M A, AL-MUFARREJ S I, et al. Effect of chelated chromium supplementation on lactation performance and blood parameters of Holstein cows under heat stress[J]. Animal Feed Science and Technology, 2004, 117(3/4): 223-233. |
| [49] |
张荣飞.半胱胺盐酸盐对高温季节高产奶牛生产性能的影响[D].硕士学位论文.南京: 南京农业大学, 2004.
|
| [50] |
ZHOU Z, BULGARI O, VAILATI-RIBONI M, et al. Rumen-protected methionine compared with rumen-protected choline improves immunometabolic status in dairy cows during the peripartal period[J]. Journal of Dairy Science, 2016, 99(11): 8956-8969. DOI:10.3168/jds.2016-10986 |
| [51] |
刘贵莲, 王之盛, 周安国. 新型饲料添加剂——半胱胺[J]. 饲料工业, 2006, 27(22): 4-8. |
| [52] |
黄雅莉, 邹彩霞, 韦升菊, 等. 体外产气法研究半胱胺对水牛瘤胃发酵参数和甲烷产量的影响[J]. 动物营养学报, 2014, 26(1): 125-133. |
| [53] |
NONAKA I, TAKUSARI N, TAJIMA K, et al. Effects of high environmental temperatures on physiological and nutritional status of prepubertal Holstein heifers[J]. Livestock Science, 2008, 113(1): 14-23. DOI:10.1016/j.livsci.2007.02.010 |
| [54] |
梁贤威, 韦升菊, 卢雪芬, 等. 半胱胺对水牛乳脂脂肪酸组成的影响[J]. 畜牧与兽医, 2012, 44(8): 40-42. |
| [55] |
MACGIBBON A K H, TAYLOR M W.Composition and structure of bovine milk lipids[M]//FOX P F, MCSWEENEY P L H.Advanced dairy chemistry.Boston, MA: Springer, 2006: 1-42.
|
| [56] |
MÅNSSON H L. Fatty acids in bovine milk fat[J]. Food & Nutrition Research, 2008, 52(1): 1821. |
| [57] |
魏亚萍, 王媛, 郭晓笋, 等. 细胞内的氧化还原感受器蛋白与氧化还原信号转导[J]. 中国病理生理杂志, 2018, 34(1): 183-187. |
| [58] |
GU C M, QU H S, HAN L L, et al. The effect of raw soybean on oxidative status of digestive organs in mice[J]. International Journal of Molecular Sciences, 2011, 12(12): 8836-8845. DOI:10.3390/ijms12128836 |
| [59] |
BESOUW M, MASEREEUW R, VAN DEN HEUVEL L, et al. Cysteamine:an old drug with new potential[J]. Drug Discovery Today, 2013, 18(15/16): 785-792. |
| [60] |
于光辉, 王煜琦, 刘正方, 等. 半胱胺螯合锌对育肥猪免疫性能、抗氧化能力、血清生化指标及肠道微生物的影响[J]. 动物营养学报, 2020, 32(4): 1891-1898. |
| [61] |
SHIN Y J, SEO J M, CHUNG T Y, et al. Effect of cysteamine on oxidative stress-induced cell death of human corneal endothelial cells[J]. Current Eye Research, 2011, 36(10): 910-917. DOI:10.3109/02713683.2011.593726 |
| [62] |
SAMANTA S, HALDAR S, BAHADUR V, et al. Chromium picolinate can ameliorate the negative effects of heat stress and enhance performance, carcass and meat traits in broiler chickens by reducing the circulatory cortisol level[J]. Journal of the Science of Food and Agriculture, 2008, 88(5): 787-796. DOI:10.1002/jsfa.3146 |
| [63] |
RAO S V R, RAJU M V L N, PANDA A K, et al. Effect of dietary supplementation of organic chromium on performance, carcass traits, oxidative parameters, and immune responses in commercial broiler chickens[J]. Biological Trace Element Research, 2012, 147(1): 135-141. |
| [64] |
JIN D X, KANG K, WNAG H Z, et al. Effects of dietary supplementation of active dried yeast on fecal methanogenic archaea diversity in dairy cows[J]. Anaerobe, 2017, 44: 78-86. DOI:10.1016/j.anaerobe.2017.02.007 |
| [65] |
QI Z, GAO J, ZHAO C, et al. PSXVII-30 Effects of dietary supplementation of yeast chromium and dihydropyridine on serum biochemical indices and HSP70 mRNA expression of lactating dairy cows in summer[J]. Journal of Animal Science, 2018, 96. |
| [66] |
BAUMGARD L H, RHOADS R P, J r. Effects of heat stress on postabsorptive metabolism and energetics[J]. Annual Review of Animal Biosciences, 2013, 1: 311-337. DOI:10.1146/annurev-animal-031412-103644 |
| [67] |
ABDELNOUR S A, ABD EL-HACK M E, KHAFAGA A F, et al. Stress biomarkers and proteomics alteration to thermal stress in ruminants:a review[J]. Journal of Thermal Biology, 2019, 79: 120-134. DOI:10.1016/j.jtherbio.2018.12.013 |
| [68] |
徐雪松.半胱胺对仔猪的促生长作用及其机理研究[D].硕士学位论文.合肥: 安徽农业大学, 2007.
|
| [69] |
韩新燕, 汪以真. 半胱胺对动物的作用及应用效果[J]. 饲料工业, 2000, 21(12): 29-30. |
| [70] |
WEST J W. Effects of heat-stress on production in dairy cattle[J]. Journal of Dairy Science, 2003, 86(6): 2131-2144. DOI:10.3168/jds.S0022-0302(03)73803-X |
| [71] |
ROGINSKI E E, MERTZ W. Effects of chromium (Ⅲ) supplementation on glucose and amino acid metabolism in rats fed a low protein diet[J]. The Journal of Nutrition, 1969, 97(4): 525-530. DOI:10.1093/jn/97.4.525 |
| [72] |
LUKASKI H C. Chromium as a supplement[J]. Annual Review of Nutrition, 1999, 19: 279-302. DOI:10.1146/annurev.nutr.19.1.279 |
| [73] |
BARON A D, BRECHTEL G, WALLACE P, et al. Rates and tissue sites of non-insulin-and insulin-mediated glucose uptake in humans[J]. The American Journal of Physiology, 1988, 255(6 pt 1): E769-E774. |
| [74] |
HALLMARK M A, REYNOLDS T H, DESOUZA CA, et al. Effects of chromium and resistive training on muscle strength and body composition[J]. Medicine and Science in Sports and Exercise, 1996, 28(1): 139-144. |
| [75] |
SENTHILKUMAR G P, THOMAS S, SIVARAMAN K, et al. Study the effect of S-methyl L-cysteine on lipid metabolism in an experimental model of diet induced obesity[J]. Journal of Clinical & Diagnostic Research, 2013, 7(11): 2449-2451. |
| [76] |
YANG J J, HAN A Y, ZHENG S S, et al. Regulation of organic nucleic acids and serum biochemistry parameters by dietary chromium picolinate supplementation in swine mode[J]. Journal of Trace Elements in Medicine and Biology, 2011, 25(2): 91-96. |
| [77] |
ANDERSON R A. Chromium, glucose intolerance and diabetes[J]. Journal of the American College of Nutrition, 1998, 17(6): 548-555. DOI:10.1080/07315724.1998.10718802 |
| [78] |
WANG Z Q, ZHANG X H, RUSSELL J C, et al. Chromium picolinate enhances skeletal muscle cellular insulin signaling in vivo in obese, insulin-resistant JCR:LA-cp rats[J]. The Journal of Nutrition, 2006, 136(2): 415-420. DOI:10.1093/jn/136.2.415 |
| [79] |
MIRZAEI M, GHORBANI G R, KHORVASH M, et al. Chromium improves production and alters metabolism of early lactation cows in summer[J]. Journal of Animal Physiology and Animal Nutrition, 2011, 95(1): 81-89. DOI:10.1111/j.1439-0396.2010.01007.x |
| [80] |
SOLTAN M. Effect of dietary chromium supplementation on productive and reproductive performance of early lactating dairy cows under heat stress[J]. Journal of Animal Physiology and Animal Nutrition, 2010, 94(2): 264-272. DOI:10.1111/j.1439-0396.2008.00913.x |
| [81] |
WANG M Q, WANG C, DU Y J, et al. Effects of chromium-loaded chitosan nanoparticles on growth, carcass characteristics, pork quality, and lipid metabolism in finishing pigs[J]. Livestock Science, 2014, 161: 123-129. DOI:10.1016/j.livsci.2013.12.029 |
| [82] |
林波, 梁辛, 韦升菊, 等. 烟酸对水牛瘤胃发酵指标及微生物区系的影响[J]. 动物营养学报, 2015, 27(8): 2396-2404. |
| [83] |
侯宇.日粮添加火麻油和半胱胺对奶水牛生产性能、脂肪酸组成及瘤胃微生物群的影响[D].硕士学位论文.南宁: 广西大学, 2016.
|
| [84] |
高雨飞.高精料日粮条件下烟酸对牛瘤胃微生物区系的影响[D].硕士学位论文.南昌: 江西农业大学, 2016.
|




