2. 上海海洋大学水产与生命学院, 农业部鱼类营养与环境生态研究中心, 上海 201306;
3. 上海海洋大学水产与生命学院, 水产动物遗传育种中心上海市协同创新中心, 上海 201306
2. Centre for Research on Environmental Ecology and Fish Nutrition(CREEFN) of the Ministry of Agriculture, College of Fisheries and Life, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding, College of Fisheries and Life, Shanghai Ocean University, Shanghai 201306, China
杜仲(Eucommia ulmoides)作为一种在东亚地区传统使用的中草药,在人类的应用已有1千多年,具有强筋健骨、降血脂、降血糖以及抗氧化和提高免疫力等功效[1],已作为饲料添加剂应用于兔[2]、鸡[3]、鱼[4]和虾[5]等养殖动物。杜仲的传统药用部位为皮部,但近年来由于杜仲皮(EB)资源的紧缺,杜仲叶(EL)也开始应用于养殖业中。有关EL应用的报道已见于羊[6-7]、兔[8]和猪[9]等。有研究表明,杜仲可以提高鳗鲡(Anguilla japonica)[10]、鲫鱼(Carassius auratus gibelio)[11]、草鱼(Ctenopharyngodon idellus)[4, 12]和凡纳滨对虾(Penaeus vannamei)[5]等水产动物肌肉的胶原蛋白含量,改善肌肉品质,但其作用机制还不清楚。
胶原蛋白作为结缔组织的主要成分,影响着肌肉的功能和结构特性,同时又影响肌肉的粘连程度和拉伸强度。胶原蛋白的生物合成涉及一系列的复杂过程,除了胶原蛋白基因的转录、翻译外,还要经历翻译后修饰及共价交联等环节。脯氨酸羟化酶(PHD)作为翻译后修饰的重要羟化酶,可以增加分子间氢键的稳定性,若羟基化不完全就不能形成三股螺旋,从而影响前胶原分子分泌到胞外[13]。赖氨酸氧化酶(LOX)作为共价交联过程中唯一参与的酶,会影响胶原纤维成熟交联的数量,若分泌不足可以导致胶原失去弹性和韧性[14]。目前,已有研究表明杜仲可以促进草鱼胶原蛋白相关基因的表达[4],但草鱼PHD、LOX基因全长序列尚未获得。此外,基质金属蛋白酶(MMPs)作为降解细胞外基质的重要蛋白水解酶,同样影响着胶原蛋白的形成。目前在水产动物中,尚未见有关营养素对PHD、LOX以及MMPs基因表达影响的报道。
草鱼是中国养殖产量最高的鱼类,2018年的产量为550多万t[15]。然而,高密度的养殖和大量的投饲,对养殖草鱼肉质产生了不利影响。今后,提高产量已不再是水产养殖的主要任务,在保持可持续水产养殖的同时获得高质量的水产品已成为行业的重要目标[16]。近年来,本实验室开展了一系列关于杜仲[12]及其活性成分绿原酸[17]、槲皮素[18]、京尼平苷[19]和京尼平苷酸[20]等对草鱼生长和肌肉品质影响的研究,但对肌肉品质改善的机制尚不清楚。杜仲对胶原蛋白合成的促进作用是通过哪个环节实现的,以及EL与EB是否具有类似的作用效果尚不清楚。故本试验将EB和EL添加到饲料中喂养草鱼,结合生化和分子水平分析以及肌肉形态学观察,研究其对草鱼生长、肌肉品质和胶原蛋白相关基因表达的影响,为阐释杜仲改善养殖动物生长和肉质的机制提供理论依据。
1 材料与方法 1.1 试验材料EB的产地为陕西省略阳县,剥取时间为当年4月,杜仲的树龄为40年;EL的产地为安徽省霍山县,采摘时间为当年5月,杜仲的树龄为15年。EB、EL的主要活性成分见表 1。
|
|
表 1 EB、EL的主要活性成分(风干基础) Table 1 Main active compounds of EB and EL (air-dry basis) |
对照组饲喂基础饲料,鱼粉添加水平为20 g/kg,粗蛋白质水平为300 g/kg,其他2组饲喂在基础饲料中分别添加20 g/kg EB和40 g/kg EL(相应减少麸皮用量)的试验饲料。EB、EL添加量分别参考Sun等[12]和冷向军等[21]的研究结果。饲料组成及营养水平、饲料氨基酸组成分别见表 2和表 3。所有饲料原料经粉碎过40目筛,充分混匀后,用单螺杆挤压机(SLP-45,中国水产科学研究院渔业机械仪器研究所研制)制成直径为2 mm的沉性颗粒饲料(制粒温度为90~95 ℃),自然风干后置于4 ℃冰箱中储存备用。
|
|
表 2 饲料组成及营养水平(风干基础) Table 2 Composition and nutrient levels of diets (air-dry basis) |
|
|
表 3 饲料氨基酸组成(干物质基础) Table 3 Amino acid composition of diets (DM basis) |
试验选取体质健壮、体重为(59.7±0.2) g的草鱼162尾,随机分配到9个网箱(1.5 m×1.0 m×1.2 m)中,每个网箱18尾,网箱置于室内水泥池中。每天于07:00、12:00和17:00投喂3次,日投喂量为鱼体重的3%~5%,每天记录饲料投喂量,根据鱼的摄食情况适当调整,以投饲后10 min内无残饵为宜,各网箱保持基本一致的投饲量。试验期间24 h充氧,每5 d换水1次,10 d吸污1次,每次换水量约为1/3。饲养周期60 d,饲养期间,水温25~30 ℃,溶氧含量>5 mg/L,pH 7.5~8.0,氨氮含量 < 0.2 mg/L。养殖试验时间为2019年8—10月,在上海海洋大学滨海养殖基地进行。
1.4 样品采集养殖试验结束后,各组鱼饥饿24 h,用MS-222麻醉后,各个网箱称重计数,计算增重率、饲料系数和存活率。每个网箱随机取3尾草鱼用注射器进行静脉采血,并立即离心(4 ℃,3 000 r/min),将血清于-80 ℃冷冻保存备用。取血后,将草鱼左侧侧线上方肌肉于-20 ℃冷冻保存,用于粗蛋白质、粗脂肪、粗灰分、水分、钙、磷、总胶原蛋白和可溶性胶原蛋白含量以及氨基酸组成测定。用于观察胶原蛋白分布的肌肉样品从草鱼右侧背部采集,保存于4%甲醛固定液中。此外,每个网箱随机另取3尾草鱼,取测线上方白肌于-80 ℃保存,用于胶原蛋白相关基因表达的测定。
1.5 测定指标 1.5.1 生长性能增重率、饲料系数、肥满度和存活率计算公式如下:

|
饲料和肌肉水分含量的测定采用105 ℃烘干失水法;粗蛋白质含量的测定采用凯氏定氮法;粗脂肪含量的测定采用氯仿甲醇抽提法;粗灰分含量测定采用马弗炉灰化法;磷含量采用磷钼酸比色法;钙含量采用甲基百里酚蓝比色法。
1.5.3 肌肉与饲料氨基酸组成测定饲料与肌肉氨基酸组成采用氨基酸自动分析仪(S-433D,德国)测定。分别称量50 mg肌肉和饲料干物质,在110 ℃条件下,用6 mol/L盐酸水解24 h。水解完后,取1.0~1.5 mL水解液于进样瓶中进行上机分析。必需氨基酸指数(EAAI)计算公式如下:
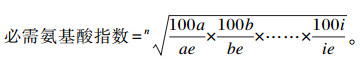
|
式中:n为比较的必需氨基酸个数;a、b、……、i为试验样品蛋白质的必需氨基酸含量;ae、be、……、ie为全鸡蛋蛋白质的必需氨基酸含量。
1.5.4 肌肉胶原蛋白含量测定肌肉总胶原蛋白和热可溶性胶原蛋白含量测定采用羟脯氨酸法(南京建成生物工程研究所测试盒),测定的羟脯氨酸含量乘以系数8得到胶原蛋白含量[17]。
热可溶性胶原蛋白前处理参考Kong等[22]的方法:称取2 g样品与4倍体积的Ringer溶液混合(由0.86% NaCl,0.03% KCl和0.033% CaCl2组成),在10 000 r/min下匀浆1 min,匀浆液在77 ℃下加热70 min,然后以12 000 r/min离心30 min,倾泻上清液,沉淀在同样的溶液中匀浆并再次离心,合并上清液。测定上清液中胶原蛋白含量为热可溶性胶原蛋白含量。

|
将肌肉样品于4%甲醛固定液中固定48 h以上,分别经无水乙醇梯度脱水,二甲苯透明,石蜡包埋,切片(8 μm;Leika RM2235切片机,德国),再经天狼星红染液染色,二甲苯透明,中性树胶封固。光学显微镜下观察肌肉中胶原蛋白分布情况并拍照(Nikon YS100显微摄影系统)。
1.5.6 血清生化指标分析血清葡萄糖(GLU)、总胆固醇(TCHO)、甘油三酯(TG)和乳酸(LA)含量等血清生化指标使用上海哈灵生物科技有限公司生产的相应试剂盒,并通过自动生化分析仪(BS-400,迈瑞)测定。
1.5.7 胶原蛋白相关基因表达测定根据GenBank中草鱼Ⅰ型胶原蛋白α1(COL1A1)、Ⅰ型胶原蛋白α2(COL1A2)、基质金属蛋白酶-2(MMP-2)和基质金属蛋白酶-9(MMP-9)以及实验室前期已克隆的LOX和PHD cDNA全序列设计荧光定量PCR引物(表 4)。使用Trizol试剂提取总RNA,紫外分光光度计和琼脂糖凝胶电泳检测总RNA的浓度和纯度,利用TaKaRa反转录试剂盒(PrimeScriptTM RT)将总RNA反转录为cDNA。荧光定量PCR反应程序如下:95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火10 s,72 ℃延伸30 s,共39个PCR循环,最后进行熔解曲线检测。以对照组草鱼肌肉组织的基因表达量为基准,以18S rRNA作为内参基因,采用2-ΔΔCt法计算EB和EL组肌肉组织COL1A1、COL1A2、PHD、LOX、MMP-2和MMP-9基因相对表达量。
|
|
表 4 实时荧光定量PCR引物 Table 4 Primers for real-time PCR |
试验结果用平均值±标准差表示,采用SPSS 22.0统计软件进行单因素方差分析,差异显著者进行Duncan氏法多重比较,差异显著水平为P < 0.05。
2 结果 2.1 EB和EL对草鱼生长性能的影响由表 5可见,在养殖期间无死亡现象发生,各组草鱼成活率均为100%。与对照组相比,EB、EL组的鱼体增重率分别显著增加3.38%、5.71%(P < 0.05),饲料系数分别显著降低0.06、0.10(P < 0.05)。各组间的肥满度没有显著差异(P>0.05)。
|
|
表 5 EB和EL对草鱼生长性能的影响 Table 5 Effects of EB and EL on growth performance of grass carp |
由表 6可见,与对照组相比,EB、EL组肌肉的水分、粗灰分、粗蛋白质和磷含量均没有显著差异(P>0.05),但肌肉钙、总胶原蛋白和热不溶性胶原蛋白含量显著增加(P < 0.05),粗脂肪含量显著降低(P < 0.05)。
|
|
表 6 EB和EL对草鱼肌肉组成的影响(湿重基础) Table 6 Effects of EB and EL on muscle composition of grass carp (wet weight basis) |
由图 1可见,红色部分反映了肌肉中胶原蛋白的分布,肌肉中胶原蛋白主要分布在肌内膜(EM)和肌束膜(PM)。EB和EL组的红色部分明显多于对照组。

|
A:对照组;B:杜仲皮组;C:杜仲叶组;PM:肌束膜;EM:肌内膜。 A: control group; B: EB group; C: EL group; PM: perimysium; EM: endomysium. 图 1 草鱼肌肉组织切片 Fig. 1 Muscle tissue sections of grass carp |
由表 7可知,在草鱼肌肉中共检测出17种氨基酸。与对照组相比,EB、EL组的肌肉天冬氨酸、丝氨酸、苯丙氨酸、苏氨酸以及总必需氨基酸、总氨基酸含量和必需氨基酸指数显著增加(P < 0.05),其余指标无显著差异(P>0.05)。
|
|
表 7 EB和EL对草鱼肌肉氨基酸组成的影响(干物质基础) Table 7 Effects of EB and EL on muscle amino acid composition of grass carp (DM basis) |
由表 8可知,饲料中添加EB、EL均显著降低血清葡萄糖、总胆固醇、甘油三酯的含量(P < 0.05),且EL组在数值上更低。各组在乳酸含量上无显著差异(P>0.05)。
|
|
表 8 EB和EL对草鱼血清生化指标的影响 Table 8 Effects of EB and EL on serum biochemical indices of grass carp |
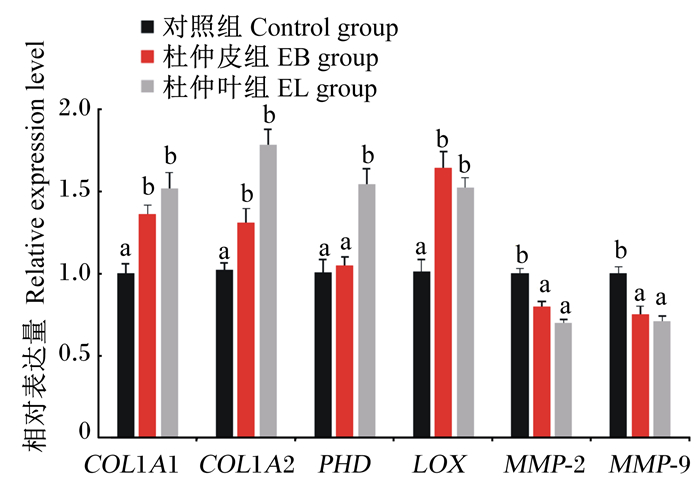
由图 2可知,饲料中添加EB、EL显著提高了肌肉COL1A1、COL1A2和LOX基因相对表达量(P < 0.05),降低了MMP-2、MMP-9基因相对表达量(P < 0.05)。此外,饲料中添加EL还提高了肌肉PHD基因相对表达量(P < 0.05)。
|
COL1A1:Ⅰ型胶原蛋白α1 Ⅰ type collagen α1;COL1A2:Ⅰ型胶原蛋白α2Ⅰ type collagen α2;PHD:脯氨酸羟化酶prolyl hydroxylase;LOX:赖氨酸氧化酶lysyl oxidase;MMP-2 matrix metalloproteinase-2:基质金属蛋白酶-2;MMP-9:基质金属蛋白酶-9 matrix metalloproteinase-9。 数据柱标注不同小写字母表示差异显著(P < 0.05)。 Values columns with different small letter superscripts mean significant difference (P < 0.05). 图 2 EB和EL对草鱼肌肉胶原蛋白合成相关基因相对表达量的影响 Fig. 2 Effects of EB and EL on relative expression of collagen synthesis-related genes in muscle of grass carp |
研究表明,饲料添加20 g/kg EB可提高草鱼[12]和凡纳滨对虾[5]的增重率(7.32%、9.8%),降低饲料系数(0.11、0.13)。此外,黄军等[2]和王福明[3]报道,饲粮中添加EB可以促进兔和鸡等陆生动物的生长性能。有关EL的研究表明,喂养草鱼[21]和青鱼[23]含有40和75 g/kg EL的饲料,其增重率分别提高14.70%、29.26%,饲料系数分别降低0.19、0.20。此外,EL还可以改善羊[6]、兔[8]和猪[9]等陆生动物的生长性能。本试验在饲料中添加20 g/kg EB和40 g/kg EL,草鱼增重率分别提高了3.36%、5.70%,饲料系数分别降低了0.06、0.10,与上述研究结果一致。
杜仲促进养殖动物生长,其原因可能与肠道消化能力改善有关。刘波等[5]和杨改青等[6]在饲料中添加EB、EL显著增加了虾肠道消化酶活性和羊对营养物质的利用率。一般情况下,肠道消化和吸收能力与肠道菌群密切相关。陈晓俊等[24]试验表明,EB可以抑制大肠杆菌和金黄色葡萄球菌等致病菌。石海仁等[25]认为,EL可以降低猪肠道内大肠杆菌和沙门氏菌数量,从而降低腹泻率,这可能与杜仲中酚酸、黄酮和多糖等活性成分有关。研究发现,酚酸[26]、黄酮[27]和多糖类化合物[28]均可以抑制肠道中病原菌的定植,增加有益菌的数量,改善肠道环境,提高肠道对营养物质的吸收。在草鱼的研究中,杜仲活性成分绿原酸[12]、槲皮素[18]和黄芩素[29]均能显著提高其生长性能。故杜仲对草鱼生长性能的改善是其中多种活性成分共同作用的结果。
同时,本试验中观察到EB、EL组的草鱼抢食迅速,食欲旺盛,这种现象在许晓莹等[4]和冷向军等[21]的研究中也有描述。可能是EB、EL中的生物碱、有机酸和黄酮类化合物等刺激了鱼类的摄食。在本试验中,各组投喂量保持基本一致,重在考察饲料质量对草鱼生长的影响,若采用饱食投喂,则EB、EL组的草鱼可能会具有更高的增重率。
3.2 EB和EL对草鱼肌肉品质的影响在鱼类的研究表明,肌肉中胶原蛋白的含量与硬度成正比[30],可作为鱼肉品质评价的重要指标。胶原蛋白可分为可溶性和不可溶性2种。Gordon等[31]认为结缔组织中的差异取决于胶原蛋白纤维之间成熟交联的数量,即不溶性胶原蛋白的部分。Sun等[12]以含20 g/kg EB的饲料喂养草鱼,提高了肌肉中总胶原蛋白和碱不溶性胶原蛋白的含量。本次研究在饲料中添加EB、EL,也显著提高了肌肉总胶原蛋白和热不溶性胶原蛋白含量,肌肉组织的天狼星红染色也可清楚地观察到肌肉胶原蛋白分布(含量)的增加。由此可见,肌肉总胶原蛋白含量的提高,主要来自于不溶性胶原蛋白含量,即增加了成熟交联的数量。
Sun等[19]和冷向军等[21]试验表明,饲料中添加EB、EL可以提高草鱼肌肉总氨基酸和总必需氨基酸含量。本试验中,饲喂EB、EL的草鱼肌肉总氨基酸和总必需氨基酸含量增加,必需氨基酸指数也显著提高。必需氨基酸指数反映了必需氨基酸含量与标准蛋白质相比的接近程度,必需氨基酸指数愈大,营养价值愈高[32]。杜仲中的活性成分绿原酸[12]、京尼平苷[17]以及槲皮素[18]等已被证明可以改善养殖动物肌肉氨基酸组成,提高氨基酸的总量,这些均有助于解释杜仲改善肌肉氨基酸营养的效应。
鱼肉的肌内脂肪含量影响肉质相关特性,与肌肉品质密切相关。本试验中EB、EL显著降低了草鱼肌肉脂肪含量,相似的结果也出现在Sun等[20]和冷向军等[21]的试验中。过高的肌内脂肪含量会影响鱼肉的系水力[33]、质构特性[34],并降低后续加工的质量[35]等。从感官方面,含有过多脂肪的鱼肉,在储存过程中易氧化并散发出不受人欢迎的“腥”味[36],并且还会导致肌肉颜色分布不均匀,影响消费欲望[37]。由此可见,鱼肉脂肪含量的降低,有助于提高肌肉品质。
此外,钙含量也是影响肌肉品质的因素之一。本试验饲料中添加EB、EL增加了草鱼肌肉中钙含量。钙作为机体内含量最多的金属元素,除了参与机体肌肉收缩、神经递质的合成和释放等多种生理过程,还与肌纤维发育[38]、肌肉纤维类型[39]以及肌肉硬度[40]有密切联系。但钙含量变化的机制,目前还不清楚。
3.3 EB和EL对草鱼糖、脂代谢的影响血液中甘油三酯和总胆固醇含量是反映机体脂肪合成与分解代谢的重要指标。EB、EL不仅可降低小鼠血液甘油三酯和总胆固醇含量,还减少了小鼠白色脂肪含量[1]。本试验中,饲料添加EB、EL同样也降低了草鱼血清甘油三酯、总胆固醇含量和肌肉脂肪含量。Kobayashi等[41]和潘永芳等[42]报道,EB、EL可以降低体内甘油三酯、总胆固醇含量,并减少体内脂肪沉积,主要原因是抑制了脂肪合成相关基因表达,促进了脂肪分解相关基因的表达,进而促进脂肪氧化。这种变化与杜仲中的绿原酸、京尼平苷酸、桃叶珊瑚甙等活性成分抑制脂肪的吸收与合成,促进脂肪的分解有关[43]。除活性成分外,EL中还含有丰富的n-3多不饱和脂肪酸(30.8 g/kg,干重)[44],也可抑制肝脏脂肪合成酶,并促进脂肪β氧化相关酶基因的表达[45],这可能是EL组草鱼的血脂和肌肉脂肪含量较EB组更低的原因之一。
鱼类对糖的利用率较低,而饲料中添加EB、EL均降低了血液中的葡萄糖含量,说明杜仲可能提高了草鱼对糖类的利用。在小鼠[46]和羊[7]的研究表明,EB、EL可以降低血液中葡萄糖的含量。孙燕荣等[47]试验证明,EB提取物可以促进脂肪细胞对葡萄糖的转运和消耗,从而降低血糖含量。也有研究发现,EL可以激活肝脏胰岛素分泌相关通路,并上调糖酵解相关酶基因以及下调糖异生相关酶,进而降低血糖[7]。故推测杜仲降低草鱼血清葡萄糖含量,可能是通过促进胰岛素分泌并限制葡萄糖生成实现的,这有待于今后的进一步研究。
3.4 EB和EL对草鱼胶原蛋白相关基因相对表达量的影响鱼类肌肉中的胶原蛋白主要是I型胶原蛋白,由2条α1链(COL1A1)和1条α2链(COL1A2)组成。胶原蛋白的生物合成是从COL1A1和COL1A2基因开始进行转录。许晓莹等[4]在草鱼的研究表明,EB可以提高草鱼肌肉和皮肤中的COL1A1和COL1A2基因表达量。关钧声等[48]发现,EL提取物可以提高大鼠成骨细胞的COL1A1基因表达。在本试验中,EB、EL也提高了草鱼肌肉中COL1A1和COL1A2基因的相对表达量,这可能与杜仲中的活性成分绿原酸、京尼平苷和京尼平苷酸等有关。已有研究表明,饲料中添加上述活性成分,提高了草鱼肌肉中的胶原蛋白含量以及COL1A1基因的相对表达量[17]。
PHD和LOX在胶原蛋白的形成过程中发挥着重要作用,影响着胶原蛋白的稳定性和成熟度。目前在水产动物中,关于PHD、LOX基因表达的营养调控研究尚未见报道。本试验在克隆PHD、LOX基因全长序列的基础上,研究了EB、EL对PHD、LOX基因表达的影响。结果表明,EL显著增加了草鱼肌肉LOX和PHD基因相对表达量,而EB只提高了LOX基因相对表达量。由此可见,EB、EL均可以作用于胶原蛋白合成的共价交联过程,但在羟基化水平有所不同,究竟是其中的何种活性成分在不同阶段发挥作用,有待于今后进一步研究。
此外,胶原的分解过程也影响着肌肉胶原蛋白的含量。参与胶原蛋白降解的酶主要为MMPs,它几乎能降解细胞外基质的所有成分[49]。在鱼类中,Ⅰ型和Ⅴ型胶原蛋白是肌肉最主要的2种胶原蛋白[50],而MMP-2和MMP-9对胶原蛋白的降解作用显著,尤其是Ⅰ、Ⅴ型胶原蛋白[51]。迄今为止,营养素对养殖动物肌肉MMP-2和MMP-9基因的影响尚未见报道。本试验中,EB、EL显著降低了肌肉MMP-2和MMP-9基因相对表达量。由此可见,EB、EL对肌肉胶原蛋白合成的促进效应,是合成代谢提高和分解代谢降低共同作用的结果。
4 结论本试验结果表明,饲料中添加20 g/kg EB和40 g/kg EL可以降低草鱼肌肉脂肪含量和血清葡萄糖、总胆固醇、甘油三酯含量,上调COL1A1、COL1A2、LOX和PHD(仅EL组)基因的表达,下调MMP-2和MMP-9基因的表达,从而提高草鱼的生长性能、饲料利用和肌肉品质。
| [1] |
HUSSAIN T, TAN B E, LIU G, et al. Health-promoting properties of Eucommia ulmoides:a review[J]. Evidence-Based Complementary and Alternative Medicine, 2016, 2016: 5202908. |
| [2] |
黄军, 解领丽, 万美娇, 等. 杜仲皮营养成分分析及其在生长獭兔中应用效果的研究[J]. 黑龙江畜牧兽医, 2017(14): 212-214. |
| [3] |
王福明. 杜仲粉对凉山岩鹰鸡生产性能和免疫功能的影响[J]. 黑龙江畜牧兽医, 2013, 12(23): 143-144. |
| [4] |
许晓莹, 李小勤, 孙文通, 等. 杜仲对草鱼生长、肌肉品质和胶原蛋白基因表达的影响[J]. 水产学报, 2018, 42(5): 787-796. |
| [5] |
刘波, 冷向军, 李小勤, 等. 杜仲对凡纳滨对虾生长、血清非特异性免疫和肌肉成分的影响[J]. 中国水产科学, 2013, 20(4): 869-875. |
| [6] |
杨改青, 王林枫, 廉红霞, 等. 杜仲叶影响绵羊血清代谢组学的研究[J]. 中国畜牧兽医, 2017, 44(07): 1915-1924. |
| [7] |
高燕, 杨改青, 王林枫, 等. 杜仲叶对绵羊肝脏糖代谢及其相关基因表达的影响[J]. 动物营养学报, 2019, 31(6): 2854-2864. |
| [8] |
LI S, ZHAO M Q, JIANG T T, et al. Growth performance and antioxidant status of growing rabbits fed on diets supplemented with Eucommia ulmoides leaves[J]. World Rabbit Science, 2018, 26(1): 35-41. DOI:10.4995/wrs.2018.7864 |
| [9] |
LEE S D, KIM H Y, SONG Y M, et al. The effect of Eucommia ulmoides leaf supplementation on the growth performance, blood and meat quality parameters in growing and finishing pigs[J]. Animal Science Journal, 2009, 80(1): 41-45. |
| [10] |
TANIMOTO S Y, IKUMA K, TAKAHASHI S. Improvement in raw meat texture of cultured eel by feeding of Tochu leaf powder[J]. Bioscience, Biotechnology, and Biochemistry, 1993, 57(2): 205-208. DOI:10.1271/bbb.57.205 |
| [11] |
石英, 冷向军, 李小勤, 等. 杜仲叶提取物对异育银鲫生长、血清非特异性免疫和肌肉品质的影响[J]. 浙江大学学报(农业与生命科学版), 2008, 34(2): 200-206. |
| [12] |
SUN W T, LI X Q, XU H B, et al. Effects of dietary chlorogenic acid on growth, flesh quality and serum biochemical indices of grass carp (Ctenopharyngodon idella)[J]. Aquaculture Nutrition, 2017, 23(6): 1254-1263. DOI:10.1111/anu.12500 |
| [13] |
GORRES K L, RAINES R T. Prolyl 4-hydroxylase[J]. Critical Reviews in Biochemistry and Molecular Biology, 2010, 45(2): 106-124. DOI:10.3109/10409231003627991 |
| [14] |
GRAU-BOVÉ X, RUIZ-TRILLO I, RODRIGUEZ-PASCUAL F. Origin and evolution of lysyl oxidases[J]. Scientific Reports, 2015, 5: 10568. DOI:10.1038/srep10568 |
| [15] |
农业农村部渔业渔政管理局. 中国渔业统计年鉴-2019[M]. 北京: 中国农业出版社, 2019: 25.
|
| [16] |
KOBAYASHI M, MSANGI S, BATKA M, et al. Fish to 2030:the role and opportunity for aquaculture[J]. Aquaculture Economics & Management, 2015, 19(3): 282-300. |
| [17] |
SUN W T, HE M, XU X Y, et al. Comparison study of three compounds in Eucommia ulmoides on growth, flesh quality of grass carp (Ctenopharyngodon idella)[J]. Aquaculture Nutrition, 2019, 25(4): 906-916. DOI:10.1111/anu.12909 |
| [18] |
XU Z, LI X Q, YANG H, et al. Dietary quercetin improved the growth, antioxidation, and flesh quality of grass carp (Ctenopharyngodon idella)[J]. Journal of the World Aquaculture Society, 2019, 50(6): 1182-1195. DOI:10.1111/jwas.12663 |
| [19] |
SUN W T, LI X Q, XU H B, et al. Effects of dietary geniposide on growth, flesh quality, and lipid metabolism of grass carp, Ctenopharyngodon idella[J]. Journal of the World Aquaculture Society, 2017, 48(6): 927-937. DOI:10.1111/jwas.12412 |
| [20] |
SUN W T, XU X Y, LI X Q, et al. Effects of dietary geniposidic acid on growth performance, flesh quality and collagen gene expression of grass carp, Ctenopharyngodon idella[J]. Aquaculture Nutrition, 2018, 24(3): 1112-1121. DOI:10.1111/anu.12650 |
| [21] |
冷向军, 孟晓林, 李家乐, 等. 杜仲叶对草鱼生长、血清非特异性免疫指标和肉质影响的初步研究[J]. 水产学报, 2008, 32(3): 434-440. |
| [22] |
KONG F B, TANG J M, LIN M S, et al. Thermal effects on chicken and salmon muscles:tenderness, cook loss, area shrinkage, collagen solubility and microstructure[J]. LWT-Food Science and Technology, 2008, 41(7): 1210-1222. DOI:10.1016/j.lwt.2007.07.020 |
| [23] |
张青红.饲料中添加杜仲叶粉对青鱼生长、免疫和肉质的影响研究[D].硕士学位论文.南宁: 广西大学, 2015.
|
| [24] |
陈晓俊, 王凤琛, 袁颖, 等. 杜仲皮、杜仲叶、杜仲雄花的药效学比较研究[J]. 甘肃中医学院学报, 2016, 33(5): 5-8. |
| [25] |
石海仁, 滚双宝, 张生伟, 等. 杜仲叶对育肥猪生长性能、胴体性状、抗氧化能力及肠道菌群的影响[J]. 动物营养学报, 2018, 30(1): 350-359. |
| [26] |
PARKAR S G, STEVENSON D E, SKINNER M A. The potential influence of fruit polyphenols on colonic microflora and human gut health[J]. International Journal of Food Microbiology, 2008, 124(3): 295-298. DOI:10.1016/j.ijfoodmicro.2008.03.017 |
| [27] |
SERRA A, MACIÀ A, ROMERO M P, et al. Metabolic pathways of the colonic metabolism of flavonoids (flavonols, flavones and flavanones) and phenolic acids[J]. Food Chemistry, 2012, 130(2): 383-393. DOI:10.1016/j.foodchem.2011.07.055 |
| [28] |
XU X F, XU P P, MA C, et al. Gut microbiota, host health, and polysaccharides[J]. Biotechnology Advances, 2013, 31(2): 318-337. DOI:10.1016/j.biotechadv.2012.12.009 |
| [29] |
徐禛, 杨航, 梁高杨, 等. 黄芩素对草鱼生长性能、血清抗氧化指标和肌肉品质的影响[J]. 水产学报, 2019, 43(11): 2383-2393. |
| [30] |
JOHNSTON I A, ALDERSON R, SANDHAM C, et al. Patterns of muscle growth in early and late maturing populations of Atlantic salmon (Salmo salar L.)[J]. Aquaculture, 2000, 189(3/4): 307-333. |
| [31] |
GORDON M K, HAHN R A. Collagen[J]. Cell and Tissue Research, 2010, 339(1): 247-257. DOI:10.1007/s00441-009-0844-4 |
| [32] |
VALVERDE J C, MARTÍNEZ-LLORENS S, VIDAL A T, et al. Amino acids composition and protein quality evaluation of marine species and meals for feed formulations in cephalopods[J]. Aquaculture International, 2013, 21(2): 413-433. DOI:10.1007/s10499-012-9569-6 |
| [33] |
LØJE H, JENSEN K N, HYLDIG G, et al. Changes in liquid-holding capacity, water distribution and microstructure during chill storage of smoked salmon[J]. Journal of the Science of Food and Agriculture, 2007, 87(14): 2684-2691. DOI:10.1002/jsfa.3031 |
| [34] |
CHAIYAPECHARA S, CASTEN M T, HARDY R W, et al. Fish performance, fillet characteristics, and health assessment index of rainbow trout (Oncorhynchus mykiss) fed diets containing adequate and high concentrations of lipid and vitamin E[J]. Aquaculture, 2003, 219. |
| [35] |
BIRKELAND S, RØRÅ A M B, SKÅRA T, et al. Effects of cold smoking procedures and raw material characteristics on product yield and quality parameters of cold smoked Atlantic salmon (Salmo salar L.) fillets[J]. Food Research International, 2004, 37(3): 273-286. DOI:10.1016/j.foodres.2003.12.004 |
| [36] |
RASMUSSEN R S. Quality of farmed salmonids with emphasis on proximate composition, yield and sensory characteristics[J]. Aquaculture Research, 2001, 32(10): 767-786. DOI:10.1046/j.1365-2109.2001.00617.x |
| [37] |
ESPE M, NORTVEDT R, LIE Ø, et al. Atlantic salmon (Salmo salar, L.) as raw material for the smoking industry.Ⅰ:effect of different salting methods on the oxidation of lipids[J]. Food Chemistry, 2001, 75(4): 411-416. DOI:10.1016/S0308-8146(01)00228-X |
| [38] |
BERCHTOLD M W, BRINKMEIER H, MÜNTENER M. Calcium ion in skeletal muscle:its crucial role for muscle function, plasticity, and disease[J]. Physiological Reviews, 2000, 80(3): 1215-1265. DOI:10.1152/physrev.2000.80.3.1215 |
| [39] |
WU H, NAYA F J, MCKINSEY T A, et al. MEF2 responds to multiple calcium-regulated signals in the control of skeletal muscle fiber type[J]. The EMBO Journal, 2000, 19(9): 1963-1973. DOI:10.1093/emboj/19.9.1963 |
| [40] |
YU E M, XIE J, WANG G J, et al. Gene expression profiling of grass carp (Ctenopharyngodon idellus) and crisp grass carp[J]. International Journal of Genomics, 2014, 2014: 639687. |
| [41] |
KOBAYASHI Y, HIROI T, ARAKI M, et al. Facilitative effects of Eucommia ulmoides on fatty acid oxidation in hypertriglyceridaemic rats[J]. Journal of the Science of Food and Agriculture, 2012, 92(2): 358-365. DOI:10.1002/jsfa.4586 |
| [42] |
潘永芳, 郑国栋, 邱阳阳, 等. 杜仲叶对小鼠脂肪沉积和脂肪代谢的的影响[J]. 营养学报, 2014, 36(4): 398-400. |
| [43] |
HIRATA T, KOBAYASHI T, WADA A, et al. Anti-obesity compounds in green leaves of Eucommia ulmoides[J]. Bioorganic & Medicinal Chemistry Letters, 2011, 21(6): 1786-1791. |
| [44] |
王翔, 胡凤杨, 杨秋玲, 等. 杜仲叶的营养评价及体外抗氧化活性分析[J]. 食品工业科技, 2019, 40(21): 290-299. |
| [45] |
RUSSO G L. Dietary n-6 and n-3 polyunsaturated fatty acids:from biochemistry to clinical implications in cardiovascular prevention[J]. Biochemical Pharmacology, 2009, 77(6): 937-946. DOI:10.1016/j.bcp.2008.10.020 |
| [46] |
吴迪炯, 周鸿, 钱晓玲, 等. 杜仲对小鼠胰岛素抵抗干预作用的研究[J]. 医学研究杂志, 2008, 37(3): 110-112. |
| [47] |
孙燕荣, 董俊兴, 吕秋军, 等. 杜仲对脂肪细胞糖代谢的影响[J]. 中医药学刊, 2004, 22(8): 1552-1553. |
| [48] |
关钧声, 郭海玲, 张紫佳, 等. 杜仲总提物对大鼠成骨细胞增殖、分化及Ⅰ型胶原蛋白表达的影响[J]. 上海中医药杂志, 2014, 48(7): 95-98. |
| [49] |
LAUER-FIELDS J L, JUSKA D, FIELDS G B. Matrix metalloproteinases and collagen catabolism[J]. Peptide Science, 2002, 66(1): 19-32. |
| [50] |
NISHIMOTO M, MIZUTA S, YOSHINAKA R. Characterization of molecular species of collagen in muscles of Japanese amberjack, Seriola quinqueradiata[J]. Food Chemistry, 2004, 84(1): 127-132. |
| [51] |
MICHELIN A C, JUSTULIN L A Jr, DELELLA F K, et al. Differential MMP-2 and MMP-9 activity and collagen distribution in skeletal muscle from pacu (Piaractus mesopotamicus) during juvenile and adult growth phases[J]. The Anatomical Record, 2010, 292(3): 387-395. |




