2. 中国水产科学研究院淡水渔业研究中心, 农业部淡水渔业和种质资源利用重点实验室, 无锡 214081
2. Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization, Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China
随着我国集约化水产养殖业的快速发展,鱼粉短缺问题日益突出。研究人员致力于寻找新的蛋白质饲料源来替代鱼粉,或者利用现代科学技术来提高传统饲料原料中蛋白质的利用率,如对饲料原料进行微生物发酵、酶解、浓缩等预处理。棉籽粕和菜籽粕是配制团头鲂饲料的适宜植物性蛋白质原料,但仍不能完全替代配合饲料中的鱼粉[1-2]。其原因与大多数植物性蛋白质原料一样,即氨基酸不平衡、消化率低、含有抗营养因子等[3]。赖氨酸和蛋氨酸是鱼类的必需氨基酸,在维持水生动物的正常生长发育及蛋白质代谢中起着十分重要的作用[4]。鱼粉被常用的植物蛋白质源替代后,赖氨酸和蛋氨酸是影响鱼类正常生长的最主要限制性氨基酸,影响蛋白质代谢,使鱼类生长缓慢[5-6],但其具体的分子机制仍不清楚。
近年来,鱼类蛋白质的代谢机制受到越来越多的关注。研究证实肠道中的小肽,由于其大多数为氨基酸残基,所以其吸收比单个氨基酸的吸收更加迅速而有效。小肽转运体1(peptide-transporter 1,PepT1)基因的表达对于小肽的吸收与利用具有重要的作用[7]。饲料中添加二肽和游离氨基酸可刺激虹鳟(Oncorhynchus mykiss)和鲤鱼(Cyprinus carpio L.)肠道中PepT1基因的表达[8-9]。雷帕霉素靶蛋白(target of rapamycin,TOR)是一种高度保守的蛋白激酶,在细胞生长中起到感受营养信号和中枢调控因子的作用[10],氨基酸、胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)及蛋白激酶B(protein kinase B,AKT)可以刺激TOR信号通路激活,并通过激活真核细胞起始因子4e结合蛋白(4E-binding protein,4E-BP)和核糖体蛋白S6激酶(ribosomal protein S6 kinase,S6K),抑制4E-BP2的活性,以及提高S6K1活性,在控制细胞生长和蛋白质翻译中发挥关键作用[11]。研究人员已经证实,虹鳟禁食5 d后再喂食时,TOR信号通路可以被激活[12],支链氨基酸能促进以植物蛋白质源为食的虹鳟中TOR基因的表达[10],同时相关研究也证实了氨基酸可以影响建鲤[13-16]、草鱼[17-19]、异育银鲫[20]以及团头鲂[21-22]中TOR基因的表达。
除了TOR信号通路以外,研究人员发现哺乳动物体内氨基酸不足时,氨基酸应答(amino acid response,AAR)信号通路会被激活[23]。饲料中氨基酸的缺乏会被小鼠通过AAR信号通路中的一般性调控阻遏蛋白激酶2(general control nonderepressible 2,GCN2)基因感知,从而抑制体内大多数基因的转录,但是某些特殊基因的转录水平却会显著升高,如激活转录因子4(activating transcription factor 4,ATF4)及其靶基因激活转录因子3(activating transcription factor 3,ATF3)和天冬酰胺合成酶(asparagine synthetase,ASNS)[24]等。研究发现军曹鱼饲料中蛋氨酸缺乏时会显著增加ATF4基因的相对表达水平[25]。但是,在其他淡水鱼种类中并没有类似的报道。
团头鲂(Megalobrama amblycephala)又名武昌鱼,属硬骨鱼纲(Osteichthyes),鲤形目(Cypriniformes),鲤科(Cyprinidae),鳊亚科(Parabramis),鲂属(Megalobrama)[26],其肉质鲜美、生长快、经济价值高,为我国目前主要养殖鱼类之一。氨基酸失衡是限制如棉籽粕、菜籽粕等植物性蛋白质原料在团头鲂配合饲料中应用的最主要因素,因此,本试验分别配制以鱼粉、棉籽粕、菜籽粕为主要蛋白质源的配合饲料,并在棉籽粕、菜籽粕饲料中添加赖氨酸和蛋氨酸等限制性氨基酸达到氨基酸平衡,分析团头鲂摄食不同饲料后蛋白质吸收、代谢及相关信号通路的变化,以了解鱼体对棉籽粕和菜籽粕的吸收和利用的分子机制,为充分利用棉籽粕和菜籽粕提供理论依据。
1 材料与方法 1.1 试验饲料和试验设计以鱼粉为主要蛋白质源配制鱼粉饲料(对照组),分别以棉籽粕和菜籽粕为主要蛋白质源配制棉籽粕饲料和菜籽粕饲料,通过在棉籽粕饲料和菜籽粕饲料中添加赖氨酸和蛋氨酸配制赖氨酸和蛋氨酸水平与鱼粉饲料相当的棉籽粕+氨基酸饲料和菜籽粕+氨基酸饲料。5组试验饲料等氮等脂(粗蛋白质含量31.1%,粗脂肪含量7.6%),其组成及营养水平见表 1。饲料脂肪源为大豆油和卵磷脂。除大豆油外的所有饲料原料经粉碎后过60目孔径分筛,逐级放大混匀后,与大豆油、水混合,使用制粒机(4-2型,中国新昌机械有限公司)制成颗粒状饲料,45 ℃烘干后,密封,-15 ℃保存备用。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experiment diets (DM basis) |
团头鲂幼鱼选自南京农业大学无锡渔业学院试验基地。试验开始前,在循环水养殖系统暂养2周,对其进行驯化。暂养结束后,选择体质健康、规格均匀、平均体重为(19.67±3.89) g的团头鲂幼鱼450尾,随机分成5个组,每组3个重复,每个重复30尾,以重复为单位随机放入15个圆形养殖桶(直径820 mm、高700 mm,300 L/箱)中,采用循环流水控温系统进行养殖。试验期间,每天人工定时投喂4次(08:00、10:30、13:30、16:00),饱食投喂,每天记录死鱼的数量、重量以及饲料摄食量。养殖试验为期9周,养殖期间控制水温为27~29 ℃,pH为7.4~7.8,溶解氧浓度约为6 mg/L。
1.3 样品采集采样前禁食24 h,对每个养殖桶中剩余的鱼体进行计数和称重。在每个养殖桶中随机取3尾鱼,用MS-222(100 mg/L,Sigma)麻醉后,称重解剖,快速取出肝脏和肠道样品(约1 mg),放入RNAiso试剂(TaKaRa)中,-80 ℃冰箱保存,用于后续基因表达分析;取肝脏和肠道样品,分别装入密封袋,-20 ℃冰箱保存,用于后续消化酶活性分析。再从每个养殖桶中随机取2尾鱼,置于-20 ℃冰箱保存,用于后续体成分分析。
1.4 营养成分分析饲料和鱼体水分、粗蛋白质、粗脂肪及粗灰分含量参照AOAC(2003)[27]的方法测定。在105 ℃烘至恒重,测定水分含量;粗蛋白质含量使用凯氏定氮法测定;粗脂肪含量使用索氏抽提法测定;粗灰分含量使用马福炉灼烧法(550 ℃燃烧5 h)测定。
1.5 消化酶和蛋白质代谢相关酶活性分析肝脏和部分肠段样品先分别进行称重后,按组织:生理盐水1 : 9的比例加入生理盐水(8.5 g/L),匀浆10 min,冰浴10 min,4 ℃、6 000×g离心15 min后取上清。按照考马斯亮蓝试剂盒(南京建城生物工程研究所)的方法测定组织上清液蛋白质浓度[28];使用福林-酚试剂法测定肠道中蛋白酶的活性;根据Habte-Tsion等[29]的方法,测定肠道中淀粉酶和脂肪酶的活性;根据Bergmeyer等[30]所建立的分光光度法,利用相应的检测试剂盒(迈瑞医疗国际有限公司)在自动生化分析仪(BS-400,迈瑞)上测定肝脏中谷草转氨酶(GOT)、谷丙转氨酶(GPT)和γ-谷氨酰转肽酶(γ-GT)的活性。
1.6 实时荧光定量PCR(RT-qPCR)分析按RNAiso plus试剂盒(TaKaRa)说明书步骤提取团头鲂幼鱼肝脏和肠道样品的总RNA。使用Nano Drop 2000(Thermo Scientific)检测提取的RNA的质量及浓度。用RNase-free distilled water将RNA样品稀释至20 ng/μL,-80 ℃冻存备用。PCR引物见表 2,ATF3、ATF4和ASNS基因的引物是根据Gao等[31]发布的团头鲂转录组序列,运用NCBI网站工具Primer-BLAST进行设计,所有引物均由生工生物(上海)有限公司合成。
|
|
表 2 PCR引物序列 Table 2 PCR primer sequences |
根据SYBR PrimeScriptTM PLUS RT-PCR one step试剂盒(TaKaRa)说明书,在ABI PRISM 7500 Real-time PCR仪上进行PCR。PCR反应体系为20 μL,包括2 μL总RNA(20 ng/μL)、10 μL one step SYBR RT-PCR buffer(2×)混合液、1.2 μL TaKaRa Ex Taq HS Mix、0.4 μL PrimeScript PLUS RTase Mix、0.8 μL上游引物(10 μmol/L)、0.8 μL下游引物(10 μmol/L)、0.4 μL ROX dyeⅡ(50×)和4.4 μL RNase-free distilled water。反应程序设置如下:42 ℃预变性5 min,95 ℃反应10 s,随后95 ℃变性5 s,60 ℃退火34 s,共进行40个循环,熔解曲线分析设置在50~95 ℃,以验证PCR引物的特异性。目的基因的表达量根据管家基因β-肌动蛋白(β-actin)的表达量进行标定。目的基因的浓度基于阈值循环数(Ct),每个样本的Ct值使用ABI 7500 v2.0.4软件进行测定。选取特定样品进行10倍梯度稀释后,进行标准曲线制作,用来计算目的基因和管家基因的扩增效率,在验证引物扩增效率约为100%后,使用2-ΔΔCt方法[32]分析目的基因的相对表达量。
1.7 计算公式分别按下式计算成活率(survival rate,SR)、增重率(weight gain rate,WGR)、蛋白质效率(protein efficiency ratio,PER)、饲料系数(feed conversion ratio,FCR)、日摄食量(feed intake,FI):

|

|
试验数据使用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),采用Duncan氏法进行组间多重比较,P < 0.05表示差异显著,结果以平均值±标准误(mean±SE)的形式表示。
2 结果与分析 2.1 团头鲂幼鱼的生长性能和饲料利用率由表 3可知,团头鲂幼鱼的SR各组间均无显著差异(P>0.05)。棉籽粕组和菜籽粕组的终重体重和WGR均显著低于鱼粉组(P < 0.05);棉籽粕+氨基酸组的终末体重高于棉籽粕组,低于鱼粉组,但差异均不显著(P>0.05);棉籽粕+氨基酸组的WGR显著高于棉籽粕组(P < 0.05),菜籽粕+氨基酸组的WGR显著高于菜籽粕组(P < 0.05),与鱼粉组无显著差异(P>0.05)。棉籽粕组和菜籽粕组的FCR显著高于鱼粉组(P < 0.05);棉籽粕+氨基酸组的FCR低于棉籽粕组,高于鱼粉组,但差异均不显著(P>0.05);菜籽粕+氨基酸组的FCR显著低于菜籽粕组(P < 0.05),与鱼粉组差异不显著(P>0.05)。棉籽粕组和菜籽粕组的PER显著低于鱼粉组(P < 0.05);棉籽粕+氨基酸组与菜籽粕+氨基酸组的PER分别较棉籽粕组和菜籽粕组升高,但差异不显著(P>0.05),同时与鱼粉组差异也不显著(P>0.05)。团头鲂幼鱼的FI各组间均无显著差异(P>0.05)。
|
|
表 3 团头鲂幼鱼的生长性能及饲料利用率 Table 3 Growth performance and feed utilization of juvenile blunt snout bream |
由表 4可知,各组团头鲂幼鱼的全鱼水分、粗蛋白质、粗脂肪含量均无显著差异(P>0.05)。菜籽粕+氨基酸组的全鱼粗灰分含量显著低于菜籽粕组(P < 0.05)。
|
|
表 4 团头鲂幼鱼的体成分 Table 4 Body composition of juvenile blunt snout bream |
由表 5可知,棉籽粕组肠道中蛋白酶活性显著高于鱼粉组(P < 0.05);棉籽粕+氨基酸组肠道中蛋白酶活性低于棉籽粕组和鱼粉组,但差异不显著(P>0.05);鱼粉组、菜籽粕组和菜籽粕+氨基酸组肠道中蛋白酶活性均无显著差异(P>0.05)。鱼粉组肠道中脂肪酶活性显著高于除菜籽粕+氨基酸组外的其他试验组(P < 0.05)。棉籽粕组肠道中淀粉酶活性显著低于鱼粉组(P < 0.05);棉籽粕+氨基酸组肠道中淀粉酶活性较棉籽粕组显著提高(P < 0.05),接近鱼粉组水平;菜籽粕组肠道中淀粉酶活性与鱼粉组无显著差异(P>0.05);菜籽粕+氨基酸组肠道中淀粉酶活性显著高于菜籽粕组和鱼粉组(P < 0.05)。
|
|
表 5 团头鲂幼鱼的肠道消化酶及肝脏蛋白质代谢相关酶活性 Table 5 Digestive enzyme activities in intestine and protein metabolism-related enzyme activities in liver of juvenile blunt snout bream |
鱼粉组肝脏中GPT活性显著低于棉籽粕组(P < 0.05),低于菜籽粕组,但差异不显著(P>0.05);棉籽粕+氨基酸组和菜籽粕+氨基酸组肝脏中GPT活性均显著低于鱼粉组、菜籽粕组和棉籽粕组(P < 0.05)。各试验组肝脏中GOT活性均显著高于鱼粉组(P < 0.05);棉籽粕+氨基酸组肝脏中GOT活性显著低于棉籽粕组(P < 0.05);菜籽粕+氨基酸组肝脏中GOT活性显著高于菜籽粕组(P < 0.05)。各试验组肝脏中γ-GT活性均显著低于鱼粉组(P < 0.05),各试验组间无显著差异(P>0.05)。
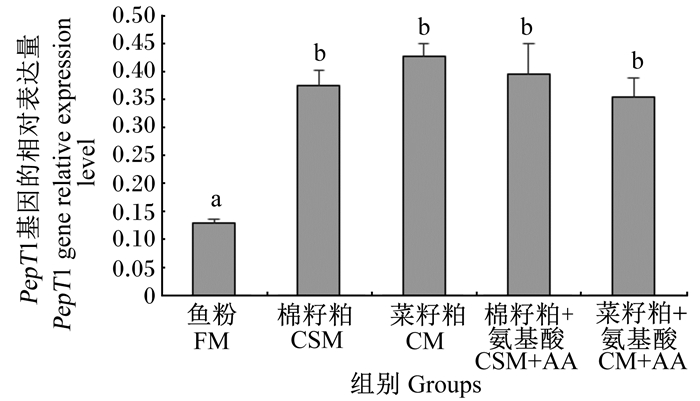
2.4 团头鲂幼鱼肠道中PepT1基因的相对表达量由图 1可知,鱼粉组团头鲂幼鱼肠道中PepT1基因的相对表达量显著低于其他组(P < 0.05),而棉籽粕饲料或菜籽粕饲料中添加氨基酸对肠道中PepT1基因的相对表达量未产生显著影响(P>0.05)。
|
数据柱标注不同字母表示差异显著(P < 0.05),相同字母或无字母表示差异不显著(P>0.05)。下图同。 Data columns with different letters were significantly different (P < 0.05), while with the same or no letters were not significantly different (P>0.05). The same as below. 图 1 PepT1基因在团头鲂幼鱼肠道中的相对表达量 Fig. 1 PepT1 gene relative expression level in intestine of juvenile blunt snout bream |
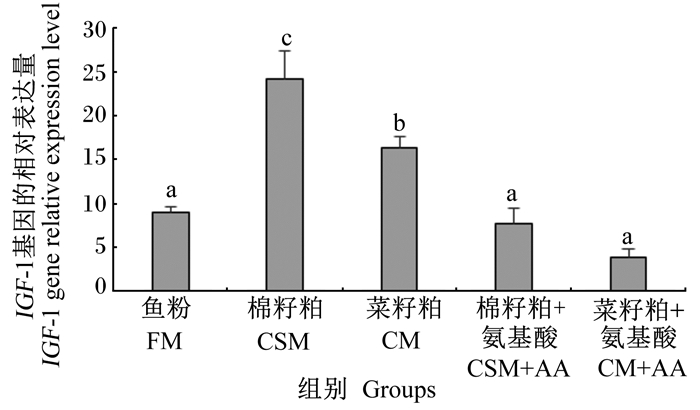
由图 2可知,鱼粉组肝脏中IGF-1基因的相对表达量显著低于棉籽粕组和菜籽粕组(P < 0.05),与棉籽粕+氨基酸组和菜籽粕+氨基酸组无显著差异(P>0.05);棉籽粕饲料与菜籽粕饲料中添加氨基酸后,肝脏中IGF-1基因的相对表达量显著降低(P < 0.05)。
|
图 2 IGF-1基因在团头鲂幼鱼肝脏中的相对表达量 Fig. 2 IGF-1 gene relative expression level in liver of juvenile blunt snout bream |
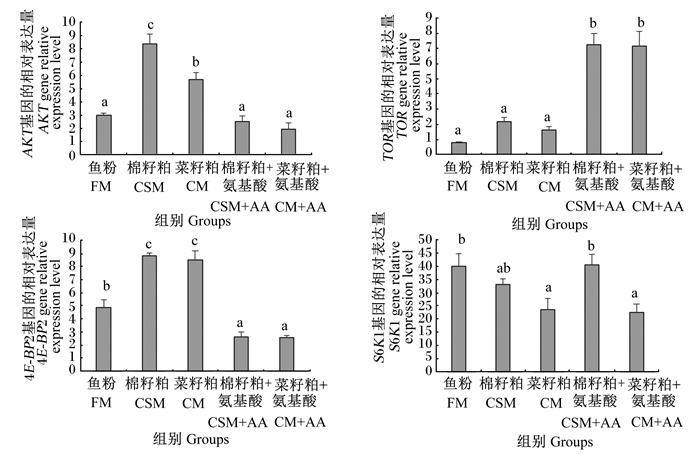
由图 3可知,棉籽粕组和菜籽粕组肝脏中AKT基因的相对表达量显著高于其他组(P < 0.05)。棉籽粕+氨基酸组和菜籽粕+氨基酸组肝脏中TOR基因的相对表达量显著高于其他组(P < 0.05)。棉籽粕组和菜籽粕组肝脏中4E-BP2基因的相对表达量显著高于鱼粉组(P < 0.05);棉籽粕+氨基酸组和菜籽粕+氨基酸组肝脏中4E-BP2基因的相对表达量显著低于其他组(P < 0.05)。菜籽粕组和菜籽粕+氨基酸组肝脏中S6K1基因的相对表达量显著低于鱼粉组(P < 0.05);棉籽粕+氨基酸组和菜籽粕+氨基酸组肝脏中S6K1基因的相对表达量低于鱼粉组,但差异不显著(P>0.05)。
|
图 3 TOR信号通路相关基因在团头鲂幼鱼肝脏中的相对表达量 Fig. 3 TOR signaling pathway-related gene relative expression levels in liver of juvenile blunt snout bream |
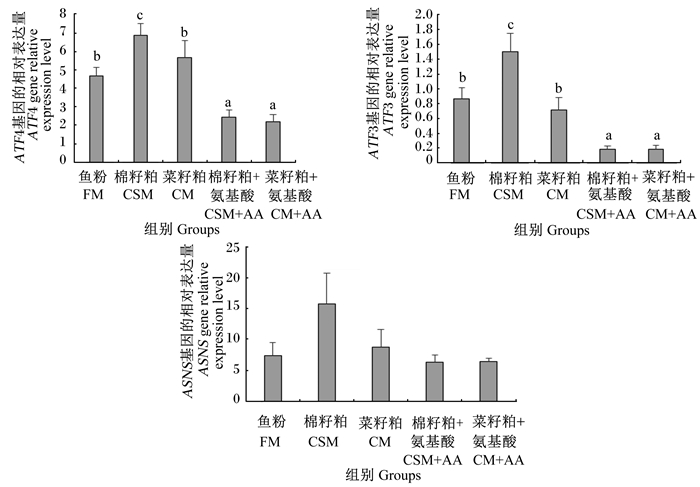
由图 3可知,肝脏中ASNS基因的相对表达量各组间均无显著差异(P>0.05)。棉籽粕+氨基酸组和菜籽粕+氨基酸组肝脏中ATF3基因的相对表达量显著低于鱼粉组和棉籽粕组、菜籽粕组(P < 0.05)。棉籽粕组肝脏中ATF4基因的相对表达量显著高于鱼粉组(P < 0.05);棉籽粕+氨基酸组和菜籽粕+氨基酸组肝脏中ATF4基因的相对表达量均显著低于其他组(P < 0.05)。
|
图 4 AAR信号通路相关基因在团头鲂幼鱼肝脏中的相对表达量 Fig. 4 AAR signaling pathway-related gene relative expression levels in liver of juvenile blunt snout bream |
正如我们所预期的,以棉籽粕、菜籽粕为主要饲料蛋白质源的团头鲂幼鱼的生长性能和饲料利用率均显著低于鱼粉组;在棉籽粕饲料和菜籽粕饲料中添加了赖氨酸、蛋氨酸后,团头鲂幼鱼的生长性能则会得到显著提高。这表明棉籽粕和菜籽粕中的氨基酸不平衡是限制其在配合饲料中大量应用的最主要因素,这已经成为整个水产饲料行业的共识[33]。但有趣的是,本研究发现棉籽粕组和棉籽粕+氨基酸组的饲料利用率低于菜籽粕组和菜籽粕+氨基酸组。由于棉籽粕中的粗蛋白质含量高于菜籽粕,通常我们会认为棉籽粕是比菜籽粕更优质的蛋白质源,但是从本试验的结果来看并不是这样,这提示在评估饲料原料营养价值时除了粗蛋白质含量以外还需要考虑更多的因素,如限制性氨基酸的含量等。Zhou等[1-2]已经证实,在团头鲂饲料中菜籽粕可以替代50%的鱼粉,而棉籽粕只能替代25%的鱼粉。然而,在罗非鱼中,棉籽粕可以替代60%的豆粕[34],而菜籽粕只能替代30%的豆粕[35]。这可能是由于不同物种对不同植物蛋白质源的利用方式不同所导致的。
3.2 棉籽粕、菜籽粕对团头鲂幼鱼体成分的影响在本次试验中,相较鱼粉饲料,投喂棉籽粕饲料和菜籽粕饲料的团头鲂幼鱼的全鱼水分及粗脂肪含量降低,粗蛋白质和粗灰分含量有所提高,但差异均不显著,只有菜籽粕+氨基酸组全鱼粗灰分含量较菜籽粕组显著降低。付熊等[36]研究表明,饲料中添加棉籽粕对虹鳟体成分无显著影响。Yue等[34]和El-Saidy等[37]的研究结果显示,棉籽粕对尼罗罗非鱼肌肉组成成分的影响并不显著。孙盛明等[38]报道,以菜籽粕替代25%的鱼粉时,青鱼的WGR、FCR等与对照组相比并无显著差异。这些结果均与本研究结果基本相似。
3.3 棉籽粕、菜籽粕对团头鲂幼鱼肠道消化酶和肝脏蛋白质代谢相关酶活性的影响本研究结果表明植物蛋白质饲料会导致肠道中蛋白酶活性的增加和脂肪酶活性的降低。该结果与草鱼幼鱼的相关研究结果相似,即投喂植物饲料与投喂动物饲料相比,可以增加肠道蛋白酶活性,降低脂肪酶活性,但影响并不显著[39]。此外,研究发现较高的饲料蛋白质水平可以显著提高团头鲂肠道中蛋白酶和淀粉酶的活性以及降低脂肪酶的活性[29]。菜籽粕对花鲈(Lateolabrax japonicus)的胃蛋白酶、肠道淀粉酶和脂肪酶活性的影响不显著[40],我们推测这可能是由于物种间的差异引起的。同时,本试验结果表明,在棉籽粕饲料和菜籽粕饲料中添加赖氨酸和蛋氨酸后,团头鲂幼鱼肠道中蛋白酶活性降低,淀粉酶活性增加,且菜籽粕+氨基酸组肠道中脂肪酶活性也增加。这表明棉籽粕饲料和菜籽粕饲料中添加适量的赖氨酸和蛋氨酸可以调节团头鲂幼鱼的肠道消化酶活性,使其能够更好地吸收和利用饲料。
与摄食鱼粉饲料相比,摄食棉籽粕饲料和菜籽粕饲料的团头鲂肝脏中GOT和GPT活性显著增加,而在棉籽粕饲料和菜籽粕饲料中添加赖氨酸和蛋氨酸后肝脏中GPT活性则会显著降低,并且在棉籽粕饲料中添加赖氨酸和蛋氨酸还会使肝脏中GOT活性显著降低。这意味着棉籽粕饲料和菜籽粕饲料中添加适量的赖氨酸和蛋氨酸可以降低团头鲂幼鱼肝脏的氨基酸代谢,这在Ren等[22]的报道中得到了证实。
3.4 棉籽粕、菜籽粕对团头鲂幼鱼肠道中PepT1基因和肝脏中IGF-1基因相对表达量的影响饲料中的大部分蛋白质要先被鱼体消化成氨基酸或二肽和三肽后才能被吸收,这些小肽的吸收必须通过肠上皮细胞膜上的小肽转运体[41]。本研究发现,棉籽粕饲料和菜籽粕饲料中无论是否添加赖氨酸和蛋氨酸,都会使团头鲂幼鱼肠道中PepT1基因的相对表达量显著提高。这与在鲤鱼上的研究结果相似,即在饲料中添加二肽和氨基酸后,相较基础植物蛋白质源饲料,肠道中PepT1基因的相对表达量显著增加[9]。然而,在虹鳟饲料中添加二肽和氨基酸并没有出现类似的结果,这可能是由于物种间差异造成的。植物蛋白质源饲料导致肠道中PepT1基因的相对表达量上调,可能是因为植物蛋白质源饲料在肠道中被消化后能产生比鱼粉更多的小肽,或者是因为摄食植物蛋白质源饲料的团头鲂需要吸收更多的小肽以缩小营养差距,在后续的研究中我们将继续进一步深入探讨。此外,由于PepT1基因的表达受到胰岛素调控[42],因此植物蛋白质源饲料组团头鲂幼鱼肠道中PepT1基因表达的上调可能与IGF-1基因表达的上调有关。
哺乳动物中肝脏的中间代谢主要受胰岛素和营养物质调节[12],IGF-1与胰岛素一样在鱼类的生长和代谢中起重要作用[43]。研究证实,饲料蛋白质水平对IGF-1基因的表达产生显著影响[20, 44],饲料中添加蛋氨酸或减少谷胱甘肽能提高草鱼IGF-1基因的相对表达量[43, 45]。本研究结果显示,植物蛋白质源饲料会使团头鲂肝脏中IGF-1基因的相对表达量显著提高,而添加了赖氨酸和蛋氨酸后,IGF-1基因的相对表达量则会显著降低。其原因可能是由于饲料中的植物蛋白质原料抑制了鱼体的生长,导致鱼体释放更多的生长激素,如IGF-1,以促进营养物质的吸收和代谢;当植物蛋白质源饲料中添加了足量的必需氨基酸后,鱼体的生长得到了显著提高,因此不再需要释放特别高水平的生长激素来促进生长。
3.5 棉籽粕、菜籽粕对团头鲂幼鱼TOR信号通路的影响IGF-1、AKT和氨基酸均可以激活TOR信号通路[46]。TOR信号通路被激活后,可以通过抑制4E-BP的活性、激活S6K的活性来促进蛋白质的翻译[47]。4E-BP是一种小分子转录抑制剂,会抑制蛋白质的翻译启动[47]。本研究发现饲料蛋白质源对团头鲂幼鱼肝脏中TOR基因的相对表达量没有显著影响,这与虹鳟[12]的相关报道相似。植物蛋白质源上调下游基因4E-BP2基因的表达、下调S6K1基因的表达,在一定程度上也被生长性能所证实。在植物蛋白质源饲料中添加赖氨酸和蛋氨酸能够显著增加TOR基因的表达,并且降低4E-BP2和AKT基因的表达。适宜的苏氨酸可以增加TOR基因的表达,并且降低肠道内4E-BP2基因的表达[21]。这表明饲料成分的改变会对TOR信号通路产生一定的影响,并且在饲料中添加氨基酸可以激活TOR信号通路,这可能是在植物蛋白质源饲料中添加氨基酸可以显著提高鱼类生长性能的潜在分子机制。
3.6 棉籽粕、菜籽粕对团头鲂幼鱼AAR信号通路的影响已有研究证实饲料中蛋白质缺乏或必需氨基酸失衡会激活AAR信号通路,如上调ATF4基因的表达[23]。本研究发现植物蛋白质源饲料可以显著提高团头鲂幼鱼肝脏中ATF4基因的相对表达量,但该影响并不显著,而在添加赖氨酸和蛋氨酸后,ATF4基因的相对表达量则显著降低。研究发现,ASNS和ATF3基因的表达与ATF4基因的表达相关[24],这与本试验中ATF3基因相对表达量随着ATF4基因相对表达量的下降而下降的结果一致。鱼粉中的氨基酸组成要优于植物蛋白质原料,因此,在植物蛋白质源饲料中AAR信号通路相关基因的表达量是增加的,而在植物蛋白质源饲料中氨基酸组成得到改善后,AAR信号通路相关基因的表达量则有所下降。
4 结论团头鲂幼鱼对棉籽粕和菜籽粕的利用率显著低于鱼粉的主要原因是氨基酸不平衡;氨基酸不平衡会导致与生长和蛋白质代谢相关的TOR信号通路被抑制,同时AAR信号通路被激活,从而最终表现为团头鲂幼鱼的生长性能较差。团头鲂幼鱼在摄食棉籽粕和菜籽粕时,也通过增加肠道中消化酶活性以及上调PepT1、IGF-1基因的表达等,以提高鱼体对饲料的消化吸收能力,促进其生长发育。在棉籽粕饲料和菜籽粕饲料中添加赖氨酸和蛋氨酸后,团头鲂幼鱼的生长性能和饲料利用率均显著提高,这是由于赖氨酸和蛋氨酸上调了TOR信号通路相关基因的表达,降低了AAR信号通路相关基因的表达所致。
| [1] |
ZHOU Q L, HABTE-TSION H M, GE X P, et al. Graded replacing fishmeal with canola meal in diets affects growth and target of rapamycin pathway gene expression of juvenile blunt snout bream, Megalobrama amblycephala[J]. Aquaculture Nutrition, 2018, 24(1): 300-309. DOI:10.1111/anu.12560 |
| [2] |
ZHOU Q L, HABTE-TSION H M, GE X P, et al. Growth performance and TOR pathway gene expression of juvenile blunt snout bream, Megalobrama amblycephala, fed with diets replacing fish meal with cottonseed meal[J]. Aquaculture Research, 2016, 48(7): 3693-3704. |
| [3] |
何远法, 郭勇, 迟淑艳, 等. 低鱼粉饲料中补充蛋氨酸对军曹鱼生长性能、体成分及肌肉氨基酸组成的影响[J]. 动物营养学报, 2018, 30(2): 624-634. |
| [4] |
朱杰.克氏原螯虾和日本沼虾对蛋氨酸需求量的研究[D].硕士学位论文.南京: 南京农业大学, 2014: 2-3.
|
| [5] |
向枭, 周兴华, 曾本和, 等. 蛋氨酸水平对罗非鱼蛋白质代谢及血清生化指标的影响[J]. 中国粮油学报, 2016, 31(11): 92-98, 105. |
| [6] |
尹东鹏, 陈秀梅, 刘丹妮, 等. 乌鳢饲料赖氨酸及其它必需氨基酸营养需求量的研究[J]. 饲料工业, 2018, 39(14): 18-23. |
| [7] |
VERRI T, KOTTRA G, ROMANO A, et al. Molecular and functional characterisation of the zebrafish (Danio rerio) PEPT1-type peptide transporter[J]. FEBS Letters, 2003, 549(1/2/3): 115-122. |
| [8] |
OSTASZEWSKA T, KAMASZEWSKI M, GROCHOWSKI P, et al. The effect of peptide absorption on PepT1 gene expression and digestive system hormones in rainbow trout (Oncorhynchus mykiss)[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2010, 155(1): 107-114. |
| [9] |
OSTASZEWSKA T, DABROWSKI K, KAMASZEWSKI M, et al. The effect of plant protein-based diet supplemented with dipeptide or free amino acids on digestive tract morphology and PepT1 and PepT2 expressions in common carp (Cyprinus carpio L.)[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2010, 157(2): 158-169. |
| [10] |
WACYK J, POWELL M, RODNICK K, et al. Dietary protein source significantly alters growth performance, plasma variables and hepatic gene expression in rainbow trout (Oncorhynchus mykiss) fed amino acid balanced diets[J]. Aquaculture, 2012, 356-357: 223-234. DOI:10.1016/j.aquaculture.2012.05.013 |
| [11] |
WULLSCHLEGER S, LOEWITH R, HALL M N. TOR signaling in growth and metabolism[J]. Cell, 2006, 124(3): 471-484. DOI:10.1016/j.cell.2006.01.016 |
| [12] |
LANSARD M, PANSERAT S, SEILIEZ I, et al. Hepatic protein kinase B (Akt)-target of rapamycin (TOR)-signalling pathways and intermediary metabolism in rainbow trout (Oncorhynchus mykiss) are not significantly affected by feeding plant-based diets[J]. British Journal of Nutrition, 2009, 102(11): 1564-1573. DOI:10.1017/S000711450999095X |
| [13] |
HU K, ZHANG J X, FENG L, et al. Effect of dietary glutamine on growth performance, non-specific immunity, expression of cytokine genes, phosphorylation of target of rapamycin (TOR), and anti-oxidative system in spleen and head kidney of Jian carp (Cyprinus carpio var.Jian)[J]. Fish Physiology and Biochemistry, 2015, 41(3): 635-649. DOI:10.1007/s10695-015-0034-0 |
| [14] |
WU P, JIANG J, LIU Y, et al. Dietary choline modulates immune responses, and gene expressions of TOR and eIF4E-binding protein 2 in immune organs of juvenile Jian carp (Cyprinus carpio var. Jian)[J]. Fish & Shellfish Immunology, 2013, 35(3): 697-706. |
| [15] |
TANG L, FENG L, SUN C Y, et al. Effect of tryptophan on growth, intestinal enzyme activities and TOR gene expression in juvenile Jian carp (Cyprinus carpio var. Jian):studies in vivo and in vitro[J]. Aquaculture, 2013, 412/413: 23-33. DOI:10.1016/j.aquaculture.2013.07.002 |
| [16] |
CHEN G F, FENG L, KUANG S Y, et al. Effect of dietary arginine on growth, intestinal enzyme activities and gene expression in muscle, hepatopancreas and intestine of juvenile Jian carp (Cyprinus carpio var. Jian)[J]. British Journal of Nutrition, 2012, 108(2): 195-207. DOI:10.1017/S0007114511005459 |
| [17] |
JIANG W D, DENG Y P, LIU Y, et al. Dietary leucine regulates the intestinal immune status, immune-related signalling molecules and tight junction transcript abundance in grass carp (Ctenopharyngodon idella)[J]. Aquaculture, 2015, 444: 134-142. DOI:10.1016/j.aquaculture.2015.04.005 |
| [18] |
WEN H L, FENG L, JIANG W D, et al. Dietary tryptophan modulates intestinal immune response, barrier function, antioxidant status and gene expression of TOR and Nrf2 in young grass carp (Ctenopharyngodon idella)[J]. Fish & Shellfish Immunology, 2014, 40(1): 275-287. |
| [19] |
LUO J B, FENG L, JIANG W D, et al. The impaired intestinal mucosal immune system by valine deficiency for young grass carp (Ctenopharyngodon idella) is associated with decreasing immune status and regulating tight junction proteins transcript abundance in the intestine[J]. Fish & Shellfish Immunology, 2014, 40(1): 197-207. |
| [20] |
TU Y Q, XIE S Q, HAN D, et al. Dietary arginine requirement for gibel carp (Carassis auratus gibelio var. CAS Ⅲ) reduces with fish size from 50 g to 150 g associated with modulation of genes involved in TOR signaling pathway[J]. Aquaculture, 2015, 449: 37-47. DOI:10.1016/j.aquaculture.2015.02.031 |
| [21] |
HABTE-TSION H M, REN M C, LIU B, et al. Threonine influences the absorption capacity and brush-border enzyme gene expression in the intestine of juvenile blunt snout bream (Megalobrama amblycephala)[J]. Aquaculture, 2015, 448: 436-444. DOI:10.1016/j.aquaculture.2015.06.030 |
| [22] |
REN M C, HABTE-TSION H M, LIU B, et al. Dietary leucine level affects growth performance, whole body composition, plasma parameters and relative expression of TOR and TNF-α in juvenile blunt snout bream, Megalobrama amblycephala[J]. Aquaculture, 2015, 448: 162-168. DOI:10.1016/j.aquaculture.2015.06.008 |
| [23] |
KILBERG M S, SHAN J, SU N. ATF4-dependent transcription mediates signaling of amino acid limitation[J]. Trends in Endocrinology & Metabolism, 2009, 20(9): 436-443. |
| [24] |
BALASUBRAMANIAN M N, SHAN J X, KILBERG M S. Dynamic changes in genomic histone association and modification during activation of the ASNS and ATF3 genes by amino acid limitation[J]. Biochemical Journal, 2013, 449(1): 219-229. |
| [25] |
WANG Z, MAI K S, XU W, et al. Dietary methionine level influences growth and lipid metabolism via GCN2 pathway in cobia (Rachycentron canadum)[J]. Aquaculture, 2016, 454: 148-156. DOI:10.1016/j.aquaculture.2015.12.019 |
| [26] |
龙萌, 侯杰, 苏玉晶, 等. 酵母硒和茶多酚对团头鲂幼鱼生长和生长轴基因表达、营养品质及抗病力的影响[J]. 水产学报, 2015, 39(1): 97-107. |
| [27] |
AOAC.Methods of analysis of the Association of Official Analytical Chemists[S].15th ed.Washington, D.C.: Association of Official Analytical Chemists, 2003.
|
| [28] |
SESAY D F, HABTE-TSION H M, ZHOU Q L, et al. Effects of dietary folic acid on the growth, digestive enzyme activity, immune response and antioxidant enzyme activity of blunt snout bream (Megalobrama amblycephala) fingerling[J]. Aquaculture, 2015, 452: 142-150. |
| [29] |
HABTE-TSION H M, BO L, GE X P, et al. Effects of dietary protein level on growth performance, muscle composition, blood composition, and digestive enzyme activity of Wuchang bream (Megalobrama amblycephala) fry[J]. The Israeli Journal of Aquaculture-Bamidgeh, 2013, 65: 9. |
| [30] |
BERGMEYER H, BERNT E.Glutamate-oxaloacetate transaminase[M].BERGMEYER H.Methods of enzymatic analysis.New York: Academic Press, 1974.
|
| [31] |
GAO Z X, LUO W, LIU H, et al. Transcriptome analysis and SSR/SNP markers information of the blunt snout bream (Megalobrama amblycephala)[J]. PLoS One, 2012, 7(8): e42637. DOI:10.1371/journal.pone.0042637 |
| [32] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4): 402-408. |
| [33] |
GATLIN D M, BARROWS F T, BROWN P, et al. Expanding the utilization of sustainable plant products in aquafeeds:a review[J]. Aquaculture Research, 2007, 38: 551-579. DOI:10.1111/j.1365-2109.2007.01704.x |
| [34] |
YUE Y R, ZHOU Q C. Effect of replacing soybean meal with cottonseed meal on growth, feed utilization, and hematological indexes for juvenile hybrid tilapia, Oreochromis niloticus×O. aureus[J]. Aquaculture, 2008, 284(1/2/3/4): 185-189. |
| [35] |
ZHOU Q C, YUE Y R. Effect of replacing soybean meal with canola meal on growth, feed utilization and haematological indices of juvenile hybrid tilapia, Oreochromis niloticus×Oreochromis aureus[J]. Aquaculture Research, 2010, 41(7): 982-990. |
| [36] |
付熊, 吴晗冰, 刘行彪, 等. 棉粕及脱毒棉粕替代鱼粉对虹鳟生长、体成分及血清生化指标的影响[J]. 淡水渔业, 2012, 42(4): 35-39, 58. |
| [37] |
EL-SAIDY D M S D, GABER M M. Use of cottonseed meal supplemented with iron for detoxification of gossypol as a total replacement of fish meal in Nile tilapia, Oreochromis niloticus (L.) diets[J]. Aquaculture Research, 2004, 35(9): 859-865. DOI:10.1111/j.1365-2109.2004.01077.x |
| [38] |
孙盛明, 叶金云, 陈建明, 等. 配合饲料中豆粕、菜粕替代鱼粉对青鱼鱼种生长、体组成的影响[J]. 浙江海洋学院学报(自然科学版), 2009, 28(1): 25-31. |
| [39] |
HE S, LIANG X F, LI L, et al. Differential gut growth, gene expression and digestive enzyme activities in young grass carp (Ctenopharyngodon idella) fed with plant and animal diets[J]. Aquaculture, 2013, 410-411: 18-24. DOI:10.1016/j.aquaculture.2013.06.015 |
| [40] |
CHENG Z Y, AI Q H, MAI K S, et al. Effects of dietary canola meal on growth performance, digestion and metabolism of Japanese seabass, Lateolabrax japonicus[J]. Aquaculture, 2010, 305(1/2/3/4): 102-108. |
| [41] |
CHEN H, PAN Y X, WONG E A, et al. Dietary protein level and stage of development affect expression of an intestinal peptide transporter (cPepT1) in chickens[J]. The Journal of Nutrition, 2005, 135(2): 193-198. DOI:10.1093/jn/135.2.193 |
| [42] |
MEREDITH D, BOYD C A R. Structure and function of eukaryotic peptide transporters[J]. Cellular and Molecular Life Sciences, 2000, 57(5): 754-778. |
| [43] |
SHAN L L, LI X Q, ZHENG X M, et al. Effects of feed processing and forms of dietary methionine on growth and IGF-1 expression in Jian carp[J]. Aquaculture Research, 2015, 48(1): 56-67. |
| [44] |
HUANG J F, XU Q Y, CHANG Y M. Effects of temperature and dietary protein on the growth performance and IGF-Ⅰ mRNA expression of juvenile mirror carp (Cyprinus carpio)[J]. Aquaculture Nutrition, 2016, 22(2): 283-292. DOI:10.1111/anu.12254 |
| [45] |
MING J H, YE J Y, ZHANG Y X, et al. Effects of dietary reduced glutathione on growth performance, non-specific immunity, antioxidant capacity and expression levels of IGF-Ⅰ and HSP70 mRNA of grass carp (Ctenopharyngodon idella)[J]. Aquaculture, 2015, 438: 39-46. DOI:10.1016/j.aquaculture.2014.12.038 |
| [46] |
LOEWITH R, HALL M N. Target of rapamycin (TOR) in nutrient signaling and growth control[J]. Genetics, 2011, 189(4): 1177-1201. |
| [47] |
ROUX P P, TOPISIROVIC I. Regulation of mRNA translation by signaling pathways[J]. Cold Spring Harbor Perspectives in Biology, 2012, 4(11): a12252. DOI:10.1101/cshperspect.a012252 |




