2. 抗性基因工程与寒地生物多样性保护黑龙江省重点实验室, 齐齐哈尔 161006
2. Heilongjiang Provincial Key Laboratory of Resistance Gene Engineering and Protection of Biodiversity in Cold Areas, Qiqihar University, Qiqihaer 161007, China
蒲公英(Taraxacum officinale)为菊科类蒲公英属多年生草本植物[1],又名婆婆丁、黄花地丁等[2],种类繁多,分布广泛[3-5]。蒲公英主要含有蛋白质、脂肪、碳水化合物、磷、铁、钙、胡萝卜素、维生素C、多种氨基酸等营养成分[6]。有研究表明,蒲公英具有广泛的生物作用,如抗氧化、抗炎、抗癌、抗高血糖作用,其提取物已被用于抗血栓、抗菌和抗病毒[7-9],蒲公英多糖是其提取物中主要活性成分之一,能够有效清除自由基,并且还可以提高机体免疫力、抗菌、抗病毒、抗肿瘤、抗寄生虫等作用,在食品、医药和保健品等领域已得到应用[10]。Huang等[11]研究发现,蒲公英多糖和黄酮具有较强的自由基清除能力,可以达到抗氧化的目的。王珅等[12]研究发现,蒲公英多糖能提高肉鸡的抗氧化能力。目前关于多糖对抗氧化酶影响的研究较多,但对抗氧化基因表达影响的研究较少。因此,本研究拟以不同浓度的蒲公英多糖连续灌胃小鼠,从酶学及分子水平研究其对小鼠抗氧化酶活性及抗氧化基因表达的影响,为进一步开发利用蒲公英提供理论依据。
1 材料与方法 1.1 试验材料试验动物及饲粮:48只5周龄无特定病原体(SPF)级ICR雄性小鼠及基础饲粮购自吉林省长春市亿斯实验动物技术有限责任公司。
主要试剂:总蛋白标准品、总抗氧化能力(T-AOC)试剂盒、超氧化物歧化酶(SOD)活性试剂盒、考马斯亮蓝蛋白含量试剂盒、谷胱甘肽过氧化物酶(GSH-Px)活性试剂盒、丙二醛(MDA)含量试剂盒均购自南京建成生物工程研究所;实时荧光定量PCR(qRT-PCR)试剂盒购自北京百泰克生物技术有限公司;纯度90%蒲公英多糖购自南京道斯夫生物科技有限公司。
仪器设备:7220-G可见分光光度计(上海精密科学仪器有限公司)、TGL-16M高速台式冷冻离心机(湖南湘仪实验室仪器开发有限公司)、数显恒温水浴锅DK-S26(上海三发科学仪器有限公司)、DYY-7C型电泳仪(北京市六一仪器厂)、BS-124S电子天平(德国赛多利斯股份公司)、TH-86-340-LA(-80 ℃)超低温冰箱(北京天地精仪科技有限公司)、TS-DI-20L/H实验室超纯水设备(陶氏水处理设备工程有限公司)、Applied biosystems PCR仪(美国应用生物系统公司)。
1.2 试验方法将48只ICR雄性小鼠[(22.00±2.00) g]按体质量随机分为4组:对照组、高浓度蒲公英多糖组[600 mg/(kg·d)]、中浓度蒲公英多糖组[300 mg/(kg·d)]、低浓度蒲公英多糖组[150 mg/(kg·d)],每组3个重复,每个重复4只,组间体质量差异不显著(P>0.05),各组均饲以基础饲粮,自由饮水,自然光照。蒲公英多糖组每天定时灌胃不同浓度蒲公英多糖1次,对照组灌胃等量的生理盐水,连续4周。末次灌胃后禁食24 h,断颈处死,取血液,离心制备血清,于冰块上迅速解剖取肝脏,用预冷生理盐水洗去肝脏血渍,滤纸吸干,置于-80 ℃冰箱中保存备用。
1.3 检测指标 1.3.1 抗氧化酶活性测定按试剂盒说明对各组样本的血清和肝脏组织进行处理,并测定T-AOC、SOD、GSH-Px活性和MDA的含量。
1.3.2 抗氧化酶相关基因表达测定从-80 ℃冰箱中取出4个组的小鼠肝脏样品,使用Trizol法提取样品的总RNA,利用Prime ScriptTM RT试剂盒把总RNA反转录成cDNA,以反转录合成的cDNA为模板,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,进行qRT-PCR检测,用2-△△Ct计算所得数据,得到铜锌超氧化物歧化酶(Cu-Zn SOD)、锰超氧化物歧化酶(Mn-SOD)、谷胱甘肽过氧化物酶-1(GPX-1)、谷胱甘肽过氧化物酶-4(GPX-4)mRNA相对表达量。引物均由上海生物工程有限公司设计并合成,引物序列见表 1。
|
|
表 1 引物序列 Table 1 Primer sequence |
利用SPSS 21.0软件进行数据统计分析。文中数据均以平均值±标准误表示,P>0.05表示组间差异不显著,P < 0.05表示组间差异显著,P < 0.01表示组间差异极显著;利用Origin 2017 64Bit作图。
2 结果与分析 2.1 蒲公英多糖对小鼠肝脏中SOD、GSH-Px活性、T-AOC和MDA含量的影响由表 2可知,灌胃4周后,低浓度组、中浓度组和高浓度组肝脏中SOD、GSH-Px活性、T-AOC均显著高于对照组(P < 0.05);低浓度组、中浓度组和高浓度组肝脏MDA含量均显著低于对照组(P < 0.05)。
|
|
表 2 不同浓度蒲公英多糖对小鼠肝脏中SOD、GSH-Px活性、T-AOC和MDA含量的影响 Table 2 Effects of different concentrations of dandelion polysaccharide on SOD, GSH-Px activities, T-AOC and MDA content in liver of mouse |
由表 3可知,灌胃4周后,低浓度组、中浓度组和高浓度组血清SOD、GSH-Px活性、T-AOC均显著高于对照组(P < 0.05);低浓度组、中浓度组和高浓度组血清MDA含量均显著低于对照组(P < 0.05)。
|
|
表 3 不同浓度蒲公英多糖对小鼠血清中SOD、GSH-Px活性、T-AOC和MDA含量的影响 Table 3 Effects of different concentrations of dandelion polysaccharide on SOD, GSH-Px activities, T-AOC and MDA content in serum of mouse |
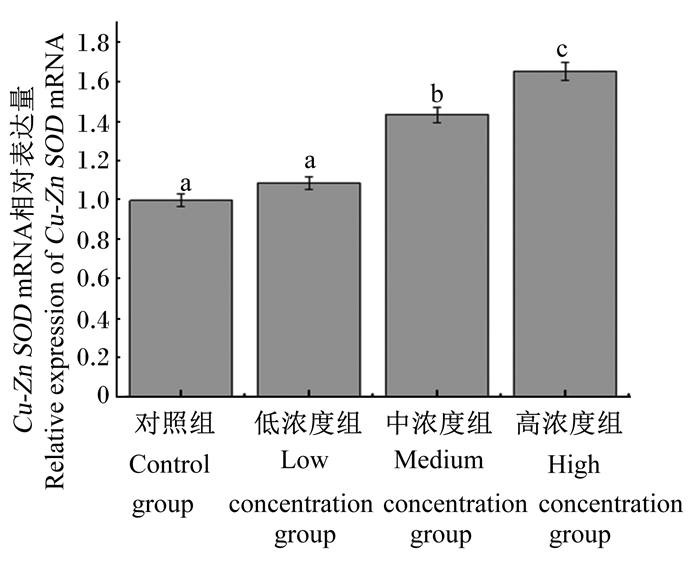
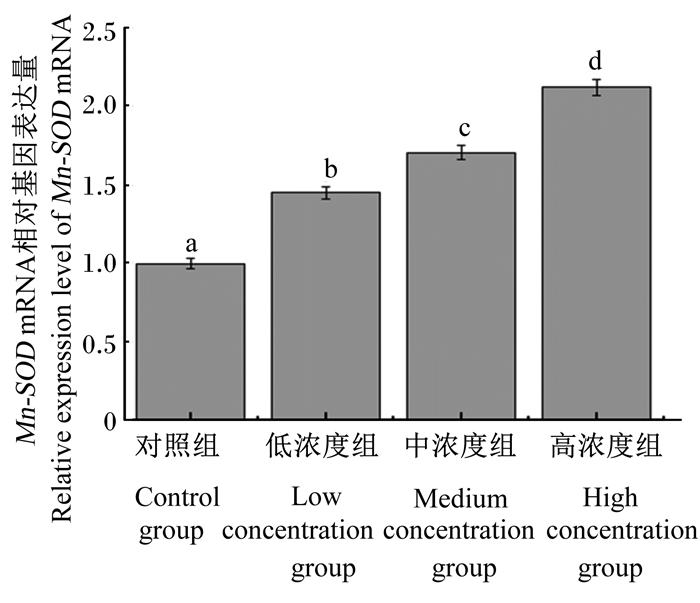
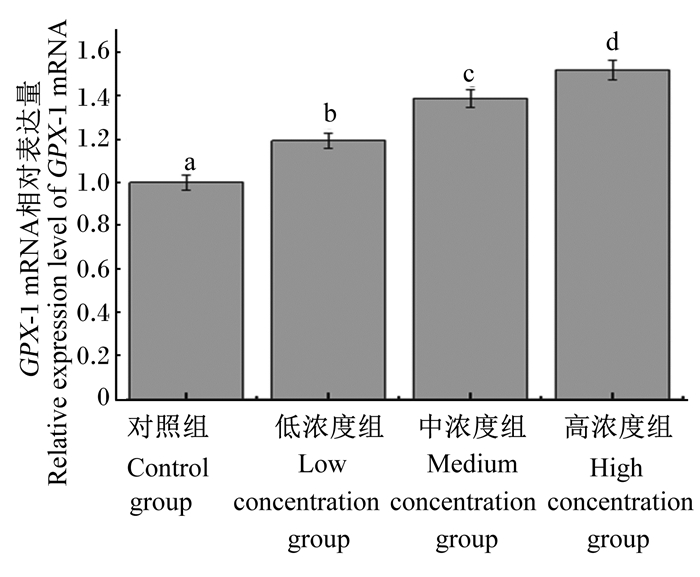
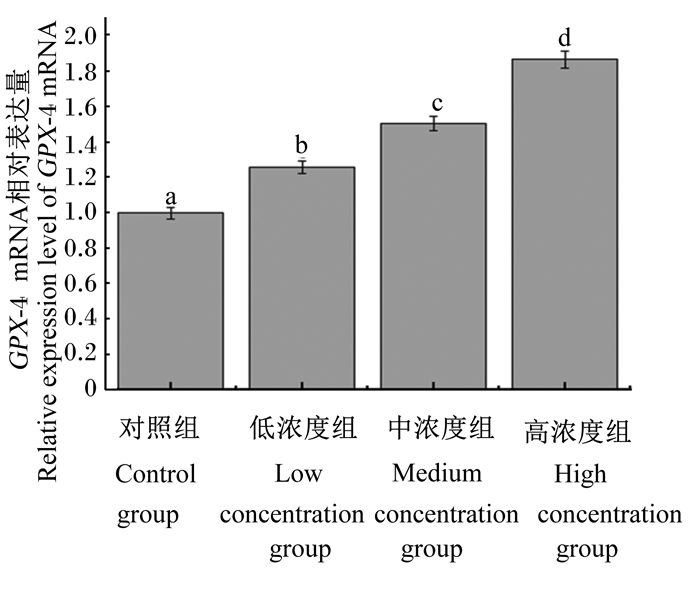
由图 1、图 2、图 3、图 4可知,灌胃4周后,低浓度组和对照组肝脏Cu-Zn SOD mRNA相对表达量差异不显著(P>0.05),中浓度组、高浓度组Cu-Zn SOD mRNA相对表达量显著高于对照组(P < 0.05)。低浓度组、中浓度组、高浓度组肝脏中Mn-SOD、GPX-1、GPX-4 mRNA相对表达量均显著高于对照组(P < 0.05)。
|
不同小写字母表示差异显著(P < 0.05),相同字母表示差异不显著(P>0.05)。下图同。 图 1 不同浓度蒲公英多糖对小鼠肝脏Cu-Zn SOD mRNA相对表达量的影响 Fig. 1 Effects of different concentrations of dandelion polysaccharide on Cu-Zn SOD mRNA relative expression level in liver of mouse |
|
图 2 不同浓度蒲公英多糖对小鼠肝脏Mn-SOD mRNA相对表达量的影响 Fig. 2 Effects of different concentrations of dandelion polysaccharide on Mn-SOD mRNA relative expression level in liver of mouse |
|
图 3 不同浓度蒲公英多糖对小鼠肝脏GPX-1 mRNA表达量的影响 Fig. 3 Effects of different concentrations of dandelion polysaccharide on GPX-1 mRNA relative expression level in liver of mouse |
|
图 4 不同浓度蒲公英多糖对小鼠肝脏GPX-4 mRNA相对表达量的影响 Fig. 4 Effects of different concentrations of dandelion polysaccharide on GPX-4 mRNA relative expression level in liver of mouse |
蒲公英多糖能够有效清除自由基延缓衰老。甘伟发[13]研究发现,茶枝柑皮提取物中多糖成分能降低D-半乳糖致衰老小鼠体内MDA含量,提高SOD和GSH-Px活性。Zhang等[14]研究表明,杏鲍菇多糖能够显著提高链霉素菌诱发的肾病小鼠肾脏中GSH-Px、SOD、CAT的活性和降低MDA的含量,减轻病理性肾病损害。Wang等[15]研究发现,五味子多糖能显著降低急性肝损伤小鼠血清中MDA的含量,显著提高GSH-Px活性,并可减轻小鼠的肝脏病理程度,推测五味子多糖对肝损伤小鼠的保护作用可能与其抗氧化、抗炎和抗凋亡特性有关。本试验以150、300、600 mg/(kg·d)浓度蒲公英多糖灌胃ICR小鼠,结果表明,蒲公英多糖能显著提高ICR小鼠的抗氧化酶活性,并且随着蒲公英多糖浓度的升高,小鼠血清和肝脏中SOD、GSH-Px活性、T-AOC显著提高,MDA含量显著降低,与上述研究结果一致,笔者认为本试验中灌胃蒲公英多糖提高ICR小鼠的抗氧化能力可能有以下几个方面的原因:1)可能是蒲公英多糖分子作用于抗氧化酶,通过提高ICR小鼠体内SOD、GSH-Px等抗氧化酶的活性,间接发挥抗氧化作用;2)可能是蒲公英多糖结构中的醇羟基与产生羟基自由基所必须的金属离子(如Fe2+、Cu2+等)络合,使羟基自由基的产生受到抑制,进而影响脂质过氧化的启动,最终抑制活性氧的产生和自由基的形成,减少自由基对不饱和脂肪酸的氧化,降低ICR小鼠血清和肝脏中MDA的含量;3)蒲公英多糖分子直接作用于自由基本身,捕获脂质过氧化链式反应中产生的活性氧,阻断或减缓脂质过氧化的进行;其碳氢链上的氢原子可以与羟基结合成水,与超氧阴离子自由基发生氧化反应,以达到清除的目的;4)蒲公英多糖还可能通过减少自由基对ICR小鼠体内蛋白质和DNA等的损伤和对机体新陈代谢的干扰,保护线粒体内过氧化氢酶的活性,起到抗氧化作用。
刘波等[16]研究当归多糖对石斑鱼抗氧化酶活性及相关基因表达的影响,发现试验组石斑鱼血浆和肝脏中抗氧化基因Cu-Zn SOD、Mn-SOD的表达量显著高于对照组。徐亚萍[17]研究发现,淫羊藿多糖能提高小鼠子宫内Mn-SOD和GPX-1基因的相对表达量。刘功成[18]的试验表明,重楼多糖对小鼠抗氧化相关基因mRNA表达量有显著提高作用。本试验以150、300、600 mg/(kg·d)浓度蒲公英多糖灌胃ICR小鼠,结果表明,蒲公英多糖能显著上调氧化应激因子Cu-Zn SOD、Mn-SOD、GPX-1、GPX-4 mRNA相对表达量,与上述试验结果一致。大量研究表明,Kelch样环氧氯丙烷相关蛋白1-红系衍生的核因子2相关因子-抗氧化反应元件(Keap1-Nrf2-ARE)信号通路是机体最重要的内源性抗氧化应激通路,可调控多种Ⅱ相解毒酶(如GPX)和抗氧化酶(Cu-Zn SOD等)基因的表达,这些酶存在于各种细胞器和亚细胞群中一起参与代谢反应[19],Nrf2是调控细胞内对氧化应激应答和外源物质代谢的一个关键转录因子,它通过与ARE结合,上调ARE相关抗氧化基因表达,包括编码细胞内内源性抗氧化剂、Ⅱ相解毒酶和转录子的基因类决定细胞生存或死亡。受Nrf2调控的蛋白持续表达对细胞氧化还原维持内环境稳定起到非常关键的作用,已经证实,许多天然或合成的小分子化合物可通过激活Nrf2/ARE途径保护细胞免受有毒或致癌物质的伤害,抵抗各种病理条件下的应激反应[20]。本试验通过测定灌胃蒲公英多糖后ICR小鼠肝脏SOD等抗氧化酶相关基因mRNA的表达和抗氧化酶类活性,证明该多糖能提升小鼠体内防御系统的抵抗能力,包括SOD活性和T-AOC;降低氧化反应产物如MDA的积累,同时,提升许多抗氧化酶基因如Cu-Zn SOD、Mn-SOD、GPX-1、GPX-4 mRNA的表达。但本试验灌胃蒲公英多糖后,ICR小鼠肝脏组织中SOD1、SOD2、GPX-1、GPX-4 mRNA相对表达量升高是否受Keap1-Nrf2-ARE信号通路的调控将在后续试验中进行研究。
4 结论蒲公英多糖具有较强的抗氧化能力,能够上调抗氧化应激因子Cu-Zn SOD、Mn-SOD、GPX-1和GPX-4 mRNA相对表达量,从而增加抗氧化酶活性,清除自由基离子对机体的损害,且随着蒲公英多糖浓度的增加,组间差异显著。
| [1] |
刘华清, 王天磷. 蒲公英水溶性化学成分研究[J]. 中药材, 2014, 37(6): 989-991. |
| [2] |
段红波, 梁引库. 蒲公英多酚的提取及其活性研究[J]. 中国食品添加剂, 2017(3): 80-86. |
| [3] |
ZHANG J C, CHEN J. The effects of Taraxacum officinale extracts (TOE) supplementation on physical fatigue in mice[J]. African Journal of Traditional, Complementary and Alternative Medicines, 2011, 8(2): 128-133. |
| [4] |
XUE Y S, ZHANG S M, DU M, et al. Dandelion extract suppresses reactive oxidative species and inflammasome in intestinal epithelial cells[J]. Journal of Functional Foods, 2017, 29: 10-18. DOI:10.1016/j.jff.2016.11.032 |
| [5] |
MINGARRO D M, PLAZA A, GALÁN A, et al. The effect of five Taraxacum species on in vitro and in vivo antioxidant and antiproliferative activity[J]. Food & Function, 2015, 6(8): 2787-2793. |
| [6] |
周伟, 邵荣, 吴俊, 等. 蒲公英黄酮的超声辅助提取工艺研究[J]. 安徽农业科学, 2012, 40(5): 2696-2698. |
| [7] |
JEON H J, KANG H J, JUNG H J, et al. Anti-inflammatory activity of Taraxacum officinale[J]. Journal of Ethnopharmacology, 2008, 115(1): 82-88. DOI:10.1016/j.jep.2007.09.006 |
| [8] |
MAJEWSKI M, LIS B, JUSKIEWICZ J, et al. Phenolic fractions from dandelion leaves and petals as modulators of the antioxidant status and lipid profile in an in vivo study[J]. Antioxidants, 2020, 9(2): 131. DOI:10.3390/antiox9020131 |
| [9] |
REHMAN S, IJAZ B, FATIMA N, et al. Therapeutic potential of Taraxacum officinale against HCV NS5B polymerase:in-vitro and in silico study[J]. Biomedicine & Pharmacotherapy, 2016, 83: 881-891. |
| [10] |
葛明明, 缪月英, 孙丽娜, 等. 蒲公英根多糖的抗氧化活性研究[J]. 黑龙江医药科学, 2014, 37(2): 39-41. |
| [11] |
HUANG D, GU Y. Comparison of DPPH scavenging ability of flavonoid and polysaccharide from dandelion (Taraxacum mongolicum)[J]. Animal Husbandry and Feed Science, 2016, 8(6): 336-338, 343. |
| [12] |
王珅, 毕聪明, 陈强, 等. 蒲公英多糖对肉鸡血清生化指标及抗氧化指标的影响[J]. 畜牧与兽医, 2015, 47(5): 74-76. |
| [13] |
甘伟发.茶枝柑皮提取物中多糖成分的分离纯化及抗氧化活性研究[D].硕士学位论文.广州: 广东药学院, 2013: 1-64.
|
| [14] |
ZHANG C, ZHANG L, LIU H, et al. Antioxidation, anti-hyperglycaemia and renoprotective effects of extracellular polysaccharides from Pleurotus eryngii SI-04[J]. International Journal of Biological Macromolecules, 2018, 111: 219-228. DOI:10.1016/j.ijbiomac.2018.01.009 |
| [15] |
WANG K P, BAI Y, WANG J, et al. Inhibitory effects of Schisandra chinensis on acetaminophen-induced hepatotoxicity[J]. Molecular Medicine Reports, 2014, 9(5): 1813-1819. DOI:10.3892/mmr.2014.2004 |
| [16] |
刘波, 王庆奎, 邢克智, 等. 喂食当归多糖对点带石斑鱼抗氧化酶活力及其基因表达的影响[J]. 江苏农业科学, 2018, 46(18): 172-175. |
| [17] |
徐亚萍.淫羊藿苷和淫羊藿多糖对卵泡发育与抗氧化作用的影响[D].硕士学位论文.南京: 南京农业大学, 2016: 1-70.
|
| [18] |
刘功成.重楼多糖对衰老模型小鼠免疫功能和抗氧化能力的影响[D].硕士学位论文.雅安: 四川农业大学, 2015: 1-24.
|
| [19] |
HU C, KITTS D D. Dandelion (Taraxacum officinale) flower extracts uppresses both reactive oxygen species and nitric oxideand prevents lipid oxidation in vitro[J]. Phytomedicine, 2005, 12(8): 588-597. DOI:10.1016/j.phymed.2003.12.012 |
| [20] |
张婷.抗氧化基因在大豆异黄酮抑制内皮细胞氧化应激损伤中的作用及机制研究[D].博士学位论文.重庆: 第三军医大学, 2012: 1-133.
|




