党参(Codonopsis pillosula,CP)是一种被广泛使用的药食两用植物,在传统中药中常用于补益,具有补中益气、健脾益肺等功效[1]。大量研究表明,党参具有显著的免疫增强作用[2-4]和促生长作用[5],可作为绿色饲料添加剂使用,而党参多糖是其发挥功效的重要有效成分之一[6],经证实,多糖在党参活性成分中所占比重最大[7],具有重要的应用价值。彭梅等[8]给小鼠灌服不同剂量的党参多糖后,小鼠的增重率和食物利用率显著提高;朱希春等[9]在饲粮中添加2%的党参多糖显著改善了仔猪的生长性能,促进了仔猪的生长。研究过程中如何提高党参多糖的免疫增强或促生长作用成为人们更为关注的问题,而新剂型可以有效提高药物作用效果。但是,目前对党参多糖免疫调节和促生长方面的研究多进行的是提取物或普通口服液产生的相关影响[10-12],新剂型的相关研究未见系统报道,因此寻找适当的新剂型以提高党参多糖的免疫增强作用具有重大意义。纳米乳(nanoemulsion,NE)是由油相和水相在乳化剂和助乳化剂作用下形成的稳定胶体体系,包括水包油型(O/W)、油包水型(W/O)和双连续型(W/O/W和O/W/O)[13],作为药物载体使用具有增强药物稳定性、提高生物利用度等作用[14],同时可灵活选择给药途径,也可直接作为饲料添加剂使用。因此,本研究拟通过注射氢化可的松建立免疫抑制小鼠,以党参多糖水溶液(Codonopsis pillosula polysaccharide solution,CPPS)作为对照药,旨在研究党参多糖纳米乳(CPPS-NE)对机体的免疫调节作用,通过分析胸腺指数、脾脏指数、碳粒廓清指数及血清溶血素、肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)、白细胞介素-2(IL-2)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、白细胞介素-12(IL-12)含量,以及剂量与效果的依赖关系,为CPPS-NE作为免疫增强剂应用提供理论依据。
1 材料与方法 1.1 试剂与仪器党参多糖(自提,水提法,得率15.66%);氢化可的松(C10382289)购自上海麦克林生物科技有限公司;TNF-α、IFN-γ、IL-2、IL-6、IL-10、IL-12试剂盒购自上海联硕生物科技有限公司;聚氧乙烯氢化蓖麻油(HEL-40)、肉豆蔻酸异丙酯(IPM)、吐温-80均购自成都艾科达化学试剂有限公司。
探头超声仪(03040518系列,江苏伟禾生物科技有限公司);漩涡振荡器(VORTEX-5,海门市其林贝尔仪器有限公司);酶标仪(ELX800,美国伯腾仪器有限公司)。
1.2 试验动物SPF级小鼠(体质量18~22 g/只)购自南京市江宁区青龙山动物繁殖场,许可证号:SCXK(苏)2017-0001。
1.3 W/O/W型CPPS-NE的制备采用两步法制备:第1步制备W/O型初乳,第2步制备W/O/W型CPPC-NE。以IPM为油相,吐温-80为乳化剂,HEL-40为助乳化剂,按体积比8 : 7 : 3混合均匀,在探头超声作用下,缓慢向混合物中滴加CPPS,直至体系由浑浊变为澄清透明,形成W/O型初乳。另取W/O型初乳为油相,HEL-40为乳化剂,丙三醇为助乳化剂,蒸馏水为水相,按体积比1 : 1 : 1 : 4混合后,涡旋振荡5 min,体系呈现均一、半透明状态,形成W/O/W型CPPS-NE。
1.4 试验动物分组与给药将320只小鼠分成4个单元,每个单元80只。在试验条件下适应性喂养3 d,将每个单元的80只小鼠随机分为空白对照组(KD组),模型对照组(MD组),CPPS-NE高(CPPS-NE-1组)、中(CPPS-NE-2组)、低(CPPS-NE-3组)剂量组,CPPS高(CPPS-1组)、中(CPPS-2组)、低(CPPS-3组)剂量组,每组10只(雌雄各占1/2),KD和MD组以0.2 mL生理盐水灌胃;CPPS-NE-1、CPPS-NE-2、CPPS-NE-3组分别以0.3、0.2、0.1 mL CPPS-NE灌胃,剂量分别为900、600、300 mg/kg BW;CPPS-1、CPPS-2、CPPS-3组分别以0.3、0.2、0.1 mL CPPS灌胃,剂量分别为900、600、300 mg/kg BW。连续灌胃14 d,1次/d。第1单元测定碳粒廓清指数;第2单元测定小鼠胸腺和脾脏指数;第3单元测定血清溶血素含量;第4单元测定血清细胞因子含量。
1.5 免疫抑制小鼠模型建立除空白对照组外,其余组在给药第1天连续每天皮下注射氢化可的松25 mg/kg,连续注射7 d。
1.6 小鼠碳粒廓清指数和胸腺指数、脾脏指数测定末次给药0.5 h后,按体重尾静脉注射10 g/0.05 mL生理盐水4倍稀释的印度墨汁,分别在注射后的2和10 min眼眶采血20 μL,加入0.1%碳酸钠溶液2 mL处理后,分光光度法测定A600值,计算廓清指数(K值)和吞噬指数(α值)[15]。
末次给药2 h后,称体重,采血并脱颈处死小鼠,解剖后摘取胸腺和脾脏并立即称重,按公式计算胸腺指数和脾脏指数。
胸腺指数(mg/g)=胸腺质量(mg)/体质量(g);
脾脏指数(mg/g)=脾脏质量(mg)/体质量(g)。
1.7 血清溶血素含量测定给药第11天,对小鼠腹腔注射0.2 mL绵羊红细胞(SRBC)悬液(体积分数为20%),第14天给药0.5 h后眼球采血,制备血清。采用分光光度法测定样品OD540值和SRBC半数溶血时OD540值,血清溶血素含量用半数溶血值(HC50)表示。
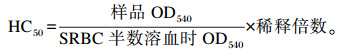
|
第14天给药12 h后,眼球采血,置于洁净无菌的抗凝离心管中,室温静置1 h后,3 000 r/min离心10 min,取上清液即为血清。采用试剂盒测定小鼠血清细胞因子TNF-α、IFN-γ、IL-2、IL-6、IL-10、IL-12含量,按照试剂盒说明书进行操作。
1.9 数据处理采用SPSS 23.0软件对试验数据进行统计分析,数据以平均值±标准差表示,组间比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD-t检验及Dunnett-t检验。P<0.05为差异显著,P<0.01表示差异极显著。
2 结果与分析 2.1 CPPS-NE对小鼠胸腺指数、脾指数及血清溶血素含量的影响由表 1可以看出,与KD组相比,MD组小鼠脾脏指数和胸腺指数均极显著降低(P<0.01),说明氢化可的松导致小鼠免疫力低下,免疫器官萎缩,造模成功。与MD组比较,CPPS-NE-1、CPPS-NE-2、CPPS-NE-3组免疫抑制小鼠胸腺指数和脾脏指数均极显著增加(P<0.01),且随着给药剂量的增加而增加,同时高于同剂量CPPS组,其中,对于胸腺指数,CPPS-NE-1、CPPS-NE-2组与同剂量组比较呈显著差异(P<0.05),CPPS-NE-3组与同剂量组比较差异不显著(P>0.05);对于脾脏指数,CPPS-NE-1、CPPS-NE-2组与同剂量组比较差异不显著(P>0.05),CPPS-NE-3组与同剂量组比较显著差异(P<0.05)。与KD组比较,MD组HC50极显著下降(P<0.01);与MD组相比,CPPS-NE-1、CPPS-NE-2、CPPS-NE-3组HC50极显著提高(P<0.01),且高于同剂量CPPS组,且3组数据均呈现极显著差异(P<0.01)。
|
|
表 1 CPPS-NE对免疫抑制小鼠血清溶血素含量及免疫器官指数的影响 Table 1 Effects of CPPS-NE on serum hemolysin content and immune organ indexes in immunosuppressed mice |
由表 2可以看出,MD组廓清指数和吞噬指数极显著低于KD组(P<0.01),表明MD小鼠碳粒廓清能力下降,建模成功;与MD组比较,CPPS-N1、CPPS-N2、CPPS-N3组的廓清指数和吞噬指数极显著升高(P<0.01),同时明显高于同剂量CPPS组,但差异并不显著(P>0.05)。
|
|
表 2 CPPS-NE对免疫抑制小鼠碳粒廓清指数的影响 Table 2 Effects of CPPS-NE on clearance of charcoal particles in immunocompromised mice |
由表 3可以看出,MD组血清TNF-α、IFN-γ、IL-2、IL-6、IL-12含量极显著低于KD组(P<0.01),说明注射氢化可的松后小鼠造模成功。CPPS-NE-1、CPPS-NE-2、CPPS-NE-3组血清TNF-α、IFN-γ、IL-2、IL-6、IL-10、IL-12含量均显著高于MD组(P<0.05)。CPPS-NE-1、CPPS-NE-2、CPPS-NE-3组血清TNF-α、IFN-γ、IL-2、IL-6、IL-10、IL-12含量高于同浓度CPPS组。其中,对于血清TNF-α含量,CPPS-NE-1、CPPS-NE-2组较同剂量组差异显著(P<0.05),CPPS-NE-3组较同剂量组差异不显著(P>0.05);对于血清IFN-γ含量,CPPS-NE-1、CPPS-NE-2、CPPS-NE-3组较同剂量组差异均为极显著(P<0.01);对于血清IL-2含量,CPPS-NE-1、CPPS-NE-2、CPPS-NE-3组较同剂量组差异均为不显著(P>0.05);对于血清IL-6含量,CPPS-NE-1、CPPS-NE-2、CPPS-NE-3组较同剂量组差异均为极显著(P<0.01);对于血清IL-10含量,CPPS-NE-1组较同剂量组差异显著(P<0.05),CPPS-NE-2、CPPS-NE-3组较同剂量组差异不显著(P>0.05);对于血清IL-12含量,CPPS-NE-1、CPPS-NE-2、CPPS-NE-3组较同剂量组差异均为极显著(P<0.01)。上述结果表明,CPPS-NE对免疫抑制小鼠的免疫调节作用较CPPS效果明显增强。
|
|
表 3 CPPS-NE对免疫抑制小鼠血清细胞因子含量的影响 Table 3 Effects of CPPS-NE on serum cytokine contents in immunocompromised mice |
多糖是党参的主要有效成分之一,在免疫调节、抗肿瘤、抗疲劳及消除自由基等方面发挥着重要的作用[16-17]。本研究对CPPS-NE在免疫抑制小鼠模型上的免疫调节作用进行了初步探讨,结果显示适宜剂量的CPPS-NE可有效提高免疫抑制小鼠的免疫功能,且作用效果显著高于同剂量CPPS,这为CPPS-NE免疫增强剂的应用提供了理论基础。
党参多糖对机体的免疫器官、免疫细胞和免疫分子均具有一定的调节作用。胸腺和脾脏是机体重要的免疫器官,分别产生T淋巴细胞参与细胞免疫和B淋巴细胞参与体液免疫,淋巴细胞增殖程度直接影响脏器指数高低,胸腺指数和脾脏指数可在一定程度上有效反映机体免疫功能的强弱。石轶男等[18]对肉仔鸡通过饮水给予0.2 g/L党参多糖可溶性粉时,可显著增加肉仔鸡胸腺指数、脾脏指数;龚其海等[19]研究发现,党参多糖可有效增强免疫抑制小鼠的胸腺指数、脾脏指数。本试验结果表明,使用免疫抑制剂后,小鼠胸腺指数和脾脏指数显著降低,胸腺和脾脏呈现萎缩状态,而应用CPPS-NE和CPPS后免疫抑制小鼠胸腺指数和脾脏指数显著增强,呈现一定的量效关系,这与上述研究结果基本一致,经对比,CPPS-NE的作用明显强于同剂量CPPS,0.1 mL CPPS-NE和0.3 mL CPPS可使免疫抑制小鼠胸腺指数和脾脏指数基本恢复正常或超出正常水平,提示党参多糖可促进胸腺细胞和脾脏细胞的增殖,而纳米乳制剂可有效增强作用效果。
碳粒廓清指数和吞噬指数可反映肝脏、脾脏及腹腔内单核巨噬细胞的吞噬功能,从而体现机体非特异性免疫功能水平。机体注射抗原SRBC后,血清中的抗体与SRBC在补体的作用下发生溶血反应,利用分光光度法测定OD540值可获知溶血程度,从而反映体内抗体水平,抗体水平高低与体液免疫功能强弱直接相关。张雅君等[20]采用气相色谱法研究了党参粗多糖中的单糖组成,并进一步研究了党参多糖对小鼠免疫细胞活性的影响,研究结果显示,党参粗多糖可通过促进小鼠B淋巴细胞的增殖提高巨噬细胞的吞噬功能,可有效增强免疫细胞的活性。本试验结果表明,对小鼠使用免疫抑制剂后,MD组碳粒廓清指数和吞噬指数明显下降,与KD组比较差异极显著,高、中、低剂量CPPS-NE和CPPS组均表现出明显升高免疫抑制小鼠碳粒廓清指数和吞噬指数的作用,这与张雅君等[20]的研究结果一致。对比CPPS-NE和CPPS的作用效果表明,同剂量CPPS-NE作用强于CPPS,但差异并不显著,0.3 mL CPPS-NE可使碳粒廓清指数和吞噬指数略高于正常水平,0.1 mL CPPS可使碳粒廓清指数和吞噬指数接近于正常水平, 说明党参多糖可促进机体非特异性免疫功能,纳米乳制剂可有效增强作用效果。血清溶血素含量测试结果显示,高、中、低剂量CPPS-NE和CPPS可显著提高免疫抑制小鼠的体液免疫功能,且随剂量增高作用增强,经比较得知,同剂量CPPS-NE的增强作用强于CPPS,且差异显著。
细胞因子的作用主要包括抗菌和抗病毒,由肿瘤坏死因子、干扰素及白细胞介素等组成。TNF-α和IL-6由活化的巨噬细胞释放,在免疫应答及抗癌作用中发挥着重要作用[21-22];IL-2、IFN-γ、IL-10由活化的Th细胞分泌,IL-2和IFN-γ属于Th1亚型,可以诱导先天免疫系统和获得性免疫系统产生有效抗病毒、抗菌的抗体和细胞,是血液和组织中抵抗病毒和细菌感染的重要成分,IL-10属于Th2亚型,可抑制由Th1细胞介导的细胞免疫,增强体液免疫和抗炎作用[23];IL-12主要由巨噬细胞分泌,可诱导自然杀伤细胞(NK)增加IFN-γ的产量,导致大量巨噬细胞致敏增强先天性免疫作用。石轶男等[24]研究表明,党参多糖可以通过刺激RAW264.7细胞增殖和激活核因子-κB(NF-κB)信号通路促使增加IL-6和TNF-α的分泌量。尹莉莉[25]以党参多糖饲喂仔猪后,仔猪血清中IL-2、IL-4、IL-6和IFN-γ含量升高。本试验结果与上述研究细胞因子含量增强的结果基本一致,本试验中对免疫抑制小鼠给药后,血清多种细胞因子含量增加,0.1 mL CPPS-NE可使血清IFN-γ、IL-2、IL-6和IL-12含量恢复正常水平,0.2 mL CPPS-NE可使血清IFN-α、IL-10含量恢复正常水平,且CPPS-NE免疫增强作用效果强于同剂量CPPS。
4 结论本研究结果显示,CPPS-NE和CPPS均能改善氢化可的松免疫抑制小鼠的免疫功能,且剂量与效果呈依赖关系,但CPPS-NE的作用效果明显优于同剂量CPPS。0.1 mL的CPPS-NE可使免疫抑制小鼠的HC50、胸脾指数、脾脏指数基本恢复到正常或超过正常水平;0.3 mL的CPPS-NE可使免疫抑制小鼠的碳粒廓清指数和吞噬指数恢复到正常或超过正常水平;0.1 mL的CPPS-NE就可使血清细胞因子IFN-γ、IL-2、IL-6、IL-12含量恢复到正常水平;0.2 mL的CPPS-NE可使血清细胞因子TNF-α、IL-10含量恢复到正常水平。
| [1] |
朱天碧, 张钊, 罗飘, 等. 党参药理学作用的相关研究进展[J]. 神经药理学报, 2018, 8(6): 46. |
| [2] |
黄圆圆, 张元, 康利平, 等. 党参属植物化学成分及药理活性研究进展[J]. 中草药, 2018, 49(1): 239-250. |
| [3] |
马玉玲, 白瑞斌, 郑晓萍, 等. 复方党参口服液的免疫增强功能研究[J]. 中国药事, 2017, 31(12): 1488-1493. |
| [4] |
樊长征, 洪巧瑜. 党参对人体各系统作用的现代药理研究进展[J]. 中国医药导报, 2016, 13(10): 39-43. |
| [5] |
曾丹, 李嘉林, 冯庆辉, 等. 党参提取物对母猪泌乳性能和仔猪生长性能的影响[J]. 猪业科学, 2016, 33(10): 82-84. |
| [6] |
王爱青. 党参多糖对肾阴虚大鼠抗氧化活性和免疫调节影响[J]. 中医药临床杂志, 2018, 30(02): 287-290. |
| [7] |
李成, 尹莉莉, 朱电锋, 等. 党参多糖对仔猪小肠黏膜免疫功能的影响[J]. 江苏农业学报, 2018, 34(2): 347-355. |
| [8] |
彭梅, 姚佳, 杨晓玲, 等. 土党参多糖促进小鼠胃肠运动的初步研究[J]. 山地农业生物学报, 2011, 30(5): 461-463, 467. |
| [9] |
王希春, 朱电锋, 尹莉莉, 等. 党参多糖对仔猪生长性能、血清细胞因子及肠黏膜分泌型免疫球蛋白A含量的影响[J]. 动物营养学报, 2017, 29(11): 4069-4075. |
| [10] |
王程成, 崔莉, 张振海, 等. 口服中药多糖调节肿瘤免疫应答研究思路[J]. 中国中药杂志, 2016, 41(10): 1965-1971. |
| [11] |
贾宁, 王汉, 郑晶. 复方党参提取物对环磷酰胺处理小鼠免疫功能的调节作用[J]. 中国实验方剂学杂志, 2011, 17(17): 206-209. |
| [12] |
晏永新, 张丽, 贾海芳, 等. 党参多糖口服液对小鼠免疫功能的影响[J]. 中国兽药杂志, 2013, 47(3): 18-20. |
| [13] |
KHATRI P, SHAO J. Mechanism and structural factors of lipid and surfactant in the formation of self-emulsified nanoemulsion[J]. Journal of Pharmaceutical Sciences, 2018, 107(8): 2198-2207. DOI:10.1016/j.xphs.2018.03.024 |
| [14] |
KOROLEVA M, NAGOVITSINA T, YURTOV E. Nanoemulsions stabilized by non-ionic surfactants:stability and degradation mechanisms[J]. Physical Chemistry Chemical Physics, 2018, 20(15): 10369-10377. DOI:10.1039/C7CP07626F |
| [15] |
黄茂林, 林伟明, 林晓玲, 等. 辣木叶提取物的制备工艺优化及其对免疫抑制小鼠免疫功能调节的研究[J]. 中国中药杂志, 2018, 43(13): 2697-2704. |
| [16] |
LI J L, HWANG I C, CHEN X G, et al. Effects of chitosan coating on curcumin loaded nano-emulsion:study on stability and in vitro digestibility[J]. Food Hydrocolloids, 2016, 60: 138-147. DOI:10.1016/j.foodhyd.2016.03.016 |
| [17] |
郜艳雪, 时坤, 李健明, 等. 党参多糖对动物免疫调节作用研究进展[J]. 动物医学进展, 2019, 40(9): 103-106. |
| [18] |
石轶男, 杨绒娟, 扆妍妍, 等. 党参多糖可溶性粉对肉仔鸡血清ND抗体水平、IgG及肠道SIgA含量的影响[J]. 中国兽药杂志, 2016, 50(9): 47-52. |
| [19] |
龚其海, 赵万, 余兰, 等. 两种党参多糖对小鼠免疫功能影响的比较[J]. 遵义医学院学报, 2012, 35(4): 267-270. |
| [20] |
张雅君, 梁忠岩, 张丽霞. 党参粗多糖的组成及其免疫活性研究[J]. 西北农林科技大学学报(自然科学版), 2012, 40(7): 199-202, 208. |
| [21] |
SUN Y X. Immunological adjuvant effect of a water-soluble polysaccharide, CPP, from the roots of Codonopsis pilosula on the immune responses to ovalbumin in mice[J]. Chemistry & Biodiversity, 2009, 69(6): 890-896. |
| [22] |
SABAT R, GRVTZ G, WARSZAWSKA K, et al. Biology of interleukin-10[J]. Cytokine & Growth Factor Reviews, 2010, 21(5): 331-344. |
| [23] |
杨玲, 胡睿智, 夏嗣廷, 等. 植物多糖的功能性研究进展及其在动物生产中的应用[J]. 动物营养学报, 2019, 31(6): 2534-2543. |
| [24] |
石轶男, 孙娜, 孙耀贵, 等. 党参多糖对巨噬细胞的诱导活化作用[J]. 畜牧兽医学报, 2017, 48(4): 777-784. |
| [25] |
尹莉莉.党参多糖对仔猪免疫机能的影响[D].硕士学位论文.合肥: 安徽农业大学, 2016.
|




