2. 中国农业科学院饲料研究所, 北京 100081
2. Feed Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081, China
据中国畜牧业协会公布的数据,2019年我国商品代白羽肉鸡、黄羽肉鸡、肉杂鸡出栏量分别为44亿、49亿和18亿只,肉鸡出栏量总量达到111亿只。可见,肉鸡产业在我国占据着非常重要的地位。现代肉鸡在品种选育过程中,因过分注重肉鸡肌肉生长速度而导致其骨骼发育相对滞后,腿病问题严重[1]。因此,改善肉鸡骨骼发育状况,提高骨骼质量,对于肉鸡的优质、高效生产具有重要意义。
当前,畜牧业生产中抗生素替代已经成为行业趋势和研究热点。饲用益生菌作为抗生素的有效替代物,受到了越来越多的关注。益生菌定义为“一类当以足够剂量给予宿主时,通过促进肠道微生态平衡对宿主产生有利影响的活的微生物制剂”[2]。饲用益生菌主要分为三大类[3]:1)益生乳酸菌[如嗜酸乳杆菌(Lactobacillus acidophilus)、干酪乳杆菌(Lactobacillus casei)、詹氏乳杆菌、拉曼乳杆菌等];2)益生双歧杆菌类(如长双歧杆菌、短双歧杆菌、卵形双歧杆菌、嗜热双歧杆菌等);3)益生芽孢杆菌类(如地衣芽孢杆菌、枯草芽孢杆菌、凝结芽孢杆菌等)。此外,还有一些酵母菌亦可归入益生菌的范畴。近来研究表明,饲粮添加益生乳酸菌能够改善骨骼发育,提高骨骼质量。然而,益生乳酸菌提高骨骼质量的机理尚不明确。因此,本文综述了益生乳酸菌对肉鸡骨骼发育的影响,并分析了益生乳酸菌影响骨骼发育的潜在作用途径,期待为益生乳酸菌改善肉鸡骨骼发育、提高骨骼质量的机制探究提供借鉴,为其更好地应用于肉鸡生产实践提供理论依据。
1 肉鸡骨骼健康及其发育机制研究 1.1 肉鸡骨骼健康的意义当前,肉鸡骨骼质量受到了越来越多的关注。腿骨脆弱和骨质疏松能够造成肉鸡跛足和死亡率上升,这已经成为动物福利关注的主要问题[4]。生产中,肉鸡通常遭受跛脚、骨骼畸形、骨质疏松等的折磨,这也会引起抓捕和运输过程中骨骼断裂,后者又会在肉制品加工过程中影响肉品质[5-6]。骨骼的易碎性和多孔性也会增加去骨肉制品加工过程中骨骼断裂发生的概率,断裂的骨骼会刺破肌肉和血管,造成血液浸出、肉品褪色,肉制品会因此失去对消费者的吸引力。总之,肉鸡生产中骨骼质量非常重要,与之相关的经济损失每年高达数十亿元[7]。
当代肉鸡经过几十年育种体系的不断选择,肌肉生长速度快,骨骼发育却相对滞后。骨骼发育不良,由此诱发的骨骼断裂及其相关感染引起的死亡、生产效率低和肉制品品质差等[8-9]是肉鸡生产中面临的主要难题。骨骼质量差造成肉鸡腿病的发病率越来越高,严重影响了肉鸡正常的运动和采食能力,制约了肉鸡的生长、增重速度,降低了养殖经济效益。因此,肉鸡的骨骼健康状况需要获得更多关注。肉鸡整个生产周期的骨骼质量主要取决于生长发育阶段结构骨的形成[10],即骨骼的发育状况。因此,改善骨骼发育对于维持肉鸡骨骼健康和促进肉鸡的优质、高效生产具有重要意义。
1.2 肉鸡骨骼的发育机制研究骨骼相关的功能失调严重影响肉鸡生产和动物福利,这激起了人们对骨骼生物学研究的浓厚兴趣。自层架式肉鸡养殖笼具引入生产,笼养肉鸡瘫痪问题就随之产生。肉鸡瘫痪和骨骼质量差密切相关,最典型的例子是肉鸡骨质疏松[11]。
肉鸡骨骼发育包括2个过程:四肢长骨纵向生长和横向生长[10]。四肢骨骼的长骨纵向生长是软骨成骨作用的结果。骨形成有2种模式:1)膜内成骨(图 1),即直接将间质组织转换成骨,该模式主要发生在颅骨;2)软骨内成骨(图 2),即先是间充质细胞分化形成软骨组织,然后软骨组织被骨取代[12],该模式主要发生在骨盆、四肢及脊柱骨[13]。在四肢长骨中,初级骨化中心形成后,不断向两端生长板延伸,从而使骨骼不断纵向加长;之后,随着次级骨化中心、骨髓腔和骨骺端的形成以及血管进入,骨骼继续生长[14-16]。
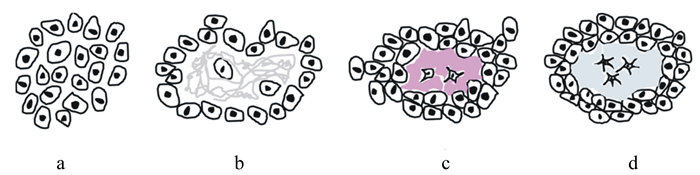
|
a:骨先质细胞聚集aggregates of osteoprogenotor cells;b:在聚集的中心及细胞间形成无定型基质和胶原蛋白网状组织amorphous ground substance and collagen meshwork formed in the center and in between the cells;c:间充质干细胞转变为成骨细胞,继而在聚集的中心合成类骨质the mesenchymal stem cell transform to osteoblasts which synthesize osteoid in the center of the aggregate;d:成骨细胞形成初步的骨组织,部分成骨细胞进入类骨质成为骨细胞a rudimentary bone tissue formed by the osteoblasts and some of these get incorporated within the osteoid to become osteocytes。 图 1 膜内成骨图解 Fig. 1 Schematic diagram of intramembranous ossification |
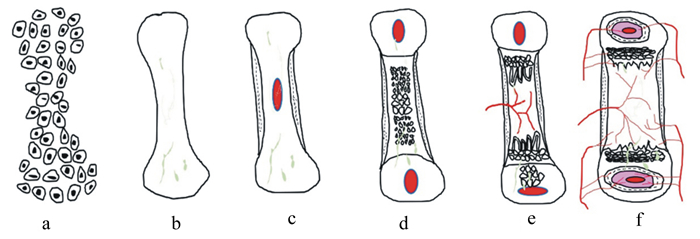
|
a:骨先质细胞聚集aggregates of osteoprogenitor cells;b:透明软骨形成model of hyaline cartilage;c:初级骨化中心形成primary center of ossification;d:次级骨化中心形成secondary center of ossification;e:骨髓腔和骨骺端形成bone with medullary cavity and epiphyseal ends;f:血管输送增加highlighting feeding blood vessels。 图 2 软骨内成骨图解 Fig. 2 Schematic diagram of endochondral ossification |
骨骼直径增加是骨骼以环形扩张的方式横向变宽的过程(在骨内膜的表面,破骨细胞分解骨骼;在骨膜,成骨细胞不断沉积骨质形成结构骨)。长骨横向变宽的过程中,涉及长骨内膜的成骨作用。成骨细胞在软骨膜中发育,并形成骨针,骨针融合形成了包含空腔的网状骨。这些空腔逐渐被成骨细胞填满,成骨细胞在其中持续分泌同轴向的、薄片状的皮质骨。在骨内膜的表面,破骨细胞分解骨骼;在外部,随着结构骨形成,骨骼以环形扩张的方式横向变宽,即内部重吸收外部骨骼形成并向外扩张[17]。在生长的早期阶段,骨骼横向生长呈环状迅速扩张,以至于在骨内膜重吸收开始之前骨骼生长过程中空腔尚未被完全填满。但随生长速度减慢,骨骼空腔的填充程度不断增加[18-19]。
改善肉鸡骨骼健康状况,获得更好的骨骼质量,不仅与动物健康状况及动物福利密切相关,更是关乎肉鸡产业的经济效益。然而,围绕肉鸡的研究绝大多数集中在生产性能和肉品质方面,骨骼健康尚未受到足够的重视。因此,改善肉鸡骨骼质量的研究不仅十分重要而且非常必要。了解骨骼发育机制有助于更好地改善骨骼发育,提高骨骼质量。
2 益生乳酸菌改善肉鸡骨骼发育作用效果研究乳酸菌属于厚壁菌门,是一类革兰氏阳性菌,主要包括乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、乳明串珠菌属(Leucocostoc)、片球菌属(Pediococcus)、酒球菌属(Oenococcus)、肠球菌属(Enterococcus)和链球菌属(Streptococcus)等。乳酸菌是一类耐酸、杆形或球形、缺乏过氧化氢酶、微量需氧的微生物,其代谢特征是能够发酵碳水化合物产生乳酸。此外,乳酸菌适应性强,适合多种肠道微环境,能够定植在动物口腔、胃肠道黏膜表面。
越来越多的研究表明,益生乳酸菌能够促进骨骼发育、维护骨骼健康。将益生乳酸菌混合物[副干酪乳杆菌(Lactobacillus paracasei)DSM 13434、植物乳杆菌(Lactobacillus plantarum)DSM 15312和Lactobacillus plantarum DSM 15313]制成胶囊(1×1010 CFU/粒),绝经早期女性每天服用,持续12个月,结果表明腰椎椎间盘骨骼矿物质密度损失大幅减少,这可能是由于益生乳酸菌加速了成骨作用,促进了骨骼的形成和矿物质的沉积[20]。此外,以小鼠为动物模型的研究也得到了相似的结果。基于前期研究[21],筛选出具有抗炎症特性的单一乳杆菌(Lactobacillus paracasei DSM13434)和混合乳杆菌(包含Lactobacillus paracasei DSM13434、Lactobacillus plantarum DSM 15312和Lactobacillus plantarum DSM 15313),通过饮水的方式饲喂卵巢切除前的小鼠,持续6周,结果表明,无论是单一乳杆菌还是混合乳杆菌,均能使小鼠免于卵巢切除造成的骨质损失和骨骼重吸收[22]。Britton等[23]研究表明,罗伊氏乳杆菌(Lactobacillus reuteri,一种能够分泌有益免疫调控因子的共生微生物)能够改变肠道微生物的组成,并能减少因卵巢切除造成的骨质损失和骨骼重吸收。另有研究表明,口服Lactobacillus reuteri能够减少肠道炎症,并能够增加性腺完整的雄性小鼠的小梁骨骨量,这可能是由于Lactobacillus reuteri在小鼠生长发育阶段促进了软骨内的成骨作用,使其体内的骨量积累增多。Lactobacillus reuteri饲喂小鼠,4周后股骨小梁骨矿物质密度及其含量显著提高[24];饲喂Lactobacillus reuteri、Lactobacillus paracasei或Lactobacillus paracasei与Lactobacillus plantarum的混合物均能显著改善由于卵巢切除造成的小鼠皮质骨含量及皮质骨矿物质含量降低[25]。Amdekar等[26]研究表明,8周龄威斯塔鼠口服Lactobacillus casei、Lactobacillus acidophilus以及两者的混合物,能够改善弗氏佐剂造成的骨骼损伤,这可能是由于这些益生乳酸菌加速了骨骼形成,从而促进了骨骼损伤的修复。斑马鱼幼鱼饲喂鼠李糖乳杆菌(Lactobacillus rhamnosus)10周后,脊柱骨钙化显著提前[27],这表明Lactobacillus rhamnosus能够促进生长发育阶段斑马鱼钙沉积和骨骼形成。通过以上分析可以得出,益生乳酸菌能够调控骨骼代谢,从而改善骨骼质量。
益生乳酸菌作为饲料添加剂,已经在禽类生产中得到了广泛的应用。然而,之前的研究绝大部分集中在益生乳酸菌对禽类生产性能、蛋品质、肉品质、肠道健康、抗应激、免疫等方面,很少关注到其对禽类骨骼质量的影响。
肉鸡生长过程中,营养物质(如钙、磷)和能量供应充足能够促进骨骼发育。并且,大量研究表明肉鸡饲粮添加益生乳酸菌能够改善肠道形态、微生物菌群,提高营养物质的消化吸收效率[3]。据此可推测饲粮添加益生乳酸菌能够促进肉鸡骨骼发育、提高骨骼质量。并且已经有大量的研究以多种动物为模型验证了该推测。事实上,肉鸡饲粮添加益生乳酸菌取得了很好的改善骨骼质量的效果:饲粮添加6×107 CFU/kg芽胞乳酸菌(Lactobacillus sporogenes)显著提高43日龄肉鸡胫骨强度和灰分含量[28];饮水添加乳酸菌(106 CFU/只)显著提高了30日龄肉鸡胫骨指数、强度、直径以及总灰分、钙、磷含量[29]。饲粮添加Lactobacillus plantarum和Lactobacillus acidophilus显著增加了肉鸡胫骨磷(21日龄)和钙(40日龄)的含量[30]。可见,饲粮添加益生乳酸菌能够促进肉鸡软骨内的成骨作用、胫骨横向生长、骨量增加以及矿物质在骨骼中沉积,进而改善骨骼发育,提高骨骼质量。
3 益生乳酸菌调控肉鸡骨骼发育的潜在机理研究探究益生乳酸菌调控肉鸡骨骼发育的机制有助于更好地利用益生乳酸菌改善肉鸡骨骼质量,进而提高肉鸡生产效率。大量研究表明,益生乳酸菌改善骨骼健康状况很可能是通过改变肠道微生物实现的[31-32]。肠道微生物影响骨骼组织潜在的途径主要有3条:1)调节肠上皮细胞的营养素吸收;2)调节黏膜和全身的免疫反应;3)微生物及其小分子代谢产物穿过肠道内皮屏障,通过循环系统迁移至骨骼组织[33-34](图 3)。
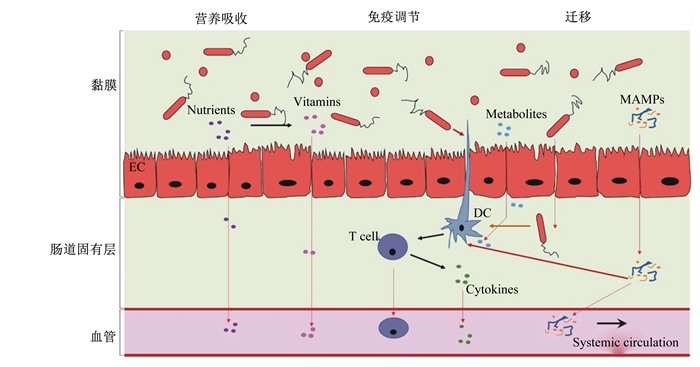
|
DC:树状细胞dendritic cell;EC:肠道内皮细胞endothelial cell;MAMPs:微生物相关模式分子microbial-associated molecular patterns;Nutrients:营养素;Vitamins:维生素;Metabolites:代谢物;Cytokines:细胞因子;Systemic circulation:体循环。 图 3 肠道微生物可以通过营养物质吸收、免疫系统调节及微生物产物迁移影响骨骼组织 Fig. 3 Gut microbiome can influence remote organs through regulation of nutrient absorption, regulation of immune system, or translocation of bacterial products |
目前为止,已有大量研究表明,益生乳杆菌能够改变肠道微生物菌群,降低肠道pH,抑制有害菌群生长,改善肠道形态,维持肠道黏膜的完整性,促进钙、磷等营养物质和能量的吸收[35]。
据此推测益生乳酸菌很可能是通过调节肠道微生物改善营养物质(包括能量)的吸收,继而调控肉鸡骨骼发育。例如,改善钙吸收能够促进骨骼发育,其主要途径为以下2条:1)钙离子通过诱导runt相关转录因子2(Runx2)和骨钙素基因表达上调,促进成骨细胞的增殖和分化,从而促进骨骼形成;2)钙增加能够减少破骨细胞的活性,进而减少骨骼重吸收[34]。研究表明,改变肠道微生物能够促进营养物质和能量吸收,进而促进动物生长和骨骼发育[36]。
3.2 益生乳酸菌通过调控免疫反应影响肉鸡骨骼发育肠道是动物体最大的免疫器官,集中了约80%的免疫细胞,产生全身将近80%的抗体。益生乳酸菌进入消化道后,能够通过调控肠道免疫反应,最终影响骨骼代谢活动。许多免疫因子参与调控成骨和破骨作用。
肠道微生物及其代谢产物刺激肠道内皮免疫细胞,被激活的免疫细胞释放抗炎或促炎介导因子(或细胞因子),这些因子能够通过循环系统作用于骨组织,通过成骨或破骨作用调节骨骼的形成和分解[35];激活的免疫细胞还能够迁移至骨髓组织,释放免疫反应产物,如核因子-κB(NF-κB)配体激活受体(RANKL),直接作用于骨组织,调节骨骼代谢[37]。
3.3 益生乳酸菌通过调控微生物相关模式分子(MAMPs)迁移影响肉鸡骨骼发育饲喂益生乳酸菌能够改变肠道微生物,继而引起肠道内MAMPs的种类和数量发生改变。MAMPs包括脂多糖、肽聚糖、鞭毛蛋白和游离DNA,它们是细菌分泌或者细胞死亡后保留下来的,体积足够小能够穿过肠道内皮屏障,进入循环系统,到达远离肠道的器官(如骨骼)。因此,益生乳酸菌很可能通过MAMPs进入循环系统对骨骼组织发挥调节作用。MAMPs可以直接刺激骨细胞的免疫受体,包括Toll样受体2(TLR2,与肽聚糖反应)[38]、Toll样受体4(TLR4,与脂多糖反应)[39]和Toll样受体5(TLR5,与肽鞭毛蛋白反应)[40],进而调节骨骼代谢。
然而,目前为止,关于益生乳酸菌影响骨骼发育机理的研究非常有限,仅有的报道又不够系统。因此,需要做更多工作来探究益生乳酸菌改善骨骼发育的机理,为更好地将益生乳酸菌应用于改善肉鸡骨骼质量的生产实践提供理论指导。
4 小结综上可知,骨骼健康对肉鸡生产意义重大,深入了解骨骼发育机制有助于采用适当的营养策略调控骨骼代谢,维持骨骼健康。益生乳酸菌作为抗生素的有效替代物,能够促进骨骼发育,提高骨骼质量,然而,其对骨骼质量的有益影响尚未受到足够的重视。本文详述了益生乳酸菌对肉鸡骨骼质量的影响,并在此基础上分析了益生乳酸菌影响骨骼代谢的潜在途径。在这方面仍需要进行大量的研究工作去探究和深化益生乳酸菌影响骨骼代谢的机制。本文将为益生乳酸菌改善肉鸡骨骼质量的生产实践提供理论指导。
| [1] |
HAVENSTEIN G B, FERKET P R, QURESHI M A. Growth, livability, and feed conversion of 1957 versus 2001 broilers when fed representative 1957 and 2001 broiler diets[J]. Poultry Science, 2003, 82(10): 1500-1508. DOI:10.1093/ps/82.10.1500 |
| [2] |
HILL C, GUARNER F, REID G, et al. Expert consensus document:the international scientific association for probiotics and prebiotics consensus statement on the scope and appropriate use of the term probiotic[J]. Nature Reviews Gastroenterology & Hepatology, 2014, 11(8): 506-514. |
| [3] |
BERTAZZONI E, DONELLI G, MIDTVEDT T, et al. Probiotics and clinical effects:is the number what counts?[J]. Journal of Chemotherapy, 2013, 25(4): 193-212. DOI:10.1179/1973947813Y.0000000078 |
| [4] |
ABDUL-AZIZ T A. Cage layer fatigue is a complicated problem[J]. World's Poultry Science Journal, 1998, 14: 56-58. |
| [5] |
GREGORY N G, WIKINS L J.Skeletal damage and bone defects during catching and processing[M]//WHITEHEAD C C.Bone biology and skeletal disorders in poultry.Oxford, UK: Carfax Publishing Co., 1992: 313-328.
|
| [6] |
JULIAN R J. Rapid growth problems:ascites and skeletal deformities in broilers[J]. Poultry Science, 1998, 77(12): 1773-1780. DOI:10.1093/ps/77.12.1773 |
| [7] |
RATH N C, HUFF G R, HUFF W E, et al. Factors regulating bone maturity and strength in poultry[J]. Poultry Science, 2000, 79(7): 1024-1032. DOI:10.1093/ps/79.7.1024 |
| [8] |
LONG P H, LEE S R, ROWLAND G N, et al. Experimental rickets in broilers:gross, microscopic, and radiographic lesions.Ⅱ.Calcium deficiency[J]. Avian Diseases, 1984, 28(4): 921-932. DOI:10.2307/1590268 |
| [9] |
WEBSTER A B. Welfare implications of avian osteoporosis[J]. Poultry Science, 2004, 83(2): 184-192. DOI:10.1093/ps/83.2.184 |
| [10] |
WHITEHEAD C C. Overview of bone biology in the egg-laying hen[J]. Poultry Science, 2004, 83(2): 193-199. DOI:10.1093/ps/83.2.193 |
| [11] |
MOSHAGE S G, MCCOY A M, POLK J D, et al. Temporal and spatial changes in bone accrual, density, and strain energy density in growing foals[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2020, 103: 103568. DOI:10.1016/j.jmbbm.2019.103568 |
| [12] |
HORTON W A. The biology of bone growth[J]. Growth Genetics & Hormones, 1990, 6(2): 1-5. |
| [13] |
KINI U, NANDEESH B N.Physiology of bone formation, remodeling, and metabolism[M]//FOGELMAN I, GNANASEGARAN G, VAN DER WALL H.Radionuclide and hybrid bone imaging.Berlin, Heidelberg: Springer, 2012: 29-57.
|
| [14] |
SEROWOKY M A, ARATA C E, CRUMP J G, et al. Skeletal stem cells:insights into maintaining and regenerating the skeleton[J]. Development, 2020, 147(5): dev179325. DOI:10.1242/dev.179325 |
| [15] |
EYAL S, KULT S, RUBIN S, et al. Bone morphology is regulated modularly by global and regional genetic programs[J]. Development, 2019, 146(14): dev167882. DOI:10.1242/dev.167882 |
| [16] |
MODLESKY C M, ZHANG C. Complicated muscle-bone interactions in children with cerebral palsy[J]. Current Osteoporosis Reports, 2020, 18(1): 47-56. |
| [17] |
SIVAN U, DE ANGELIS J, KUSUMBE A P. Role of angiocrine signals in bone development, homeostasis and disease[J]. Open Biology, 2019, 9(10): 190144. DOI:10.1098/rsob.190144 |
| [18] |
LIPPHAUS A, WITZEL U. Biomechanical study of the development of long bones:finite element structure synthesis of the human second proximal phalanx under growth conditions[J]. The Anatomical Record, 2019, 302(8): 1389-1398. DOI:10.1002/ar.24006 |
| [19] |
ZHANG C Y, ZHANG S, SUN Y. Expression of IFT140 during bone development[J]. Journal of Histochemistry & Cytochemistry, 2019, 67(10): 723-734. |
| [20] |
JANSSON P A, CURIAC D, AHRÉN I L, et al. Probiotic treatment using a mix of three Lactobacillus strains for lumbar spine bone loss in postmenopausal women:a randomised, double-blind, placebo-controlled, multicentre trial[J]. The Lancet Rheumatology, 2019, 1(3): e154-e162. DOI:10.1016/S2665-9913(19)30068-2 |
| [21] |
LAVASANI S, DZHAMBAZOV B, NOURI M, et al. A novel probiotic mixture exerts a therapeutic effect on experimental autoimmune encephalomyelitis mediated by IL-10 producing regulatory T cells[J]. PLoS One, 2010, 5(2): e9009. DOI:10.1371/journal.pone.0009009 |
| [22] |
OHLSSON C, ENGDAHL C, FÅK F, et al. Probiotics protect mice from ovariectomy-induced cortical bone loss[J]. PLoS One, 2014, 9(3): e92368. DOI:10.1371/journal.pone.0092368 |
| [23] |
BRITTON R A, IRWIN R, QUACH D, et al. Probiotic L.reuteri treatment prevents bone loss in a menopausal ovariectomized mouse model[J]. Journal of Cellular Physiology, 2014, 229(11): 1822-1830. DOI:10.1002/jcp.24636 |
| [24] |
MCCABE L R, IRWIN R, SCHAEFER L, et al. Probiotic use decreases intestinal inflammation and increases bone density in healthy male but not female mice[J]. Journal of Cellular Physiology, 2013, 228(8): 1793-1798. DOI:10.1002/jcp.24340 |
| [25] |
OHLSSON C, ENGDAHL C, FÅK F, et al. Probiotics protect mice from ovariectomy-induced cortical bone loss[J]. PLoS One, 2014, 9(3): e92368. DOI:10.1371/journal.pone.0092368 |
| [26] |
AMDEKAR S, KUMAR A, SHARMA P, et al. Lactobacillus protected bone damage and maintained the antioxidant status of liver and kidney homogenates in female Wistar rats[J]. Molecular and Cellular Biochemistry, 2012, 368(1/2): 155-165. |
| [27] |
AVELLA M A, PLACE A, DU S J, et al. Lactobacillus rhamnosus accelerates zebrafish backbone calcification and gonadal differentiation through effects on the GnRH and IGF systems[J]. PLoS One, 2012, 7(9): e45572. DOI:10.1371/journal.pone.0045572 |
| [28] |
PANDA A K, RAO S V R, RAJU M V L N, et al. Dietary supplementation of Lactobacillus sporogenes on performance and serum biochemico-lipid profile of broiler chickens[J]. The Journal of Poultry Science, 2006, 43(3): 235-240. DOI:10.2141/jpsa.43.235 |
| [29] |
GUTIERREZ-FUENTES C E, ZUNIGA-OROZCO L A, VICENTE J L, et al. Effect of a lactic acid bacteria based probiotic, Floramax-B11, on performance, bone qualities and morphometric analysis of broiler chickens:an economic analysis[J]. International Journal of Poultry Science, 2013, 12(6): 322-327. DOI:10.3923/ijps.2013.322.327 |
| [30] |
ABDULWAHAB A A, HORNIAKOVA E. Some parameters of meat and bone chemical content of broilers fed diets containing Lactobacillus species based on dried yogurt[J]. Acta Universitatis Agriculturae et Silviculturae Mendelianae Brunensis, 2010, 58(2): 13-18. DOI:10.11118/actaun201058020013 |
| [31] |
DOUILLARD F P, DE VOS W M. Functional genomics of lactic acid bacteria:from food to health[J]. Microbial Cell Factories, 2014, 13(1): S8. DOI:10.1186/1475-2859-13-8 |
| [32] |
CARR F J, CHILL D, MAIDA N. The lactic acid bacteria:a literature survey[J]. Critical Reviews in Microbiology, 2002, 28(4): 281-370. |
| [33] |
HERNANDEZ C J, GUSS J D, LUNA M, et al. Links between the microbiome and bone[J]. Journal of Bone and Mineral Research, 2016, 31(9): 1638-1646. DOI:10.1002/jbmr.2887 |
| [34] |
ZHANG H Y, ZENG Q F, BAI S P, et al. Effect of graded calcium supplementation in low-nutrient density feed on tibia composition and bone turnover in meat ducks[J]. British Journal of Nutrition, 2018, 120(11): 1217-1229. DOI:10.1017/S0007114518002556 |
| [35] |
IBÁÑEZ L, ROULEAU M, WAKKACH A, et al. Gut microbiome and bone[J]. Joint Bone Spine, 2019, 86(4): 43-47. |
| [36] |
LIN X X, SONG F M, ZHOU L, et al. Cepharanthine suppresses osteoclast formation by modulating the nuclear factor-κB and nuclear factor of activated T-cell signaling pathways[J]. Journal of Cellular Biochemistry, 2019, 120(2): 1990-1996. |
| [37] |
THUMMURI D, GUNTUKU L, CHALLA V S, et al. Abietic acid attenuates RANKL induced osteoclastogenesis and inflammation associated osteolysis by inhibiting the NF-κB and MAPK signaling[J]. Journal of Cellular Physiology, 2019, 234(1): 443-453. |
| [38] |
KASSEM A, LINDHOLM C, LERNER U H. Toll-like receptor 2 stimulation of osteoblasts mediates Staphylococcus aureus induced bone resorption and osteoclastogenesis through enhanced RANKL[J]. PLoS One, 2016, 11(6): e0156708. DOI:10.1371/journal.pone.0156708 |
| [39] |
ZHANG Y Z, SHEN X M, CHENG L, et al. Toll-like receptor 4 knockout protects against diabetic-induced imbalance of bone metabolism via autophagic suppression[J]. Molecular Immunology, 2020, 117: 12-19. DOI:10.1016/j.molimm.2019.10.025 |
| [40] |
GORSKAYA Y F, TUKHVATULIN A I, NESTERENKO V G. NLR2 and TLR3, TLR4, TLR5 ligands, injected in vivo, improve after 1 h the efficiency of cloning and proliferative activity of bone marrow multipotent stromal cells and reduce the content of osteogenic multipotent stromal cells in CBA mice[J]. Bulletin of Experimental Biology and Medicine, 2017, 163(3): 356-360. DOI:10.1007/s10517-017-3803-1 |




