肠膜蛋白粉(dried porcine solubles,DPS)一直因营养好、诱食性佳的特点而被普遍应用于断奶仔猪饲粮中[1],但动物性蛋白质来源的饲料原料始终存在着传染疾病的风险,尤其在我国目前非洲猪瘟爆发的情况下,替代动物性蛋白质来源的饲料原料的开发和研究更显得迫在眉睫。但是,目前还没有一种单一植物性蛋白质来源的饲料原料能实现对肠膜蛋白粉在营养和诱食2方面的替代作用。有研究表明,优质的玉米蛋白粉(corn gluten meal,CGM)蛋白质含量高达65%,且含有多种无机盐和维生素,可提高猪的平均日增重(ADG)和养分消化率[2-3]。鲜味剂(umami enhancer)可以提高猪的采食量和生长性能,并对肠道神经有一定的保护作用,同时鲜味剂可以参与并影响饲粮风味的形成,起到强烈的增鲜、增香的作用,使饲粮总体味感更加协调、细腻,进而增加猪的采食量[4-6]。但目前有关断奶仔猪饲粮中玉米蛋白粉配合鲜味剂能否替代肠膜蛋白粉的研究尚未见报道。因此,本试验拟通过分别向肠膜蛋白粉和玉米蛋白粉饲粮中添加鲜味剂,考察不同蛋白质饲料原料种类配合鲜味剂对断奶仔猪生长性能、养分和氨基酸表观消化率、血清激素指标及粪便菌群结构的影响,以此来研究断奶仔猪饲粮中玉米蛋白粉配合鲜味剂能否起到替代肠膜蛋白粉的作用。
1 材料与方法 1.1 试验材料肠膜蛋白粉营养成分含量为:粗蛋白质(CP)53.00%、钙0.40%、总磷0.50%、消化能4.00 MJ/kg、赖氨酸3.74%、蛋氨酸0.54%、蛋氨酸+半胱氨酸0.20%、苏氨酸1.82%、色氨酸0.50%、缬氨酸3.64%。玉米蛋白粉营养成分含量为:CP 53.90%、钙0.07%、总磷0.44%、消化能3.60 MJ/kg、赖氨酸0.97%、蛋氨酸1.42%、蛋氨酸+半胱氨酸2.38%、苏氨酸2.08%、色氨酸0.36%、缬氨酸2.94%。鲜味剂主要成分为鸡肉水解蛋白、植物水解蛋白、酵母提取物和核苷酸,其中有效成分含量为4%,其余为载体二氧化硅。
1.2 试验设计与饲养管理试验采用2×2析因设计,2个因素分别为蛋白质饲料原料种类(肠膜蛋白粉和玉米蛋白粉)和鲜味剂[添加(0.2%)和无添加]。随机选取28日龄、体重9 kg左右的大白×长白二元断奶仔猪128头,按遗传背景相同、体重基本一致的原则,随机分为4个组,分别为肠膜蛋白粉组、肠膜蛋白粉+鲜味剂组、玉米蛋白粉组和玉米蛋白粉+鲜味剂组,每组4个重复,每个重复8头猪。试验期21 d。
试验在辽宁省铁岭市沈阳农业大学科研种猪场进行,试验开始前,对试验猪舍进行了彻底的清洗和消毒,试验期间所有断奶仔猪均在相同条件下饲养,于同一栋猪舍进行分栏饲养,按分组饲喂试验饲料,试验期间保持温度在20~30 ℃,同时保持良好的通风和光照。断奶仔猪自由采食和饮水,按照常规管理规程及正常免疫程序进行饲养。基础饲粮参照NRC(2012)标准配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
分别于试验第1天和第21天08:00对每头仔猪进行称重,记录初重(IW)和末重(FW),计算仔猪ADG。每隔7 d记录各个重复试验猪饲粮供给和余料情况,得出7 d的耗料量,计算平均日采食量(ADFI)。根据ADG和ADFI计算料重比(F/G)。记录试验猪腹泻情况,计算腹泻率(diarrhea rate,DR)。计算公式如下:

|
利用外源指示剂法测定养分和氨基酸表观消化率。试验第14~21天,各组试验饲粮以4‰比例加入二氧化钛(TiO2),试验结束前连续3 d以不完全收粪法于每个重复中采集粪便,每天上、下午各收粪1次,每次采集粪便30~50 g,每100 g粪样加20 mL的10%浓硫酸以固氮,于-20 ℃冰箱保存。将每组粪样混合搅拌均匀,放置70 ℃烘箱中烘干至恒重,室温环境回潮24 h后粉碎过60目筛分装备测。同时将各组饲粮样品也粉碎过60目筛备测。
使用日立L-8800全自动氨基酸分析仪,采用外标法测定氨基酸含量。脯氨酸含量测定波长为440 nm,其他氨基酸含量测定波长为570 nm。每组称取0.02 g样品于水解管中,加入6 mol/mL盐酸15 mL于水解管中,1滴正辛醇消泡剂,抽真空10 min后,封水解管,放入110 ℃干燥箱水解24 h,冷却后定容、赶酸,待测样于样品瓶中上机检测。
采用分光光度计法测定TiO2含量,105 ℃烘箱法测定干物质(DM)含量,凯氏定氮法测定CP含量,索氏抽提法测定粗脂肪(EE)含量,乙二胺四乙酸(EDTA)络合法测定钙含量,钒钼黄比色法测定磷含量。
根据测定出饲粮和粪便中对应养分、氨基酸及指示剂含量计算某指标表观消化率。

|
于试验结束当天08:00,分别从每组的每个重复选取1头体况良好、接近平均体重的仔猪,前腔静脉采血10 mL左右,静置30 min后3 500 r/min离心10 min,将收集的血清分装于离心管中,于-20 ℃冰箱保存待测。血清胃饥饿素(ghrelin)、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、胰岛素生长因子-Ⅰ(insulin growth factor-Ⅰ,IGF-Ⅰ)、促肾上皮质激素释放激素(corticotropin releasing hormone,CRH)、胆囊收缩素(cholecystokinin,CCK)、瘦素(leptin,LEP)、胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)和皮质醇(cortisol)含量采用双抗体夹心法测定,按试剂盒说明书进行操作,试剂盒由江苏宝莱生物科技有限公司提供。
1.3.4 粪便菌群结构试验第21天时,取各组粪样5.0 g,用于16S rRNA高通量测序分析。提取样品总DNA,利用1%琼脂糖凝胶电泳对抽提的基因组DNA进行检测。在引物341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)末端加上测序接头,对V3~V4基因片段进行PCR扩增,并对其产物进行纯化、定量和均一化形成测定文库,建好的文库进行文库质检,质检合格的文库用Illumina HiSeq 2500平台进行测序分析。
1.4 数据处理和分析采用Excel 2007对数据进行初步整理,首先采用SPSS 17.0进行单因素方差分析(one-way ANOVA),当差异显著时采用Duncan氏法进行多重比较,P < 0.05为差异显著,P < 0.01为差异极显著,结果以平均值±标准差表示。然后采用2×2双因素试验设计进行分析,数学模型为:
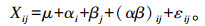
|
式中:Xij为观测值;μ为总体平均效应;αi为蛋白质饲料原料种类效应;βj为鲜味剂效应;(αβ)ij为蛋白质饲料原料种类与鲜味剂的交互效应;εij为误差效应。
2 结果与分析 2.1 鲜味剂与不同蛋白质饲料原料组合对断奶仔猪生长性能的影响如表 2所示,主效应分析结果表明,肠膜蛋白粉组断奶仔猪的末重、ADFI和ADG均极显著高于玉米蛋白粉组(P < 0.01),F/G和腹泻率均极显著低于玉米蛋白粉组(P < 0.01)。鲜味剂的添加可以极显著提高断奶仔猪末重、ADFI和ADG(P < 0.01),极显著降低断奶仔猪F/G和腹泻率(P < 0.01)。
|
|
表 2 鲜味剂与不同蛋白质饲料原料组合对断奶仔猪生长性能的影响 Table 2 Effects of umami enhancer and different protein feedstuff combinations on growth performance of weaned piglets |
单因素分析结果表明,玉米蛋白粉+鲜味剂组的ADFI与肠膜蛋白粉组无显著差异(P>0.05),玉米蛋白粉+鲜味剂组的ADG显著低于肠膜蛋白粉组(P < 0.05)。
2.2 鲜味剂与不同蛋白质饲料原料组合对断奶仔猪养分表观消化率的影响如表 3所示,主效应分析结果表明,肠膜蛋白粉组的断奶仔猪CP表观消化率极显著高于玉米蛋白粉组(P < 0.01),DM和EE表观消化率显著高于玉米蛋白粉组(P < 0.05)。鲜味剂的添加可显著提高断奶仔猪的CP表观消化率(P < 0.05)。
|
|
表 3 鲜味剂与不同蛋白质饲料原料组合对断奶仔猪养分表观消化率的影响 Table 3 Effects of umami enhancer and different protein feedstuff combinations on nutrient apparent digestibility of weaned piglets |
单因素分析结果表明,玉米蛋白粉+鲜味剂组CP表观消化率显著低于肠膜蛋白粉组(P < 0.05),其余养分表观消化率与肠膜蛋白粉组无显著差异(P>0.05)。
2.3 鲜味剂与不同蛋白质饲料原料组合对断奶仔猪氨基酸表观消化率的影响如表 4所示,主效应分析结果表明,肠膜蛋白粉组断奶仔猪的各氨基酸表观消化率均极显著高于玉米蛋白粉组(P < 0.01)。鲜味剂的添加可极显著提高赖氨酸、丝氨酸和缬氨酸的表观消化率(P < 0.01),显著提高除谷氨酸、组氨酸和脯氨酸外其余氨基酸表观消化率(P < 0.05)。
|
|
表 4 鲜味剂与不同蛋白质饲料原料组合对断奶仔猪氨基酸表观消化率的影响 Table 4 Effects of umami enhancer and different protein feedstuff combinations on amino acids apparent digestibility of weaned piglets |
单因素分析结果表明,玉米蛋白粉+鲜味剂组断奶仔猪的赖氨酸、丝氨酸、缬氨酸、异亮氨酸和苯丙氨酸表观消化率均显著高于玉米蛋白粉组(P < 0.05)。这说明玉米蛋白粉配合鲜味剂可提高氨基酸的表观消化率,缩小了玉米蛋白粉与肠膜蛋白粉之间的差距。
2.4 鲜味剂与不同蛋白质饲料原料组合对断奶仔猪血清激素指标的影响如表 5所示,主效应分析结果表明,肠膜蛋白粉组断奶仔猪的血清胃饥饿素和IGF-Ⅰ含量极显著高于玉米蛋白粉组(P < 0.01),血清ACTH、CRH、CCK和皮质醇含量极显著低于玉米蛋白粉组(P < 0.01)。鲜味剂的添加可显著提高断奶仔猪的血清胃饥饿素和IGF-Ⅰ含量(P < 0.05),显著降低血清CRH含量(P < 0.05)。
|
|
表 5 鲜味剂与不同蛋白质饲料原料组合对断奶仔猪血清激素指标的影响 Table 5 Effects of umami enhancer and different protein feedstuff combinations on serum hormones indexes of weaned piglets |
单因素分析结果表明,玉米蛋白粉+鲜味剂组断奶仔猪的血清胃饥饿素和IGF-Ⅰ含量显著高于玉米蛋白粉组(P < 0.05),血清胃饥饿素含量与肠膜蛋白粉组无显著差异(P>0.05)。
2.5 鲜味剂与不同蛋白质饲料原料组合对断奶仔猪粪便菌群结构的影响 2.5.1 鲜味剂与不同蛋白质饲料原料组合对断奶仔猪粪便菌群α多样性的影响如表 6所示,4组ACE和Chao1指数由高到低的排序依次为:肠膜蛋白粉组>玉米蛋白粉+鲜味剂组>肠膜蛋白粉+鲜味剂组>玉米蛋白粉组。4组Shannon指数由高到低的排序依次为:玉米蛋白粉+鲜味剂组>肠膜蛋白粉组>肠膜蛋白粉+鲜味剂组>玉米蛋白粉组。4组Simpson指数由高到低的排序依次为:玉米蛋白粉组>肠膜蛋白粉组肠膜蛋白粉+鲜味剂组>玉米蛋白粉+鲜味剂组。
|
|
表 6 α多样性指数 Table 6 α diversity indexes |
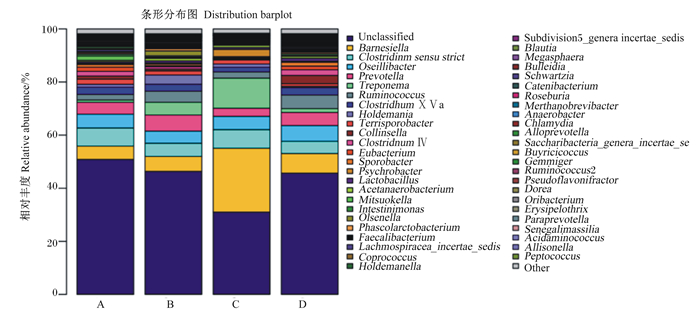
如图 1所示,除未知菌属和其他菌属,4个组在属水平上相对丰度超过1%的有巴氏杆菌属(Barnesiella)、狭义梭菌属(Clostridium sensu stricto)、致病菌属(Oscillibacter)、普雷沃菌属(Prevotella)、密螺旋体菌属(Treponema)、瘤胃球菌属(Ruminococcus)、梭菌属ⅩⅣa(Clostridium ⅩⅣa)、霍尔德曼氏菌属(Holdemania)、地孢子菌属(Terrisporobacter)、柯林斯氏菌属(Collinsella)和梭菌属Ⅳ(Clostridium Ⅳ)。玉米蛋白粉组的巴氏杆菌属和密螺旋体菌属相对丰度远高于其余3组。
|
Unclassified:未分类;Subdivision5_genera incertae_sedis:位置未定的亚门5;Barnesiella:巴氏杆菌属;Blautia:布劳特氏菌属;Clostridinm sensu strict:严格意义上的梭属;Megasphaera:巨球菌属;Oseillibacter:奥塞氏杆菌;Bulleidia:丹毒丝菌属;Prevotella:普雷沃氏菌属;Schwartzia:施瓦茨氏菌属;Treponema:密螺旋体属;Catenibacterium:链型杆菌属;Ruminococcus:瘤胃球菌属;Roseburia:罗氏菌属;Clostridhum ⅩⅤa:梭状芽孢杆菌ⅩⅤa属;Merthanobrevibacter:梅尔塔诺布氏杆菌属;Holdemania:霍尔德曼氏菌属;Anaerobacter:厌氧杆菌属;Terrisporobacter:地孢杆菌属;Chlamydia:衣原体属;Collinsella:柯林斯菌属;Alloprevotella:拟普雷沃菌属;Clostridnum Ⅳ:梭状芽孢杆菌Ⅳ属;Saccharibacteria_genera_incertae_se:一般不确定度糖化细菌属;Eubacterium:真杆菌属;Buyricicoccus:布氏杆菌;Sporobacter:孢杆菌属;Gemmiger:芽殖菌属;Psychrobacter:冷杆菌属;Ruminococcus2:瘤胃球菌2属;Lactobacillus:乳酸杆菌;Mitsuokella:光冈菌属;Oribacterium:原生菌属;Erysipelothrix:丹毒杆茵属;Olsenella:欧陆森氏菌属;Phascolarctobacterium:考拉杆菌属;Faecalibacterium:粪杆菌属;Acidaminococcus:氨基酸球菌属;Lachmospiracea_incertae_sedis:不确定沉积物属;Coprococcus:粪球菌属;Peptococcus:消化球菌属;Holdemanella:霍尔德曼氏菌。 A:肠膜蛋白粉组DPS group;B:肠膜蛋白粉+鲜味剂组DPS+umami enhancer group;C:玉米蛋白粉组CGM group;D:玉米蛋白粉+鲜味剂组;CGM+umami enhancer group。下图同The same as below。 图 1 各组菌群结构(属水平) Fig. 1 Microbial structure of each group (genus level) |
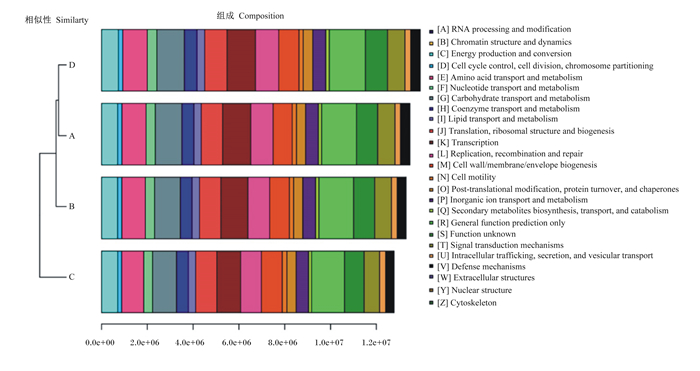
由图 2所示,对测序微生物基因组的基因功能的构成进行分析可知,玉米蛋白粉+鲜味剂组的功能基因相对丰度最大,其次为肠膜蛋白粉组,玉米蛋白粉组的功能基因相对丰度最低,且玉米蛋白粉+鲜味剂组与肠膜蛋白粉组的功能基因分布最为相似。
|
[A]:RNA加工与修饰;[B]:染色质结构与动力学;[C]:能源生产和转换;[D]:细胞周期控制、细胞分裂、染色体分裂;[E]:氨基酸转运与代谢;[F]:核苷酸转运与代谢;[G]:碳水化合物转运与代谢;[H]:辅酶转运与代谢;[I]:脂质转运与代谢;[J]:翻译、核糖体结构与生源论;[K]:转录;[L]:复制、重组和修复;[M]:细胞壁/膜/包膜生源论;[N]:细胞运动;[O]:翻译后修饰、蛋白质转换和伴侣;[P]:无机离子转运与代谢;[Q]:次生代谢生物合成、运输和分解代谢;[R]:仅限一般功能预测;[S]:未知功能;[T]:信号传导机制;[U]:细胞内运输、分泌和囊泡转运;[V]:防卫机制;[W]:真核细胞的细胞外结构;[Y]:核结构;[Z]:细胞骨架。下图同The same as below。 图 2 基于COG的所有样品聚类树与柱状图组合分析图 Fig. 2 Combination analysis chart of COG based multi-sample cluster tree and bar chart |
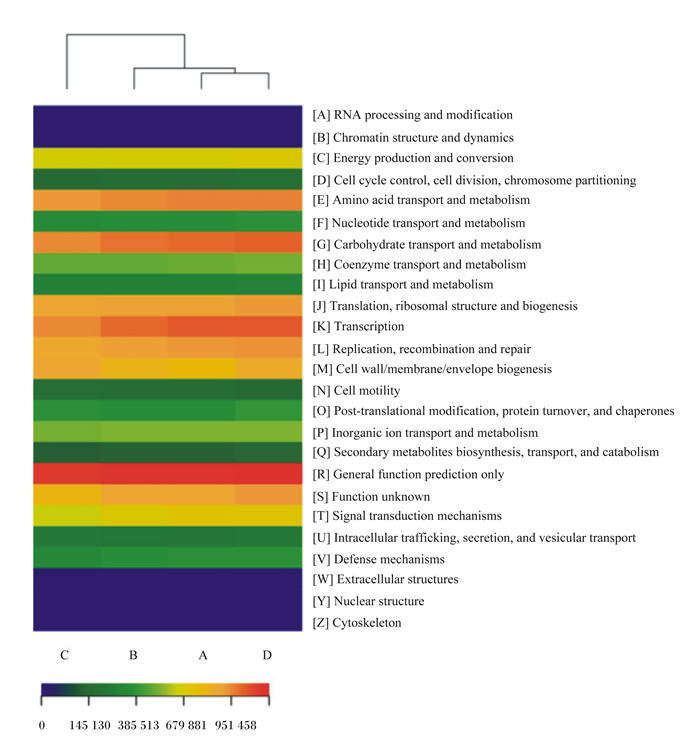
如图 3所示,玉米蛋白粉+鲜味剂组和肠膜蛋白粉组的菌群功能最为相似,玉米蛋白粉组在菌群氨基酸和碳水化合物的运输与代谢、翻译、核糖体结构和转录等功能上弱于其余3组,较其余3组显现出的差异性最大。
|
图 3 基于COG的功能丰度热图 Fig. 3 Heatmap of COG based multi-sample functional abundance |
研究表明,肠膜蛋白粉可以提高断奶仔猪的ADG和ADFI,降低F/G和腹泻率,同时促进肠道绒毛生长和腺窝细胞发育[7-9]。本试验中,主效应分析结果也表明肠膜蛋白粉对断奶仔猪生产性能各项指标的影响均优于玉米蛋白粉,与前人研究结果[7-9]一致。这与肠膜蛋白粉的蛋白质主要以小肽的形式存在有关,断奶仔猪消化器官尚未发育完全,体内的蛋白酶分泌量较低,水解大分子蛋白质能力弱,而肠膜蛋白粉约有2/3的小肽形式蛋白质是可以直接通过小肽转运载体被断奶仔猪吸收利用,减少了未消化完全的蛋白质直接刺激断奶仔猪肠道,进而极大程度上提高了断奶仔猪的各项生长性能[10]。
添加鲜味剂的饲粮会更受断奶仔猪喜爱,提高其采食量、生长性能和饲料消化率,同时会降低仔猪在断奶后第1周腹泻的发生率,并且增强小肠的吸收能力[4-5]。本试验主效应分析结果也表明,添加鲜味剂可显著提高断奶仔猪ADG和ADFI,并降低F/G和腹泻率,与前人研究结果[4-5]一致,这是由于鲜味物质可以刺激断奶仔猪的味觉感受器释放信号,经味觉神经传导至下丘脑弓状核控制口腔及胃肠道中的激素分泌,增加了断奶仔猪采食量的同时也降低了胃肠道的应激反应[11]。
单因素分析结果表明,玉米蛋白粉+鲜味剂组的ADFI与肠膜蛋白粉组相当,同时ADG显著低于肠膜蛋白粉组。这说明玉米蛋白粉+鲜味剂缩短了与肠膜蛋白粉间的差距,起到对肠膜蛋白粉部分替代的作用。
3.2 鲜味剂与不同蛋白质饲料原料组合对断奶仔猪养分和氨基酸表观消化率的影响本试验主效应分析结果表明,肠膜蛋白粉组相较于玉米蛋白粉组断奶仔猪的CP和氨基酸表观消化率极显著提高,同时DM和EE表观消化率显著增加,这与要秀兵[12]的研究结果一致。这是由于肠膜蛋白粉的小肽在动物体内的吸收机制与游离氨基酸相互独立、互不干扰,与游离氨基酸相比,小肽的吸收速度更快、耗能更低、吸收率更高、载体不易饱和,而且避免了由于游离氨基酸之间相互竞争共同的吸收位点而产生的吸收抑制[13]。
添加鲜味剂可减少仔猪断奶时肠道应激和空肠的萎缩,增加肠道抗氧化能力,显著提高养分和氨基酸表观消化率,同时可促进机体蛋白质的沉积,从而增加断奶仔猪的体重[14-15]。本试验主效应分析结果也表明,添加鲜味剂可增加断奶仔猪的DM、CP、磷和部分氨基酸的表观消化率。由于鲜味剂能对小肠细胞的屏障功能起到改善和修复的作用,而屏障功能越好,其营养物质跨膜转运的能力就越强,因此,鲜味剂可提高断奶仔猪的养分表观消化率[16-17]。
单因素分析结果表明,玉米蛋白粉+鲜味剂组的赖氨酸、丝氨酸、缬氨酸、异亮氨酸和苯丙氨酸表观消化率均显著高于玉米蛋白粉组。因此,玉米蛋白粉配合鲜味剂可以实现对肠膜蛋白粉CP和氨基酸养分表观消化率方面部分替代、其余养分表观消化率方面完全替代的作用。
3.3 鲜味剂与不同蛋白质饲料原料组合对断奶仔猪血清激素指标的影响胃饥饿素作为饿感信号,通过下丘脑神经肽Y和Y1受体作用促进胃动能活性,进而促进动物采食[18]。而CCK作为饱感信号,能够调节某些G蛋白偶联受体的兴奋性以及其他肽类神经递质的释放,起到抑制动物进食的作用[19]。在动物生长发育过程中,IGF-Ⅰ是一类具有细胞分化和增殖功能的多肽,它可以直接作用于动物体组织,促进骨骼的合成代谢和细胞的有丝分裂[20]。
目前有关肠膜蛋白粉在断奶仔猪血清激素方面的影响未见报道。在本试验中,主效应分析结果表明,肠膜蛋白粉组相较于玉米蛋白粉组断奶仔猪的血清胃饥饿素和IGF-Ⅰ含量极显著提高,血清ACTH、CRH、CCK和皮质醇含量极显著降低。
研究表明,添加鲜味剂能够增加哺乳仔猪血清中胃饥饿素和IGF-Ⅰ含量,降低GLP-1和CCK含量[21]。本试验主效应分析结果表明,添加鲜味剂可显著提高断奶仔猪的血清胃饥饿素和IGF-Ⅰ含量,显著降低血清CRH含量,与前人研究结果[21]一致。当鲜味剂被动物采食后会改变星形胶质细胞形态,致使胃饥饿素的mRNA表达量有所提高[22],影响胃饥饿素的分泌,同时胃饥饿素还会调节生长激素(GH)的分泌,两者存在剂量上的依存关系,GH的分泌又会对IGF-Ⅰ起到调控作用,从而间接导致了IGF-Ⅰ分泌的增加[23]。
单因素分析结果表明,玉米蛋白粉+鲜味剂组断奶仔猪的血清胃饥饿素和IGF-Ⅰ含量显著高于玉米蛋白粉组。由此可见,玉米蛋白粉配合鲜味剂可以在仔猪血清胃饥饿素含量上完全替代肠膜蛋白粉,在血清IGF-Ⅰ含量上部分替代肠膜蛋白粉。
3.4 鲜味剂与不同蛋白质饲料原料组合对断奶仔猪粪便菌群结构的影响很多研究表明,当肠道菌群多样性减少时,引起疾病的概率就会增加[24-27]。而Shannon和Simpson指数是判定菌群多样性的重要指标,通常菌群多样性指数越高,菌群区系平衡就越难被破坏[28]。本试验中,玉米蛋白粉组的Shannon指数最低,Simpson指数最高,说明玉米蛋白粉组菌群多样性最低;而玉米蛋白粉+鲜味剂组Shannon指数最高,Simpson指数最低,说明玉米蛋白粉+鲜味剂组菌群多样性最高。这表明玉米蛋白粉配合鲜味剂能增加断奶仔猪肠道微生物多样性,从而形成一种平衡而复杂的肠道屏障体系,可代替肠膜蛋白粉对断奶仔猪肠道的保护作用,也是生长性能试验结果中提高奶仔猪平均日增重的可能原因之一。
在本试验中,断奶仔猪粪便属水平菌群结构上,玉米蛋白粉组的断奶仔猪肠道内巴氏杆菌属和密螺旋体菌属相对丰度最高,而玉米蛋白粉+鲜味剂组相较于较玉米蛋白粉组的巴氏杆菌属和密螺旋体菌属相对丰度均降低,使断奶仔猪肠道菌群的结构相似性更趋近于优质的肠膜蛋白粉,证明玉米蛋白粉配合鲜味剂可以降低断奶仔猪患血痢或炎症的潜在风险,这也印证了前文中鲜味剂的添加能够降低断奶仔猪的腹泻率的结论。巴氏杆菌属为无芽孢、不运动、兼性厌氧的革兰氏染色阴性小杆菌,Borewicz等[29]在受肠炎沙门氏杆菌感染猪的研究中发现,受感染的猪相较于健康的猪,其肠道内的巴氏杆菌属相对丰度有显著增加,这可能是成为急、慢性病或流行性疾病的病原。密螺旋体菌属同样是广义细菌的一属,运动活泼,不易着色,在猪体内的痢疾蛇样密螺旋体会导致猪血痢的发生。Karlsson[30]的研究指出,在猪的各种皮肤溃疡中都有密螺旋体菌属的参与,且可能起到致病的主要作用。
通过菌群基因功能预测可以发现,玉米蛋白粉组菌群的氨基酸和碳水化合物的运输与代谢、翻译、核糖体结构和转录等功能基因的相对丰度低于其余3组,而玉米蛋白粉+鲜味剂组的菌群功能基因相对丰度最高,与肠膜蛋白粉组菌群功能基因相对丰度最相似,这也印证了鲜味剂的添加可以提高断奶仔猪的养分和氨基酸消化率及生长性能的结论。
4 结论玉米蛋白粉配合鲜味剂具有改善饲料适口性、增加断奶仔猪对养分的消化吸收、提高生长性能的作用。因此,在断奶仔猪饲粮中使用玉米蛋白粉配合鲜味剂替代肠膜蛋白粉是可行的。
| [1] |
CHO J H, LINDEMANN M D, MONEGUE H J, et al. Feeding value of dried porcine solubles for weanling pigs[J]. The Professional Animal Scientist, 2010, 26(4): 425-434. DOI:10.15232/S1080-7446(15)30624-0 |
| [2] |
郭亮, 李德发, 邢建军, 等. 玉米、玉米蛋白粉、菜籽粕和玉米干酒糟可溶物的猪消化能值测定[J]. 饲料工业, 2000, 21(10): 29-31. GUO L, LI D F, XING J J, et al. Determination of porcine digestibility of soluble substances in corn corn protein powder rapeseed meal and corn distiller's grains[J]. Feed Industry, 2000, 21(10): 29-31 (in Chinese). |
| [3] |
郭亮, 李德发, 邢建军, 等. 玉米蛋白粉日粮纤维和能量对猪氮代谢的影响[J]. 粮食与饲料工业, 2001(4): 34-36. GUO L, LI D F, XING J J, et al. Effects of dietary fiber and energy of corn protein powder on nitrogen metabolism in pigs[J]. Food and Feed Industry, 2001(4): 34-36 (in Chinese). DOI:10.3969/j.issn.1003-6202.2001.04.013 |
| [4] |
LERNER A B, TOKACH M D, DEROUCHEY J M, et al. Effects of monosodium glutamate on nursery pig performance[J]. Journal of Animal Science, 2018, 96(Suppl.2): 113. |
| [5] |
REZAEI R, KNABE D A, TEKWE C D, et al. Dietary supplementation with monosodium glutamate is safe and improves growth performance in post weaning pigs[J]. Amino Acids, 2013, 44(3): 911-923. DOI:10.1007/s00726-012-1420-x |
| [6] |
刘义, 赵钺沁, 周怡梅, 等. 鲜味肽的研究进展[J]. 西华大学学报(自然科学版), 2016, 35(3): 21-25. LIU Y, ZHAO Y Q, ZHOU Y M, et al. Research progress of umami peptide[J]. Journal of Xihua University (Natural Science Edition), 2016, 35(3): 21-25 (in Chinese). DOI:10.3969/j.issn.1673-159X.2016.03.005 |
| [7] |
曾礼华. 大豆浓缩蛋白, 肠膜蛋白粉, 血浆蛋白粉对早期断奶仔猪生产性能的影响[J]. 西南农业学报, 2006, 19(5): 949-952. ZENG L H. Evaluation of SPC, DPS SDPP in diets on performance of early-weaned pigs[J]. Southwest China Journal of Agricultural Sciences, 2006, 19(5): 949-952 (in Chinese). DOI:10.3969/j.issn.1001-4829.2006.05.040 |
| [8] |
司马博锋, 陈代文, 吴德, 等. 不同料型教槽料对乳仔猪生产性能及腹泻、皮毛状况的影响[J]. 饲料博览, 2011(4): 5-8. SI MA B F, CHEN D W, WU D, et al. Effect of different feed type group feeds on growth performance, diarrhea and skin condition of sucking and weaning piglets[J]. Feed Review, 2011(4): 5-8 (in Chinese). DOI:10.3969/j.issn.1001-0084.2011.04.002 |
| [9] |
JONES C K, DEROUCHEY J M, NELSSEN J L, et al. Effects of pepsoygen and dried porcine solubles 50 in nursery pig diets[J]. Report of Progress, 2008(10): 52-61. |
| [10] |
范淳, 陈代文, 余冰, 等. 小肽转运载体(PepT1和PepT2)研究进展[J]. 饲料工业, 2007, 28(1): 11-15. FAN C, CHEN D W, YU B, et al. Progress in research on PepT1 and PepT2 small peptide transporters[J]. Feed Industry, 2007, 28(1): 11-15 (in Chinese). |
| [11] |
ZHANG J, YIN Y L, SHU X G, et al. Oral administration of MSG increases expression of glutamate receptors and transporters in the gastrointestinal tract of young piglets[J]. Amino Acids, 2013, 45(5): 1169-1177. DOI:10.1007/s00726-013-1573-2 |
| [12] |
要秀兵.不同动物蛋白源在早期断奶仔猪日粮中的应用效果研究[D].硕士学位论文.乌鲁木齐: 新疆农业大学, 2009. YAO X B.Effect of different animal protein sources on early weaning piglets diet[D]. Master's Thesis.Urumqi: Xinjiang Agricultural University, 2009. (in Chinese) |
| [13] |
李燕, 王中华.小肽营养研究进展: 动物对小肽的吸收及组织利用[C]//中国林牧渔业经济学会饲料经济专业委员会第九届学术交流大会论文集.北京: 中国林牧渔业经济学会, 中国饲料工业协会, 2012. LI Y, WANG Z H.Progress in the study of small peptide nutrition: absorption and tissue utilization of small peptide in animals[C]//Proceedings of the 9th academic exchange meeting of feed economics committee of China Forestry, Animal Husbandry and Fishery Economic Society.Beijing: China Forestry, Animal Husbandry and Fishery Economic Association, China Feed Industry Association, 2012.(in Chinese) |
| [14] |
LIN M, ZHANG B L, YU C N, et al. L-glutamate supplementation improves small intestinal architecture and enhances the expressions of jejunal mucosa amino acid receptors and transporters in weaning piglets[J]. PLoS One, 2014, 9(11): e111950. DOI:10.1371/journal.pone.0111950 |
| [15] |
陈罡.谷氨酸纳对哺乳仔猪蛋白质和脂肪代谢影响的研究[D].硕士学位论文.长沙: 湖南农业大学, 2013. CHEN G.Effect of glutamate on protein and fat metabolism of suckling piglets[D]. Master's Thesis.Changsha: Hunan Agricultural University, 2013. (in Chinese) |
| [16] |
任效瑞, 朱惠玲, 刘玉兰, 等.谷氨酸对脂多糖刺激仔猪肠道免疫屏障损伤的调控作用[C]//中国畜牧兽医学会动物营养学分会第七届中国饲料营养学术研讨会.郑州: 中国畜牧兽医学会动物营养学分会, 2014. REN X R, ZHU H L, LIU Y L, et al.Effects of glutamate on intestinal immune barrier injury induced by lipopolysaccharide in piglets[C]// The 7th China feed nutrition symposium, Animal Nutrition Branch of Chinese Society of Animal Husbandry and Veterinary Sciences.Zhengzhou: Animal Nutrition Branch of Chinese Society of Animal Husbandry and Veterinary Science, 2014.(in Chinese) |
| [17] |
WIJTTEN P J A, VAN DER MEULEN J, VERSTEGEN M W A. Intestinal barrier function and absorption in pigs after weaning:a review[J]. British Journal of Nutrition, 2011, 105(7): 967-981. DOI:10.1017/S0007114510005660 |
| [18] |
ASAKAWA A, INUI A, KAGA O, et al. Ghrelin is an appetite-stimulatory signal from stomach with structural resemblance to motilin[J]. Gastroenterology, 2001, 120(2): 337-345. DOI:10.1053/gast.2001.22158 |
| [19] |
石慧琳, 张健发. 胆囊收缩素与摄食调节的研究进展[J]. 中国行为医学科学, 2003, 12(2): 239-240. SHI H L, ZHANG J F. Advances in the study of cholecystokinin and regulation of food intake[J]. Chinese Journal of Behavioral Medicine, 2003, 12(2): 239-240 (in Chinese). DOI:10.3760/cma.j.issn.1674-6554.2003.02.059 |
| [20] |
DELAFONTAINE P, SONG Y H, LI Y X. Expression, regulation, and function of IGF-Ⅰ, IGF-ⅠR, and IGF-Ⅰ binding proteins in blood vessels[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2004, 24(3): 435-444. DOI:10.1161/01.ATV.0000105902.89459.09 |
| [21] |
张军.谷氨酸钠在仔猪胃肠道的转运和代谢及机制研究[D].博士学位论文.北京: 中国科学院大学, 2013: 46-51. ZHANG J.Studies on the transport and metabolism of glutamate in the gastrointestinal tract of piglets[D]. Ph.D.Thesis.Beijing: University of Chinese Academy of Sciences, 2013: 46-51.(in Chinese) |
| [22] |
LEE S, KIM Y, LI E D, et al. Ghrelin protects spinal cord motoneurons against chronic glutamate excitotoxicity by inhibiting microglial activation[J]. The Korean Journal of Physiology and Pharmacology, 2012, 16(1): 43-48. DOI:10.4196/kjpp.2012.16.1.43 |
| [23] |
SATO T, KUROKAWA M, NAKASHIMA Y, et al. Ghrelin deficiency does not influence feeding performance[J]. Regulatory Peptides, 2008, 145(1/2/3): 7-11. |
| [24] |
GUO X, XIA X, TANG R, et al. Development of a real-time PCR method for Firmicutes and Bacteroidetes in faeces and its application to quantify intestinal population of obese and lean pigs[J]. Letters in Applied Microbiology, 2008, 47(5): 367-373. |
| [25] |
SHEN J, ZHANG B R, WEI G F, et al. Molecular profiling of the Clostridium leptum subgroup in human fecal microflora by PCR-denaturing gradient gel electrophoresis and clone library analysis[J]. Applied and Environmental Microbiology, 2006, 72(8): 5232-5238. |
| [26] |
ABRAHAMSSON T R, JAKOBSSON H E, ANDERSSON A F, et al. Low diversity of the gut microbiota in infants with atopic eczema[J]. Journal of Allergy and Clinical Immunology, 2012, 129(2): 434-440. |
| [27] |
WANG M, KARLSSON C, OLSSON C, et al. Reduced diversity in the early fecal microbiota of infants with atopic eczema[J]. Journal of Allergy and Clinical Immunology, 2008, 121(1): 129-134. |
| [28] |
FORNO E, ONDERDONK A B, MCCRACKEN J, et al. Diversity of the gut microbiota and eczema in early life[J]. Clinical and Molecular Allergy, 2008, 6(1): 11. |
| [29] |
BOREWICZ K A, KIM H B, SINGER R S, et al. Changes in the porcine intestinal microbiome in response to infection with Salmonella enterica and Lawsonia intracellularis[J]. PLoS One, 2015, 10(10): e0139106. |
| [30] |
KARLSSON F.Treponema spp. in porcine skin ulcers[D]. Ph.D.Thesis.Uppsala: Swedish University of Agricultural Sciences, 2014.
|




