2. 甘肃农业大学理学院, 兰州 730070;
3. 兰州大学草地农业科技学院草地农业生态系统国家重点实验室, 农业农村部草牧业创新重点实验室, 兰州 730020
2. School of Science, Gansu Agricultural University, Lanzhou 730070, China;
3. State Key Laboratory of Grassland Agro-Ecosystems, Key Laboratory of Grassland Livestock Industry Innovation, Ministry of Agriculture and Rural Affairs, College of Pastoral Agriculture Science and Technology, Lanzhou University, Lanzhou 730020, China
谷物类、豆类、块茎类饲料富含的淀粉是畜禽的主要能源,具有促进生长和影响机体代谢活动的作用。淀粉来源不同,其晶体结构、淀粉颗粒、淀粉组成等均有差异,进而影响机体对淀粉的消化及对能量、葡萄糖和氨基酸的利用。补充直链淀粉可以避免氨基酸在肠黏膜中的分解代谢,使肉鸡可以更有效地从葡萄糖中获得能量从而提高氨基酸的后肠利用率[1]。小肠前端主要消化直链淀粉/支链淀粉低的淀粉,直链淀粉/支链淀粉高的淀粉能够减缓和抵御小肠中消化酶的水解,进入消化道后端依靠微生物发酵产生挥发性脂肪酸(volatile fatty acid,VFA),进而改变肠道菌群结构以及微生物的发酵模式[2]。余苗等[3]以木薯淀粉、玉米淀粉和豌豆淀粉(直链淀粉/支链淀粉分别为0.11、0.25、0.44)作为唯一淀粉源配制饲粮饲喂育肥猪,发现豌豆淀粉饲粮增加了其盲肠食糜中乙酸、丁酸和总挥发性脂肪酸(total volatile fatty acid,TVFA)含量,促进了盲肠部分有益菌的繁殖,降低了大肠杆菌等潜在致病菌的数量。生长育肥猪长期采食生土豆淀粉(含高直链淀粉)饲粮时可显著改变后肠微生物的组成[4]。Li等[5]研究了不同淀粉源(玉米、小麦、大米)对肉鸡葡萄糖和脂肪代谢的影响,结果显示不同淀粉源对肉鸡血液葡萄糖和糖原含量无显著影响,但对糖脂合成酶基因的表达有显著影响,从侧面说明了饲粮淀粉源的消化吸收对糖脂代谢途径相关酶编码基因表达的影响更为明显。目前,不同的淀粉源饲粮对肉仔鸡的生长性能、养分利用率及淀粉消化率等方面的研究报道较多,而对肉仔鸡盲肠食糜VFA含量、肠道食糜和黏膜消化酶活性以及微生物菌群的研究较少。因此,本文旨在探讨玉米淀粉、豌豆淀粉、木薯淀粉、高粱淀粉和小麦淀粉5种不同来源淀粉对肉仔鸡小肠消化酶活性、盲肠VFA含量及微生物菌群的影响,为不同能量饲粮地合理选配提供参考依据。
1 材料与方法 1.1 试验材料玉米淀粉、木薯淀粉、豌豆淀粉、小麦淀粉(淀粉含量≥98%)购自西安市某化工原料有限公司,高粱淀粉(淀粉含量≥78%)购自某粮油市场。
1.2 试验设计选取480只健康、体重相近的1日龄爱拔益加(AA)肉仔鸡(公雏),随机分为5组,每组8个重复,每个重复12只鸡。5组分别饲喂玉米淀粉、豌豆淀粉、木薯淀粉、高粱淀粉和小麦淀粉配制的半纯合等氮等能饲粮,5组饲粮总淀粉水平一致。试验期21 d。
1.3 试验饲粮以玉米淀粉、木薯淀粉、豌豆淀粉、高粱淀粉、小麦淀粉作为唯一淀粉源配制5种等氮等能半纯合饲粮,其总淀粉水平一致,饲粮干物质、粗蛋白质、钙、磷、直链淀粉、支链淀粉及总淀粉的水平均为实测值,代谢能为计算值。其他原料参照饲料公司原料成分及营养价值表,根据配方比例配制成1~3周龄颗粒破碎料,制粒温度为75 ℃。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
试验肉鸡采用3层叠笼饲养,各组的安排考虑位置效应的影响,鸡舍温度、湿度、光照等饲养管理条件均保持一致,试验期间,试验鸡自由采食和饮水,参照商业公司推荐的免疫程序进行免疫接种。
1.5 样品采集与处理试验结束后,从每个重复中选取8只体重[(450±25) g]相近的公鸡颈部放血处死,解剖分离十二指肠、空肠、回肠和盲肠,取小肠各肠段食糜2 mL于冻存管,用生理盐水冲洗各肠段,滤纸吸附水分后用载玻片剥离黏膜放入2 mL冻存管,同时收集盲肠食糜于5 mL冻存管中,液氮速冻,-80 ℃保存。
1.6 测定指标与方法 1.6.1 盲肠食糜VFA含量盲肠食糜在4 ℃解冻后,准确称取食糜0.5 g于离心管中,按照质量体积比1.0:2.5加入超纯水,旋涡振荡3~5 min,5 000 r/min离心10 min,取上清液1 mL于2 mL离心管中,加入0.2 mL含有2-乙基丁酸(2-EB)的偏磷酸去蛋白溶液,旋涡混匀,并置冰水浴中30 min,10 000 r/min,4 ℃离心10 min,采用安捷伦6890N气相色谱仪测定盲肠食糜VFA含量。
1.6.2 小肠食糜和黏膜的消化酶活性小肠食糜和黏膜在4 ℃解冻后,准确称取食糜和黏膜各0.5和0.2 g,分别按照质量体积比1:4和1:9加入4 ℃、0.9%的生理盐水稀释,冰浴中充分匀浆后置于4 ℃离心机中分别离心20(4 500 r/min)和10 min (3 000 r/min),取上清液分装于冻存管并置于-18 ℃保存。按照试剂盒(南京建成生物工程研究所)方法分别测定小肠食糜和黏膜的脂肪酶和淀粉酶活性。
1.6.3 盲肠食糜微生物菌群采用十六烷基三甲基溴化铵(CTAB)的方法[6]提取盲肠食糜的DNA,检测其纯度,同时将浓度稀释至1 ng/μL,然后合成带有barcode的特异引物341-F(5’-CCTAYGGGRBGCASCAGG-3’)和806-R(5’-GGACTACNNGGGTATCTAAT-3’),扩增16S V3~V4区,扩增产物用2%的琼脂糖凝胶电泳检测,选择主带大小在400~450 bp的序列,割胶回收目的条带,使用TruSeqⓇ DNA PCR-Free Sample Preparation Kit建库试剂盒构建文库,用Qubit和Q-PCR检测,文库合格后,使用NovaSeq6000进行上机测序。测序工作由北京诺禾致源科技有限公司完成。
1.7 数据统计与分析VFA含量和消化酶活性数据经Excel 2013初步处理后采用SPSS 21.0软件进行统计分析。使用one-way ANOVA程序对数据进行方差分析,并用Duncan氏法进行多重比较。微生物菌群数据分析利用Uparse v7.0.1001软件将序列聚类成为操作分类单元(operational taxonomic units,OTUs)并筛选,用Mothur方法与SILVA 132的SSUrRNA数据库进行物种注释分析,从而获得分类学信息并分别在各个分类水平上统计各样本的群落组成,使用Qiime 1.9.1软件计算α多样性指数,利用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)软件分析不同组中具有显著差异的微生物,线性判别分析(linear discriminant analysis,LDA)值大于4的菌种表示组间具有统计学差异的生物标记物。显著性水平为P < 0.05,结果以平均值±标准误表示。
2 结果 2.1 不同淀粉源饲粮对肉仔鸡盲肠食糜VFA含量的影响不同淀粉源饲粮对肉仔鸡盲肠食糜VFA含量的影响见表 2。豌豆淀粉组的盲肠食糜乙酸含量显著高于木薯淀粉组、玉米淀粉组和小麦淀粉组(P < 0.05);高粱淀粉组的盲肠食糜乙酸含量仅次于豌豆淀粉组,差异不显著(P>0.05)。豌豆淀粉组的盲肠食糜丙酸含量显著高于其他各组(P < 0.05);木薯淀粉组的盲肠食糜丙酸含量最低,显著低于其他各组(P < 0.05)。小麦淀粉组、玉米淀粉组和豌豆淀粉组的盲肠食糜异丁酸含量显著高于高粱淀粉组和木薯淀粉组(P < 0.05)。玉米淀粉组的盲肠食糜戊酸含量显著高于木薯淀粉组和豌豆淀粉组(P < 0.05)。豌豆淀粉组和高粱淀粉组的盲肠食糜TVFA含量显著高于其他各组(P < 0.05)。
|
|
表 2 不同淀粉源饲粮对肉仔鸡盲肠食糜VFA含量的影响 Table 2 Effects of different starch source diets on caecum chyme VFA contents of broilers |
不同淀粉源饲粮对肉仔鸡小肠食糜消化酶活性的影响见表 3。随肠段的后移,食糜脂肪酶活性随之增强。在十二指肠食糜中,玉米淀粉组的脂肪酶活性最高,显著高于小麦淀粉组、木薯淀粉组和高粱淀粉组(P < 0.05);在空肠和回肠食糜中,木薯淀粉组的脂肪酶活性显著高于其他各组(P < 0.05)。在十二指肠食糜中,玉米淀粉组和小麦淀粉组的淀粉酶活性显著高于高粱淀粉组和木薯淀粉组(P < 0.05);在空肠食糜中,高粱淀粉组的淀粉酶活性显著高于其他组(P < 0.05);在回肠食糜中,高粱淀粉组和小麦淀粉组的淀粉酶活性显著高于其他各组(P < 0.05),豌豆淀粉组和木薯淀粉组的淀粉酶活性显著低于其他各组(P < 0.05)。
|
|
表 3 不同淀粉源饲粮对肉仔鸡小肠食糜消化酶活性的影响 Table 3 Effects of different starch source diets on small intestinal chyme digestive enzyme activities of broilers |
不同淀粉源饲粮对肉仔鸡小肠黏膜消化酶活性的影响见表 4。在十二指肠黏膜中,玉米淀粉组、木薯淀粉组和高粱淀粉组的脂肪酶活性显著高于豌豆淀粉组(P < 0.05);在空肠黏膜中,木薯淀粉组和玉米淀粉组的脂肪酶活性显著高于其他各组(P < 0.05);在回肠黏膜中,高粱淀粉组和小麦淀粉组的脂肪酶活性显著高于其他各组(P < 0.05)。在十二指肠黏膜中,木薯淀粉组的淀粉酶活性显著高于其他各组(P < 0.05);在空肠黏膜中,木薯淀粉组的淀粉酶活性显著高于其他组(P < 0.05);在回肠黏膜中,高粱淀粉和小麦淀粉组的淀粉酶活性显著高于其他各组(P < 0.05)。
|
|
表 4 不同淀粉源饲粮对肉仔鸡小肠黏膜消化酶活性的影响 Table 4 Effects of different starch source diets on small intestinal mucosal digestive enzyme activities of broilers |
采用Illumina Nova测序平台进行双末端(paired-end)测序,通过对Reads拼接后平均每样品测得91 485条Tags,质控后平均得到85 175条有效数据,质控有效数据量达64 815条,序列平均长度达414 bp,有效率达70.69%。由图 1可知,每个样品的稀释曲线趋于平缓,说明测序数据量合理。基于97%的一致性原则将序列聚类成OTUs,5组共测得2 371个OTUs,共有367个OTUs,占总OTUs数目的15.48%,同时玉米淀粉组、豌豆淀粉组、木薯淀粉组、高粱淀粉组、小麦淀粉组分别有1005、751、1452、662、1717个OTUs,特有的OTUs数目分别为261、18、120、30、374个。
|
Y:玉米淀粉组;W:豌豆淀粉组;M:木薯淀粉组;G:高粱淀粉组;X:小麦淀粉组。下图同。 Y: corn starch group; W: pea starch group; M: tapioca starch group; G: sorghum starch group; X: wheat starch group. The same as below. 图 1 样品稀释曲线分析图 Fig. 1 Rarefaction curve analysis of samples |
由表 5可知,不同淀粉源饲粮对肉仔鸡盲肠的α多样性指数均无显著影响(P>0.05),且覆盖率均超过99.40%,说明每组数据能准确反映肉仔鸡盲肠微生物菌群的组成。与玉米淀粉组、木薯淀粉组和小麦淀粉组相比,豌豆淀粉组和高粱淀粉组的ACE指数、Chao1指数、Simpson指数、Shannon指数、观察到的物种以及系统发育指数均有所降低,小麦淀粉组的ACE指数、Chao1指数、Simpson指数、Shannon指数、观察到的物种以及系统发育指数最高。
|
|
表 5 不同淀粉源饲粮对肉仔鸡盲肠微生物α多样性指数的影响 Table 5 Effects of different starch source diets on caecum microbial α diversity index of broilers |
本试验共鉴定出肉仔鸡盲肠微生物中的31个门(phylum)、44个纲(class)、106个目(order)、193个科(family)、354个属(genus)和232个种(species)。由表 6可知,各组在门水平上的微生物菌群主要以拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和柔膜菌门(Tenericutes)为主。豌豆淀粉组的拟杆菌门相对丰度最高,显著高于其他各组(P < 0.05);玉米淀粉组和木薯淀粉组的厚壁菌门相对丰度显著高于其他各组(P < 0.05);高粱淀粉组的变形菌门相对丰度最高,显著高于其他各组(P < 0.05);豌豆淀粉组和木薯淀粉组的柔膜菌门相对丰度显著高于其他各组(P < 0.05);豌豆淀粉组的Melainabacteria相对丰度显著低于其他各组(P < 0.05);高粱淀粉组和豌豆淀粉组的放线菌门相对丰度显著低于其他各组(P < 0.05);玉米淀粉组的蓝藻门相对丰度显著高于其他各组(P < 0.05);豌豆淀粉组的疣微菌门相对丰度最低,显著低于其他各组(P < 0.05)。
|
|
表 6 不同淀粉源饲粮对肉仔鸡盲肠微生物菌群组成的影响 Table 6 Effects of different starch source diets on caecum microbial community of broilers |
在属水平上,各组肉仔鸡盲肠中拟杆菌属(Bacteroides)的相对丰度均大于16%。豌豆淀粉组和木薯淀粉组的拟杆菌属相对丰度显著高于其他各组(P < 0.05),肠杆菌科未定义属相对丰度显著低于其他各组(P < 0.05);木薯淀粉组的瘤胃菌科未定义属相对丰度显著高于其他各组(P < 0.05);玉米淀粉组和小麦淀粉组的肠球菌属、粪杆菌属和副拟杆菌属(Parabacteroides)相对丰度显著高于豌豆淀粉组(P < 0.05);豌豆淀粉组的Odoribacter相对丰度显著高于其他各组(P < 0.05);玉米淀粉组的Romboutsia相对丰度显著高于木薯淀粉组和小麦淀粉组(P < 0.05);木薯淀粉组的毛螺菌科未定义属相对丰度显著高于其他各组(P < 0.05)。
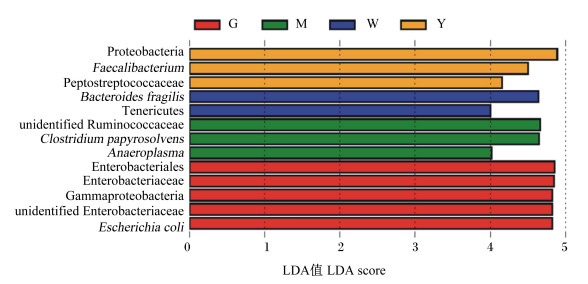
2.4.3 不同淀粉源饲粮对肉仔鸡盲肠差异微生物的影响通过LEfSe分析不同水平上具有显著差异的微生物(图 2),发现小麦淀粉组与玉米淀粉、豌豆淀粉、木薯淀粉和高粱淀粉组相比没有差异显著的菌种,而高粱淀粉组中具有显著差异的细菌分类群是大肠杆菌(Escherichia coli)、肠杆菌科未定义属(unidentified Enterobacteriaceae)、丙型变形菌纲(Gammaproteobacteria)、肠杆菌科(Enterobacteriaceae)、肠杆菌目(Enterobacteriales),木薯淀粉组中具有显著差异的细菌分类群是厌氧枝原体属(Anaeroplasma)、溶大伞莎草梭菌(Clostridium papyrosolvens)、瘤胃球菌科未定义属(unidentified Ruminococcaceae),豌豆淀粉组中具有显著差异的细菌分类群是脆弱拟杆菌(Bacteroides fragilis)、柔膜菌门(Tenericutes),玉米淀粉组中具有显著差异的细菌分类群是变形菌门、粪杆菌属(Faecalibacterium)、消化链球菌科(Peptostreptococcaceae)。
|
Proteobacteria:变形菌门;Faecalibacterium:粪杆菌属;Peptostreptococcaceae:消化链球菌科;Bacteroides fragilis:脆弱拟杆菌;Tenericutes:柔膜菌门;unidentified Ruminococcaceae:瘤胃球菌科未定义属;Clostridium papyrosolvens:溶大伞莎草梭菌;Anaeroplasma:厌氧枝原体属;Enterobacteriales:肠杆菌目;Enterobacteriaceae:肠杆菌科;Gammaproteobacteria:丙型变形菌纲;unidentified Enterobacteriaceae:肠杆菌科未定义属;Escherichia coli:大肠杆菌。 图 2 差异微生物LEfSe分析 Fig. 2 LEfSe analysis on differential microorganisms |
单胃动物体内的VFA来源于食物和肠道细菌发酵,而细菌发酵主要发生在消化道后端[7]。研究表明,肉仔鸡盲肠的发酵能力与盲肠中可发酵的底物浓度有关[8],直链或抗性淀粉的含量越高,底物浓度越高[9],则产生的VFA含量越高。Haenen等[10]研究了可消化淀粉和抗性淀粉对成年母猪肠道的影响,结果表明抗性淀粉可以提高成年母猪结肠和盲肠VFA含量。Yu等[11]研究发现,与木薯淀粉相比,豌豆淀粉可以提高育肥猪结肠中VFA、乙酸、丙酸、丁酸和戊酸含量。本研究也发现,5组饲粮总淀粉水平一致的情况下,豌豆淀粉组肉仔鸡盲肠食糜乙酸、丙酸和TVFA含量最高,高粱淀粉组肉仔鸡盲肠食糜TVFA含量也较高,原因在于豌豆淀粉饲粮和高粱淀粉饲粮中含有较高的直链淀粉(分别为14.41%和15.18%)和直链淀粉/支链淀粉(分别为0.57和0.61),说明淀粉来源不同会影响肉仔鸡盲肠发酵水平,高直链淀粉饲粮不能被家禽前消化道充分消化利用,提示在使用这2种饲料原料时可以通过添加酶制剂或应用热加工技术提高淀粉利用率。
3.2 不同淀粉源饲粮对肉仔鸡小肠消化酶活性的影响研究发现,不同品种的鸡消化道中食糜的淀粉酶和脂肪酶活性均表现为空肠最高,说明食糜在空肠停留时间较长,与酶可以充分反应[12]。于洋洋[13]研究了木薯、玉米、小麦和豌豆4种不同淀粉源对羔羊不同生长时期小肠消化酶活性的影响,结果发现直链淀粉/支链淀粉高的豌豆淀粉组(0.48)羔羊小肠食糜中淀粉酶的活性提高。本试验中,直链淀粉/支链淀粉最高的高粱淀粉组(0.61)空肠和回肠食糜以及回肠黏膜的淀粉酶活性均较高,这与上述结果一致。5种不同的淀粉源对肉仔鸡小肠食糜淀粉酶和脂肪酶活性影响均表现为空肠和回肠高于十二指肠,与前人研究结果[14-15]相似。玉米淀粉组肉仔鸡十二指肠食糜的脂肪酶和淀粉酶活性最高,这与玉米淀粉的快速消化性能一致。相振田[16]研究表明,豌豆淀粉可以提高断奶仔猪肠道食糜淀粉酶活性,而木薯淀粉显著降低了淀粉酶活性。本试验结果发现,木薯淀粉饲粮可以适当提高肉仔鸡十二指肠和空肠黏膜脂肪酶和淀粉酶活性,与上述研究结果不同,这可能是饲料加工方式或不同种类动物消化生理差异所致。
3.3 不同淀粉源饲粮对肉仔鸡盲肠微生物菌群的影响机体的正常生理、新陈代谢、免疫和神经功能等均受到体内微生物的调节,微生物的定植和发展是从动态变化到逐渐趋于稳定的内外因素共同作用的复杂过程[17-19],肉仔鸡盲肠中优势菌门为厚壁菌门、拟杆菌门、变形菌门和柔膜菌门,其中相对丰度最高的是厚壁菌门[20]。厚壁菌门的代谢产物主要是丁酸,与物质的运输有关,参与机体的能量代谢,拟杆菌门可以利用多糖产生乙酸和丙酸[21],而变形菌门相对丰度的增加会导致肠道菌群失调,引起肠道炎症[22]。本试验发现,饲喂不同淀粉源饲粮的肉仔鸡盲肠优势菌门为拟杆菌门、厚壁菌门、变形菌门和柔膜菌门,与上述结果一致。豌豆淀粉组拟杆菌门和柔膜菌门相对丰度最高,变形菌门和Melainabacteria相对丰度最低,这与前面豌豆淀粉饲粮可以提高盲肠乙酸、丙酸和TVFA含量相一致,而木薯淀粉组和玉米淀粉组厚壁菌门相对丰度较高,这可能为其盲肠内丁酸的产生提供了条件。
Fouhse等[23]和Yang等[24]研究发现,抗性淀粉或直链淀粉可以抑制肠道有害菌增殖,增加有益菌数量,促进肠道健康。本试验中,豌豆淀粉组拟杆菌属和Odoribacter相对丰度最高,肠杆菌科未定义属、肠球菌属、粪杆菌属和Parabacteroides相对丰度最低。研究发现,拟杆菌属和另枝菌属与乙酸的产生有显著相关性[25],拟杆菌属可产生琥珀酸和乙酸,粪杆菌属可产生丁酸[26],进一步说明了豌豆淀粉饲粮通过增加肠道中的产酸菌群促进微生物发酵,改变肠道菌群结构,促进有益菌的生长,抑制有害菌的繁殖,从而促进肉仔鸡的肠道健康。
通过LEfSe分析得出高粱淀粉组中具有生物标记物的菌群以革兰氏阴性菌为主,包括变形菌门的大肠杆菌、肠杆菌科未定义属、丙型变形菌纲、肠杆菌科和肠杆菌目等潜在致病菌。高粱淀粉不易提取得到纯品,常会包含一定量的醇溶蛋白(含丰富的脯氨酸和谷氨酰胺)、单宁和植酸等抗营养因子。本试验所用高粱淀粉为食品级褐高粱淀粉,其蛋白质含量为19.88%,这会造成更多的蛋白质到达后肠,增加后肠挥发性盐基氮的含量,为大肠杆菌等其他潜在致病菌提供发酵底物[27]。也有可能是高粱淀粉中含有1%~2%的单宁造成了潜在致病菌的升高,具体原因有待进一步研究。饲粮中适宜剂量的单宁可促进肉仔鸡的生长,但高剂量的单宁对肉仔鸡具有毒害作用,目前对单宁在肉仔鸡上的安全应用剂量还没有统一标准[28-29]。豌豆淀粉组具有生物标记物的菌群是脆弱拟杆菌和柔膜菌门,脆弱拟杆菌可以产生两性离子多糖A(PSA),促进免疫细胞的发育和成熟。正常情况下,肠道内的有益菌会抑制部分潜在致病菌,使肠道中的微生物达到动态平衡,共同维持机体的健康。
4 结论① 不同来源淀粉饲粮影响肉仔鸡小肠消化酶活性,高粱淀粉饲粮可以提高肉仔鸡空肠食糜的淀粉酶活性,木薯淀粉组可提高肉仔鸡空肠、回肠食糜脂肪酶活性以及空肠黏膜脂肪酶和淀粉酶活性。
② 豌豆淀粉饲粮可以提高肉仔鸡盲肠食糜中乙酸、丙酸及TVFA含量,同时高粱淀粉饲粮可以提高肉仔鸡盲肠食糜中TVFA含量。
③ 豌豆淀粉、木薯淀粉和玉米淀粉饲粮通过增加肉仔鸡盲肠中的产酸菌群促进微生物发酵,改善肠道菌群结构,促进有益菌生长。
| [1] |
YIN D F, SELLE P H, MOSS A F, et al. Influence of starch sources and dietary protein levels on intestinal functionality and intestinal mucosal amino acids catabolism in broiler chickens[J]. Journal of Animal Science and Biotechnology, 2019, 10(3): 658-672. |
| [2] |
李岫怡, 杨桂芹, 郭东新. 不同来源淀粉的组成、结构及其在动物生产上的应用研究进展[J]. 动物营养学报, 2019, 31(3): 1053-1060. LI Y Y, YANG G Q, GUO D X. Research progress on composition, structure and application of different starch sources in animal production[J]. Chinese Journal of Animal Nutrition, 2019, 31(3): 1053-1060 (in Chinese). |
| [3] |
余苗, 李贞明, 陈卫东, 等. 不同淀粉类型饲粮对育肥猪盲肠食糜主要微生物及其代谢产物的影响[J]. 动物营养学报, 2020, 32(2): 613-625. YU M, LI Z M, CHEN W D, et al. Effects of different starch type diets on main microbes and their metabolites in cecal digesta of finishing pigs[J]. Chinese Journal of Animal Nutrition, 2020, 32(2): 613-625 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.02.017 |
| [4] |
SUN Y, SU Y, ZHU W Y. Microbiome-metabolome responses in the cecum and colon of pig to a high resistant starch diet[J]. Frontiers in Microbiology, 2016, 7: 779. |
| [5] |
LI Z, LI J, LIU X L, et al. Effects of different starch sources on glucose and fat metabolism in broiler chickens[J]. British Poultry Science, 2019, 60(4): 449-456. DOI:10.1080/00071668.2019.1605150 |
| [6] |
王伟兰.不同日粮纤维对猪肠道微生物多样性及挥发性脂肪酸的影响[D].硕士学位论文.南京: 南京农业大学, 2014. WANG W L.Influence of different diet fiber on swine gastrointestinal tract microbial diversity and metabolites[D].Master's Thesis.Nanjing: Nanjing Agricultural University, 2014.(in Chinese) |
| [7] |
赵怀宝, 任玉龙. 短链脂肪酸在动物体内的生理特点和功能[J]. 饲料研究, 2016(3): 29-32. ZHAO H B, REN Y L. Physiological characteristics and functions of short-chain fattyacids in animals[J]. Feed Research, 2016(3): 29-32 (in Chinese). |
| [8] |
MCCAFFERTY K W, BEDFORD M R, KERR B J, et al. Effects of age and supplemental xylanase in corn- and wheat-based diets on cecal volatile fatty acid concentrations of broilers[J]. Poultry Science, 2019, 98(10): 4787-4800. DOI:10.3382/ps/pez194 |
| [9] |
余苗, 陈卫东, 邓盾, 等. 日粮淀粉对猪肠道微生物和臭气排放调控的研究进展[J]. 家畜生态学报, 2018, 39(9): 1-6. YU M, CHEN W D, DENG D, et al. Advance in dietary starch regulating intestinal microbiota and odor emission reduction of swine[J]. Acta Ecologae Animalis Domastici, 2018, 39(9): 1-6 (in Chinese). DOI:10.3969/j.issn.1673-1182.2018.09.001 |
| [10] |
HAENEN D, ZHANG J, DA SILVA C S, et al. A diet high in resistant starch modulates microbiota composition, SCFA concentrations, and gene expression in pig intestine[J]. The Journal of Nutrition, 2013, 143(3): 274-283. DOI:10.3945/jn.112.169672 |
| [11] |
YU M, LI Z M, CHEN W D, et al. Microbiome-metabolomics analysis investigating the impacts of dietary starch types on the composition and metabolism of colonic microbiota in finishing pigs[J]. Frontiers in Microbiology, 2019(10): 1143. |
| [12] |
袁丹丹, 程晓芳, 张余慧, 等. 脂肪酶在禽类养殖中的研究进展[J]. 广东饲料, 2017, 26(9): 33-34. YUAN D D, CHEN X F, ZHANG Y H, et al. Advances in the study of lipase in poultry breeding[J]. Guangdong Feed, 2017, 26(9): 33-34 (in Chinese). DOI:10.3969/j.issn.1005-8613.2017.09.009 |
| [13] |
于洋洋.不同淀粉源对羔羊小肠发育、消化酶活性及相关基因表达量的影响[D].硕士学位论文.大庆: 黑龙江八一农垦大学, 2018. YU Y Y.Effects of different starch sources on intestinal development, digestive enzyme activities and related gene expression in lambs[D]. Master's Thesis.Da qing: Heilongjiang Bayi Agricultural University, 2018.(in Chinese) |
| [14] |
林厦菁, 蒋守群, 洪平, 等. 黄羽肉鸡与白羽肉鸡胃肠道消化酶活性比较研究[J]. 中国家禽, 2017, 39(13): 26-30. LIN X J, JIANG S Q, HONG P, et al. Comparison on gastrointestinal digestive enzymes between Ross white chicken and yellow-feather chicken[J]. Chinese National Poultry, 2017, 39(13): 26-30 (in Chinese). |
| [15] |
张余慧, 袁丹丹, 程晓芳, 等. 泰和乌骨鸡消化道中淀粉酶、脂肪酶、胰蛋白酶活性的研究[J]. 黑龙江畜牧兽医, 2018(10): 208-211. ZHANG Y H, YUAN D D, CHENG X F, et al. Study on amylase, lipase and trypsin activities in the digestive tract of Taihe silky fowl[J]. Heilongjiang Animal Husbandry and Veterinary Medicine, 2018(10): 208-211 (in Chinese). |
| [16] |
相振田.饲粮不同来源淀粉对断奶仔猪肠道功能和健康的影响及机理研究[D].博士学位论文.雅安: 四川农业大学, 2011. XIANG Z T.Effects of different dietary starches on intestinal function and health andthe underlying mechanism in weaned piglets[D].Ph.D.Thesis.Ya'an: Sichuan Agricultural University, 2011.(in Chinese) |
| [17] |
BIAN G R, MA S Q, ZHU Z G, et al. Age, introduction of solid feed and weaning are more important determinants of gut bacterial succession in piglets than breed and nursing mother as revealed by a reciprocal cross-fostering model[J]. Environmental Microbiology, 2016, 18(5): 1566-1577. DOI:10.1111/1462-2920.13272 |
| [18] |
GRIER A, MCDAVID A, WANG B K, et al. Neonatal gut and respiratory microbiota:coordinated development through time and space[J]. Microbiome, 2018, 6(1): 193. DOI:10.1186/s40168-018-0566-5 |
| [19] |
LI T, TENG H, AN F P, et al. The beneficial effects of purple yam (Dioscorea alata L.) resistant starch on hyperlipidemia in high-fat-fed hamsters[J]. Food & Function, 2019, 10(5): 2642-2650. |
| [20] |
OAKLEY B B, LILLEHOJ H S, KOGUT M H, et al. The chicken gastrointestinal microbiome[J]. FEMS Microbiology Letters, 2014, 360(2): 100-112. DOI:10.1111/1574-6968.12608 |
| [21] |
MORRISON D J, PRESTON T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism[J]. Gut Microbes, 2016, 7(3): 189-200. DOI:10.1080/19490976.2015.1134082 |
| [22] |
LITVAK Y, BYNDLOSS M X, TSOLIS R M, et al. Dysbiotic proteobacteria expansion:a microbial signature of epithelial dysfunction[J]. Current Opinion in Microbiology, 2017, 39: 1-6. DOI:10.1016/j.mib.2017.07.003 |
| [23] |
FOUHSE J M, GÄNZLE M G, REGMI P R, et al. High amylose starch with low in vitro digestibility stimulates hindgut fermentation and has a bifidogenic effect in weaned pigs[J]. The Journal of Nutrition, 2015, 145(11): 2464-2470. DOI:10.3945/jn.115.214353 |
| [24] |
YANG X, DARKO K O, HUANG Y, et al. Resistant starch regulates gut microbiota:structure, biochemistry and cell signalling[J]. Cellular Physiology and Biochemistry, 2017, 42(1): 306-318. DOI:10.1159/000477386 |
| [25] |
YIN J, LI Y Y, HAN H, et al. Melatonin reprogramming of gut microbiota improves lipid dysmetabolism in high-fat diet-fed mice[J]. Journal of Pineal Research, 2018, 65(4): e12524. DOI:10.1111/jpi.12524 |
| [26] |
ZHANG J C, GUO Z, XUE Z S, et al. A phylo-functional core of gut microbiota in healthy young Chinese cohorts across lifestyles, geography and ethnicities[J]. The ISME Journal, 2015, 9(9): 1979-1990. DOI:10.1038/ismej.2015.11 |
| [27] |
亓宏伟.不同来源蛋白对断奶仔猪肠道微生态环境及肠道健康的影响[D].博士学位论文.雅安: 四川农业大学, 2011. QI H W.Effects of dietary protein sources on intestinal micro-ecological environment and health in weaned piglets[D].Ph.D.Thesis.Ya'an: Sichuan Agricultural University, 2011.(in Chinese) |
| [28] |
CENGIZ Ö, KÖKSAL B H, TATLI O, et al. Effect of dietary tannic acid supplementation in corn- or barley-based diets on growth performance, intestinal viscosity, litter quality, and incidence and severity of footpad dermatitis in broiler chickens[J]. Livestock Science, 2017, 202: 52-57. DOI:10.1016/j.livsci.2017.05.016 |
| [29] |
HUANG Q Q, LIU X L, ZHAO G Q, et al. Potential and challenges of tannins as an alternative to in-feed antibiotics for farm animal production[J]. Animal Nutrition, 2018, 4(2): 137-150. DOI:10.1016/j.aninu.2017.09.004 |




