2. 保定市顺平县农业农村局, 保定 071001;
3. 河北大学基础医学院, 保定 071001
2. Agricultural and Rural Bureau of Shunping County in Baoding City, Baoding 071001, China;
3. School of Basic Medicine, Hebei University, Baoding 071001, China
我国是鸡蛋消费大国,蛋类的需求使得家禽的集约化生产成为必然。为了提高蛋鸡的生产性能及抗病力,过去的几十年中,抗生素常被当作饲料添加剂使用[1],由于人类对抗生素会产生耐药性,禁抗成为了新的发展趋势[2]。鉴于此,研究人员致力于开发抗生素替代品,其中天然植物精油是当今的研究热点之一。大蒜精油是取自鲜大蒜的一种天然植物精油,主要成分为大蒜素,大蒜素具有良好的诱食、促生长、抗菌和消炎等作用[3],且在动物体内无残留、无副作用。已有研究表明,饲粮中添加大蒜素可以提高产蛋鸡的生产性能[4-5],还可通过提高体液免疫和细胞免疫来提高机体的免疫力[6]。目前有关大蒜素或大蒜精油的研究多以肉鸡为试验对象,且大多探究其对肉鸡生长、免疫及抗氧化等性能的影响,关于大蒜精油在蛋鸡方面的应用研究较少,且极少有试验探究大蒜精油对鸡肠道形态及盲肠微生物区系的影响,而动物机体的肠道形态、饲粮营养物质消化和吸收、免疫系统发育、致病性肠道细菌的增殖等都与肠道菌群有关[7-9]。因此,本试验在5~9周龄蛋鸡的饮水中添加不同浓度的大蒜精油,通过测定生长性能、肠道组织形态及盲肠菌群等指标,探究大蒜精油对蛋鸡的影响,为实际生产中合理使用大蒜精油提供理论依据。
1 材料与方法 1.1 试验设计试验选用200只1日龄健康状况良好且体重相近的农大三号节粮蛋鸡,随机分为4组,每组5个重复,每个重复10只鸡。各组试验鸡饲喂相同的基础饲粮,对照组正常饮水,试验Ⅰ、Ⅱ、Ⅲ组在饮水中添加大蒜精油(大蒜精油中大蒜素含量为7.5%),使其浓度分别为0.04、0.06和0.08 mL/L,试验期为56 d。基础饲粮参照我国《鸡饲养标准》(NY/T 33—2004)配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验鸡只采用双层笼养的方式于河北农业大学试验基地进行饲养,自由采食和饮水,试验期间严格按照农大三号蛋鸡饲养标准控制光照。
1.3 指标测定 1.3.1 生长性能测定以重复为单位,每周末测定采食量。试验第1天和第56天08:00分别测定试验鸡体重,作为初始体重和终末体重,并计算平均日采食量、平均日增重和料重比。
1.3.2 肠道组织形态测定试验第56天,于每个重复随机取5只试验鸡进行屠宰,打开腹腔,分离出十二指肠、空肠和回肠,在每段肠道中段取3 cm左右肠道样品,用生理盐水把肠道内容物冲洗干净,放到4%甲醛溶液中常温保存,以备制作石蜡切片。制作切片的具体操作为固定、石蜡包埋、切片、苏木精-伊红(HE)染色和封固,采用正置光学显微镜测定绒毛高度和隐窝深度,并计算绒隐比(绒毛高度/隐窝深度)。
1.3.3 盲肠菌群测定试验第56天,于每个重复随机取2只试验鸡进行屠宰,无菌采集盲肠内容物放入冻存管,-80 ℃保存。采用Hiseq 2500高通量测序技术对盲肠微生物16S rDNA基因全长进行测序,由北京百迈克生物科技有限公司完成。测序流程为:使用德国MN公司的NucleoSpin 96 Soil(4×96)试剂盒提取样品总细菌DNA后,根据16S rDNA全长引物27F和1492R,合成带有Barcode的特异引物,进行PCR扩增并对其产物进行纯化、定量和均一化形成测序文库(SMRT Bell),建好的文库先进行文库质检,质检合格的文库用PacBio Sequel进行测序。
将PacBio下机数据导出为CCS文件(CCS序列使用Pacbio提供的smrtlink工具获取)后,进行如下3个步骤的操作。
1) CCS识别:使用lima v1.7.0软件,通过Barcode对CCS进行识别,得到的Barcode-CCS序列数据;
2) CCS长度过滤:使用北京百迈克生物科技有限公司自主研发的软件,对Barcode-CCS序列进行过滤,得到有效序列;
3) 去除嵌合体:使用UCHIME v4.2软件,鉴定并去除嵌合体序列,得到Optimization-CCS序列。
对序列信息进行操作分类单元(OTU)、多样性及差异性分析。
1.4 数据整理与分析应用SPSS 21.0统计软件的单因素方差分析(one-way ANOVA)程序对试验数据进行分析,并采用Duncan氏法进行组间的多重比较。试验数据以“平均值±标准差”表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果 2.1 饮水中添加大蒜精油对蛋鸡生长性能的影响由表 2可知,与对照组相比,饮水中添加0.04、0.06和0.08 mL/L大蒜精油对蛋鸡的平均日采食量无显著影响(P>0.05);饮水中添加0.04、0.06和0.08 mL/L大蒜精油均使蛋鸡的料重比极显著降低(P < 0.01),其中以大蒜精油浓度为0.06 mL/L时效果最好;饮水中添加0.04和0.06 mL/L大蒜精油均使蛋鸡的平均日增重极显著升高(P < 0.01),同样是以大蒜精油浓度为0.06 mL/L时效果最好。
|
|
表 2 饮水中添加大蒜精油对蛋鸡生长性能的影响 Table 2 Effects of adding garlic essential oil into drinking water on growth performance of laying hens |
由表 3可知,与对照组相比,饮水中添加0.04 mL/L大蒜精油使蛋鸡回肠绒毛高度极显著降低(P < 0.01),蛋鸡回肠隐窝深度及绒隐比无显著变化(P>0.05);饮水中添加0.06 mL/L大蒜精油使蛋鸡回肠隐窝深度显著降低(P < 0.05),回肠绒隐比极显著升高(P < 0.01);饮水中添加0.04 mL/L大蒜精油使蛋鸡空肠绒毛高度与绒隐比均极显著升高(P < 0.01),回肠隐窝深度显著下降(P < 0.05);饮水中添加0.06 mL/L大蒜精油使蛋鸡空肠隐窝深度显著下降(P < 0.05),十二指肠绒隐比显著升高(P < 0.05);饮水中添加0.04、0.06和0.08 mL/L大蒜精油使蛋鸡十二指肠隐窝深度极显著下降(P < 0.01),其中以大蒜精油浓度为0.06 mL/L时效果最显著。
|
|
表 3 饮水中添加大蒜精油对蛋鸡肠道组织形态的影响 Table 3 Effects of adding garlic essential oil into drinking water on intestinal tissue morphology of laying hens |
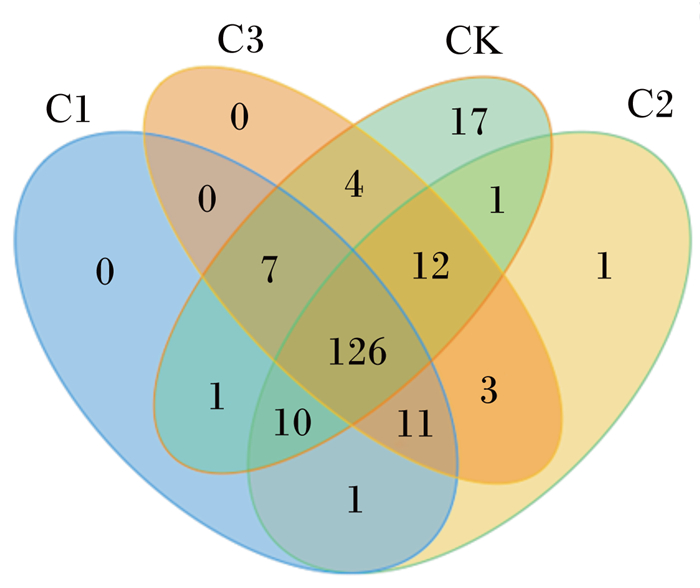
图 2为根据不同分组绘制的OTU Venn图,不同组用不同颜色表示,不同颜色图形之间交叠部分数字为2个组之间共有的OTU个数。由图 2可知,各组共有126个OTU;对照组特有17个OTU;与对照组相比,大蒜精油组特有11个OTU。其中,对照组特有OTU含拟杆菌门的为14个,大蒜精油组特有OTU含厚壁菌门的为7个。

|
A、B、C、D分别为对照组以及0.04、0.06和0.08 mL/L大蒜精油组十二指肠组织切片(40×);E、F、G、H分别为对照组以及0.04、0.06和0.08 mL/L大蒜精油组空肠组织切片(40×);I、J、K、L分别为对照组以及0.04、0.06和0.08 mL/L大蒜精油组回肠组织切片(100×)。 A, B, C and D were the tissue sections of duodenum in control group and 0.04, 0.06, 0.08 mL/L garlic essential oil groups (40×), respectively; E, F, G and H were the tissue sections of jejunum in control group and 0.04, 0.06, 0.08 mL/L garlic essential oil groups (40×), respectively; I, J, K and L were the tissue sections of ileum in control group and 0.04, 0.06, 0.08 mL/L garlic essential oil groups (100×), respectively. 图 1 肠道组织切片 Fig. 1 Intestinal tissue sections |
|
CK:对照组control group;C1:0.04 mL/L大蒜精油组0.04 mL/L garlic essential oil group;C2:0.06 mL/L大蒜精油组0.06 mL/L garlic essential oil group;C3:0.08 mL/L大蒜精油组0.08 mL/L garlic essential oil group。下图同the same as below。 图 2 OTU Venn图 Fig. 2 OTU Venn diagram |
由表 4可知,饮水中添加大蒜精油对蛋鸡盲肠微生物α多样性指数无显著影响(P>0.05)。
|
|
表 4 α多样性分析结果 Table 4 α diversity analysis results |
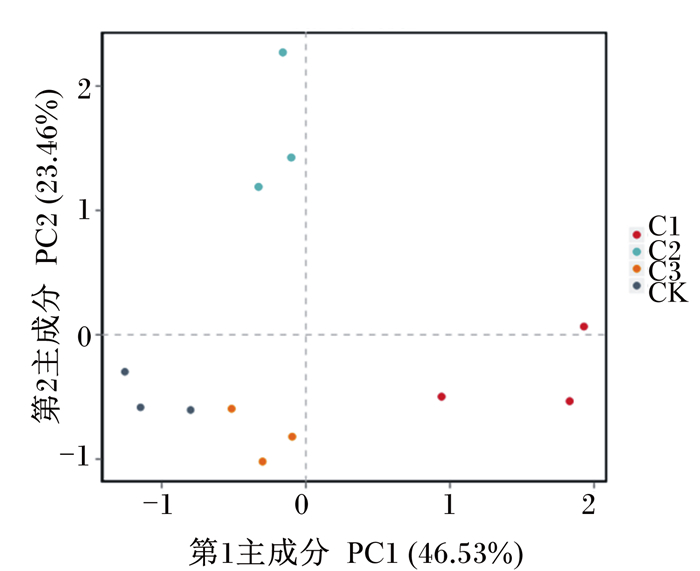
将构建的OTU进行主成分分析,由图 3可知,第1主成分和第2主成分的贡献率分别为46.53%和23.46%,4组间样品无交叠情况,各组盲肠在菌群构成上无相似性。
|
图 3 主成分分析散点图 Fig. 3 PCA scatter plot |
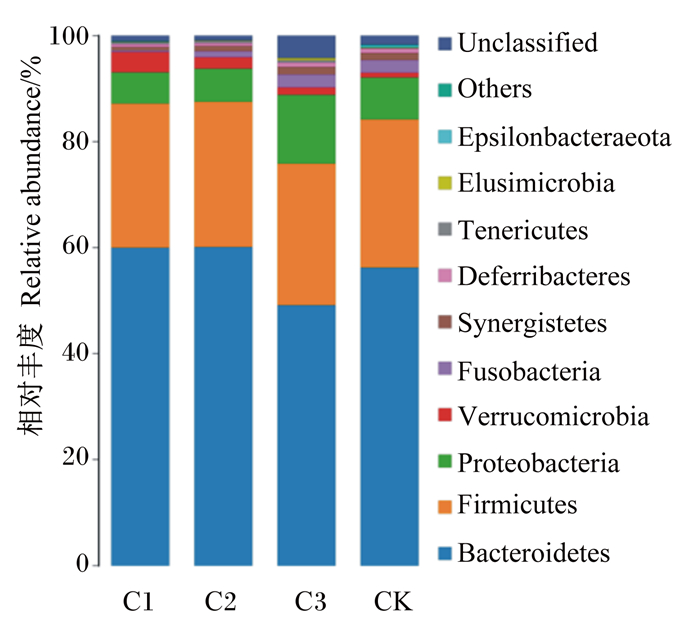
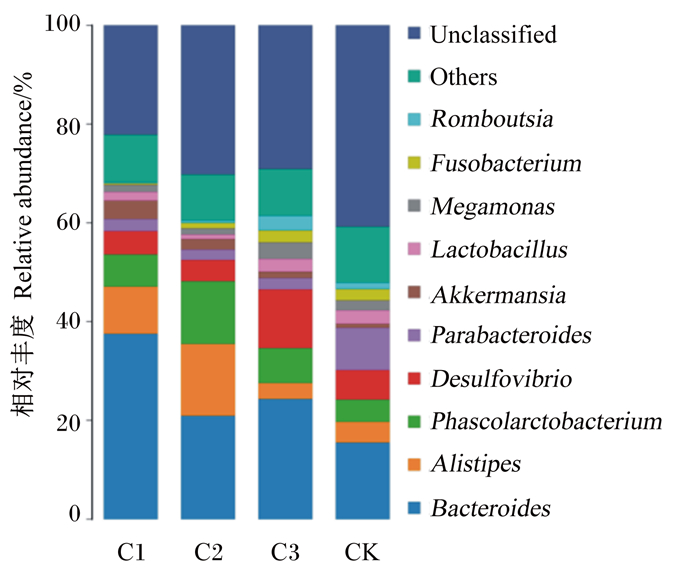
由图 4可知,在门水平上,试验鸡盲肠中主要检出拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、梭杆菌门(Fusobacteria)以及互养菌门(Synergistetes)等菌群,其中拟杆菌门、厚壁菌门与变形菌门为优势菌门。由图 5可知,在属水平上,试验鸡盲肠中主要检出拟杆菌属(Bacteroides)、别样杆菌属(Alistipes)、考拉杆菌属(Phascolarctobacterium)、脱硫弧菌属(Desulfovibrio)、副拟杆菌属(Parabacteroides)等菌群,其中拟杆菌属为核心优势菌属。由表 5可知,与对照组相比,各大蒜精油添加组拟杆菌门与厚壁菌门的相对丰度均无显著变化(P>0.05);饮水中添加0.08 mL/L大蒜精油使蛋鸡盲肠中变形菌门的相对丰度极显著升高(P < 0.01)。与对照组相比,饮水中添加0.04 mL/L大蒜精油使蛋鸡盲肠中拟杆菌属的相对丰度极显著升高(P < 0.01);饮水中添加0.06 mL/L大蒜精油使蛋鸡盲肠中别样杆菌属和考拉杆菌属的相对丰度均显著升高(P < 0.05);饮水中添加0.08 mL/L大蒜精油使蛋鸡盲肠中脱硫弧菌属的相对丰度极显著升高(P < 0.01)。
|
Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Proteobacteria:变形菌门;Verrucomicrobia:疣微菌门;Fusobacteria:梭杆菌门;Synergistetes:互养菌门;Deferribacteres:脱铁杆菌门;Tenericutes:软壁菌门;Elusimicrobia:迷踪菌门;Others:其他;Unclassified:未分类。 图 4 蛋鸡盲肠菌群在门水平上的组成 Fig. 4 Composition of cecum microbial flora of laying hens at phylum level |
|
Bacteroides:拟杆菌属;Alistipes:别样杆菌属;Phascolarctobacterium:考拉杆菌属;Desulfovibrio:脱硫弧菌属;Parabacteroides:副拟杆菌属;Akkermansia:艾克曼菌属;Lactobacillus:乳杆菌属;Megamonas:巨单胞菌属;Fusobacterium:梭杆菌属;Others:其他;Unclassified:未分类。 图 5 蛋鸡盲肠菌群在属水平上的组成 Fig. 5 Composition of cecum microbial flora of laying hens at genus level |
|
|
表 5 蛋鸡盲肠菌群在门、属水平上的相对丰度 Table 5 Relative abundance of cecum microbial flora of laying hens at phylum and genus levels |
本试验结果显示,饮水中添加大蒜精油对蛋鸡的平均日采食量无显著影响,0.06 mL/L大蒜精油组与对照组相比料重比极显著降低,平均日增重极显著升高。Lim等[10]研究报道在蛋鸡饲粮中添加大蒜素后蛋鸡的采食量无显著变化,王凡等[11]的试验结果表明大蒜素可增加蛋雏鸡的平均日增重和降低料重比,与本试验研究结果基本一致。大蒜精油能够促进禽类生长,可能是因为大蒜精油中的主要成分大蒜素具有刺激性,能够加快肠道蠕动、促进营养物质吸收,进而提高饲料的利用率,降低成本[12]。
3.2 饮水中添加大蒜精油对蛋鸡肠道组织形态的影响本试验结果显示,饮水中添加0.06 mL/L大蒜精油能够明显改善蛋鸡回肠、空肠和十二指肠的组织形态。小肠结构与功能的完整性影响着营养物质的消化、吸收与转运,其中小肠绒毛高度和隐窝深度与肠道生理相关,并且也是衡量肠道功能的重要指标[13]。小肠绒毛的高度、粗细以及排列密度代表着该段肠道接触食糜的多少,与食糜接触越多,对营养物质的摄入就越充分[14-15]。隐窝深度与肠上皮细胞的增殖率成反比,细胞成熟率上升的表观即为隐窝深度下降,营养物质利用率升高。绒隐比则是小肠功能的综合体现,绒隐比增加说明小肠的消化吸收能力增强[16]。因此,本试验结果说明在蛋鸡饮水中添加大蒜精油能够提高饲粮中营养物质的吸收利用效率。
3.3 饮水中添加大蒜精油对蛋鸡盲肠菌群的影响动物的生长发育与肠道微生物区系的平衡有着直接关系,当动物肠道受有害菌入侵时,会减少肠道菌群的多样性,使得肠道微生态失衡,从而降低机体抵抗力,影响动物的生长性能[17]。本试验使用Usearch软件[18]对Tags在97%的相似度下进行聚类获得OTU,OTU反映肠道菌群的物种数目信息。α多样性反映了单个样品物种丰度及物种多样性,可通过Chao1、Ace、Shannon和Simpson指数等指标进行衡量。Chao1和Ace指数表示了物种数量,Shannon和Simpson指数表示物种多样性,当物种丰度相同时,Shannon指数越大、Simpson指数越小的样品物种多样性越高[19]。OTU的覆盖率(coverage)反映了测序结果是否具有代表性,其值越高,样本中物种被测出的概率越高。
本试验结果显示,蛋鸡盲肠菌群在门水平上的优势菌群为拟杆菌门、厚壁菌门和变形菌门,与前人研究结果[20]一致。厚壁菌门的纤维分解菌较丰富[21],盲肠拟杆菌门丰度较高时,纤维分解菌的数量也有所增加,因此当拟杆菌门与厚壁菌门的丰度升高时,盲肠的发酵作用也随之增强[22]。拟杆菌门在维持肠道微生态平衡中起着重要的作用,能够改善宿主健康状况[23]。而变形菌门则包括很多病原菌,如沙门氏菌和幽门螺杆菌等。洪伟[24]在蛋鸡饲粮中添加150 mg/kg大蒜素,结果显示大蒜素对变形菌门中大肠杆菌有显著的抑制作用,Sarica等[25]、何云等[6]在肉鸡上也得到相似的试验结果。本试验中,在蛋鸡饮水中添加大蒜精油,结果发现厚壁菌门相对丰度增加,但拟杆菌门与厚壁菌门的相对丰度均无显著变化,0.04、0.06 mL/L大蒜精油对蛋鸡盲肠中变形菌门的相对丰度无显著影响,0.08 mL/L大蒜精油使变形菌门的相对丰度极显著升高,与上述前人研究结果不同。本试验结果说明过高浓度的大蒜精油可能增加了有害微生物对蛋鸡肠道健康的危害。
本试验结果显示,蛋鸡盲肠菌群在属水平上的优势菌群主要为拟杆菌属,随后别样杆菌属、考拉杆菌属和脱硫弧菌属的相对丰度依次递减。拟杆菌属不仅能够维持肠道微生态平衡,还能够加速多糖的分解和利用[26],促进机体免疫系统的发育。考拉菌属属于厚壁菌门,能够在肠道内发酵产生短链脂肪酸,而短链脂肪酸能够通过保护肠道黏膜屏障为肠道上皮细胞供能,具有降低动物机体的炎症水平以及增强胃肠道功能的作用[27]。肠道脱硫弧菌属的丰度是溃疡性结肠炎疾病的重要特征。本试验中,在蛋鸡饮水中添加0.04 mL/L大蒜精油使盲肠中拟杆菌属的相对丰度极显著升高;添加0.06 mL/L大蒜精油使蛋鸡盲肠中别样杆菌属和考拉杆菌属的相对丰度均极显著升高;添加0.08 mL/L大蒜精油使蛋鸡盲肠中脱硫弧菌属的相对丰度极显著升高。大蒜精油有较好的抗菌能力,其通过抑制细菌代谢达到抑菌和杀菌的效果[28],高浓度的大蒜精油会损伤肠道,益于有害菌增长;而低浓度的大蒜精油则能够增加拟杆菌门和厚壁菌门中有益菌的数量,改善蛋鸡的肠道形态和肠道健康,提营养物质利用率,最终提高生长性能。
4 结论饮水中添加0.04和0.06 mL/L大蒜精油能够增加蛋鸡盲肠中有益菌的种类和数量,有助于盲肠微生态平衡的建立,提高盲肠消化能力和免疫机能,且添加0.06 mL/L大蒜精油能够有效改善蛋鸡十二指肠、空肠和回肠肠道组织形态,有助于蛋鸡对营养物质的吸收和利用,提高蛋鸡的平均日增重,降低料重比,从而提高蛋鸡的生长性能。
| [1] |
STEINER T. Managing gut health:natural growth promoters as a key to animal performance[M]. Notingham, UK: Nottingham University Press, 2006.
|
| [2] |
BRADEN C R. Salmonella enterica serotype enteritidis and eggs:a national epidemic in the United States[J]. Clinical Infectious Diseases, 2006, 43(4): 512-517. DOI:10.1086/505973 |
| [3] |
YANG L J, YANG M, LI S Y, et al. S-allylmercaptocysteine attenuates posaconazole-induced adverse effects in mice through antioxidation and anti-inflammation[J]. International Immunopharmacology, 2018, 58: 9-14. DOI:10.1016/j.intimp.2018.03.006 |
| [4] |
YALÇIN S, ONBAŞILAR E E, REISLI Z, et al. Effect of garlic powder on the performance, egg traits and blood parameters of laying hens[J]. Journal of the Science of Food and Agriculture, 2006, 86(9): 1336-1339. DOI:10.1002/jsfa.2515 |
| [5] |
KHAN S H, SARDAR R, ASHRAF M A. Effects of dietary garlic on performance and serum and egg yolk cholesterol concentration in laying hens[J]. Asian Journal of Poultry Science, 2007, 1(1): 22-27. |
| [6] |
何云, 王浓章, 周培军, 等. 大蒜、杜仲添加剂对雏鸡生产性能和肠道微生物的影响[J]. 兽药与饲料添加剂, 2004, 9(4): 6-9. HE Y, WANG N Z, ZHOU P J, et al. Effects of garlic and Eucommia ulmoides additives on production performance and intestinal microorganisms of chicks[J]. Veterinary Pharmaceuticals & Feed Additives, 2004, 9(4): 6-9 (in Chinese). |
| [7] |
OAKLEY B B, LILLEHOJ H S, KOGUT M H, et al. The chicken gastrointestinal microbiome[J]. FEMS Microbiology Letters, 2014, 360(2): 100-112. DOI:10.1111/1574-6968.12608 |
| [8] |
WAITE D W, TAYLOR M W. Characterizing the avian gut microbiota:membership, driving influences, and potential function[J]. Frontiers in Microbiology, 2014, 5: 223. |
| [9] |
SHAUFI M A M, SIEO C C, CHONG C W, et al. Deciphering chicken gut microbial dynamics based on high-throughput 16S rRNA metagenomics analyses[J]. Gut Pathogens, 2015, 7: 4. DOI:10.1186/s13099-015-0051-7 |
| [10] |
LIM K S, YOU S J, AN B K, et al. Effects of dietary garlic powder and copper on cholesterol content and quality characteristics of chicken eggs[J]. Asian-Australasian Journal of Animal Sciences, 2006, 19(4): 582-586. DOI:10.5713/ajas.2006.582 |
| [11] |
王凡, 张学科, 张学艳, 等. 大蒜素对蛋雏鸡免疫器官抗氧化能力及生产性能的影响[J]. 饲料博览, 2019(10): 19-23. WANG F, ZHANG X K, ZHANG X Y, et al. Effects of allicin on immune organs antioxidant function and growth performance of laying hens[J]. Feed Review, 2019(10): 19-23 (in Chinese). |
| [12] |
DIKEL S. The use of garlic (Allium sativum) as a growth promoter in aquaculture[J]. Turkish Journal of Agriculture:Food Science And Technology, 2015, 3(7): 529-536. DOI:10.24925/turjaf.v3i7.529-536.356 |
| [13] |
于会民, 王瑞生, 陈宝江, 等. 葡萄糖氧化酶及粪肠球菌对肉仔鸡生长性能、血液抗氧化指标及养分表观消化率的影响[J]. 中国畜牧杂志, 2016, 52(23): 60-64. YU H M, WANG R S, CHEN B J, et al. Effects of glucose oxidase and enterococcus faecalis on growth performance, serum antioxidant parameters and apparent digestibility of nutrients in broilers[J]. Chinese Journal of Animal Science, 2016, 52(23): 60-64 (in Chinese). |
| [14] |
PLAZA-DÍAZ J, RUIZ-OJEDA F J, GIL-CAMPOS M, et al. Immune-mediated mechanisms of action of probiotics and synbiotics in treating pediatric intestinal diseases[J]. Nutrients, 2018, 10(1): 42. DOI:10.3390/nu10010042 |
| [15] |
JIN L Z, BAIDOO S K, MARQUARDT R R, et al. In vitro inhibition of adhesion of enterotoxigenic Escherichia coli K88 to piglet intestinal mucus by egg-yolk antibodies[J]. FEMS Immunology and Medical Microbiology, 2013, 21(4): 313-321. |
| [16] |
CHEN Z, XIE J, HU M Y, et al. Protective effects of γ-aminobutyric acid (GABA) on the small intestinal mucosa in heat-stressed Wenchang chicken[J]. The Journal of Animal & Plant Sciences, 2015, 25(1): 78-87. |
| [17] |
MOUNTZOURIS K C, DALAKA E, PALAMIDI I, et al. Evaluation of yeast dietary supplementation in broilers challenged or not with Salmonella on growth performance, cecal microbiota composition and Salmonella in ceca, cloacae and carcass skin[J]. Poultry Science, 2015, 94(10): 2445-2455. DOI:10.3382/ps/pev243 |
| [18] |
EDGAR R C. UPARSE:highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998. DOI:10.1038/nmeth.2604 |
| [19] |
GRICE E A, KONG H H, CONLAN S, et al. Topographical and temporal diversity of the human skin microbiome[J]. Science, 2009, 324(5931): 1190-1192. DOI:10.1126/science.1171700 |
| [20] |
WEI S, MORRISON M, YU Z. Bacterial census of poultry intestinal microbiome[J]. Poultry Science, 2013, 92(3): 671-683. DOI:10.3382/ps.2012-02822 |
| [21] |
DALY K, STEWART C S, FLINT H J, et al. Bacterial diversity within the equine large intestine as revealed by molecular analysis of cloned 16S rRNA genes[J]. FEMS Microbiology Ecology, 2001, 38(2/3): 141-151. |
| [22] |
MATSUI H, KATO Y, CHIKARAISHI T, et al. Microbial diversity in ostrich ceca as revealed by 16S ribosomal RNA gene clone library and detection of novel Fibrobacter species[J]. Anaerobe, 2010, 16(2): 83-93. DOI:10.1016/j.anaerobe.2009.07.005 |
| [23] |
MANAF M, HEDAYATI M, YARI M. Aflatoxicosis and herbal detoxification:the effectiveness of thyme essence on performance parameters and antibody titers of commercial broilers fed aflatoxin B1[J]. Research in Zoology, 2014, 4(2): 43-50. |
| [24] |
洪伟.大蒜素对产蛋鸡生产性能、盲肠微生物和血清生化指标的影响[D].硕士学位论文.杨凌: 西北农林科技大学, 2005. HONG W.Effects of allicin on performance, caecum microorganism and serum biochemical index in laying hens[D].Master's Thesis.Yangling: Northwest A&F University, 2005.(in Chinese) |
| [25] |
SARICA S, CIFTCI A, DEMIR E, et al. Use of an antibiotic growth promoter and two herbal natural feed additives with and without exogenous enzyme in wheat based broiler diets[J]. South African Journal of Animal Sciences, 2005, 35(1): 61-72. |
| [26] |
HOOPER L V. Bacterial contributions to mammalian gut development[J]. Trends in Microbiology, 2004, 12(3): 129-134. DOI:10.1016/j.tim.2004.01.001 |
| [27] |
VON ROSENVINGE E C, SONG Y, WHITE J R, et al. Immune status, antibiotic medication and pH are associated with changes in the stomach fluid microbiota[J]. The ISME Journal, 2013, 7(7): 1354-1366. DOI:10.1038/ismej.2013.33 |
| [28] |
YU J, LIU R X, WANG P, et al. Allicin attenuates global cerebral ischemia/reperfusion injury in gerbils via anti-oxidative and anti-apoptotic pathway[J]. International Journal of Clinical and Experimental Medicine, 2016, 9(2): 2375-2382. |




