2. 宁夏农林科学院动物科学研究所, 银川 750002
2. Animal Sciences Institute of Ningxia Academy of Agriculture and Forestry Sciences, Yinchuan 750002, China
长期以来,反刍动物营养学家一直致力于通过优化饲粮配方和利用饲料添加剂来改善、调节瘤胃中不同微生物菌群之间的竞争关系,以提高机体能量和蛋白质的利用效率。饲料添加剂不仅可以改善瘤胃内环境,而且能够增强或抑制特定微生物菌群的结构[1]。植物多糖是广泛存在于植物体组织中的酮糖或醛糖通过糖苷键连接在一起组成的天然高分子化合物,近年来因其具有增强免疫机能、改善幼畜肠道健康和瘤胃微生态环境等特点,被用作绿色、安全的饲料添加剂之一。沙蒿多糖是植物多糖的一种,具有植物多糖的全部特性,本实验室的前期研究结果表明,沙蒿多糖能够能抑制消化道中有害菌的生长与繁殖,同时也可调节反刍动物瘤胃微生物发酵,提高机体对营养物质的消化吸收,进而促进动物的生长发育[2-3]。此外,丁酸作为一种短链脂肪酸,能够快速、直接的为胃肠道上皮细胞生长发育提供能量,也被证实具有改善胃肠道健康的功能。丁酸甘油酯和包膜丁酸钠同为丁酸衍生物,在肠道内部可水解产生丁酸。丁酸甘油酯无毒性和刺激性,在动物体内发挥作用时间长,能够提供更加集中的能量形式[4]。包膜丁酸钠则无需主动转运直接进入血液,作用迅速[5]。据报道,三丁酸甘油酯和包膜丁酸钠均具有抗炎、保护肠黏膜的作用,能够为消化道提供营养需要,进而预防断奶应激对动物机体造成的压力,提高动物的生长性能[6]。但是,目前关于沙蒿多糖与丁酸类物质的研究主要集中在猪和家禽等单胃动物上,在反刍动物中的研究相对较少,且大多数试验都是集中在单一物质的效果研究上,有关沙蒿多糖与丁酸类物质复合使用对滩羊羔羊瘤胃的作用机理研究尚未见报道。因此,本试验利用16S rDNA高通量测定技术,分析饲粮中添加沙蒿多糖不同组合制剂对滩羊羔羊瘤胃菌群组成及多样性的影响,以期为沙蒿多糖不同组合制剂在舍饲滩羊生产实践中的合理应用提供理论依据。
1 材料与方法 1.1 试验材料沙蒿多糖(含量为95%以上)为实验室自制,丁酸甘油酯(含量为60%)购于四川某饲料有限公司,包被丁酸钠(含量为60%)购于杭州某饲料有限公司,莫能菌素(含量3.8%)购于北京某生物技术有限公司。
1.2 试验设计和基础饲粮采用完全随机试验设计,选择健康、体况良好、体重相近的断奶滩羊公羔60只,按体重随机分为4个组,每组15只羊。对照组饲喂基础饲粮,试验1组、试验2组和试验3组分别饲喂在基础饲粮中添加5.5 g/d沙蒿多糖+5.5 g/d包被丁酸钠、5.5 g/d沙蒿多糖+5.5 g/d丁酸甘油酯和5.5 g/d沙蒿多糖+1.1 g/d莫能菌素的试验饲粮。参照NRC(2007)[7]饲养标准配制基础饲粮,基础饲粮组成及营养水平见表 1。其中,沙蒿多糖、包被丁酸钠、丁酸甘油酯的添加水平在NRC(2007)[7]饲养标准的基础上,并结合课题组前期李胜利[2]和邴新帅[3]的研究结果设定;莫能菌素的添加水平按照产品说明的推荐剂量设定。整个试验期75 d,其中预试期为15 d,正试期为60 d。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验在宁夏灵诚农牧科技有限公司养殖场进行,试验期间所有羊只每日饲喂2次(08:00和17:00),自由采食及饮水。各组试验羊只单栏饲喂,环境条件及饲养管理均保持一致,由专人负责饲养,并每天记录羊只的个体采食量。
1.4 基础饲粮营养水平测定饲粮中干物质含量按照GB/T 6435—2014的方法进行检测[9];粗蛋白质含量使用凯式定氮法,按照GB/T 6432—1994的方法,通过凯氏定氮仪(KDY-9820,北京科拓有限公司)进行检测[10];钙含量使用乙二胺四乙酸二钠络合滴定法,按照GB/T 6436—2002的方法进行检测[11];磷含量定使用分光光度法,按照GB/T 6437—2002的方法,应用紫外可见分光光度计(UV-2600,日本岛津公司)进行检测[12]。
1.5 瘤胃液的采集与处理试验结束后,每个组选择3只试验羊进行屠宰,屠宰后立即无菌操作采集试验羊的瘤胃液,一部分分装于50 mL的离心管中,用于测定pH;一部分用4层纱布过滤收集上清液,分装于5 mL的离心管中,-20 ℃冰箱保存,用于测定氨态氮和挥发性脂肪酸(VFA)浓度;一部分置于5 mL的冻存管中,-80 ℃冰箱保存,用于瘤胃微生物区系测定。
1.6 瘤胃发酵参数测定瘤胃液pH使用酸度计(FE20,瑞士梅特勒-托利多公司)现场进行测定;瘤胃液氨态氮浓度的测定采用冯宗慈等[13]的方法;瘤胃液VFA浓度采用姜芳等[14]的方法,通过气相色谱仪(GC-2014,日本岛津公司)检测。
1.7 样本测序 1.7.1 DNA样品提取和PCR扩增按照粪便基因组提取试剂盒说明书的方法对试验样品进行DNA提取,之后用1.0%琼脂糖凝胶电泳和Nanodrop对提取的DNA样品进行质量检测。引物上添加测序接头和样本特异性Barcode序列,进而扩增16s rDNA序列的V3~V4区域,引物序列为:338F,5’-GTACTCCTACGGGAGGCAGCA-3’,806R,5’-GTGGACTACHVGGGTWTCTAAT-3’。PCR采用25 μL扩增体系:DNA模板5 ng,5 μmol/L的上、下游引物各1 μL,2 ng/μL的牛血清白蛋白(BSA) 3 μL,2xTaq Plus Master Mix 12.5 μL,双蒸水(ddH2O)补加至25 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸60 s,共30个循环;72 ℃延伸7 min。PCR产物用1.0%琼脂糖凝胶电泳鉴定,用PCR纯化试剂盒纯化回收,并按测序要求进行混合。
1.7.2 MiSeq测序将样品送至北京奥维森基因科技有限公司运用Mixed PE 300平台进行MiSeq测序。
1.8 数据统计分析试验数据处理采用Excel 2010进行计算,并采用SAS 9.0统计软件进行单因素方差分析(one-way ANOVA),Duncan氏法进行多重比较。P < 0.05为差异显著,P < 0.01为差异极显著,0.05≤P < 0.10为差异有显著趋势。
2 结果与分析 2.1 瘤胃发酵参数由表 2可知,与对照组相比,试验1组和试验2组滩羊瘤胃液乙酸、丁酸、总挥发性脂肪酸(TVFA)浓度和乙酸比例显著提高(P < 0.05)。各组之间滩羊瘤胃液pH,氨态氮、丙酸浓度,丙酸、丁酸比例以及乙酸/丙酸无显著差异(P>0.05)。
|
|
表 2 沙蒿多糖组合制剂对滩羊瘤胃发酵参数的影响 Table 2 Effects of Artemisia polysaccharide combination preparation on rumen fermentation parameters of Tan lambs |
Venn图用于统计多个样本中所共有和独有的OTU数目,可以比较直观地表现环境样本的OTU数目组成相似性及特异性。利用瘤胃内细菌群落共享和独特的OTU数目对饲粮内添加沙蒿多糖混合制剂效果进行分析,由图 1可知,4个组共产生1 530个OTU,其中对照组产生1 048个OTU,试验1组产生912个OTU,试验2组产生1 286个OTU,试验3组产生839个OTU,4个组共享了541个OTU,占总OTU数目的35.36%。对照组、试验1组、试验2组和试验3组独有的OTU数目分别为29、30、263和31个,分别占1.90%、1.96%、17.19%和2.03%,OTU数目顺序为试验2组>试验3组>试验1组>对照组,表明试验2组、试验3组和试验1组均提高了瘤胃内特有微生物的种类,增加了其微生物的多样性。
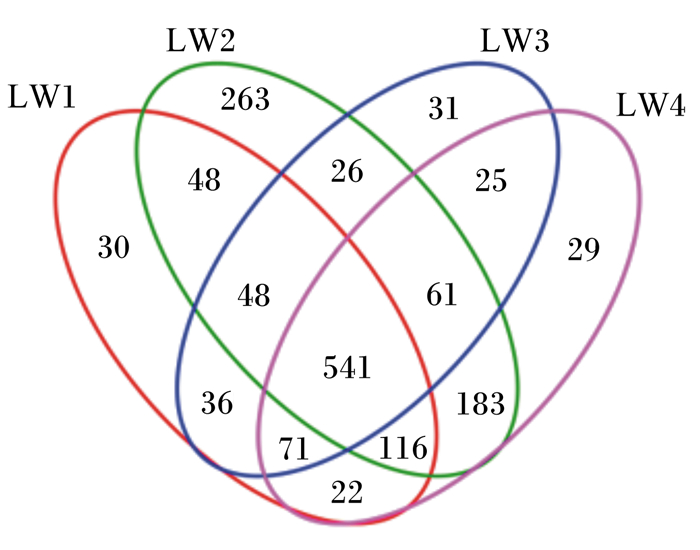
|
LW1、LW2、LW3和LW4分别代表试验1组、试验2组、试验3组和对照组。下图同。 LW1, LW2, LW3 and LW4 represent the trial group 1, trial group 2, trial group 3 and control group, respectively. The same as below. 图 1 瘤胃液菌群Venn图 Fig. 1 Venn graph of microflora in rumen fluid |
稀释曲线和Shannon曲线反映本试验的测序量和97%相似度OTU数目下制备的文库微生物多样性。由图 2可以看出,随着测序深度的增加,新物种出现的增加速度变得缓慢,但是仍然有新种群出现。由图 3可以看出,当测序深度较小时,Shannon曲线急速上升,当测序深度达到5 000 reads时,该多样性曲线变化缓慢,已接近饱和,说明测序趋向饱和,即本试验当前的测序量足够进行样品菌群多样性分析。
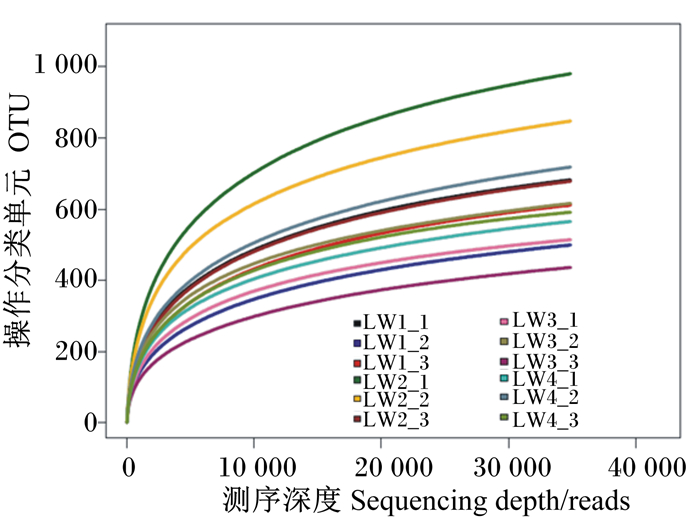
|
图 2 样品的稀释曲线 Fig. 2 Dilution curve of sample |
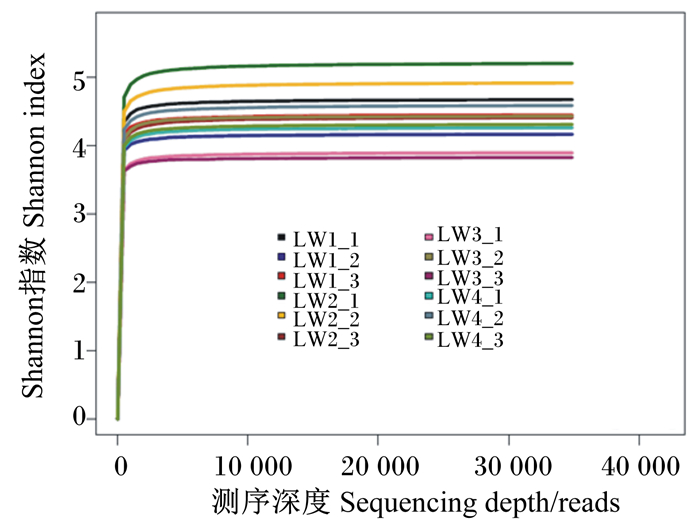
|
图 3 样品的Shannon曲线 Fig. 3 Shannon curve of sample |
α多样性是对单个样品中物种多样性的分析,包括Chao1指数、Shannon指数和Simpson指数等。其中,Chao1指数反映样品中微生物的种类,即OTU数目。Shannon指数和Simpson指数则用于估计微生物多样性,Shannon指数越大反映了样品中微生物多样性越丰富。由表 3可知,试验2组的Chao1指数显著高于对照组(P < 0.05),说明试验2组样品中细菌物种总数高于对照组。试验2组的Shannon指数和Simpson指数有大于对照组的趋势(0.05≤P < 0.10),说明试验2组样品中细菌的多样性高于对照组。各组的覆盖率均高于99%,说明足够反映试验不同组别中每只滩羊瘤胃菌群的情况。
|
|
表 3 α多样性指数 Table 3 α diversity indexes |
β多样性主要是为了研究不同样品或组别之间的菌群结构差异。采用加权Unifrac比较组别之间的微生物群落之间的距离,可以直观地反映出不同组别之间物种的组成结构差异性。各组之间离散的越远,说明各组差异越大。由图 4可以看出,本试验中,试验2组与其他各组相距较远,说明其与其他各组瘤胃微生物区系存在着差异,也进一步可以说明饲粮添加沙蒿多糖+丁酸甘油酯可以使滩羊羔羊的瘤胃微生物群落结构发生改变。
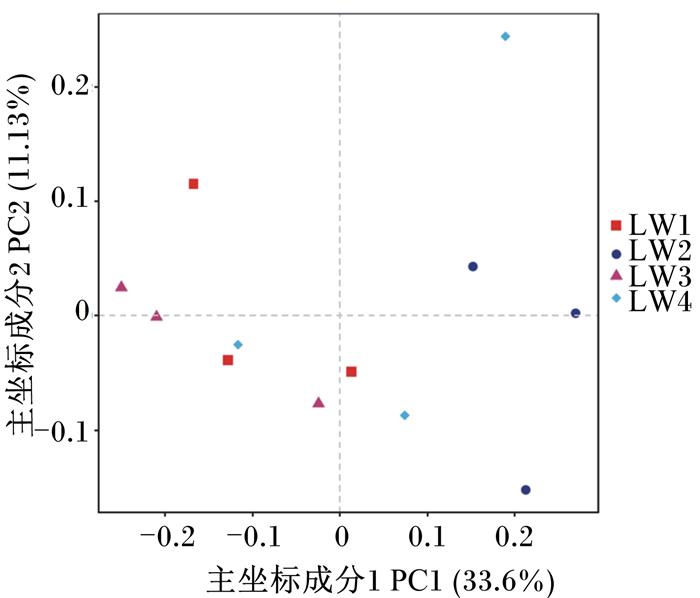
|
图 4 16S rDNA的主坐标分析 Fig. 4 Principal coordinate analysis of 16S rDNA |
滩羊瘤胃细菌在门水平上的组成和相对丰度见表 4和图 5,共检测到21种菌门,包括厚壁菌门、拟杆菌门、放线菌门、螺旋菌门、软壁菌门、糖细菌门、变形菌门、丝状杆菌门、蓝藻菌门、SR1_Absconditabacteria、疣微菌门、绿弯菌门、未注释细菌门、互养菌门、广古菌门、黏胶球形菌门、浮霉菌门等。4个组中滩羊瘤胃液中的菌门主要为厚壁菌门、拟杆菌门和放线菌门,占到了总细菌的94.52%。与对照组相比,试验1组瘤胃液中软壁菌门的相对丰度显著升高(P < 0.05),厚壁菌门和丝状杆菌门的相对丰度有升高的趋势(0.05≤P < 0.10);试验2组瘤胃液中绿弯菌门的相对丰度显著升高(P < 0.05),而疣微菌门的相对丰度有升高的趋势(0.05≤P < 0.10);试验3组瘤胃液中蓝藻菌门和互养菌门的相对丰度显著升高(P < 0.05)。
|
|
表 4 沙蒿多糖组合制剂对滩羊瘤胃菌群在门水平上相对丰度的影响 Table 4 Effects of Artemisia polysaccharide combination preparation on relative abundance ofrumen microflora at phylum level of Tan lambs |
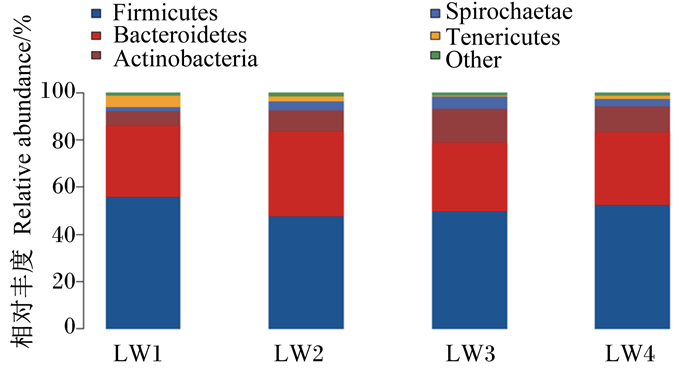
|
Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Actinobacteria:放线菌门;Spirochaetae:螺旋菌门;Tenericutes:软壁菌门;Other:其他。 图 5 门水平上瘤胃菌群分布图 Fig. 5 Distribution diagram of rumen microflora at phylum level |
滩羊瘤胃细菌在上水平上的组成和相对丰度见表 5和图 6,将瘤胃细菌群落细化分类注释到细菌属水平,4组滩羊瘤胃液菌群总共包含173个属。其中有18个菌属相对比例均占到序列总数的1%以上,分别为普雷沃氏菌属_1、克里斯滕森菌科_R-7、奥尔森菌属、理研菌科_RC9、毛螺菌科_NK3A20、密螺旋体属_2、Saccharofermentans、瘤胃球菌属_gauvreauii、瘤胃球菌科_NK4A214、瘤胃球菌科_UCG-014、Sharpea、双歧杆菌属、毛螺旋菌科、互营球菌属、Catenisphaera、产粪甾醇真细菌、解琥珀酸菌属、啮齿真杆菌等。与对照组相比,试验1组瘤胃液中理研菌科RC9的相对丰度显著降低(P < 0.05),解琥珀酸菌属和丹毒丝菌属的相对丰度显著升高(P < 0.05);试验2组瘤胃液中Sharpea的相对丰度显著降低(P < 0.05),假丁酸弧菌属的相对丰度显著升高(P < 0.05);试验3组瘤胃液中理研菌科RC9和Sharpea的相对丰度显著降低(P < 0.05),互营球菌属的相对丰度有增加的趋势(0.05≤P < 0.10)。
|
|
表 5 沙蒿多糖组合制剂对滩羊瘤胃菌群在属水平的丰度影响 Table 5 Effects of Artemisia polysaccharide combination preparation on relative abundance ofrumen microflora at genus level of Tan lambs |
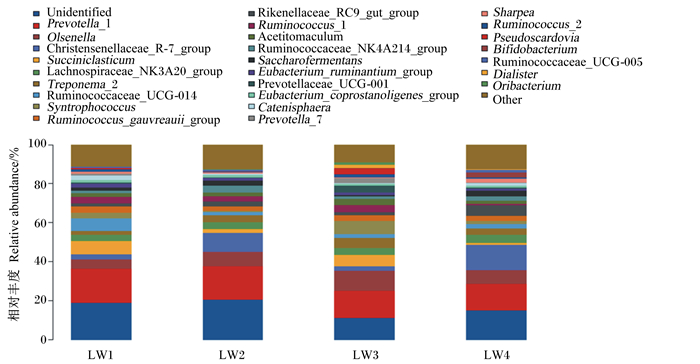
|
Unidentified:未分类;Prevotella_1:普雷沃氏菌属_1;Olsenella:奥尔森菌属;Christensenellaceae_R-7_group:克里斯滕森菌科_R-7;Succiniclasticum:解琥珀酸菌属;Lachnospiraceae_NK3A20_group:毛螺菌科_NK3A20;Treponema_2:密螺旋体属_2;Ruminococcaceae_UCG-014:瘤胃球菌科_UCG-014;Syntrophococcus:互营球菌属;Ruminococcus_gauvreauii_group:瘤胃球菌属_gauvreauii;Rikenellaceae_RC9_gut_group:理研菌科_RC9;Ruminococcus_1:瘤胃球菌属_1;Acetitomaculum:毛螺旋菌科;Ruminococcaceae_NK4A214:瘤胃球菌科_NK4A214;Eubacterium_ruminantium_group:啮齿真杆菌;Prevotellaceae_UCG-001:普雷沃氏菌科_UCG-001;Eubacterium_coprostanoligenes_group:产粪甾醇真细菌;Prevotella_7:普雷沃氏菌属_7;Ruminococcus_2:瘤胃球菌属_2;Bifidobacterium:双歧杆菌属;Ruminococcaceae_UCG-005:瘤胃球菌科_UCG-005;Other:其他。 图 6 属水平上瘤胃菌群分布图 Fig. 6 Distribution diagram of rumen microflora at genus level |
反刍动物的瘤胃是一个复杂的厌氧微生物发酵系统,主要包括细菌和古菌、原虫和真菌以及噬菌体,其中细菌是瘤胃中数量最多、种类最复杂的微生物。细菌的生长代谢不仅能够为反刍动物提供能量、蛋白质、必需氨基酸等营养物质,而且可以降解纤维物质,使其转化为供机体吸收利用的能源物质,进而维持反刍动物的营养需要[15]。研究表明,反刍动物瘤胃中的优势菌群主要为厚壁菌门和拟杆菌门,其在瘤胃发酵过程中扮演着重要角色[16-17]。本试验中,瘤胃优势菌群按照相对丰度由大到小依次为厚壁菌门、拟杆菌门和放线菌门,这与上述研究得出的结果一致。郭伟[18]使用RDP数据库资源对瘤胃菌群16S rRNA基因序列进行Meta分析后,得出山羊瘤胃中优势菌群依次为拟杆菌门、变形菌门和厚壁菌门,与本研究得出的结论不同,探究其原因可能是与动物的品种与日龄、饲粮结构、采样方式以及测序区域等的不同有关。厚壁菌门与拟杆菌们分别在纤维物质与非纤维物质的降解中发挥着重要作用,纤维与非纤维物质经瘤胃发酵后分别产生乙酸和丙酸[19]。有学者认为,厚壁菌门和拟杆菌门二者含量的比例会影响机体对能量的吸收。Turnbaugh等[20]研究发现,肠道富集厚壁菌门细菌的小鼠比较肥胖,然而拥有更高比例拟杆菌门细菌的小鼠却相对消瘦。这可能是因为厚壁菌门细菌富含淀粉、半乳糖及丁酸等代谢酶,有助于促进机体对能量的吸收,更有利于脂肪的沉积[21]。本试验前期研究结果的生长性能数据表明,与对照组相比,沙蒿多糖+包被丁酸钠组、沙蒿多糖+丁酸甘油酯组和沙蒿多糖+莫能菌素组显著提高了滩羊羔羊的末重和平均日增重,平均日增重比对照组分别增加了15.29%、11.98%和17.33%,但对平均日采食量无显著影响,4个组的平均日采食量分别为2 120、2 110、2 140和2 180 g/d;4个组的料重比分别为10.99、9.86、10.20和9.99,以沙蒿多糖+包被丁酸钠组为最低,且与对照组相比差异显著[22]。因此,本试验中饲粮添加沙蒿多糖+包被丁酸钠后滩羊羔羊的增重并非由采食量导致的,推测其一方面是由于其提高了瘤胃中厚壁菌门的相对丰度;另一方面可能与沙蒿多糖、丁酸钠营养肠道的作用有关[23]。此外,与生长性能相一致,本研究中饲粮添加沙蒿多糖+包被丁酸钠有提高Shannon指数和Simpson指数的趋势,虽然与对照组相比差异不显著,但在数值上均有所提高。这说明饲粮添加沙蒿多糖+包被丁酸钠可能通过提高瘤胃微生物丰度和多样性导致羔羊生长性能提高。
Daly等[24]研究表明,厚壁菌门中包含有较多的纤维分解菌。本研究中,饲粮添加沙蒿多糖+包被丁酸钠有提高瘤胃液中厚壁菌门的相对丰度的趋势,说明添加沙蒿多糖+包被丁酸钠后促进了纤维分解菌的生长,这可能会提高瘤胃内纤维类物质的分解效率,发酵产生更多的乙酸。VFA(乙酸、丙酸、丁酸)的组成和浓度除受饲粮结构和品质的影响外,瘤胃微生物活性和微生物区系也会影响VFA的生成[25]。本研究得出,饲粮添加沙蒿多糖+包被丁酸钠显著提高瘤胃液乙酸比例,说明添加沙蒿多糖+包被丁酸钠后纤维的降解率有所提高,可能是由于添加沙蒿多糖+包被丁酸钠后提高了厚壁菌门相对丰度的原因。此外,碳水化合物发酵产生VFA的过程中释放的能量可以供微生物生长繁殖利用。据报道,pH的高低也会直接影响瘤胃微生物的生长代谢,反刍动物瘤胃液适宜pH为6.00~6.30,pH过低将会抑制纤维分解菌的活性[26-27]。本试验中,各试验组瘤胃液pH虽略有提高,但均处于正常范围内,说明发酵环境有利于微生物的生长和代谢。
变形菌门是细菌域中最大的一门,除了包含纤维素降解菌、半纤维素降解菌、蛋白质降解菌、淀粉降解菌以及乳酸利用菌以外,还包含很多如大肠杆菌、沙门氏菌、霍乱弧菌、幽门螺杆菌等致病菌,容易引起动物腹泻等疾病[28]。本试验中试验1组和试验2组中变形菌门的相对丰度与对照组相比虽然差异不显著,但在数值上有所降低,说明饲粮添加沙蒿多糖+包被丁酸钠或沙蒿多糖+丁酸甘油酯具有较好的平衡肠道菌群的作用。目前关于沙蒿多糖与丁酸类物质复合使用对肠道菌群的影响鲜有报道,只有少量试验集中在单一物质的效果研究上,并且主要以单胃动物为主。本课题组李胜利[2]的研究结果表明,饲粮添加沙蒿多糖能够减少肠道致病性如弧菌、空肠弯曲菌等的相对丰度。Rivera-Chavez等[29]研究发现,三丁酸甘油酯和包被丁酸钠释放出的有效物质丁酸,其强酸性可以有效抑制有害致病菌的增殖,并且能够促进乳酸菌等益生菌的生长,使肠道微生态维持在正常水平。此外,本试验中,试验3组与对照组间互养菌门的相对丰度差异显著。互养菌门是一种较新分类门,属革兰氏阴性厌氧杆菌,具有降解氨基酸和丙酮酸的能力[30]。疣微菌门在哺乳动物胃肠道免疫耐受中起主要作用,其相对丰度的减少或缺失与宿主免疫力的下降密切相关[31]。本研究中,试验2组与对照组相比,疣微菌门的相对丰度显著升高,这表明在饲粮中添加沙蒿多糖+丁酸甘油酯可增强机体免疫力。
进一步从属水平来看,普雷沃氏菌属是普遍存在于草食动物瘤胃中数量最多的一类拟杆菌门菌属,参与多种微生物代谢、具有较高活性的半纤维素降解能力和适应不同饲粮结构的能力[32],在蛋白质、淀粉、木聚糖和果胶的降解过程中发挥着重要作用[33-34]。本试验中,普雷沃氏菌属1的相对丰度最高,但各组之间差异不显著,这与前人研究结果[35]一致。然而从数值上看,试验1组和试验2组瘤胃液中普雷沃氏菌属1的相对丰度均高于对照组,说明饲粮添加沙蒿多糖+包被丁酸钠组或沙蒿多糖+丁酸甘油酯均能在一定程度上提高普雷沃氏菌属的数量,进而可能提高半纤维素被分解的效率。瘤胃球菌属包括黄色瘤胃球菌和白色瘤胃球菌,是瘤胃中主要的纤维降解菌,能产生大量的纤维素酶、半纤维素酶和木聚糖酶,降解粗饲料中的纤维素和半纤维素[36]。Shen等[37]在研究莫能菌素对荷斯坦奶牛瘤胃发酵参数的影响中发现,由于莫能菌素降低了革兰氏阳性纤维溶解菌(如瘤胃球菌属)在瘤胃液中的相对丰度,因此降低了瘤胃液中乙酸比例。在本试验中,试验2组瘤胃液中瘤胃球菌科_NK4A214的相对丰度显著高于试验3组,而瘤胃球菌科_UCG-014的相对丰度低于试验3组,这可能是由于滩羊瘤胃内瘤胃球菌科_NK4A214的生长因添加莫能菌素而受到抑制,导致了与它有竞争关系的其他瘤胃球菌属的相对丰度提高。Grilli等[38]研究证实,丁酸弧菌属中的假丁酸弧菌是山羊瘤胃中主要降解纤维的细菌,发酵各种碳水化合物,丁酸是主要的代谢产物。Koike等[39]研究发现,解琥珀酸菌属中产琥珀酸拟杆菌,纤维分解活性很高,能够降解白色瘤胃球菌不能降解的晶体纤维素,是研究纤维素酶最早的瘤胃菌株之一。有研究表明,产琥珀酸丝状杆菌产生的酶具有独立的纤维素化区和结合区,纤维降解能力很强,并且还能降解黄白瘤胃球菌不能降解的纤维素[40]。本研究发现,饲粮添加沙蒿多糖+丁酸甘油酯或沙蒿多糖+包被丁酸钠促进了滩羊瘤胃中假丁酸弧菌属和解琥珀酸菌属的生长繁殖,提高了瘤胃液中乙酸和丁酸浓度,表明这2组瘤胃内纤维类物质的消化率会提高,这也与课题组前期得出的其显著增加了中性洗涤纤维(NDF)表观消化率的研究结果[22]相吻合。
此外,基于当前细菌数据库,本研究在滩羊瘤胃内还检测到大量未被分类鉴定的菌属,这些结果暗示滩羊具有自己特有的瘤胃微生物菌群,同时也反映了目前对其瘤胃微生物区系研究很少的事实,在今后的研究中有待于进一步发掘。
4 结论在滩羊羔羊饲粮中添加沙蒿多糖组合制剂均可提高菌群多样性,改善瘤胃微生物区系,且以添加沙蒿多糖+包被丁酸钠效果最好。
| [1] |
CALSAMIGLIA S, CASTILLEJOS L, BUSQUET M. Alternatives to antimicrobial growth promoters in cattle[M]. Nottingham: Nottingham University Press, 2006: 129-167.
|
| [2] |
李胜利.淬灭酶及沙蒿多糖对绵羊瘤胃微生态和营养代谢及免疫影响研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2016: 31-40. LI S L.Effects of AHL-lactonase and Artemisia seed polysaccharide on rumen microflora and nutrient metabolism and immune effect in sheep[D].Ph.D.Thesis.Hohhot: Inner Mongolia Agricultural University, 2016: 31-40. (in Chinese) |
| [3] |
邴新帅.丁酸钠与沙蒿多糖对断奶羔羊肠道发育及胰高血糖素样肽-2的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2018: 24-33. BING X S.Effect of sodium butyrate and Artemisia seed polysaccharide on intestinal development and glucagon-like peptide-2 of weaning lambs[D].Master's Thesis.Hohhot: Inner Mongolia Agricultural University, 2018: 24-33. (in Chinese) |
| [4] |
余东游, 孙健栋, 麻剑雄, 等. 三丁酸甘油酯的生物学功能及其在畜牧生产中的应用[J]. 中国畜牧杂志, 2014, 50(17): 91-95. YU D Y, SUN J D, MA J X, et al. Biological functions and application of tributyl in livestock production[J]. Chinese Journal of Animal Science, 2014, 50(17): 91-95 (in Chinese). DOI:10.3969/j.issn.0258-7033.2014.17.022 |
| [5] |
MA X, FAN P X, LI L S, et al. Butyrate promotes the recovering of intestinal wound healing through its positive effect on the tight junctions[J]. Journal of Animal Science, 2012, 90(4): 266-268. |
| [6] |
张俊.丁酸酯和丁酸钠对急性应激肉仔鸡小肠形态结构、二糖酶活性及能量状态的影响[D].硕士学位论文.武汉: 武汉轻工大学, 2013: 2-9. ZHANG J.Effect of tributyrin and coated sodium butyrate on morphology, disaccharidase and energy status of small intestine in acute stressed broilers[D].Master's Thesis.Wuhan: Wuhan Polytechnic University.2013: 2-9. (in Chinese) |
| [7] |
NRC.Nutrient requirements of small ruminants: sheep, goats, cervids, and new world camelids[S]. Washington, D.C.: National Academies Press, 2007.
|
| [8] |
中国饲料数据库. 中国饲料成分及营养价值表(2018年第29版)[J]. 中国饲料, 2018(21): 64-73. China Feed Database. Chinese feed composition and nutritional value table (29th edition, 2018)[J]. China Feed, 2018(21): 64-73 (in Chinese). |
| [9] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 6435-2014饲料中水分的测定[S].北京: 中国标准出版社, 2015. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China.National standardization administration of China.GB/T 6435-2014 Determination of moisture in feedstuffs[S].Beijing: Standards Press of China, 2015.(in Chinese) |
| [10] |
国家技术监督局.GB/T 6432-1994饲料中粗蛋白测定方法[S].北京: 中国标准出版社, 1994. The State Bureau of Technical Supervision. B/T 6432-1994 Method for the determination of crude protein in feedstuffs[S]. Beijing: Standards Press of China, 1994.(in Chinese) |
| [11] |
中华人民共和国国家质量监督检验检疫总局.GB/T6436-2002饲料中钙的测定[S].北京: 中国标准出版社, 2002. General Administration of Quality Supervision, nspection and Quarantine of the People's Republic of China. GB/T 6436-2002 Determination of calcuim in feedstuffs[S].Beijing: Standards Press of China, 2002.(in Chinese) |
| [12] |
中华人民共和国国家质量监督检验检疫总局.GB/T6437-2002饲料中总磷的测定分光光度法[S].北京: 中国标准出版社, 2002. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China.GB/T 6437-2002 Determination of phosphorus in feed-spectrophotometry[S].Beijing: Standards Press of China, 2002.(in Chinese) |
| [13] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 内蒙古畜牧科学, 1993(4): 40-41. FENG Z C, GAO M. Improvement of colorimetric determination of ammonia nitrogen in rumen fluid[J]. Animal Husbandry and Feed Science, 1993(4): 40-41 (in Chinese). |
| [14] |
姜芳, 王佳堃, 刘建新. 内标法同时测定挥发性脂肪酸和乳酸的方法探究[J]. 中国畜牧杂志, 2009, 45(21): 73-76. JIANG F, WANG JK, LIU J X. Internal standard method for simultaneous determination of volatile fatty acids and lactic acid[J]. Chinese Journal of Animal Science, 2009, 45(21): 73-76 (in Chinese). |
| [15] |
MULLINS C R, MAMEDOVA L K, CARPENTER A J, et al. Analysis of rumen microbial populations in lactating dairy cattle fed diets varying in carbohydrate profiles and Saccharomyces cerevisiae fermentation product[J]. Journal of Dairy Science, 2013, 96(9): 5872-5881. DOI:10.3168/jds.2013-6775 |
| [16] |
SINGH K M, AHIR V B, TRIPATHI A K, et al. Metagenomic analysis of Surti buffalo (Bubalus bubalis) rumen:a preliminary study[J]. Molecular Biology Reports, 2012, 39(4): 4841-4848. DOI:10.1007/s11033-011-1278-0 |
| [17] |
DE OLIVEIRA M N V, JEWELL K A, FREITAS F S, et al. Characterizing the microbiota across the gastrointestinal tract of a Brazilian Nelore steer[J]. Veterinary Microbiology, 2013, 164(3): 307-314. |
| [18] |
郭伟.不同年龄阶段山羊瘤胃古菌, 细菌菌群结构组成研究[D].硕士学位论文.雅安: 四川农业大学, 2015, 11-24. GUO W.The research on the composition structure of archaea and bacteria in the rumen of goat at different age stages[D].Master's Thesis.Yaan: Sichuan Agricultural University, 2015, 11-24.(in Chinese) |
| [19] |
EVANS N J, BROWN J M, MURRAY R D, et al. Characterization of novel bovine gastrointestinal tract treponema Isolates and comparison with bovine digital dermatitis treponemes[J]. Applied and Environmental Microbiology, 2011, 77(1): 138-147. DOI:10.1128/AEM.00993-10 |
| [20] |
TUMBAUGH P J, LEY R E, MAHOWALD M A, et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444(7122): 1027-10131. DOI:10.1038/nature05414 |
| [21] |
MURPHY E F, COTTER P D, HEALY S, et al. Composition and energy harvesting capacity of the gut microbiota:relationship to diet, obesity and time in mouse models[J]. Gut, 2010, 59(12): 1635-1642. DOI:10.1136/gut.2010.215665 |
| [22] |
张俊丽, 金鹿, 施安, 等. 沙蒿多糖不同组合添加制剂对滩羊羔羊生产性能及肉品质的影响[J]. 饲料研究, 2020(06): 18-21. ZHANG J L, JIN L, SHI A, et al. Effect of different combined preparations of Artemisia seed polysaccharides on production performance and meat quality of Tan lambs[J]. Feed Research, 2020(06): 18-21 (in Chinese). |
| [23] |
LEONEL A J, ALVEREZ-LEITE J I. Butyrate:implication for intestinal function[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2012, 15(5): 474-479. DOI:10.1097/MCO.0b013e32835665fa |
| [24] |
DALY K, STEWART C S, FLINT H J, et al. Bacterial diversity within the equine large intestine as revealed by molecular analysis of cloned 16S rRNA genes[J]. FEMS Microbiology Ecology, 2001, 38(2-3): 141-151. DOI:10.1111/j.1574-6941.2001.tb00892.x |
| [25] |
金亚倩, 赵俊星, 刘文忠, 等. 酿酒葡萄皮渣对绵羊瘤胃代谢及发育的影响[J]. 畜牧兽医学报, 2017, 48(09): 1683-1693. JIN Y Q, ZHAO J X, LIU W Z, et al. Effect of dietary wine grape pomace supplementation on rumen metabolism and development in lambs[J]. Chinese Journal of Animal and Veterinary Sciences, 2017, 48(09): 1683-1693 (in Chinese). |
| [26] |
RUSSELL J B. The importance of pH in the regulation of ruminal acetate to propionate ratio and methane production in vitro[J]. Journal of Dairy Science, 1998, 81(12): 3222-3230. DOI:10.3168/jds.S0022-0302(98)75886-2 |
| [27] |
MURPHY J J, KENNELLY J J. Effect of protein concentration and protein source on the degradability of dry matter and protein in situ[J]. Journal of Dairy Science, 1987, 70(9): 1841-1849. DOI:10.3168/jds.S0022-0302(87)80223-0 |
| [28] |
BYNDLOSS M X, BAUMLER A J. The germ-organ theory of non-communicable diseases[J]. Nature Reviews Microbiology, 2018, 16: 103-110. DOI:10.1038/nrmicro.2017.158 |
| [29] |
RIVERA-CHAVEZ F, ZHANG L F, FABER F, et al. Depletion of butyrate-producing clostridia from thegut microbiota drives an aerobic luminal expansion of Salmonella[J]. Cell host & microbe, 2016, 19(4): 443-454. |
| [30] |
张李荣, 杨海明. 应用Illumina MiSeq高通量测序技术分析饲粮添加丁酸钠对蛋雏鸡盲肠微生物的影响[J]. 中国饲料, 2018(23): 12-17. ZHANG L R, YANG H M. Effects of diets supplemented with sodium butyrate on cecum microorganism of layer chicks analyzed by Illumina MiSeq sequencing technology[J]. China Feed, 2018(23): 12-17 (in Chinese). |
| [31] |
DERRIEN M, BAARLEN P V, HOOIVELD G, et al. Modulation of mucosal immune response, tolerance, and proliferation in mice colonized by the mucin-degrader Akkermansia muciniphila[J]. Front Microbiol, 2011, 2: 166. |
| [32] |
LI Z P, WRIGHT A D G, LIU H L, et al. Response of the rumen microbiota of sika deer (Cervus nippon) fed different concentrations of tannin rich plants[J]. PLoS One, 2015, 10(5): e0123481. DOI:10.1371/journal.pone.0123481 |
| [33] |
JAMI E, ISRAEL A, KOTSER A, et al. Exploring the bovine rumen bacterial community from birth to adulthood[J]. ISME Journal, 2013, 7(6): 1069-1079. DOI:10.1038/ismej.2013.2 |
| [34] |
THOETKIATTIKUL H, MHUANTONG W, LAOTHANACHAREON T, et al. Comparative analysis of microbial profiles in cow rumen fed with different dietary fiber by tagged 16S rRNA gene pyrosequencing[J]. Current Microbiology, 2013, 67: 130-137. DOI:10.1007/s00284-013-0336-3 |
| [35] |
BEKELE A Z, KOIKE S, KOBAYASHI Y. Genetic diversity and diet specificity of ruminal Prevotella revealed by 16S r RNA gene-based analysis[J]. FEMS microbiology letters, 2010, 305(1): 49-57. DOI:10.1111/j.1574-6968.2010.01911.x |
| [36] |
张红涛.不同玉米青贮水平对荷斯坦后备牛瘤胃液微生物组及其代谢组的影响[D].博士学位论文.北京: 中国农业大学, 2017: 28-32. ZHANG H T.Effects of corn silage levels on rumen fluid microbiota and its metabolome in Holstein heifers[D].Ph.D.Thesis.Beijing: China Agricultural University, 2017: 28-32.(in Chinese) |
| [37] |
SHEN J S, LIU Z, YU Z T, et al. Monensin and nisin affect rumen fermentation and microbiota differently in vitro[J]. Frontiers in Microbiology, 2017, 8: 1111. DOI:10.3389/fmicb.2017.01111 |
| [38] |
GRILLI D J, CERON M E, PAEZ S, et al. Isolation of Pseudobutyrivibrio ruminis and Pseudobutyrivibrio xylanivorans from rumen of Creole goats fed native forage diet[J]. Folia Microbiologica, 2013, 58: 367-373. DOI:10.1007/s12223-012-0219-1 |
| [39] |
KOIKE S, KOBAYASHI Y. Fibrolytic rumen bacteria:their ecology and functions[J]. Asian-Australasian Journal of Animal Sciences, 2009, 22(1): 131-138. DOI:10.5713/ajas.2009.r.01 |
| [40] |
王梦芝, 沈建昭, 刘莹, 等. 蛋白质来源对瘤胃细菌和原虫群体结构的影响[J]. 中国畜牧杂志, 2011, 47(3): 35-40. WANG M Z, SHEN J Z, LIU Y, et al. Effects of dietary protein sources on bacterial and protozoal community structure in goat rumen[J]. Chinese Journal of Animal Science, 2011, 47(3): 35-40 (in Chinese). |




