2. 天津市微生物代谢与发酵过程控制工程研究中心, 天津 300457
2. Tianjin Engineering Research Center of Microbial Metabolism and Fermentation Process Control, Tianjin 300457, China
枯草芽孢杆菌(Bacillus subtilis)是一种革兰氏阳性兼性厌氧菌,属于芽孢杆菌属,能够耐高温、耐挤压、耐酸碱、耐胃肠道中各种酶,从而有效地定植于肠道内,消耗肠道环境中的游离氧,造成厌氧环境,对动物生长和健康产生积极影响[1-2]。哺乳动物及禽类出生后的早期阶段是肠道菌群定植的关键时期,对早期生长和肠道发育有重要作用[3]。目前对枯草芽孢杆菌的研究大多集中在其对断奶后动物的生长性能、肠道发育及肠道微环境的研究,对于断奶之前肠道菌群的定植以及作用机制的研究相对较少。因此,研究枯草芽孢杆菌对动物早期的生长、肠道发育和功能成熟、肠道菌群的影响及潜在的作用机制具有重要意义,可为今后的动物生产中由液体母乳喂养转变为适口性较差的固体饲粮添加剂中科学、安全、有效地使用枯草芽孢杆菌提供理论依据。研究表明,25日龄仔猪饲粮中添加枯草芽孢杆菌WEI-62可以提高其生长性能,改善肠道形态结构,降低料重比,调控肠道菌群结构[4]。枯草芽孢杆菌PB6对7日龄宫内生长迟缓的仔猪的生长、肠道发育和屏障功能、消化功能以及免疫功能有一定的改善作用[5]。补充枯草芽孢杆菌DSM32315可以改善42日龄肉仔鸡的生长性能和肠道结构,提高肉仔鸡的平均体重和平均日增重,提高回肠绒毛长度和绒毛长度/隐窝深度[6]。Li等[7]发现,从藏牦牛中分离的枯草芽孢杆菌18能提高15日龄小鼠的平均日增重和饲料转化率,改善黏膜形态。
Wnt信号通路的激活是肠上皮细胞分化和干细胞稳态维持所必需的[8]。研究发现,乳酸菌能够刺激基质细胞和潘氏细胞分泌Wnt3配体,之后通过Wnt/β-连环蛋白(β-catenin)途径促进肠道干细胞的增殖和肠上皮细胞的发育[9]。由此可见,益生菌可能对Wnt信号的激活产生一定的影响,从而调控肠道干细胞的增殖和分化。而枯草芽孢杆菌是否能够影响肠道干细胞的增殖和分化,是否能激活Wnt信号通路目前尚未见相关报道。本实验室前期从健康新生儿粪便中分离到1株枯草芽孢杆菌RZ001,证实其能够在小鼠的肠道内定植、增强肠黏膜屏障功能、改善葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠炎[10]。但是枯草芽孢杆菌RZ001是否影响动物的早期生长发育、肠道菌群及其作用机制尚需进一步研究。因此,本试验选用刚出生的小鼠乳鼠,旨在研究枯草芽孢杆菌对乳鼠的早期生长、肠道发育和功能成熟、肠道菌群及Wnt信号通路相关基因表达的影响,从而揭示枯草芽孢杆菌影响动物早期肠道发育、功能成熟和肠道菌群的潜在作用机制,为今后动物饲料添加剂中科学、有效地使用枯草芽孢杆菌提供理论依据。
1 材料与方法 1.1 菌种、动物、细胞、试剂和仪器 1.1.1 菌种、动物、细胞枯草芽孢杆菌RZ001分离自健康新生儿粪便,经16S rDNA测序为枯草芽孢杆菌(GenBank登录号: NC 000964),并保藏于中国微生物菌种保藏中心(保藏编号:CGMCC 17116)。
雄性和雌性无特定病原体(SPF)级C57BL/6小鼠(8周龄)购买于中国军事医学科学院实验动物中心(北京)。小鼠在控制条件(25 ℃、55%湿度、12 h光/暗循环)下自由采食基础饲粮,充分饮水,每2 d更换1次鼠料和垫料。所有动物试验均按照天津科技大学试验动物福利伦理委员会批准的方案进行。
人结肠癌细胞HT-29(ATCC HTB-38)由本实验室保藏。使用含10%胎牛血清的DMEM/F12培养基(含1×105 U/L青霉素和100 mg/L链霉素),在37 ℃、5% CO2及饱和湿度下培养,24 h后换液,以后每2~3 d更换1次培养液。细胞长满后,用2.5 g/L胰酶消化后传代。
1.1.2 试剂DMEM/F12培养基,美国Gibco公司;胎牛血清,杭州四季青生物工程公司;M-MLV逆转录酶、Trizol试剂,北京索莱宝科技有限公司;SYBR Green qPCR Master mix,DBI Bioscience公司;小鼠抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗、兔抗人β-catenin一抗,美国Santa Cruz公司;IRDye-800标记山羊抗小鼠二抗、IRDye-680标记山羊抗兔二抗,美国Li-COR公司;小鼠黏蛋白2(mucin 2,MUC2)检测试剂盒,武汉华美生物工程有限公司;粪便基因组DNA提取试剂盒,天根生化科技(北京)有限公司。
1.1.3 仪器多功能酶标仪,美国Thermo公司;转膜仪,美国Bio-Rad公司;Odyssey红外激光成像系统,美国LI-COR公司;Stepone Plus实时荧光定量PCR仪,美国ABI公司;DG-250厌氧培养箱,英国Don Whitley Scientifi(DWS)公司;正置荧光显微镜、激光扫描共聚焦显微镜,日本Olympus公司;DYY-6C型电泳仪,北京市六一仪器厂。
1.2 试验设计在准备试验阶段,将来自同一窝产的2只雌性小鼠、1只雄性小鼠置于同一笼中,直至分娩前1~3 d。产下的乳鼠由雌性小鼠自由喂养。正式试验阶段,从新出生的乳鼠中选择4窝窝仔数量相同的乳鼠,并将它们分为2个组(试验组和对照组),每组2个重复。从出生后第2天开始,试验组乳鼠连续14 d灌胃10 μL枯草芽孢杆菌RZ001(1×107 CFU/d),对照组乳鼠连续14 d灌胃10 μL磷酸盐缓冲液(PBS)。
1.3 样品采集每天记录乳鼠体重。出生后第16天颈椎脱臼处死乳鼠,取肝脏、肾脏、脾脏、胸腺称重,计算器官指数:

|
迅速剪取小肠组织回肠段约2 cm,用生理盐水冲洗干净后在4%多聚甲醛溶液中固定,之后进行苏木精-伊红(HE)染色和阿利新蓝-过碘酸-雪夫(AB-PAS)染色。剩余小肠组织分段放于离心管中,液氮中速冻后置于-80 ℃冷冻保藏用于后续试验检测。取下整个盲肠,液氮速冻后放置于-80 ℃冰箱中保存,用于测定盲肠内容物中微生物组成。
1.4 HE染色测定肠道黏膜形态将多聚甲醛溶液中固定的小肠段取出,流水冲洗,进行梯度无水乙醇脱水,二甲苯透明、石蜡包埋、切片(厚度为5 μm)、展片、烤片,进行HE染色。将带有小肠组织的载玻片在二甲苯溶液中脱蜡,梯度无水乙醇复水,苏木精染色,伊红复染,梯度无水乙醇脱水,二甲苯透明,中性树胶封片。所有标本均在正置显微镜下观察并拍照记录。采用Image-Pro Plus 6.0图像分析软件进行数据分析,每组选取5张切片,每张切片计数4个视野中的绒毛个数,并取平均值,计算绒毛密度;每张切片选取6~8根绒毛和隐窝测量肠绒毛长度及隐窝深度,计算平均值,并计算绒毛长度/隐窝深度。
1.5 AB-PAS染色测定肠道组织杯状细胞数量将带有小肠组织的常规石蜡切片脱蜡至水,阿利新蓝染色液染色20 min,蒸馏水洗,过碘酸溶液氧化5 min,水洗,Schiff染色液浸染20 min,水洗10 min,可选用苏木素染色液染核1~2 min,分化、返蓝、水洗,逐级无水乙醇脱水,二甲苯透明,中性树胶封固。染色结果为杯状细胞呈蓝色(含酸性黏蛋白)、深红/红紫色(含中性黏蛋白)及深浅不同的紫色(同时含酸性和中性黏蛋白)。所有切片在正置荧光显微镜下观察并拍照,采用Image-Pro Plus 6.0图像分析软件进行杯状细胞计数,每组选取5张AB-PAS染色的石蜡切片,每张切片随机取4个视野,统计杯状细胞的数目,对计数结果进行统计学分析。
1.6 实时荧光定量PCR测定基因mRNA相对表达量小肠组织经液氮研磨之后采用Trizol法提取总RNA,并用M-MLV逆转录酶将RNA逆转录成2 μg cDNA,逆转录体系为25 μL。实时荧光定量PCR检测目的基因mRNA相对表达量。PCR扩增体系20 μL:qPCR master mix 10 μL,50×ROX 0.4 μL,上、下游引物各0.5 μL,cDNA模板1 μL,无菌蒸馏水7.6 μL。PCR反应条件:95 ℃预变性2 min;95 ℃变性10 s,60 ℃退火和延伸30 s,40个循环;95 ℃ 1 min,55 ℃ 1 min,95 ℃ 15 s绘制熔解曲线。以GAPDH作为参考基因,2-ΔΔCt法计算目的基因mRNA相对表达量。目的基因的引物序列见表 1。
|
|
表 1 基因的引物序列 Table 1 Primer sequences of genes |
将小肠组织样品从-80 ℃冰箱中取出平衡至室温,按1 : 10(质量:体积)的比例加入无菌pH 7.2的1×PBS,在4 ℃下用组织匀浆器破碎成粉末,于4 ℃、2 000 r/min离心20 min,取上清液,检测MUC2含量。检测方法按照试剂盒说明书进行。具体操作如下:在96孔板中加入100 μL待测组织样本或标准品,37 ℃温育2 h;弃掉液体,加入生物素标记抗体工作液100 μL,37 ℃温育1 h;弃掉液体洗板之后,每孔加入辣根过氧化物酶标记亲和素工作液100 μL,37 ℃温育1 h;弃掉液体洗板并加入90 μL反应底物,37 ℃避光显色30 min之后加入50 μL终止液终止反应,在450 nm波长测定光密度值。根据标准品绘制标准曲线并计算样本中MUC2含量。
1.8 蛋白免疫印迹(Western blotting)法测定β-catenin蛋白相对表达量枯草芽孢杆菌RZ001条件培养基的制备按文献[10]进行。将保存在-80 ℃冰箱中的枯草芽孢杆菌RZ001常温下解冻,按2%接种量接种于LB液体培养基中,37 ℃培养12 h进行活化,经过2次活化,终接菌于100 mL培养基中,同时以100 mL空白培养基为对照组,12 h后离心,取上清液,50 ℃旋蒸1.5 h左右,倒入玻璃培养皿中,放入-80 ℃冰箱24 h,于冻干机中冻干处理。冻干样品重悬于细胞培养基中。
HT-29细胞以1×104 mL/个的密度均匀铺种在6孔板中培养2 d,加入5 mg/mL制备的枯草芽孢杆菌RZ001条件性培养基处理24 h后,收集总蛋白。蛋白进十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),之后转移到硝化纤维素膜上,浸入封闭液中封闭1 h。分别加稀释后的β-catenin一抗(1 : 1 000)和GAPDH一抗(1 : 3 000),在4 ℃下孵育过夜,然后在室温下分别用山羊抗兔(1 : 10 000)和山羊抗鼠(1 : 10 000)二抗避光孵育1.5 h,利用Odyssey红外激光成像系统扫膜,用Image J软件对蛋白条带进行灰度分析。
1.9 实时荧光定量PCR测定盲肠微生物种群丰度将盲肠内容物从-80 ℃冰箱中取出在冰上解冻,利用粪便基因组DNA提取试剂盒提取总DNA。按照文献[11]中报导的肠道微生物种群相对丰度检测方法,利用实时荧光定量PCR测定肠道组织样本中拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、乳杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)、大肠杆菌(Escherichia coli)和产气荚膜梭菌(Clostridium perfringens)在总菌中所占的比例。PCR反应条件以及反应体系与测定目的基因mRNA水平表达条件相同。所用的引物序列参考文献[12-14],细菌种群的引物序列见表 2。测定结果通过2-ΔΔCt法计算,与细菌总16S rDNA进行比较,数值显示为细菌总16S rDNA的相对丰度。
|
|
表 2 细菌种群的引物序列 Table 2 Primer sequences of bacterial populations |
试验数据使用GraphPad Prism 5.0软件进行统计及差异性分析。采用t检验比较2组间的统计学差异,数据以平均值±标准差(mean±SD)表示,P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果与分析 2.1 枯草芽孢杆菌RZ001对乳鼠体重和器官指数的影响如图 1所示,与对照组相比,试验组的乳鼠从出生后第2天到第8天体重显著或极显著增加(P < 0.05或P < 0.01)。如表 3和表 4所示,与对照组相比,试验组的脾脏、肾脏、胸腺重量和指数显著或极显著增加(P < 0.05或P < 0.01),但肝脏重量和指数无显著差异(P>0.05)。以上数据表明,枯草芽孢杆菌RZ001可以促进乳鼠的早期生长,但对后期的体重增加无显著影响。
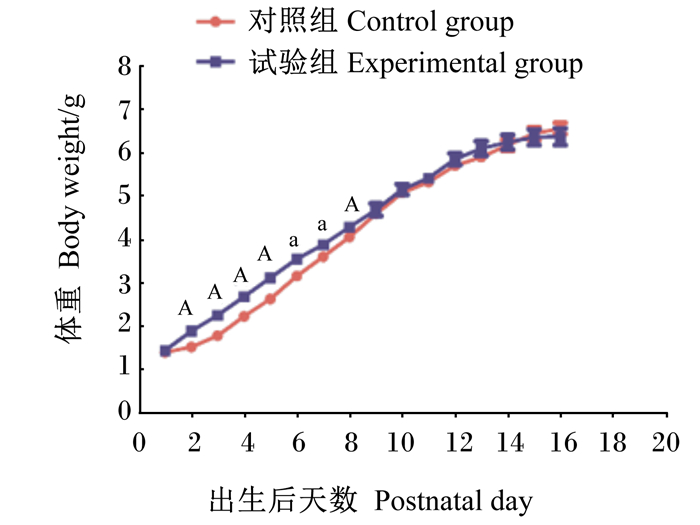
|
“A”表示与对照组差异极显著(P<0.01),“a”表示与对照组差异显著(P<0.05)。下图同。 "A" mean significant difference compared with the control group (P < 0.01), "a" mean significant difference compared with the control group (P < 0.05). The same as below. 图 1 枯草芽孢杆菌RZ001对乳鼠体重的影响 Fig. 1 Effects of Bacillus subtilis RZ001 on body weight of suckling mice |
|
|
表 3 枯草芽孢杆菌RZ001对乳鼠器官重量的影响 Table 3 Effects of Bacillus subtilis RZ001 on organ weight of suckling mice |
|
|
表 4 枯草芽孢杆菌RZ001对乳鼠器官指数的影响 Table 4 Effects of Bacillus subtilis RZ001 on organ indexes of suckling mice |
如图 2所示,与对照组相比,试验组的乳鼠小肠上皮细胞微绒毛长短一致、排列整齐且更加致密。此外,如表 5所示,与对照组相比,试验组的乳鼠绒毛密度和绒毛长度均显著或极显著增加(P < 0.05或P < 0.01),隐窝深度极显著降低(P < 0.01),绒毛长度/隐窝深度极显著增加(P < 0.01)。以上数据表明,枯草芽孢杆菌RZ001可以改变乳鼠小肠黏膜形态结构。
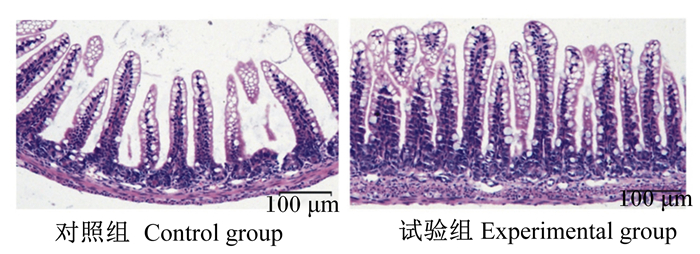
|
图 2 枯草芽孢杆菌RZ001对乳鼠小肠黏膜形态结构的影响(HE染色) Fig. 2 Effects of Bacillus subtilis RZ001 on small intestinal mucosa morphological structure of suckling mice (HE staining) |
|
|
表 5 枯草芽孢杆菌RZ001对乳鼠小肠绒毛形态结构的影响 Table 5 Effects of Bacillus subtilis RZ001 on small intestinal villi morphological structure of suckling mice |
如图 3所示,AB-PAS染色结果表明,与对照组相比,试验组的乳鼠小肠杯状细胞数量明显较多;数据统计结果表明,与对照组相比,试验组的乳鼠小肠杯状细胞的数量显著增加(P < 0.05)。
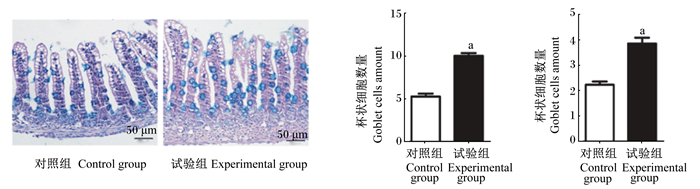
|
图 3 枯草芽孢杆菌RZ001对乳鼠小肠杯状细胞数量的影响(AB-PAS染色) Fig. 3 Effects of Bacillus subtilis RZ001 on number of goblet cells in small intestine of suckling mice (AB-PAS staining) |
如图 4所示,利用实时荧光定量PCR和ELISA方法观察到试验组的乳鼠小肠中MUC2的mRNA相对表达量和MUC2含量均较对照组显著增加(P < 0.05)。
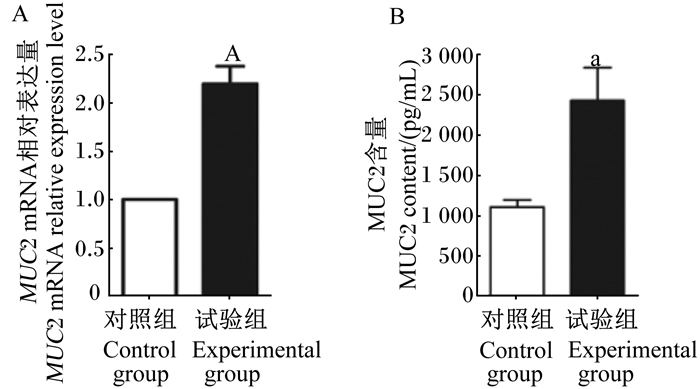
|
A:实时荧光定量PCR分析小肠中MUC2的mRNA相对表达量;B:ELISA法分析小肠中MUC2含量。 A: the mRNA relative expression level of MUC2 in small intestine tested by real time fluorescence quantification PCR; B: the content of MUC2 in small intestine tested by ELISA method. 图 4 枯草芽孢杆菌RZ001对乳鼠小肠MUC2 mRNA相对表达量和MUC2含量的影响 Fig. 4 Effects of Bacillus subtilis RZ001 on MUC2 mRNA relative expression level and MUC2 content in small intestine of suckling mice |
如图 5所示,与对照组相比,试验组的乳鼠小肠中紧密连接蛋白闭锁小带蛋白-1(zonula occluden-1,ZO-1)、闭锁蛋白(occludin,Ocln)、封闭蛋白-3(claudin-3,Cldn-3)的mRNA相对表达量均极显著增加(P < 0.01)。
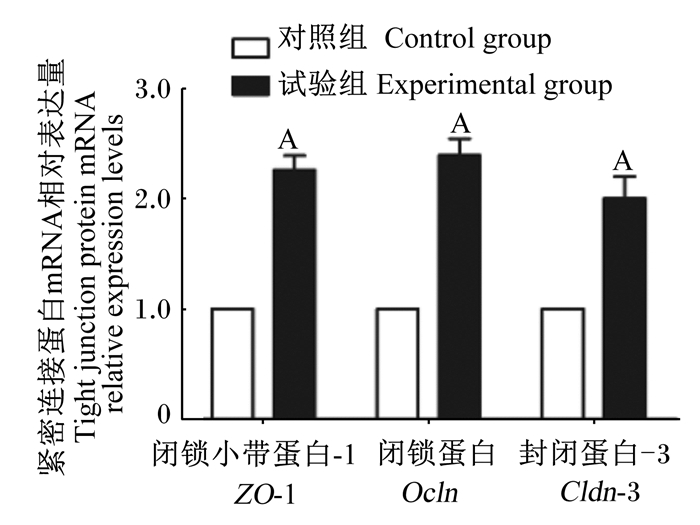
|
图 5 枯草芽孢杆菌RZ001对乳鼠小肠紧密连接蛋白mRNA相对表达量的影响 Fig. 5 Effects of Bacillus subtilis RZ001 on mRNA relative expression levels of tight junction proteins in small intestine of suckling mice |
以上数据表明,枯草芽孢杆菌RZ001能够促进乳鼠肠黏膜屏障的完整以及紧密连接的形成,从而促进肠道屏障功能的成熟。
2.4 枯草芽孢杆菌RZ001对乳鼠Wnt信号通路相关蛋白mRNA相对表达量的影响如图 6所示,与对照组相比,试验组的乳鼠Wnt3、卷曲受体蛋白7(frizzled 7,Fzd7)、低密度脂蛋白受体相关蛋白5(low density lipoprotein receptor related protein 5,Lrp5)、糖原合成激酶-3β(glycogen synthase kinase-3β,Gsk-3β)、Ctnnb1、细胞性骨髓细胞瘤病毒癌基因(cellular-myelocytomatosis viral oncogene,C-myc)、轴蛋白抑制蛋白2(Axin2)和无张力同系物1(atonal homolog 1,Atoh1)的mRNA相对表达量显著或极显著升高(P < 0.05或P < 0.01),但低密度脂蛋白受体相关蛋白6(low density lipoprotein receptor related protein 6,Lrp6)的mRNA相对表达量显著降低(P < 0.05)。此外,与对照组相比,试验组的乳鼠肠道干细胞(intestinal stem cells,ISCs)标记物富含亮氨酸重复序列的G蛋白偶联受体5(leucine rich repeat containing G protein-coupled receptor 5,Lgr5)和Ki67的mRNA相对表达量也显著或极显著升高(P < 0.05或P < 0.01)。以上结果提示,枯草芽孢杆菌RZ001激活了乳鼠Wnt信号通路及靶基因的转录。
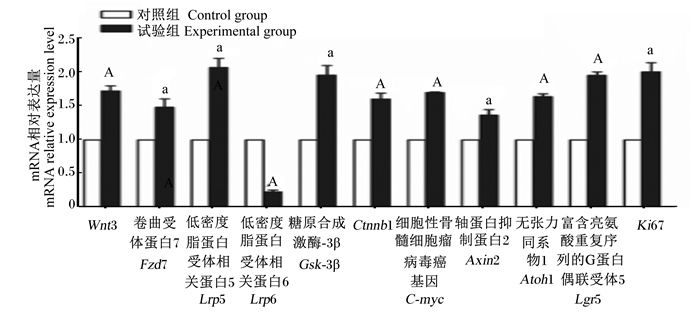
|
图 6 枯草芽孢杆菌RZ001对乳鼠小肠Wnt信号通路相关蛋白mRNA相对表达量的影响 Fig. 6 Effects of Bacillus subtilis RZ001 on mRNA relative expression levels of Wnt signal pathway related proteins in small intestine of suckling mice |
如图 7所示,与对照组相比,试验组的乳鼠小肠β-catenin蛋白相对表达量显著升高(P < 0.05)。以上结果表明,枯草芽孢杆菌RZ001促进β-catenin蛋白在细胞质中的积累,β-catenin随后进入细胞核中激活Wnt信号通路靶基因的转录表达。
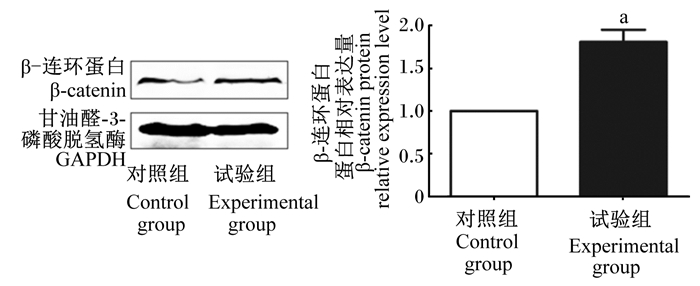
|
图 7 枯草芽孢杆菌RZ001对乳鼠小肠β-catenin蛋白相对表达量的影响 Fig. 7 Effects of Bacillus subtilis RZ001 on protein relative expression level of β-catenin in small intestine of suckling mice |
如表 6所示,门水平上,与对照组相比,试验组的乳鼠盲肠中拟杆菌门的相对丰度显著增加(P < 0.05),而厚壁菌门的相对丰度显著降低(P < 0.05)。属水平上,与对照组相比,试验组的乳鼠盲肠中双歧杆菌属的相对丰度极显著增加(P < 0.01),乳杆菌属的相对丰度也有所增加,但差异不显著(P>0.05);而产气荚膜梭菌的相对丰度极显著降低(P < 0.01),大肠杆菌的相对丰度也有所降低,但差异不显著(P>0.05)。以上结果表明,枯草芽孢杆菌RZ001可以调控乳鼠肠道微生物群的相对丰度。
|
|
表 6 枯草芽孢杆菌RZ001对乳鼠肠道菌群相对丰度的影响 Table 6 Effects of Bacillus subtilis RZ001 on intestinal microbiota relative abundance of suckling mice |
遗传、品种、疾病、饲粮结构、饲养方式及环境湿度等因素都可以影响动物体重的增长。大量的研究结果表明,动物饲粮中添加一定量的益生菌制剂可以改善动物的生长性能[15]。枯草芽孢杆菌是一种在饲料工业及畜牧业中广泛应用的益生菌。枯草芽孢杆菌对肠细胞具有很强的黏附性,通过消耗肠内氧气在肠道微生态平衡中发挥重要作用,从而创造厌氧环境[16]。研究表明,枯草芽孢杆菌在胃肠道中的孢子萌发可以独立进行,也可以与小肠中的其他肠道微生物联合进行[17-18]。一些芽孢杆菌物种通过调节免疫功能来防止病原体感染,从而改善猪的肠道健康[19]。饲粮中添加枯草芽孢杆菌PB6能够提高断奶仔猪的生长速度、肠道发育和免疫功能[5]。本研究表明,枯草芽孢杆菌RZ001能够显著增加乳鼠早期的体重(出生后第2天到第8天),同时显著增加脾脏、肾脏、胸腺等器官指数,这些结果表明枯草芽孢杆菌RZ001对乳鼠的生长产生积极作用。
3.2 枯草芽孢杆菌RZ001对乳鼠肠道发育的影响小肠是动物机体消化与吸收营养物质的主要场所,小肠的消化吸收能力直接受到小肠绒毛长度和隐窝深度的影响[7]。绒毛长度增加,隐窝深度变浅,可以增加小肠与营养物质的接触面积,进而增强小肠对营养物质的消化与吸收能力[4, 15]。绒毛长度、绒毛长度/隐窝深度越高,说明小肠消化吸收能力强。已有研究发现动物饲粮中添加枯草芽孢杆菌可改善小鼠、断奶仔猪、肉鸡、肉牛、羔羊、鹅等动物的肠道黏膜形态,促进小肠绒毛发育。Li等[7]研究发现,连续18 d补充枯草芽孢杆菌可以改善15日龄小鼠的黏膜形态,增加绒毛与隐窝细胞的比例。研究发现,断奶仔猪补充枯草芽孢杆菌可以显著增加回肠绒毛长度,显著降低回肠隐窝深度,极显著增加回肠绒毛长度/隐窝深度[15, 20]。钟光等[21]研究发现,饲粮中添加枯草芽孢杆菌能显著降低肉仔鸡空肠的隐窝深度,改善肉鸡空肠黏膜形态。本研究结果表明,乳鼠连续14 d灌胃枯草芽孢杆菌RZ001后,小肠绒毛密度和绒毛长度显著增加,而隐窝深度显著降低,绒毛长度/隐窝深度显著增加。
MUC2是肠上皮杯状细胞产生的一种黏蛋白,它是肠上皮黏液层的主要结构成分,能够保护肠上皮免受化学和微生物损伤。肠道黏液中MUC2分子受到破坏会增加肠黏膜通透性,进而肠道中的毒素和病原微生物与上皮细胞的接触增加,导致严重的肠道损伤和炎症反应[22]。Shen等[23]发现早产仔猪MUC2合成减少,肠黏膜屏障功能减弱,因而仔猪易患坏死性结肠炎。MUC2-/-小鼠因缺乏保护性黏膜屏障,使得宿主肠上皮直接与肠道菌群接触,最终导致小鼠发生自发性结肠炎[24]。已有文献证实枯草芽孢杆菌能增加小鼠[25]和肉鸡[26]的MUC2含量,防止肠黏膜损伤,促进肠黏膜的修复。Zhang等[25]利用AB-PAS染色证实枯草芽孢杆菌处理的小鼠MUC2的mRNA相对表达量增加。饲粮添加枯草芽孢杆菌显著提高了肉鸡肠道中MUC2的mRNA相对表达量[26-27]。本研究结果表明,乳鼠连续14 d灌胃枯草芽孢杆菌RZ001后小肠杯状细胞数量显著增加,小肠MUC2含量显著提高。
紧密连接蛋白的形成对防止细菌和抗原细胞旁扩散具有重要意义,一些重要的上皮性紧密连接蛋白,如ZO-1、Ocln和Cldn-3,有助于维持肠上皮屏障的完整性,对肠黏膜损伤的修复和肠道健康具有重要意义[28]。Gong等[29]发现枯草芽孢杆菌通过上调闭合蛋白-1(claudin-1)、Ocln、连接黏附分子-A(JAM-A)和ZO-1等紧密连接蛋白的表达改善小鼠肠道屏障功能,减少肠道上皮损伤,减轻DSS诱导的结肠炎。枯草芽孢杆菌HB3通过促进紧密连接蛋白表达从而改善猪上皮屏障功能[30]。本研究发现,乳鼠连续14 d灌胃枯草芽孢杆菌RZ001提高了小肠中ZO-1、Ocln、Cldn-3的mRNA相对表达量,表明枯草芽孢杆菌RZ001能在早期提高乳鼠小肠紧密连接的形成以及改善肠屏障功能。这些结果表明,枯草芽孢杆菌RZ001能够促进肠屏障功能的成熟。
3.3 枯草芽孢杆菌RZ001对乳鼠Wnt信号通路介导的上皮细胞生长分化的影响典型Wnt/β-catenin信号通路对肠隐窝基底部ISCs的存活和维持具有重要意义。肠道隐窝的分裂是由Wnt信号介导的,用Wnt激动剂局部治疗可促进肠道生长。Wnt3是一种经典的Wnt信号配体,与受体Fzd7和共受体Lrp5/6结合,阻止β-catenin在细胞质中的降解,从而积聚并转运到细胞核[31]。随后,靶基因Lgr5、C-myc、Axin2和Atoh1被转录激活[32]。本研究证实,乳鼠连续14 d灌胃枯草芽孢杆菌RZ001显著上调了乳鼠小肠Wnt3、Fzd7、Lrp5、Gsk-3β、Ctnnb1、C-myc、Axin2和Atoh1的mRNA相对表达量。此外,枯草芽孢杆菌RZ001也能够增加小肠β-catenin的蛋白相对表达量。这些结果表明,枯草芽孢杆菌RZ001可能通过激活Wnt信号通路促进肠道发育,且Lrp5可能是一个必需的共受体。近年来,一些学者报道了其他益生菌对肠道发育和ISCs生长分化的影响。新生小鼠体内鼠李糖杆菌GG(LGG)定植促进肠上皮细胞增殖和分化[33]。乳杆菌D8通过加速ISCs再生从而保护肠黏膜的完整性,改善DSS诱导的肠黏膜损伤[34]。双歧杆菌和乳酸杆菌促进ISCs的增殖以及肠上皮细胞的再生[9]。而枯草芽孢杆菌是否能影响肠道干细胞的生长分化,是否能激活Wnt信号通路目前尚未见相关报道。在本研究中,乳鼠连续14 d灌胃枯草芽孢杆菌RZ001可增加小肠组织中ISCs标记物Lgr5和Ki67的mRNA相对表达量,暗示其促进新生小鼠肠道发育、肠道屏障成熟和细胞增殖的作用可能是通过激活Wnt信号通路进而促进ISCs介导的上皮细胞生长分化而实现的。
3.4 枯草芽孢杆菌RZ001对乳鼠肠道菌群的影响肠道微生物的早期定植是维持和调节肠道屏障功能的必要条件[35]。肠道共生菌群通过促进上皮细胞增殖以及改善肠上皮完整性参与屏障功能的维持[36]。本研究发现,乳鼠连续14 d灌胃枯草芽孢杆菌RZ001能够增加乳鼠盲肠中拟杆菌门、乳杆菌属和双歧杆菌属的相对丰度,降低厚壁菌门、大肠杆菌和产气荚膜梭菌的相对丰度。与本研究结果相似,Yang等[37]研究发现补充枯草芽孢杆菌KT260179显著增加了昆明小鼠盲肠中有益细菌乳酸杆菌和双歧杆菌的数量,而显著减少了条件致病菌大肠杆菌的数量。枯草芽孢杆菌18可以增加小鼠肠道中乳酸杆菌的数量[7]。已有报道证实乳酸杆菌和双歧杆菌产生的乳酸可以通过激活Paneth和肠基质细胞中的Wnt/β-catenin信号通路促进ISCs介导的上皮细胞的发育[34]。而枯草芽孢杆菌RZ001可以增加乳酸产生菌的相对丰度,这可能是其发挥作用的主要原因。因此,枯草芽孢杆菌RZ001可能通过增加乳酸产生菌在肠道内的早期定植,促进ISCs介导的肠上皮发育和成熟。
4 结论早期应用枯草芽孢杆菌RZ001能够促进乳鼠生长,改善肠道形态,促进肠道屏障功能成熟,从而促进早期肠道发育。早期应用枯草芽孢杆菌RZ001还能够激活乳鼠的Wnt信号通路,降低肠道致病菌产气荚膜梭菌的相对丰度,增加肠道益生菌双歧杆菌属的相对丰度。
致谢:
感谢天津蓝海兰母婴家政服务有限公司开发区分公司提供的新生儿粪便样本。
| [1] |
班博, 戴维, 田科雄. 枯草芽孢杆菌的生理功能及其在动物生产中的应用[J]. 湖南饲料, 2020(2): 42-45. BAN B, DAI W, TIAN K X. Physiological function of Bacillus subtilis and its application in animal production[J]. Hunan Feed, 2020(2): 42-45 (in Chinese). |
| [2] |
朱瑾, 朱红军. 枯草芽孢杆菌的作用机制及其在动物生产中的应用[J]. 粮食与饲料工业, 2019(8): 47-51. ZHU J, ZHU H J. Mechanism of Bacillus subtilis and its application in animal production[J]. Cereal & Feed Industry, 2019(8): 47-51 (in Chinese). |
| [3] |
肖莎莎, 王燕. 动物肠道细菌定植规律研究进展[J]. 家畜生态学报, 2019, 40(9): 1-8. XIAO S S, WANG Y. Research progress on colonization of intestinal bacteria in animals[J]. Acta Ecologiae Animals Domastici, 2019, 40(9): 1-8 (in Chinese). |
| [4] |
黄玉岚, 霍小东, 姚宏明, 等.枯草芽孢杆菌WEI-62体外益生评价及其对仔猪生长性能、肠道形态和肠道菌群的影响[J/OL].中国畜牧杂志, [2020-06-21].https://doi.org/10.19556/j.0258-7033.20191216-04. HUANG Y L, HUO X D, YAO H M, et al.In vitro probiotic evaluation of Bacillus subtilis WEI-62 and its effects on growth performance, intestinal morphology and intestinal microflora of piglets[J]. Chinese Journal of Animal Science, [2020-06-21]. https://doi.org/10.19556/j.0258-7033.20191216-04.(in Chinese) |
| [5] |
HU L, PENG X, CHEN H, et al. Effects of intrauterine growth retardation and Bacillus subtilis PB6 supplementation on growth performance, intestinal development and immune function of piglets during the suckling period[J]. European Journal of Nutrition, 2017, 56(4): 1753-1765. DOI:10.1007/s00394-016-1223-z |
| [6] |
MA Y B, WANG W W, ZHANG H J, et al. Supplemental Bacillus subtilis DSM 32315 manipulates intestinal structure and microbial composition in broiler chickens[J]. Scientific Reports, 2018, 8(1): 12358. DOI:10.1038/s41598-018-29899-1 |
| [7] |
LI A Y, JIANG X, WANG Y P, et al. The impact of Bacillus subtilis 18 isolated from Tibetan yaks on growth performance and gut microbial community in mice[J]. Microbial Pathogenesis, 2019, 128: 153-161. DOI:10.1016/j.micpath.2018.12.031 |
| [8] |
PINTO D, GREGORIEFF A, BEGTHEL H, et al. Canonical Wnt signals are essential for homeostasis of the intestinal epithelium[J]. Genes & Develpoment, 2003, 17(14): 1709-1713. |
| [9] |
LEE Y S, KIM T Y, KIM Y, et al. Microbiota-derived lactate accelerates intestinal stem-cell-mediated epithelial development[J]. Cell Host & Microbe, 2018, 24(6): 833-846. |
| [10] |
LI Y R, ZHANG T X, GUO C C, et al. Bacillus subtilis RZ001 improves intestinal integrity and alleviates colitis by inhibiting the Notch signalling pathway and activating ATOH-1[J]. Pathogens and Disease, 2020, 78(2): ftaa016. DOI:10.1093/femspd/ftaa016 |
| [11] |
FUHRE A, SPRENGER N, KURAKEVICH E, et al. Milk sialyllactose influences colitis in mice through selective intestinal bacterial colonization[J]. Journal of Experimental Medicine, 2010, 207(13): 2843-2854. DOI:10.1084/jem.20101098 |
| [12] |
KANG M, MISCHEL R A, BHAVE S, et al. The effect of gut microbiome on tolerance to morphine mediated antinociception in mice[J]. Scientific Reports, 2017, 7: 42658. DOI:10.1038/srep42658 |
| [13] |
STEED H, MACFARLANE G T, BLACKETT K L, et al. Bacterial translocation in cirrhosis is not caused by an abnormal small bowel gut microbiota[J]. FEMS Immunology and Medical Microbiology, 2011, 63(3): 346-354. DOI:10.1111/j.1574-695X.2011.00857.x |
| [14] |
YANG L N, BIAN G R, SU Y, et al. Comparison of faecal microbial community of lantang, bama, erhualian, meishan, xiaomeishan, duroc, landrace, and yorkshire sows[J]. Asian-Australasian Journal of Animal Sciences, 2014, 27(6): 898-906. DOI:10.5713/ajas.2013.13621 |
| [15] |
邢帅兵, 陈代文, 余冰, 等. 枯草芽孢杆菌对断奶仔猪生长性能和肠道形态、黏膜免疫及菌群数量的影响[J]. 动物营养学报, 2020, 32(5): 2066-2073. XING S B, CHEN D W, YU B, et al. Effects of Bacillus subtilis on growth performance, intestinal morphology, mucosal immune and microflora number of weaned piglets[J]. Chinese Journal of Animal Nutrition, 2020, 32(5): 2066-2073 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.05.015 |
| [16] |
HONG H A, DUC L H, CUTTING S M. The use of bacterial spore formers as probiotics[J]. FEMS Microbiology Reviews, 2005, 29(4): 813-835. DOI:10.1016/j.femsre.2004.12.001 |
| [17] |
BRANDA S S, GONZÁLEZ-PASTOR J E, BEN-YEHUDA S, et al. Fruiting body formation by Bacillus subtilis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(20): 11621-11626. DOI:10.1073/pnas.191384198 |
| [18] |
HU Y L, DUN Y H, LI S N, et al. Effects of Bacillus subtilis KN-42 on growth performance, diarrhea and faecal bacterial flora of weaned piglets[J]. Asian-Australasian Journal of Animal Sciences, 2014, 27(8): 1131-1140. DOI:10.5713/ajas.2013.13737 |
| [19] |
ROLFE R D. The role of probiotic cultures in the control of gastrointestinal health[J]. The Journal of Nutrition, 2000, 130(2S Suppl.): 396S-402S. |
| [20] |
邓军, 李云锋, 杨倩. 枯草芽孢杆菌和猪源乳酸杆菌混合饲喂对仔猪肠绒毛发育的影响[J]. 畜牧兽医学报, 2013, 44(2): 295-301. DENG J, LI Y F, YANG Q, et al. Effects of co-administration of Bacillus subtilis and procine Lactobacillus salivarius on intestinal villus of piglet[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(2): 295-301 (in Chinese). |
| [21] |
钟光, 王强, 沈一茹, 等. 枯草芽孢杆菌对肉鸡生长性能、抗氧化功能和肠道形态的影响[J]. 动物营养学报, 2020, 32(4): 1675-1683. ZHONG G, WANG Q, WANG Y R, et al. Effects of Bacillus subtilis on growth performance, antioxidant function and intestinal morphology of broilers[J]. Chinese Journal of Animal Nutrition, 2020, 32(4): 1675-1683 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.04.026 |
| [22] |
聂烁, 闻正顺. 肠道黏蛋白2的分泌、结构、合成调控及其在肠道疾病发生发展中的作用[J]. 动物营养学报, 2020, 32(6): 2521-2532. NIE S, WEN D S. Secretion, structure, synthesis regulation of intestinal mucin 2 and its role in development of intestinal diseases[J]. Chinese Journal of Animal Nutrition, 2020, 32(6): 2521-2532 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.06.011 |
| [23] |
SHEN R L, THYMANN T, ØSTERGAARD M V, et al. Early gradual feeding with bovine colostrum improves gut function and NEC resistance relative to infant formula in preterm pigs[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2015, 309(5): G310-G323. DOI:10.1152/ajpgi.00163.2015 |
| [24] |
JOHANSSON M E V, GUSTAFSSON J K, HOLMEN-LARSSON J, et al. Bacteria penetrate the normally impenetrable inner colon mucus layer in both murine colitis models and patients with ulcerative colitis[J]. Gut, 2014, 63(2): 281-291. DOI:10.1136/gutjnl-2012-303207 |
| [25] |
ZHANG H L, LI W S, XU D N, et al. Mucosa-reparing and microbiota-balancing therapeutic effect of Bacillus subtilis alleviates dextrate sulfate sodium-induced ulcerative colitis in mice[J]. Experimental and Therapeutic Medicine, 2016, 12(4): 2554-2562. DOI:10.3892/etm.2016.3686 |
| [26] |
ALIAKBARPOUR H R, CHAMANI M, RAHIMI G, et al. The Bacillus subtilis and lactic acid bacteria probiotics influences intestinal mucin gene expression, histomorphology and growth performance in broilers[J]. Asian-Australasian Journal of Animal Sciences, 2012, 25(9): 1285-1293. DOI:10.5713/ajas.2012.12110 |
| [27] |
GADDE U D, OH S, LEE Y, et al. Dietary Bacillus subtilis-based direct-fed microbials alleviate LPS-induced intestinal immunological stress and improve intestinal barrier gene expression in commercial broiler chickens[J]. Research in Veterinary Science, 2017, 114: 236-243. DOI:10.1016/j.rvsc.2017.05.004 |
| [28] |
GONZÁLEZ-MARISCAL L, BETANZOS A, NAVA P, et al. Tight junction proteins[J]. Progress in Biophysics and Molecular Biology, 2003, 81(1): 1-44. DOI:10.1016/S0079-6107(02)00037-8 |
| [29] |
GONG Y, LI H, LI Y. Effects of Bacillus subtilis on epithelial tight junctions of mice with inflammatory bowel disease[J]. Journal of Interferon & Cytokine Research, 2016, 36(2): 75-85. |
| [30] |
GU M J, SONG S K, PARK S M, et al. Bacillus subtilis protects porcine intestinal barrier from deoxynivalenol via improved zonula occludens-1 expression[J]. Asian-Australasian Journal of Animal Sciences, 2014, 27(4): 580-586. DOI:10.5713/ajas.2013.13744 |
| [31] |
VALENTA T, DEGIRMENCI B, MOOR A E, et al. Wnt ligands secreted by subepithelial mesenchymal cells are essential for the survival of intestinal stem cells and gut homeostasis[J]. Cell Reports, 2016, 15(5): 911-918. DOI:10.1016/j.celrep.2016.03.088 |
| [32] |
SHI F X, CHENG Y F, WANG X L, et al. β-catenin up-regulates Atoh1 expression in neural progenitor cells by interaction with an Atoh1 3' enhancer[J]. Journal of Biological Chemistry, 2010, 285(1): 392-400. DOI:10.1074/jbc.M109.059055 |
| [33] |
YAN F, LIU L, CAO H, et al. Neonatal colonization of mice with LGG promotes intestinal development and decreases susceptibility to colitis in adulthood[J]. Mucosal Immunology, 2017, 10(1): 117-127. DOI:10.1038/mi.2016.43 |
| [34] |
HOU Q H, YE L L, LIU H F, et al. Lactobacillus accelerates ISCs regeneration to protect the integrity of intestinal mucosa through activation of STAT3 signaling pathway induced by LPLs secretion of IL-22[J]. Cell Death & Differentiation, 2018, 25(9): 1657-1670. |
| [35] |
HUANG X Z, ZHU L B, LI Z R, et al. Bacterial colonization and intestinal mucosal barrier development[J]. World Journal of Clinical Pediatrics, 2013, 2(4): 46-53. DOI:10.5409/wjcp.v2.i4.46 |
| [36] |
SANGILD P T. Development of the mammalian gastrointestinal tract, the resident microbiota, and the role of diet in early life[J]. Journal of Animal Science, 2011, 89(5): 1506-1519. DOI:10.2527/jas.2010-3705 |
| [37] |
YANG J J, XU Y Y, KUN Q, et al. Effects of chromium-enriched Bacillus subtilis KT260179 supplementation on growth performance, caecal microbiology, tissue chromium level, insulin receptor expression and plasma biochemical profile of mice under heat stress[J]. British Journal of Nutrition, 2016, 115(5): 774-781. DOI:10.1017/S0007114515005127 |




