2. 成都大帝汉克生物科技有限公司, 成都 611130;
3. 河南银发牧业有限公司, 郑州 451100
2. Chengdu Dadhank Biotechnology Co., Ltd., Chengdu 611130, China;
3. Henan Yinfa Animal Husbandry Co., Ltd., Zhengzhou 451100, China
我国是世界第一猪肉生产国和消费国,但我国养猪业整体水平明显低于欧美等养猪业发达国家[1]。以每头母猪每年提供的断奶仔猪数(PSY)为例,欧美国家在2012年已达到25头,丹麦甚至达到了30头,而我国规模化养猪场在2018年才达到24头[2]。因此,通过品种改良、营养调控和加强饲养管理等手段提高母猪的繁殖性能及其子代健康水平就显得尤为重要。
动物的胃肠道中栖息着大量的微生物,它们对宿主的养分利用和生理代谢都有重要的调节作用[3-4]。同时,肠道微生物会受到宿主遗传背景、生理状态、营养、疾病、药物的使用和生活环境等诸多因素的影响[4]。肠道微生物与母猪的繁殖性能密切相关,Shao等[5]研究了母猪的繁殖性能与肠道微生物的关系后发现,与低产仔数(窝仔数≤7头)母猪相比,高产仔数(窝仔数≥15头)母猪在妊娠后期肠道微生物多样性较低,普雷沃氏菌属相对丰度较高,瘤胃球菌属相对丰度较低,但在泌乳早期肠道微生物的多样性较高,瘤胃球菌属相对丰度增加。除影响繁殖性能外,母猪肠道微生物还会影响仔猪的生长发育和健康。Cao等[6]研究表明,在母猪妊娠后期和泌乳期饲粮中添加0.2%的丁酸梭菌,妊娠后期母猪肠道中拟杆菌门相对丰度升高,变形菌门的相对丰度下降,且提高了泌乳期母猪及仔猪的抗氧化水平及仔猪的生长性能。Li等[7]研究了母猪饲粮中纤维成分对妊娠母猪及其仔猪的影响,发现饲粮中不可溶解纤维与可溶解纤维的比例下降,母猪妊娠后期肠道中软壁菌门的相对丰度增加,变形菌门的相对丰度减少,母猪及其仔猪抗氧化水平和抗炎能力提高。母猪的肠道微生物是如何影响仔猪生长发育的尚不清楚,李浩等[8]推测这可能是由于妊娠期和泌乳期母体肠道微生物通过胎盘、产道和乳汁进入子代肠道定植,从而直接或间接影响子代生长发育。这些研究提示,妊娠期与泌乳期母猪的肠道微生物可能是影响母猪繁殖性能及仔猪生长发育的重要因素。因此,深入了解妊娠期与泌乳期母猪肠道微生物的组成及变化情况,有利于通过优化肠道微生物组成提高母猪繁殖性能。
Koren等[9]的临床研究表明,从妊娠前期至妊娠后期,妇女肠道微生物的多样性下降,变形菌门和放线菌门的相对丰度升高,而且这种现象会持续到分娩后1个月。Kong等[10]在环江香猪上的研究发现,从妊娠前期至妊娠后期,母猪肠道微生物多样性明显下降,但变形菌门和放线菌门的相对丰度随着妊娠的进程而降低。Cheng等[11]发现,从妊娠后期到泌乳前期,长白母猪肠道微生物多样性下降,变形菌门和梭杆菌门的相对丰度增加,产丁酸菌属的相对丰度下降。然而,Ji等[12]研究表明,从妊娠前期至泌乳期,二元(大白×长白)母猪肠道微生物多样性上升,拟杆菌门、脱硫弧菌属和普雷沃氏菌属的数量先增加后降低。造成这些研究结果并不一致的确切原因并不清楚,可能与研究对象选取、遗传背景、妊娠或泌乳阶段生理状况的差异及肠道微生物的动态变化等因素有关。本试验以大白母猪为研究对象,通过高通量测序技术,研究妊娠后期和泌乳期母猪肠道微生物的多样性及变化规律,为通过调控肠道微生物改善母猪繁殖性能提供基础数据。
1 材料与方法 1.1 试验设计与饲养管理选取6头健康、背膘厚与分娩日期相近的第2胎次大白母猪。试验于妊娠期第90天开始,至产后第25天结束。妊娠期第90~107天饲喂妊娠期饲粮,妊娠期第108天至产后第25天饲喂泌乳期饲粮,饲粮参照NRC(2012)猪营养需要量配制,其组成及营养水平见表 1。
|
|
表 1 母猪妊娠期和泌乳期饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of diets for sows in gestation and lactation periods (as-fed basis) |
饲养试验在河南银发牧业众品养猪场进行。母猪妊娠期第90~107天,每天分别在06:00和14:00投料,每天饲喂2.8 kg妊娠期饲粮。预产期前1周将母猪转入彻底消毒的产仔舍,更换泌乳期饲粮,分娩前每天饲喂2.8 kg。舍内保持清洁干燥,通风良好,舍内温度保持在25 ℃左右,全程自由饮水。临产前用0.1%的高锰酸钾水溶液将其外阴和乳房清洗消毒。分娩当天不喂料,分娩后第2天饲喂2.0 kg,以后每天增加0.5 kg,至产后第7天让母猪自由采食。自由采食阶段每天分别在06:00、12:00和18:00投料,自由采食时期保持食槽内饲粮略有剩余。
1.2 样品采集每头母猪分别于妊娠期第93天(G93)和第100天(G100)以及泌乳期第14天(L14)及第21天(L21)采集新鲜未被污染的直肠粪样,-20 ℃冻存,然后转到-80 ℃冻存备用,用于微生物区系的分析。
1.3 微生物DNA提取、测序及数据分析母猪直肠粪样微生物DNA使用粪便DNA提取试剂盒(QIAamp Fast DNA Stool Mini Kit)进行提取。使用引物341F(5′-CCTACGGGRSGCAGCAG-3′)和806R(5′-GGACTACVVGGGTATCTAATC-3′),扩增细菌核糖体RNA基因的V3~V4区,得到500 bp左右的扩增片段。PCR反应条件为:95 ℃预变性3 min;98 ℃变性20 s,58 ℃退火15 s,72 ℃延伸20 s,执行30个循环;最后72 ℃维持5 min。PCR反应体系为:2×KAPA Library Amplification ReadyMix 15 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA为50 ng,加双蒸水(ddH2O)补齐30 μL。
PCR扩增产物使用2%琼脂糖凝胶电泳检测,再使用AxyPrep DNA凝胶提取试剂盒(Axygen Biosciences,美国)切胶回收。用扩增片段构建文库,文库质检合格后,采用HiSeq平台PE250策略(Illumina,美国)进行测序。测序服务由上海锐翌生物科技有限公司完成。使用UPARSE根据97%相似度进行操作分类单元(operational taxonomic unit, OTU)聚类,并使用Userach鉴定和移除嵌合体序列。每个OTU都有1个代表性的序列,使用RDP数据库,置信度阈值设置为0.8,利用RDP Classifer将每个代表性序列进行物种注释。OTU profiling table以及alpha和beta多样性分析通过Qiime的python脚本实现。
1.4 数据统计分析首先检验数据是否符合正态分布,符合正态分布再进行单因素方差分析(one-way ANOVA),多重比较使用Tukey法检验。对于alpha多样性和微生物的相对丰度数据进行非参数检验中的Kruskal-Wallis检验。数据分析使用SPSS 20.0统计软件。数据用平均值和均值标准误(SEM)表示,P < 0.05为差异显著。
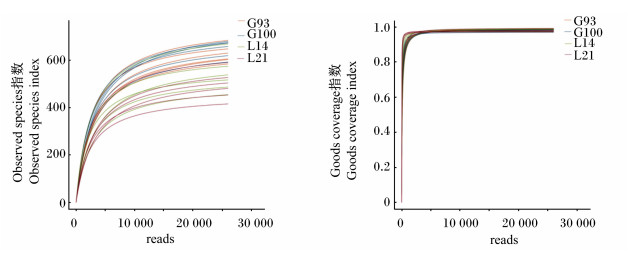
2 结果 2.1 测序质量及OTU分析6头母猪在4个时间点共采集了24份直肠粪样,通过Illumina Hiseq平台进行Paired-End测序,得到平均长度为416 bp左右的有效序列875 732条,平均每个样品有效序列36 488.83条。Observed species指数的稀释曲线在测到15 000条序列时已基本达到平台期(图 1-A),Goods coverage指数的稀释曲线已经到平台期(图 1-B),说明测序深度足够,可以反映样品中绝大多数微生物的信息。利用UPARSE根据97%相似度进行OTU聚类,并使用Userach鉴定和移除嵌合体序列得到1 298个OTU,分别有1 181和429个OTU可以注释到门和属水平。由表 2可知,4个时间点所测得的有效序列数差异不显著(P>0.05)。妊娠后期(G93和G100)的OTU数显著高于泌乳期(L14和L21)的OTU数(P < 0.05),但G93和G100、L14和L21之间的OTU数无显著差异(P>0.05)。
|
图 1 Observed species指数(A)和Goods coverage指数(B)的稀释曲线 Fig. 1 Rarefaction curves of Observed species (A) and Goods coverage indexes (B) |
|
|
表 2 母猪粪便微生物alpha多样性分析 Table 2 Alpha diversity analysis of sow's fecal microbiota |
由表 2可知Chao1、Observed species、Shannon和Simpson指数在G93、G100和L14时无显著差异(P>0.05);Chao1、Observed species、Shannon和Simpson指数在L14和L21时也无显著差异(P>0.05);但与G100时相比,Chao1、Observed species、Shannon指数在L21时显著下降(P < 0.05)。就Shannon指数而言,L21时显著低于G93和G100时(P < 0.05),L21时与L14时无显著差异(P>0.05)。与G93时相比,L21时Simpson指数显著降低(P < 0.05)。由上述结果可知,与妊娠后期(G93和G100)相比,泌乳期(L14和L21)的alpha多样性减小。
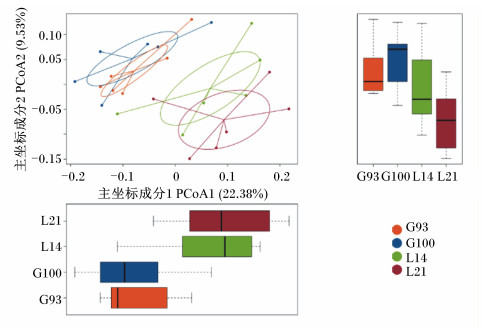
2.3 beta多样性分析主坐标分析结果见图 2。通过图中的样品点的距离来判断个体或群体间的差异,样品点距离越远说明样品间微生物群落组成差异越大,距离越近说明样品间微生物群落组成越相似。G93和G100时的微生物群落组成相似,L14和L21时的微生物群落组成相似,但妊娠后期(G93和G100)和泌乳期(L14和L21)的微生物群落组成差异较大。
|
图 2 母猪粪便微生物的主坐标分析图 Fig. 2 Principal co-ordinates analysis (PCoA) plot of sow's fecal microbiota |
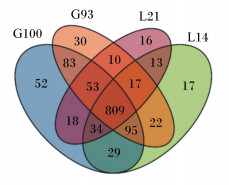
Venn图可以反映样本组间共有和特有的OTU数,从而直观地反映样本组间微生物群落的相似程度。从图 3可知,4个时间点的直肠粪样中共有微生物OTU 809个,占微生物OTU总数的62.33%,809个共有OTU分别注释到13个门和69个属。而G93、G100、L14和L21还各有30、52、17和16个特有的OTU。G93和G100间共有OTU 1 040个,G100和L14间共有OTU 967个,L14和L21间共有OTU 873个。
|
图 3 母猪粪便微生物Venn图 Fig. 3 Venn diagram of sow's fecal bacteria |
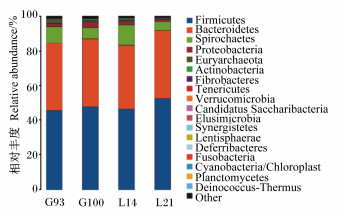
如图 4所示,各个时间点的直肠粪样微生物可以注释到18个菌门,排名前10的菌门见表 3,其中优势菌门为厚壁菌门(相对丰度为45.72%~52.55%)、拟杆菌门(相对丰度为36.80%~39.19%)和螺旋菌门(相对丰度为5.04%~11.70%),以上3个菌门的菌数占各时间点总菌数的93.20%以上。广古菌门的相对丰度在G93、G100和L14时差异不显著(P>0.05),但G93时的相对丰度显著高于L21时(P < 0.05)。其余菌门在各时间点的相对丰度无显著差异(P>0.05)。
|
Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Spirochaetes:螺旋菌门;Proteobacteria:变形菌门;Euryarchaeota:广古菌门;Actinobacteria:放线菌门;Fibrobacteres:纤维杆菌门;Tenericutes:软壁菌门;Verrucomicrobia:疣微菌门;Elusimicrobia:迷踪菌门;Synergistetes:互养菌门;Lentisphaerae:黏胶球形菌门;Deferribacteres:脱铁杆菌门;Fusobacteria:梭杆菌门;Cyanobacteria/Chloroplast:蓝细菌门/叶绿体;Planctomycetes:浮霉菌门;Deinococcus-Thermus:异常球菌-栖热菌门;Other:其他。 图 4 母猪粪便微生物在门水平上的组成及相对丰度 Fig. 4 Composition and relative abundance of sow's fecal microbiota at phylum level |
|
|
表 3 母猪粪便微生物中排名前10的菌门的相对丰度 Table 3 Relative abundance of the top 10 dominant phyla in sow's fecal microbiota |
相对丰度排名前10的菌属见表 4。普雷沃氏菌属、乳酸菌属和密螺旋体属是母猪直肠粪样中相对丰度较高的菌属,在各时间点分别占菌群总数的11.37%~17.39%、1.64%~22.21%和4.06%~10.75%。乳酸菌属的相对丰度在L21时显著高于G93时(P < 0.05)。梭状芽胞杆菌属ⅩⅣa的相对丰度在G93时显著高于L14和L21时(P < 0.05),但在G100、L14和L21之间无显著差异(P>0.05)。其余菌属在各时间点的相对丰度无显著差异(P>0.05)。
|
|
表 4 母猪粪便微生物中排名前10的菌属的相对丰度 Table 4 Relative abundance of the top 10 dominant genera in sow's fecal microbiota |
Illumina高通量测序技术是研究微生物群落的稳定性、多样性以及微生物与宿主之间相互关系的常用技术手段[9, 13-14]。本试验通过高通量测序技术,总共得到有效序列875 732条,平均每个样品有效序列36 488.83条,测序深度均大于99.39%,说明测序结果对母猪粪便样品中的微生物覆盖率高,可满足微生物多样性的分析需求。关于微生物多样性,本研究中,从妊娠后期到泌乳期大白母猪直肠粪样微生物alpha多样性下降。Leblois等[15]分析了妊娠期第106天和产后第15天的长白母猪粪便微生物后发现,产后母猪粪便微生物的alpha多样性降低,本试验结果与其一致。Liu等[16]的研究也发现从妊娠期到泌乳期长白母猪粪便微生物的alpha多样性有下降趋势,但在相同条件下,荣昌母猪的粪便微生物alpha多样性却不受妊娠期和泌乳期的影响。由于肠道微生物会受到宿主遗传背景和生理状态等诸多因素的影响[4],所以上述研究中母猪微生物alpha多样性变化不一致,可能是母猪遗传背景不同所致。
猪肠道微生物不仅影响着营养物质的消化、吸收与代谢,还影响着宿主的生理状态及疾病的发生和发展[17]。尽管肠道中微生物数量和种类繁多,但有研究表明仔猪、生长猪、育肥猪及母猪的肠道微生物中厚壁菌门和拟杆菌门为优势菌门[13-14, 18-20]。本试验中,妊娠后期及泌乳期母猪肠道微生物中的优势菌门均为厚壁菌门和拟杆菌门,与前人的研究结果一致。厚壁菌门和拟杆菌门参与碳水化合物的降解与发酵,在大肠中发酵的产物为短链脂肪酸[21]。有研究表明,短链脂肪酸可为机体提供10%~15%的能量[17],说明厚壁菌门和拟杆菌门在宿主能量代谢中发挥着重要作用。本试验中,从妊娠后期到泌乳期,大白母猪肠道微生物中广古菌门的相对丰度降低,这与Leblois等[15]的研究结果相似,但广古菌门的相对丰度与母猪生理阶段的关系还有待研究。姬玉娇等[22]研究表明,与饲喂低营养水平饲粮(消化能=12.24 MJ/kg,粗蛋白质含量=9.77%)相比,饲喂高营养水平饲粮(消化能=14.73 MJ/kg,粗蛋白质含量=13.11%)会减少猪肠道中广古菌门的相对丰度。本试验中,大白母猪肠道微生物中广古菌门的相对丰度在泌乳期低于妊娠后期,这可能是由于泌乳期饲粮营养水平高于妊娠期饲粮所致。这提示我们,饲粮在肠道微生物组成变化中可能发挥着重要作用。
Huang等[23]发现妊娠期及泌乳早期母猪肠道优势菌属为乳酸菌属和普雷沃氏菌属,Ji等[12]发现妊娠期及泌乳期母猪肠道的优势菌属为普雷沃氏菌属。本试验中,妊娠后期和泌乳期的母猪肠道优势菌属为普雷沃氏菌属和乳酸菌属,与前人的研究一致。普雷沃氏菌属细菌可以降解纤维类多糖,如纤维素和木质素,发酵产生乙酸和丙酸[24],乙酸和丙酸可被转运至肝脏分别参与脂肪和葡萄糖的合成[25]。前人的研究表明从妊娠期到泌乳期母猪肠道中乳酸菌属的相对丰度增加[15, 23],本试验中从妊娠期第93天到泌乳期第21天,乳酸菌属的相对丰度显著提升,与前人结果相同。乳酸菌属细菌可以提高母猪健康水平和繁殖性能[26],还可以提高仔猪健康水平和生长性能,抑制病原菌和降低腹泻率[27-28]。这提示泌乳期乳酸菌属的相对丰度提高有利于提高母猪及其仔猪的健康水平和生产性能。在妊娠后期母体会经历免疫和代谢状态的变化[29],而且这种变化还可能引起肠道菌群失衡。梭状芽孢杆菌属Ⅹ Ⅳa属于条件性致病菌[30],本试验发现泌乳期母猪直肠粪样中梭状芽孢杆菌属Ⅹ Ⅳa的相对丰度从妊娠后期到泌乳期呈下降趋势,这种变化有利于母猪恢复健康进入下一个繁殖周期。
综上所述,从妊娠后期到泌乳期母猪肠道微生物多样性下降,梭状芽孢杆菌属Ⅹ Ⅳa的相对丰度下降,乳酸菌属的相对丰度增加,但优势菌群相对稳定,这种变化可能有利于母猪及其子代健康。
4 结论① 与妊娠后期相比,泌乳期母猪肠道微生物多样性下降。
② 妊娠后期与泌乳期母猪的肠道优势菌门为厚壁菌门、拟杆菌门和螺旋菌门,其组成相对稳定;优势菌属为普雷沃氏菌属、乳酸菌属和密螺旋菌属。
| [1] |
孔祥峰, 刘雅婷. 母猪肠道微生态与繁殖生理研究进展[J]. 猪业科学, 2020, 37(5): 64-66. KONG X, LIU Y. Research progress on intestinal microecology and reproductive physiology of sows[J]. Swine Industry Science, 2020, 37(5): 64-66. |
| [2] |
高开国, 王丽, 胡胜兰, 等. 我国规模化猪场母猪繁殖性能的调查分析[J]. 中国畜牧杂志, 2019, 55(9): 155-157. GAO K, WANG L, HU S, et al. Survey and analysis on reproductive performance of sows in large scale pig farms in China[J]. Chinese Journal of Animal Science, 2019, 55(9): 155-157 (in Chinese). |
| [3] |
SOMMER F, BÄCKHED F. The gut microbiota-masters of host development and physiology[J]. Nature Reviews Microbiology, 2013, 11(4): 227-238. DOI:10.1038/nrmicro2974 |
| [4] |
NICHOLSON J K, HOLMES E, KINROSS J, et al. Host-gut microbiota metabolic interactions[J]. Science, 2012, 336(6086): 1262-1267. DOI:10.1126/science.1223813 |
| [5] |
SHAO Y R, ZHOU J, XIONG X, et al. Differences in gut microbial and serum biochemical indices between sows with different productive capacities during perinatal period[J]. Frontiers in Microbiology, 2019, 10: 3047. |
| [6] |
CAO M, LI Y, WU Q J, et al. Effects of dietary Clostridium butyricum addition to sows in late gestation and lactation on reproductive performance and intestinal microbiota[J]. Journal of Animal Science, 2019, 97(8): 3426-3439. DOI:10.1093/jas/skz186 |
| [7] |
LI Y, LIU H Y, ZHANG L J, et al. Maternal dietary fiber composition during gestation induces changes in offspring antioxidative capacity, inflammatory response, and gut microbiota in a sow model[J]. International Journal of Molecular Sciences, 2019, 21(1): 31. DOI:10.3390/ijms21010031 |
| [8] |
李浩, 谷雪玲, 吕宏伟, 等. 仔猪肠道菌群的母源传递[J]. 动物营养学报, 2019, 31(9): 3983-3990. LI H, GU X, LYU H, et al. Maternal transmissionof intestinal microflora in piglets[J]. Chinese Journal of Animal Nutrition, 2019, 31(9): 3983-3990 (in Chinese). |
| [9] |
KOREN O, GOODRICH J K, CULLENDER T C, et al. Host remodeling of the gut microbiome and metabolic changes during pregnancy[J]. Cell, 2012, 150(3): 470-480. DOI:10.1016/j.cell.2012.07.008 |
| [10] |
KONG X F, JI Y J, LI H W, et al. Colonic luminal microbiota and bacterial metabolite composition in pregnant huanjiang mini-pigs:effects of food composition at different times of pregnancy[J]. Scientific Reports, 2016, 6: 37224. DOI:10.1038/srep37224 |
| [11] |
CHENG C S, WEI H K, YU H C, et al. Metabolic syndrome during perinatal period in sows and the link with gut microbiota and metabolites[J]. Frontiers in Microbiology, 2018, 9: 1989. DOI:10.3389/fmicb.2018.01989 |
| [12] |
JI Y J, LI H, XIE P F, et al. Stages of pregnancy and weaning influence the gut microbiota diversity and function in sows[J]. Journal of Applied Microbiology, 2019, 127(3): 867-879. DOI:10.1111/jam.14344 |
| [13] |
KIM J, NGUYEN S G, GUEVARRA R B, et al. Analysis of swine fecal microbiota at various growth stages[J]. Archives of Microbiology, 2015, 197(6): 753-759. DOI:10.1007/s00203-015-1108-1 |
| [14] |
WANG H, JI Y C, YIN C, et al. Differential analysis of gut microbiota correlated with oxidative stress in sows with high or low litter performance during lactation[J]. Frontiers in Microbiology, 2018, 9: 1665. DOI:10.3389/fmicb.2018.01665 |
| [15] |
LEBLOIS J, MASSART S, SOYEURT H, et al. Feeding sows resistant starch during gestation and lactation impacts their faecal microbiota and milk composition but shows limited effects on their progeny[J]. PLoS One, 2018, 13(7): e0199568. DOI:10.1371/journal.pone.0199568 |
| [16] |
LIU H B, HOU C L, LI N, et al. Microbial and metabolic alterations in gut microbiota of sows during pregnancy and lactation[J]. The FASEB Journal, 2019, 33(3): 4490-4501. DOI:10.1096/fj.201801221RR |
| [17] |
刘壮. 猪肠道微生物与机体营养代谢[J]. 饲料博览, 2017(8): 16-22. LIU Z. The pigs intestinal microbiota and host nutrition metabolism[J]. Feed Review, 2017(8): 16-22 (in Chinese). DOI:10.3969/j.issn.1001-0084.2017.08.005 |
| [18] |
CHEN L M, XU Y S, CHEN X Y, et al. The maturing development of gut microbiota in commercial piglets during the weaning transition[J]. Frontiers in Microbiology, 2017, 8: 1688. |
| [19] |
ZHAO J B, LIU P, HUANG C F, et al. Effect of wheat bran on apparent total tract digestibility, growth performance, fecal microbiota and their metabolites in growing pigs[J]. Animal Feed Science and Technology, 2018, 239: 14-26. |
| [20] |
LARIVIÈRE-GAUTHIER G, THIBODEAU A, LETELLIER A, et al. Reduction of Salmonella shedding by sows during gestation in relation to its fecal microbiome[J]. Frontiers in Microbiology, 2017, 8: 2219. |
| [21] |
DAHIYA D K, RENUKA, PUNIYA M, et al. Gut microbiota modulation and its relationship with obesity using prebiotic fibers and probiotics:A review[J]. Frontiers in Microbiology, 2017, 8: 563. |
| [22] |
姬玉娇, 祝倩, 耿梅梅, 等. 高、低营养水平饲粮对环江香猪结肠菌群结构及代谢物的影响[J]. 微生物学通报, 2016, 43(7): 1650-1659. JI Y, ZHU Q, GENG M, et al. Effect of diets with high- or low-level nutrient on colonic microbial community structure and metabolites in Huanjiang mini-pigs[J]. Microbiology China, 2016, 43(7): 1650-1659 (in Chinese). |
| [23] |
HUANG X C, GAO J, ZHAO Y Z, et al. Dramatic remodeling of the gut microbiome around parturition and its relationship with host serum metabolic changes in sows[J]. Frontiers in Microbiology, 2019, 10: 2123. |
| [24] |
WANG J W, QIN C F, HE T, et al. Alfalfa-containing diets alter luminal microbiota structure and short chain fatty acid sensing in the caecal mucosa of pigs[J]. Journal of Animal Science and Biotechnology, 2018, 9: 11. |
| [25] |
TREMAROLI V, BÄCKHED F. Functional interactions between the gut microbiota and host metabolism[J]. Nature, 2012, 489(7415): 242-249. |
| [26] |
WANG J, JI H F, HOU C L, et al. Effects of Lactobacillus johnsonii XS4 supplementation on reproductive performance, gut environment, and blood biochemical and immunological index in lactating sows[J]. Livestock Science, 2014, 164: 96-101. |
| [27] |
LIU H, ZHANG J, ZHANG S H, et al. Oral administration of Lactobacillus fermentum I5007 favors intestinal development and alters the intestinal microbiota in formula-fed piglets[J]. Journal of Agricultural and Food Chemistry, 2014, 62(4): 860-866. DOI:10.1021/jf403288r |
| [28] |
YANG J J, QIAN K, WANG C L, et al. Roles of probiotic lactobacilli inclusion in helping piglets establish healthy intestinal inter-environment for pathogen defense[J]. Probiotics and Antimicrobial Proteins, 2018, 10(2): 243-250. DOI:10.1007/s12602-017-9273-y |
| [29] |
NAIR R R, VERMA P, SINGH K. Immune-endocrine crosstalk during pregnancy[J]. General and Comparative Endocrinology, 2017, 242: 18-23. DOI:10.1016/j.ygcen.2016.03.003 |
| [30] |
ZHOU W T, YAN Y M, MI J, et al. Simulated digestion and fermentation in vitro by human gut microbiota of polysaccharides from bee collected pollen of chinese wolfberry[J]. Journal of Agricultural and Food Chemistry, 2018, 66(4): 898-907. DOI:10.1021/acs.jafc.7b05546 |




