2. 南京农业大学动物科学类国家级实验教学中心, 南京 210095
2. National Experimental Teaching Center for Animal Science, Nanjing Agricultural University, Nanjing 210095, China
三甲胺(trimethylamine,TMA)是反刍动物瘤胃中重要的微生物代谢中间产物,它主要来源于瘤胃细菌对饲料中的胆碱和甜菜碱等甲基化合物的降解[1-2]。胆碱和甜菜碱是反刍动物重要的营养成分[3-4],但饲粮中胆碱和甜菜碱易被瘤胃微生物降解成三甲胺,这不仅降低了饲料养分利用率,三甲胺在瘤胃中被甲烷菌转化成甲烷[5-6],还进一步增加了反刍动物甲烷排放量。甲烷是一种重要的温室气体,约占全球温室气体总排放量的14%[7]。因此,深入研究瘤胃中三甲胺的代谢具有重要意义。
目前已有多种三甲胺检测方法。苦味酸衍生法和福林酚结合法的测定结果易受其他胺(一甲胺和二甲胺)的影响[8-10]。高效液相色谱法检测三甲胺需要先衍生化,以促进化合物的分离和检测[11]。液相色谱-质谱联用(LS-MS)法是一种准确而灵敏的三甲胺测定方法[12-13],但LS-MS法的仪器价格昂贵且使用技术要求较高。因此,建立一种对仪器要求较低、操作步骤简单、快速、准确,且适用于检测瘤胃发酵液样品的三甲胺检测方法是必要的。
本试验优化了样品的预处理条件和气相色谱的分离程序,在色谱分析程序的设定上参考了大量文献[14-18],研究不同溶剂对制备标准曲线的影响,旨在建立一种适用于测定瘤胃体外发酵液中三甲胺浓度的气相色谱法。
1 材料与方法 1.1 瘤胃液供体动物选择3头装有永久性瘤胃瘘管的非泌乳荷斯坦奶牛作为瘤胃液的供体动物,平均体重为(748±59) kg。每天在08:00和17:00各饲喂1次,自由饮水。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
安捷伦7890A气相色谱仪(美国Agilent公司),氢火焰离子检测器(FID)。WEL-PEG20M(30 m×0.25 mm×0.5 μm)气相色谱柱;Thermo Scientific Sorvall Legend Micro 21R微量离心机(德国ThermoFisher公司)。
三甲胺盐酸盐(美国Sigma公司)纯度为98%;氢氧化钾(KOH)(国药集团化学试剂有限公司)为分析纯;水为超纯水(经检测不含三甲胺)。
1.3 试验方法 1.3.1 瘤胃体外发酵瘤胃体外发酵试验参照Menke等[19]的方法。于早晨饲喂前,通过瘤胃瘘管采集瘤胃液,在厌氧条件下,将瘤胃液经4层纱布过滤。将瘤胃液滤液和发酵缓冲液按照1 : 3的比例混合配制成发酵液,发酵缓冲液组成成分见表 2。每个发酵瓶(100 mL)分装60 mL发酵液,用橡胶塞和铝盖密封,并在39 ℃下发酵24 h。每个发酵瓶在分装发酵液之前,添加0.6 g稻秸(0.42 mm)作为发酵底物。试验分为2组,对照组(n=4)和试验组(n=4)。试验组每个发酵瓶中含有0.041 4 g三甲胺盐酸盐(即添加浓度约为0.69 mg/mL)。在发酵开始(0 h)和发酵结束(24 h)时分别采集2 mL发酵上清液,用于三甲胺浓度的检测。
|
|
表 2 发酵缓冲液组成成分 Table 2 Composition of fermentation buffer |
三甲胺标准溶液的制备:分别采用超纯水和无三甲胺背景值的发酵培养基(经15 000×g离心10 min)2种溶剂制备。三甲胺标准溶液设置8个浓度梯度,分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mg/mL。三甲胺标准溶液应现用现配。
KOH溶液制备:采用超纯水作为溶剂,设置6个浓度梯度,分别为6、8、10、12、15、20 mol/L。
1.3.3 气相色谱程序进样口温度220 ℃;检测器温度220 ℃;柱温箱采用程序升温,60 ℃,保持3 min,45 ℃/min升温至150 ℃,150 ℃保持2 min。总程序时间6.5 min。氢气流速40 mL/min,空气流速400 mL/min,氮气流速25 mL/min。色谱柱气体流速1 mL/min,分流比为30 : 1。
1.3.4 样品前处理取1.0 mL标准溶液或样品,15 000×g、4 ℃离心5 min[10]。取200 μL上清液,加入50 μL KOH溶液,混合均匀,充分碱化,将离子态三甲胺转化成分子态三甲胺[20]。混合液15 000×g、4 ℃离心2 min,上清液经0.22 μm水相滤器过滤,取1 μL滤液上机检测。
1.3.5 回收率、精确度和数据分析回收率:在2个已知三甲胺浓度的样品中分别加入0.1和0.6 mg/mL三甲胺标准溶液,每个浓度设置4个重复,测定回收率。
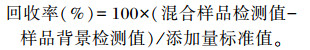
|
精确度:重复测量样品中三甲胺浓度6次,分析检测方法的可重复性和再现性。
1.4 统计方法使用SPSS 25.0软件中的单因素方差分析对数据进行统计分析,P < 0.05表示差异显著。
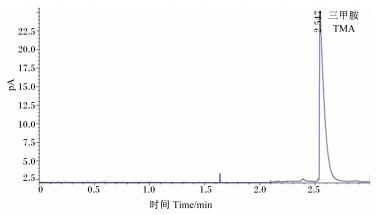
2 结果与分析 2.1 色谱条件的优化如图 1所示,三甲胺在2.55 min左右出峰,峰被很好地分离并形成尖锐对称峰。
|
图 1 三甲胺色谱图 Fig. 1 TMA chromatogram |
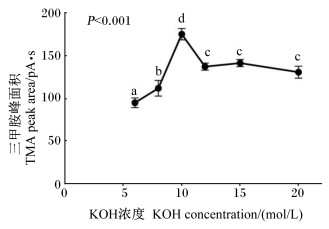
如图 2所示,在三甲胺标准溶液中分别添加6、8、10、12、15、20 mol/L KOH溶液进行处理,结果表明,KOH溶液对三甲胺峰面积影响显著(P < 0.05)。10 mol/L KOH溶液处理得到的三甲胺峰面积最大(174.67 pA·s),显著高于其他浓度KOH溶液(P < 0.05)。结果还显示,KOH溶液浓度过低或过高均会影响检测结果,因此针对不同的样品首先需要确定KOH溶液浓度,对样品进行恰当的预处理。
|
数据点标不同小写字母表示差异显著(P < 0.05),相同或无字母表示差异不显著(P>0.05)。 Date points with different small letters mean significant difference (P < 0.05), while with the same or no letters mean no significant difference (P>0.05). 图 2 不同浓度KOH溶液预处理得到的三甲胺峰面积 Fig. 2 TMA peak area pretreatment with different concentrations of KOH solutions |
如表 3所示,2种溶剂制备的三甲胺标准曲线均有良好的线性关系(R2=0.996、R2=0.993),且2种溶剂下的三甲胺出峰时间(保留时间)一致。根据信噪比(S/N)=3计算检测限,以超纯水为溶剂的三甲胺检测限为0.005 mg/mL,优于以发酵液为溶剂的检测限(0.010 mg/mL)。根据S/N=10计算定量限,以超纯水为溶剂的定量限为0.018 mg/mL,而以发酵液为溶剂的定量限为0.040 mg/mL。需要注意的是2个标准曲线回归方程差异很大。
|
|
表 3 不同溶剂制备的三甲胺标准曲线 Table 3 TMA standard curves prepared by different solvents |
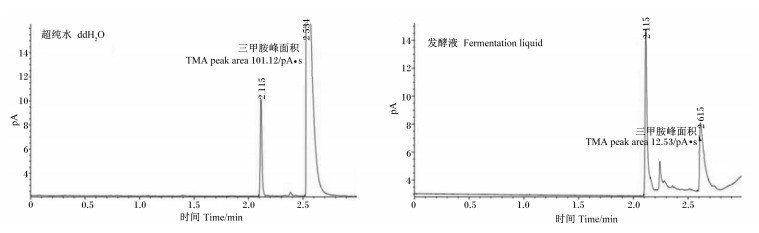
如图 3所示,0.1 mg/mL的三甲胺标准溶液以超纯水作为溶剂获得的峰面积为101.12 pA·s,而以发酵液为溶剂获得的峰面积为12.53 pA·s。可见溶剂对三甲胺检测结果影响非常大。
|
图 3 不同溶剂制备的三甲胺标准溶液色谱图 Fig. 3 Chromatograms of TMA standard solutions prepared by different solvents |
如表 4所示,对照组中未检测到三甲胺,说明对照组发酵液中三甲胺浓度低于本方法的检测限。试验组发酵初始时添加的三甲胺浓度为0.69 mg/mL,采用超纯水为溶剂制备的标准曲线方程,计算得到的三甲胺浓度为0.90 mg/mL;而以发酵液为溶剂制备的标准曲线方程,计算得到的三甲胺浓度为0.65 mg/mL,这与理论添加量相符合,略有减少可能是由于三甲胺在添加过程中的损失,或者是在从添加到取样这段时间内被降解,导致测定值比理论添加值偏低。试验组发酵24 h后,三甲胺浓度为0.12 mg/mL,表明三甲胺被瘤胃微生物大量利用。
|
|
表 4 瘤胃体外发酵液中三甲胺浓度 Table 4 TMA concentration in rumen in vitro fermentation liquid |
如表 5所示,2个浓度的三甲胺回收率均接近100%,相对标准偏差 < 5%。
|
|
表 5 瘤胃体外发酵液中三甲胺回收率 Table 5 TMA recovery in rumen in vitro fermentation liquid |
如表 6所示,样品S1中三甲胺平均浓度为0.64 mg/mL,相对标准偏差为3.95%。样品S2中三甲胺平均浓度为0.11 mg/mL,相对标准偏差为7.42%。这表明该方法测定含三甲胺浓度较高的样品比含三甲胺浓度较低的样品精度更高。
|
|
表 6 分析方法的重复性和再现性 Table 6 Repeatability and reproducibility of analytical method |
瘤胃体外发酵液呈酸性,三甲胺呈离子态,在气化室中较难汽化,因此需要对样品进行碱化处理,将离子态三甲胺转化成分子态三甲胺。用KOH对样品进行前处理是三甲胺检测的常用方法[10, 14, 21]。样品碱化不充分,三甲胺转化不完全,会导致检测值偏小。碱化过度也会导致过多的钾离子(K+)进入色谱系统,对氢离子火焰检测器产生干扰,导致检测值偏小。此外,用KOH预处理也能使发酵液中的蛋白质沉淀,降低样品对气化室的污染。检测肉产品和鱼虾等水产品中三甲胺浓度的方法,采用三氯乙酸沉淀样品中的蛋白质[14, 22]。本文用KOH预处理也可以在一定程度上达到除蛋白质的目的,在后续的研究中可尝试在KOH预处理前增加三氯乙酸处理步骤,提高样品的纯净度。采用顶空进样气相色谱法分析三甲胺确实是一个比较好的分析方法,能一定程度上减少对色谱柱和汽化室的污染,本文采用直接进水相样品的方法,考虑的是发酵液中三甲胺浓度较低,顶空法可能不能够将样品中的三甲胺完全释放出来,导致检测值偏低,影响检测结果的准确度。
以超纯水为溶剂制备的三甲胺标准溶液检测得到的三甲胺峰面积显著高于以发酵液为溶剂制备的标准溶液,这可能是由于发酵液中某些成分干扰了三甲胺的信号强度。这一现象导致利用以超纯水为溶剂制备的三甲胺标准曲线计算样品中三甲胺的浓度时得到的数值高于实际值。因此,制备标准曲线的溶剂应与所检测样品的背景溶液相同。
本方法未能检测到对照组中三甲胺,说明样品中三甲胺浓度低于本方法检测限。Martinez-Fernandez等[23]利用核磁共振法检测了饲喂一种热带牧草的波罗门牛瘤胃液中的代谢产物,发现三甲胺浓度为0.334~0.564 mmol/L。本方法的检测限为0.01 mg/mL(即0.169 mmol/L),本文中的发酵液是将瘤胃液按1 : 3的比例稀释制备而成,这可能是导致未能检测到对照组发酵液中三甲胺的原因。
4 结论本试验建立的利用气相色谱快速检测三甲胺浓度的方法前处理简单、检测结果准确度较高,可以快速高效检测瘤胃体外发酵液中三甲胺的浓度变化,适用于瘤胃微生物三甲胺代谢的体外研究。
| [1] |
DAWSON R M C, HEMINGTON N. Digestion of grass lipids and pigments in the sheep rumen[J]. British Journal of Nutrition, 1974, 32(2): 327-340. DOI:10.1079/BJN19740086 |
| [2] |
KELLY W J, LEAHY S C, KAMKE J, et al. Occurrence and expression of genes encoding methyl-compound production in rumen bacteria[J]. Animal Microbiome, 2019, 1: 15. DOI:10.1186/s42523-019-0016-0 |
| [3] |
HARTWELL J R, CECAVA M J, DONKIN S S. Impact of dietary rumen undegradable protein and rumen-protected choline on intake, peripartum liver triacylglyceride, plasma metabolites and milk production in transition dairy cows[J]. Journal of Dairy Science, 2000, 83(12): 2907-2917. DOI:10.3168/jds.S0022-0302(00)75191-5 |
| [4] |
DAVIDSON S, HOPKINS B A, ODLE J, et al. Supplementing limited methionine diets with rumen-protected methionine, betaine, and choline in early lactation holstein cows[J]. Journal of Dairy Science, 2008, 91(4): 1552-1559. DOI:10.3168/jds.2007-0721 |
| [5] |
BROAD T E, DAWSON R M. Role of choline in the nutrition of the rumen protozoon Entodinium caudatum[J]. Journal of General Microbiology, 1976, 92(2): 391-397. DOI:10.1099/00221287-92-2-391 |
| [6] |
NEILL A R, GRIME D W, DAWSON R M C. Conversion of choline methyl groups through trimethylamine into methane in the rumen[J]. Biochemical Journal, 1978, 170(3): 529-535. DOI:10.1042/bj1700529 |
| [7] |
REISINGER A, CLARK H. How much do direct livestock emissions actually contribute to global warming?[J]. Global Change Biology, 2018, 24(4): 1749-1761. DOI:10.1111/gcb.13975 |
| [8] |
TOPUZ O K, YERLIKAYA P, UCAK I, et al. Effects of olive oil and olive oil-pomegranate juice sauces on chemical, oxidative and sensorial quality of marinated anchovy[J]. Food Chemistry, 2014, 154: 63-70. DOI:10.1016/j.foodchem.2013.12.103 |
| [9] |
IKAWA M, SCHAPER T D, DOLLARD C A, et al. Utilization of folin-ciocalteu phenol reagent for the detection of certain nitrogen compounds[J]. Journal of Agricultural and Food Chemistry, 2003, 51(7): 1811-1815. DOI:10.1021/jf021099r |
| [10] |
KRÄTZER C, CARINI P, HOVEY R, et al. Transcriptional profiling of methyltransferase genes during growth of Methanosarcina mazei on trimethylamine[J]. Journal of Bacteriology, 2009, 191(16): 5108-5115. DOI:10.1128/JB.00420-09 |
| [11] |
HERRÁEZ-HERNÁNDEZ R, CHÁFER-PERICÁS C, VERD Ú-ANDRÉS J, et al. An evaluation of solid phase microextraction for aliphatic amines using derivatization with 9-fluorenylmethyl chloroformate and liquid chromatography[J]. Journal of Chromatography A, 2006, 1104(1/2): 40-46. |
| [12] |
CRACIUN S, BALSKUS E P. Microbial conversion of choline to trimethylamine requires a glycyl radical enzyme[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(52): 21307-21312. DOI:10.1073/pnas.1215689109 |
| [13] |
RATH S, HEIDRICH B, PIEPER D H, et al. Uncovering the trimethylamine-producing bacteria of the human gut microbiota[J]. Microbiome, 2017, 5: 54. DOI:10.1186/s40168-017-0271-9 |
| [14] |
胡彩虹, 许梓荣. 气相色谱法测定猪肉、鱼和虾中三甲胺的含量[J]. 食品科学, 2001, 22(5): 62-64. HU C, XU Z. Determination of trimethylamine in pork, fish and shrimp by gas chromatography[J]. Food Science, 2001, 22(5): 62-64 (in Chinese). DOI:10.3321/j.issn:1002-6630.2001.05.020 |
| [15] |
陶雪, 宋景平, 季永平. 车间空气中三甲胺的气相色谱测定法[J]. 工业卫生与职业病, 2000, 26(6): 367-369. TAO X, SONG J P, JI Y P. Determination of trimethylamine in workplace air by gas ghromatography[J]. Industrial Health and Occupational Diseases, 2000, 26(6): 48-50 (in Chinese). |
| [16] |
钱瑾, 夏凡, 忻雯怡, 等. 气相色谱法测定环境空气中三甲胺[J]. 环境监测管理与技术, 2003, 15(6): 29-30. QIAN J, XIA F, XIN W Y, et al. To detect trimethylamine in ambient air with gas chromatography[J]. The Administration and Technique of Environmental Monitoring, 2003, 15(6): 29-30 (in Chinese). DOI:10.3969/j.issn.1006-2009.2003.06.011 |
| [17] |
朱仁康, 王逸虹, 侯定远. 甲胺、二甲胺及三甲胺的气相色谱测定[J]. 中国环境监测, 2000, 16(1): 20-22. ZHU R K, WANG Y H, HOU D Y. Determination of monomethylamine, dimethylamine and trimethylamineby gas chromatography[J]. Environmental Monitoring in China, 2000, 16(1): 20-22 (in Chinese). DOI:10.3969/j.issn.1002-6002.2000.01.007 |
| [18] |
夏枚生, 胡彩虹. 气相色谱法快速测定甜菜碱盐酸盐中三甲胺的含量[J]. 浙江大学学报(农业与生命科学版), 1999, 25(6): 608-610. XIA M S, HU C H. Rapid determination of trimethylamine in betaine hydrochloride by gas chromatography[J]. Journal of Zhejiang University (Agriculture and Life Science Edition), 1999, 25(6): 608-610 (in Chinese). |
| [19] |
MENKE K H, STEINGASS H. Estimation of the energetic feeding value from gas production with rumen fluid in vitro and from chemical analysis, 2:regression equations[J]. Uebersichten Zur Tierernaehrung, 1987, 52. |
| [20] |
HIPPE H, CASPARI D, FIEBIG K, et al. Utilization of trimethylamine and other N-methyl compounds for growth and methane formation by Methanosarcina barkeri[J]. Proceedings of the National Academy of Sciences of the United States of America, 1979, 76(1): 494-498. DOI:10.1073/pnas.76.1.494 |
| [21] |
田映, 巴依尔. 气相色谱法测定猪肉中的三甲胺[J]. 中国卫生检验杂志, 2010, 20(1): 227. TIAN Y, BA Y E. Determination of trimethylamine in pork by gas chromatography[J]. Chinese Journal of Health Laborratory Technology, 2010, 20(1): 227 (in Chinese). |
| [22] |
喻开瑞, 金良正. 肉品中三甲胺的鼓泡分离及气相色谱测定[J]. 环境与健康杂志, 2000, 17(增刊): 64. YU K R, JIN L Z. Bubbling separation and gas chromatography determination of trimethylamine in meat[J]. Journal of Environment and Health, 2000, 17(Suppl.): 64 (in Chinese). |
| [23] |
MARTINEZ-FERNANDEZ G, DUVAL S, KINDERMANN M, et al. 3-NOP vs. halogenated compound:Methane production, ruminal fermentation and microbial community response in forage fed cattle[J]. Frontiers in Microbiology, 2018, 9: 1582. DOI:10.3389/fmicb.2018.01582 |




