淀粉是谷物类饲料碳水化合物的主要成分,其供能水平约占畜禽生产所需能量的40%[1]。研究表明,淀粉由于来源、组成和结构的不同,其在动物和人体内消化的速度和部位存在差异,如支链淀粉在小肠的前段即可以被淀粉酶迅速降解,直链淀粉分子比支链淀粉分子连接葡萄糖链的氢键强,因而直链淀粉被消化酶降解的效率低于支链淀粉,但其在小肠末端几乎可以完全被淀粉酶降解[2]。然而,抗性淀粉在小肠内几乎不降解,其主要在消化道后段被微生物发酵进而产生挥发性脂肪酸,主要是乙酸、丙酸和丁酸。目前越来越多的研究表明,挥发性脂肪酸对于维持动物胃肠道正常的生理功能、提高肠道的免疫功能以及促进肠道有益菌的生长具有十分重要的作用[3-4],但是挥发性脂肪酸被肠上皮细胞吸收供能的效率远远低于葡萄糖被吸收后的供能效率[5]。因此,不同类型的淀粉由于其降解位点和降解速率的差异,导致其在体内能量供应效率以及对动物生产性能和肠道健康等方面的影响存在明显差异。
猪饲粮中淀粉根据其类型主要分为三大类,分别为谷物类淀粉、薯类淀粉和豆类淀粉,其淀粉的组成和结构等理化特性具有很大的差异[6]。谷物类淀粉的颗粒直径较小,支链淀粉含量较高,容易被肠道淀粉酶消化,如玉米和小麦;薯类淀粉的吸湿性强,直链淀粉含量和颗粒直径大小略高于谷物淀粉,如红薯和木薯;豆类淀粉的颗粒直径较大,直链淀粉和抗性淀粉含量较高,很难被肠道淀粉酶完全消化,这部分淀粉进入动物体后肠被微生物发酵降解产生挥发性脂肪酸,比如豌豆和蚕豆[7]。因此,本研究挑选玉米、红薯干粉和豌豆粉3种原料,探究不同类型的淀粉对生长猪饲粮消化能、代谢能、能量利用效率和营养物质表观全肠道消化率的影响,同时比较玉米、红薯干粉和豌豆粉的有效能值和能量利用效率。
1 材料与方法 1.1 试验材料本试验在农业农村部饲料工业中心丰宁动物试验基地(河北承德九运农牧有限公司院士工作站)进行,按照农业部饲料效价与安全监督检验测试中心(北京)的猪饲料营养价值评价技术规程进行所有试验操作。玉米产自于山东,其品种为半紧凑型玉米鲁糯玉1号;红薯干粉产自河南,购于河南爱猪人生物科技股份有限公司;豌豆粉从澳大利亚进口,购买于广东东瑞集团。
1.2 试验设计与试验饲粮试验采用完全随机试验设计,选取初始体重为(35.38±1.36) kg的杜×长×大三元杂交去势公猪18头,随机分为3组,分别饲喂玉米饲粮、红薯干粉饲粮和豌豆粉饲粮。试验饲粮的原料组成见表 1。玉米饲粮中玉米作为唯一的能量来源,通过直接法计算玉米的消化能和代谢能。红薯干粉饲粮和豌豆粉饲粮分别由红薯干粉和豌豆粉替代玉米饲粮中30%的玉米配制而成,采用套算法计算红薯干粉和豌豆粉的消化能和代谢能。试验期19 d,其中7 d为消化代谢笼适应期,7 d为饲粮适应期,5 d为粪尿收集期。试验饲粮的营养水平见表 2。饲粮中矿物质和维生素营养水平参照《猪饲养标准》[8](NY/T 65—2004)推荐值进行设计。
|
|
表 1 试验饲粮的原料组成(饲喂基础) Table 1 Ingredient composition of experimental diets (as-fed basis) |
|
|
表 2 试验饲粮的营养水平(饲喂基础) Table 2 Nutrient levels of experimental diets (as-fed basis) |
所有试验猪均饲养在猪专用不锈钢代谢笼中单笼饲养,代谢笼的规格为1.4 m×0.7 m×0.6 m。试验猪自由饮水,每天的采食量为其初始体重的4%[9],每天09:00和16:00将饲粮分2次等量饲喂试验猪。试验期间每天不定时巡视,观察记录采食、饮水、排粪、瘘管护理等情况。同时每天猪舍进行常规消毒,舍温控制在(21±3) ℃。每天17:00对圈舍进行清扫,保持猪舍环境的干净卫生。
1.4 样品收集试验采用全收粪法收集样品。收集期开始时,将收尿桶放置于代谢笼下面,并加入50 mL 6 mol/L盐酸,混合均匀,将每头猪第15~19的连续5 d所收集的全部尿样解冻并充分混匀,取部分尿样装入50 mL离心管中,4 ℃静置待检。将收粪盘放置在猪笼漏缝板下,保证猪所排的粪全部落入收粪盘中。结束后将收集的粪进行称重,于65 ℃烘箱中烘72 h至风干状态,回潮24 h后至恒重,粉碎过60目筛,装袋备用。
1.5 检测指标和方法干物质、粗蛋白质、粗脂肪、总淀粉和粗灰分含量分别按照GB/T 6435—2006、GB/T 6432—1994、GB/T 6433—2006、GB/T 5009—2006、GB/T 6438—2007[10-14]方法测定;可溶性膳食纤维和不可溶性膳食纤维含量参考AOAO(2007)[15]的方法测定(AnkomTDF分析仪,美国);中性洗涤纤维和酸性洗涤纤维含量参考Van Soest等[16]的方法测定(ANKOM200纤维分析仪);总能按照国际标准ISO9831:1998推荐的方法使用氧弹式测热仪(Parr 6300 Calorimeter,美国)测定;直链淀粉和抗性淀粉含量参照Deng等[17]的方法测定;非抗性淀粉含量参照Björck等[18]的方法测定。
1.6 计算公式猪饲粮消化能和代谢能的计算公式[9]如下:

|
猪饲粮营养物质表观全肠道消化率的计算公式[9]如下:

|
猪饲粮的原料消化能和代谢能的计算公式[9]如下:

|
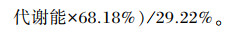
|
式中:97.4%为玉米饲粮中玉米添加的比例;68.18%为玉米在红薯干粉饲粮和豌豆粉饲粮中的添加比例;29.22%为红薯干粉和豌豆粉分别在红薯干粉饲粮和豌豆粉饲粮中的添加比例。
1.7 统计方法试验数据采用SAS 9.2统计软件中的GLM进行统计分析。以每个重复为统计单位,不同饲粮为固定效应,试验猪为随机效应。用Tukey法进行多重比较,P < 0.05为差异显著,0.05≤P < 0.10为有差异显著趋势。
2 结果 2.1 玉米、红薯干粉和豌豆粉的化学成分分析由表 3可知,红薯干粉的总能(14.43 MJ/kg)低于玉米(16.38 MJ/kg)和豌豆粉(16.32 MJ/kg)。豌豆粉的粗蛋白质含量(22.80%)远远高于玉米(7.96%)和红薯干粉(4.12%)。红薯干粉的可溶性膳食纤维和总膳食纤维的比值(31.17%)远远高于玉米(11.73%)和豌豆粉(5.37%)。玉米(54.39%)和红薯干粉(49.24%)的支链淀粉含量较高,而豌豆粉的直链淀粉(30.57%)和抗性淀粉含量(9.38%)较高。
|
|
表 3 玉米、红薯干粉和豌豆粉的化学成分(饲喂基础) Table 3 Chemical composition of corn, sweet potato flour and pea flour (as-fed basis) |
由表 4可知,红薯干粉饲粮中粗蛋白质表观全肠道消化率(68.81%)显著低于玉米饲粮(80.60%)和豌豆粉饲粮(82.64%)(P < 0.05),豌豆粉饲粮中粗脂肪表观全肠道消化率(38.07%)显著低于玉米饲粮(52.76%)和红薯干粉饲粮(52.65%)(P < 0.05),而玉米饲粮中性洗涤纤维和酸性洗涤纤维表观全肠道消化率(37.33%和30.28%)显著低于红薯干粉饲粮(50.38%和46.76%)和豌豆粉饲粮(56.22%和48.75%)(P < 0.05)。另外,玉米、红薯干粉和豌豆粉3种饲粮之间的总能、干物质、有机物质、淀粉和粗灰分表观全肠道消化率无显著差异(P>0.05)。
|
|
表 4 不同的淀粉类型对生长猪饲粮营养物质表观全肠道消化率的影响 Table 4 Effects of different starch types on apparent total tract digestibility of dietary nutrients in growing pigs |
由表 5可知,玉米饲粮、红薯干粉饲粮和豌豆粉饲粮中消化能和代谢能以及消化能与总能间的比值无显著差异(P>0.05)。但是,玉米饲粮中代谢能与总能的比值(86.30%)远远高于红薯干粉饲粮(84.67%)和豌豆粉饲粮(84.09%)(P < 0.05)。另外,玉米饲粮中代谢能与消化能的比值(97.12%)具有高于红薯干粉饲粮(96.06%)和豌豆粉饲粮(95.48%)的趋势(P=0.076)。
|
|
表 5 不同的淀粉类型对生长猪饲粮有效能值和能量利用效率的影响(饲喂基础) Table 5 Effects of different starch types on available energy value and energy utilization efficiency of diets in growing pigs (as-fed basis) |
通过直接法计算玉米的有效能值,而通过套算法计算出红薯干粉和豌豆粉的有效能值。由表 6可知,玉米、红薯干粉和豌豆粉的消化能与总能间的比值无显著差异(P>0.05)。但是红薯干粉的消化能和代谢能(12.66和11.81 MJ/kg)显著低于玉米(14.31和13.88 MJ/kg)和豌豆粉(14.44和13.43 MJ/kg)(P < 0.05)。另外,玉米的代谢能与消化能的比值和代谢能与总能的比值(84.74%和97.00%)显著高于红薯干粉(81.84%和93.29%)和豌豆粉(82.29%和93.01%)(P < 0.05)。
|
|
表 6 不同的淀粉类型对生长猪饲粮原料有效能值和能量利用效率的影响(饲喂基础) Table 6 Effects of different starch types on available energy value and energy utilization efficiency of feed ingredients in growing pigs (as-fed basis) |
淀粉由于其组成及结构不同在动物和人体内消化的速度和部位存在差异[19]。直链淀粉中葡萄糖单分子以α-1,4糖苷键连接,糊化温度较高,在动物体肠道内被淀粉酶降解速率较慢,但绝大多数直链淀粉再回肠末端可以完全被降解成葡萄糖。支链淀粉除了主链葡萄糖单分子以α-1,4糖苷键连接以外,分支是以α-1,4糖苷键连接,容易糊化,糊化后结构疏散,黏度较高,容易被淀粉酶降解,主要在十二指肠和空肠前端被完全快速降解并生成葡萄糖。抗性淀粉结构紧密,不能被肠道淀粉酶降解,但可以被后肠道微生物发酵代谢生成挥发性脂肪酸,从而改善动物体肠道环境并促进益生菌的繁殖。淀粉颗粒大小、淀粉的物理存在形式以及直链淀粉、支链淀粉和抗性淀粉的数量和比例直接影响到淀粉消化产物葡萄糖的吸收能力、淀粉的供能方式、饲粮在消化道中停留的时间和消化酶与淀粉的接触程度等,进而改变饲粮的营养物质消化率及其饲喂价值[20]。
本试验中红薯干粉饲粮粗蛋白质表观全肠道消化率低于玉米饲粮和豌豆粉饲粮,首先,这主要是由于红薯干粉含有较多的可溶性膳食纤维,而可溶性膳食纤维由于其理化特性可以增加食糜在猪小肠的黏度,促使肠道食糜的表面形成“水化膜”,从而阻碍胰蛋白酶和食糜中粗蛋白质的酶解作用[21-22]。其次,可溶性膳食纤维会增加生长猪前肠道内源氨基酸的分泌,比如脱落的上皮细胞和黏蛋白,进而降低饲粮氨基酸的消化率[23]。最后,可溶性膳食纤维在生长猪后肠道中易被微生物降解生成挥发性脂肪酸,有利于微生物的生长和菌体蛋白的合成,然后随未消化的饲粮残渣排除体外,增加了内源氮的浓度[24]。豌豆粉饲粮的粗脂肪表观全肠道消化率低于玉米和红薯干粉饲粮,这可能与豌豆粉中抗性淀粉含量较高有关。抗性淀粉作为猪饲粮中能量饲料主要的抗营养因子,可以抑制饲粮中能量利用效率和营养物质消化率,从而降低动物的生长性能[25]。除此之外,直链淀粉比支链淀粉易与油脂等化合物形成复合物,导致直链淀粉和粗脂肪不易被消化酶降解[26],这也是豌豆粉饲粮的粗脂肪表观全肠道消化率较低的原因之一。玉米饲粮的中性洗涤纤维和酸性洗涤纤维表观全肠道消化率低于红薯干粉饲粮和豌豆粉饲粮。这是由于玉米的不可溶性膳食纤维含量较高,其主要成分为阿拉伯木聚糖。由于阿拉伯木聚糖紧密的分子结构和糖苷键的组成,导致其不易被微生物降解[27]。但是,红薯干粉和豌豆粉含有较多的可溶性膳食纤维,其在猪的后肠道容易被微生物降解生成挥发性脂肪酸。另外,虽然玉米、红薯干粉和豌豆粉淀粉的组成和结构存在很大差异,但是三者的淀粉表观全肠道消化率无显著差异。尽管红薯中抗性淀粉和直链淀粉含量高于麦类原料,黄菊等[1]报道了麦类原料(如燕麦、小麦)和红薯相比,其淀粉的表观全肠道消化率无显著差异。这是由于原料中的支链淀粉和直链淀粉在生长猪的前肠道中几乎可以被完全降解,而抗性淀粉在微生物组成趋于稳定的后肠道可以被微生物完全降解合成挥发性脂肪酸。因此,不同类型的淀粉在生长猪上表观全肠道消化率均约为100%。
3.2 不同的淀粉类型对生长猪饲粮和原料有效能值和能量利用效率的影响本试验研究表明,玉米饲粮、红薯干粉饲粮和豌豆粉饲粮的消化能和代谢能以及消化能与总能之间的比值无显著差异。但是,玉米饲粮的代谢能与总能的比值以及代谢能与消化能的比值高于红薯干粉饲粮和豌豆粉饲粮。这是由于3种试验饲粮中淀粉是主要的供能来源,玉米的支链淀粉含量较高,容易被淀粉酶在猪的小肠前端快速消化,生成葡萄糖后迅速被肠上皮细胞吸收提供能量;豌豆粉的抗性淀粉含量较高,而抗性淀粉不能在猪的小肠被淀粉酶消化,但可以进入猪的后肠被微生物发酵合成挥发性脂肪酸,主要是乙酸、丙酸和丁酸[28]。然而,挥发性脂肪酸被肠上皮细胞吸收后的供能效率远远低于小肠内葡萄糖的供能效率,从而导致豌豆粉饲粮的能量利用效率低于玉米饲粮[29]。红薯干粉的抗性淀粉和直链淀粉含量均高于玉米,与支链淀粉相比,直链淀粉在猪小肠内消化速率较慢,因此直链淀粉被降解成葡萄糖后的供能速率较低。另外,红薯干粉含有较高的可溶性膳食纤维,与抗性淀粉相似,猪自身不能分泌降解可溶性膳食纤维的酶,但可以被后肠微生物降解生成挥发性脂肪酸,从而导致红薯干粉饲粮的能量利用效率较低[30]。类似地,本试验中玉米的代谢能与消化能比值和代谢能与总能比值高于红薯干粉和豌豆粉,这同样是由于玉米的支链淀粉含量较高,而红薯干粉和豌豆粉的可溶性膳食纤维和抗性淀粉含量较高,导致猪饲喂玉米的能量利用效率优于红薯干粉和豌豆粉。另外,很多研究表明,原料中消化能和代谢能含量和总能呈极显著正相关[31-32]。本研究中红薯干粉的消化能和代谢能远远低于玉米和豌豆粉,这和红薯干粉的总能含量较低有关。
4 结论不同的淀粉类型影响饲粮和原料在生长猪体内的能量利用效率和营养物质消化率,其中玉米作为典型的谷物类淀粉来源在生长猪上的饲用价值优于分别以红薯干粉和豌豆粉作为代表的薯类淀粉和豆类淀粉,其饲喂价值优劣顺序为玉米>豌豆粉>红薯干粉。
| [1] |
黄菊, 尹富贵, 柏美娟, 等. 半纯合日粮法测定几种麦类及红薯淀粉在生长猪体内的消化率[J]. 农业现代化研究, 2009, 30(4): 501-504. HUANG J, YIN F G, BAI M J, et al. Study on digestibility of starch from oat, wheat, buckwheat and sweet potato in intestinal tract of growing pigs by feeding semi-single diet[J]. Research of Agricultural Modernization, 2009, 30(4): 501-504 (in Chinese). |
| [2] |
WEURDING R E, VELDMAN A, VEEN W A G, et al. Starch digestion rate in the small intestine of broiler chickens differs among feedstuffs[J]. The Journal of Nutrition, 2001, 131(9): 2329-2335. DOI:10.1093/jn/131.9.2329 |
| [3] |
KOH A, DE VADDER F, KOVATCHEVA-DATCHARY P, et al. From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites[J]. Cell, 2016, 165(6): 1332-1345. DOI:10.1016/j.cell.2016.05.041 |
| [4] |
LIU H, WANG J, HE T, et al. Butyrate: a double-edged sword for health?[J]. Advances in Nutrition, 2018, 9(1): 21-29. DOI:10.1093/advances/nmx009 |
| [5] |
NIELSEN T S, THEIL P K, PURUP S, et al. Effects of resistant starch and arabinoxylan on parameters related to large intestinal and metabolic health in pigs fed fat-rich diets[J]. Journal of Agricultural and Food Chemistry, 2015, 63(48): 10418-10430. DOI:10.1021/acs.jafc.5b03372 |
| [6] |
戴求仲. 日粮淀粉来源对生长猪氨基酸消化率、门静脉净吸收量和组成模式的影响[D]. 博士毕业论文. 雅安: 四川农业大学, 2005. DAI Q Z.The effect of dietary starch sources on ileum digestibility, net portal absorption and pattern of amino acids in growing pigs[D]. Ph.D.Thesis.Ya'an: Sichuang Agricultural University, 2005.(in Chinese) |
| [7] |
WEURDING R E, ENTING H, VERSTEGEN M W A. The effect of site of starch digestion on performance of broiler chickens[J]. Animal Feed Science and Technology, 2003, 110. |
| [8] |
中华人民共和国农业部. NY/T 65—2004猪饲养标准[S]. 北京: 中国农业出版社, 2004. Ministry of Agriculture and Rural Affairs of the People's Republic of China.NY/T 65—2004 Feeding standard of swine[S]. Beijing: China Agriculture Press, 2004.(in Chinese) |
| [9] |
ADEOLA O.Digestion and balance techniques in pigs[M]//LEWIS A J, SOUTHERN L L.Swine nutrition.2nd ed.New York: CRC Press, 2001: 903-916.
|
| [10] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 6435—2006饲料中水分和其他挥发性物质含量的测定[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China.GB/T 6435—2006 Determination method of water in feedstuffs[S]. Beijing: Standards Press of China, 2007.(in Chinese) |
| [11] |
中华人民共和国国家技术监督局. GB/T 6432—1994饲料中粗蛋白测定方法[P]. 北京: 中国标准出版社, 1994. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China.GB/T 6432—1994 Determination method of crude protein in feedstuffs[S]. Beijing: Standards Press of China, 1995.(in Chinese) |
| [12] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 6433—2006饲料中粗脂肪的测定[S]. 北京: 中国标准出版社, 2006. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China.GB/T 6433—2006 Determination method of ether extract in feedstuffs[S]. Beijing: Standards Press of China, 2006.(in Chinese) |
| [13] |
中华人民共和国国家技术监督局. GB/T 5009—2006饲料中淀粉的测定[S]. 北京: 中国标准出版社, 2006. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China.GB/T 5009—2006 Determination method of starch in feedstuffs[S]. Beijing: Standards Press of China, 2006.(in Chinese) |
| [14] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 6438—2007饲料中粗灰分的测定[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China.GB/T 6438—2007 Determination method of crude ash in feedstuffs[S]. Beijing: Standards Press of China, 2006.(in Chinese) |
| [15] |
AOAC.Official methods of analysis[M]. 18th ed.Gaithersburg: Association of Official Analytical Chemists, 2007.
|
| [16] |
VAN SOEST P V, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [17] |
DENG J, WU X, BIN S, et al. Dietary amylose and amylopectin ratio and resistant starch content affects plasma glucose, lactic acid, hormone levels and protein synthesis in splanchnic tissues[J]. Journal of Animal Physiology and Animal Nutrition, 2010, 94(2): 220-226. DOI:10.1111/j.1439-0396.2008.00902.x |
| [18] |
BJÖRCK I, ASP N G. Controlling the nutritional properties of starch in foods—a challenge to the food industry[J]. Trends in Food Science & Technology, 1994, 5(7): 213-218. |
| [19] |
HEATON K W, MARCUS S N, EMMETT P M, et al. Particle size of wheat, maize, and oat test meals: effects on plasma glucose and insulin responses and on the rate of starch digestion in vitro[J]. The American Journal of Clinical Nutrition, 1988, 47(4): 675-682. DOI:10.1093/ajcn/47.4.675 |
| [20] |
CONE J W, VLOT M. Comparison of degradability of starch in concentrates by enzymes and rumen fluid[J]. Journal of Animal Physiology and Animal Nutrition, 1990, 63(1/2/3/4/5): 142-148. |
| [21] |
VON HEIMENDAHL E, BREVES G, ABEL H J. Fiber-related digestive processes in three different breeds of pigs[J]. Journal of Animal Science, 2010, 88(3): 972-981. DOI:10.2527/jas.2009-2370 |
| [22] |
RAINBIRD A L, LOW A G. Effect of various types of dietary fibre on gastric emptying in growing pigs[J]. British Journal of Nutrition, 1986, 55(1): 111-121. DOI:10.1079/BJN19860015 |
| [23] |
PAHM A A, PEDERSEN C, STEIN H H. Standardized ileal digestibility of reactive lysine in distillers dried grains with solubles fed to growing pigs[J]. Journal of Agricultural and Food Chemistry, 2009, 57(2): 535-539. DOI:10.1021/jf802047d |
| [24] |
LIU H Y, IVARSSON E, DICKSVED J, et al. Inclusion of chicory (Cichorium intybus L.) in pigs' diets affects the intestinal microenvironment and the gut microbiota[J]. Applied and Environmental Microbiology, 2012, 78(12): 4102-4109. DOI:10.1128/AEM.07702-11 |
| [25] |
JAWORSKI N W, STEIN H H. Disappearance of nutrients and energy in the stomach and small intestine, cecum, and colon of pigs fed corn-soybean meal diets containing distillers dried grains with solubles, wheat middlings, or soybean hulls[J]. Journal of Animal Science, 2017, 95(2): 727-739. DOI:10.2527/jas.2016.0752 |
| [26] |
魏衍超, 杨连生. 抗消化淀粉研究最新进展[J]. 郑州粮食学院学报, 2000, 21(1): 70-72. WEI X C, YANG L C. The latest research progress of resistant starch[J]. Journal of Zhengzhou Institute of Technology, 2000, 21(1): 70-72 (in Chinese). |
| [27] |
LÆRKE H N, ARENT S, DALSGAARD S, et al. Effect of xylanases on ileal viscosity, intestinal fiber modification, and apparent ileal fiber and nutrient digestibility of rye and wheat in growing pigs[J]. Journal of Animal Science, 2015, 93(9): 4323-4335. DOI:10.2527/jas.2015-9096 |
| [28] |
HAENEN D, ZHANG J, SOUZA DA SILVA C, et al. A diet high in resistant starch modulates microbiota composition, SCFA concentrations, and gene expression in pig intestine[J]. The Journal of Nutrition, 2013, 143(3): 274-283. DOI:10.3945/jn.112.169672 |
| [29] |
ANGUITA M, CANIBE N, PÉREZ J F, et al. Influence of the amount of dietary fiber on the available energy from hindgut fermentation in growing pigs: use of cannulated pigs and in vitro fermentation[J]. Journal of Animal Science, 2006, 84(10): 2766-2778. DOI:10.2527/jas.2005-212 |
| [30] |
MOLIST F, DE SEGURA A G, GASA J, et al. Effects of the insoluble and soluble dietary fibre on the physicochemical properties of digesta and the microbial activity in early weaned piglets[J]. Animal Feed Science and Technology, 2009, 149(3/4): 346-353. |
| [31] |
LI P L, CHEN Y F, LYU Z Q, et al. Concentration of metabolizable energy and digestibility of amino acids in Chinese produced dehulled double-low rapeseed expellers and non-dehulled double-low rapeseed co-products fed to growing-finishing pigs[J]. Animal Feed Science and Technology, 2017, 234: 10-19. DOI:10.1016/j.anifeedsci.2017.09.001 |
| [32] |
HUANG B B, HUANG C F, LYU Z Q, et al. Available energy and amino acid digestibility of defatted rice bran fed to growing pigs[J]. Journal of Animal Science, 2018, 96(8): 3138-3150. |




