2. 中国科学院亚热带农业生态研究所, 动物营养生理与代谢过程湖南省重点实验室, 长沙 410125;
3. 安琪酵母股份有限公司, 宜昌 443000
2. Key Laboratory of Animal Nutritional Physiology and Metabolic Process of Hunan, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China;
3. Angel Yeast Co., Ltd., Yichang 443000, China
为了提高畜禽的生长速度和饲料利用效率,降低发病率和死亡率,抗生素被广泛应用于畜禽生产中[1]。然而,抗生素的滥用导致耐药菌的产生且在动物体内大量残留,同时过量的抗生素通过粪尿途径排出畜体,对生态环境造成了污染,破坏了生态平衡[2]。随着除中草药外的所有促生长类药物饲料添加剂的全面禁用,寻找安全绿色的抗生素替代品成为亟待解决的问题。
研究表明,添加酵母多糖可吸附饲粮中的霉菌毒素,缓解仔猪的断奶应激,增强免疫调节功能,改善生长性能[3-4]。化学成分分析显示,甘露寡糖约占酵母细胞壁干重的30%,β-葡聚糖约占30%,糖蛋白和几丁质约占20%,蛋白质、脂质、无机盐和其他组分约占20%[5]。报道认为,饲粮中添加甘露聚糖可提高保育猪的生长性能,促进断奶仔猪从先天性免疫反应向适应性免疫反应转变[6]。酵母细胞壁中的β-葡聚糖可作为免疫活性物质,通过刺激免疫细胞发挥免疫刺激作用,从而抵抗致病菌的入侵,提高动物的生产性能[7]。
目前研究所用的酵母多糖大都是采用全破碎酵母细胞壁技术,通过抽提的方法直接离心干燥制成的[8]。而本试验所使用的酵母多糖是通过酶解破壁后进一步加复合酶处理,再离心干燥而制成的[9]。活化的酵母细胞壁,由于酶解处理,外层甘露聚糖酶解成甘露寡糖溶于水,内层葡聚糖表面功能性位点暴露更充分,更易发挥其生物学功能。因此,本研究旨在评估饲粮中添加活化酵母多糖(以下简称酵母多糖)对21日龄断奶仔猪生长性能、肠道形态、抗氧化能力和肠道免疫状态的影响。
1 材料与方法本试验使用的试验设计和程序已获得中国科学院亚热带农业研究所动物护理和使用委员会的批准。
1.1 试验材料酵母多糖(含20%甘露寡糖、35% β-葡聚糖、45%蛋白质)为宜昌某股份有限公司提供,吉他霉素和硫酸黏菌素购于上海某生物科技有限公司。
1.2 试验动物与试验设计试验选取体重[(6.89±0.88) kg]相近、健康状况良好的21日龄长×大×杜杂交阉公断奶仔猪32头,随机分为4个组,每组8个重复,每个重复1头猪。对照组饲喂基础饲粮,试验组分别饲喂在基础饲粮中添加0.1%酵母多糖(0.1%酵母多糖组)、0.2%酵母多糖(0.2%酵母多糖组)、55 mg/kg吉他霉素和20 mg/kg硫酸黏菌素(抗生素组)的试验饲粮。基础饲粮参照NRC(2012)和《猪饲养标准》(NY/T 65—2004)配制,其组成及营养水平见表 1。预试期3 d,正试期28 d。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
本试验在中国科学院亚热带农业生态研究所动物房进行,全封闭式猪舍,漏缝金属材质地面,不锈钢可调式料槽,乳头式饮水器。仔猪单笼饲养,并按照猪场标准饲养管理程序对仔猪进行驱虫和免疫处理。自由饮水和采食,粉料饲喂。整个圈舍采取自然通风,保持清洁,在试验期内对所在圈舍进行不定期消毒。
1.4 样品采集与指标测定 1.4.1 生长性能和器官指数测定观察并记录仔猪每天的采食量,淘汰或死亡仔猪及时称重并记录。试验第1天和第29天早晨对每头仔猪称重并做记录,称重前空腹12 h,计算平均日增重、平均日采食量及料重比。试验结束时,对所有仔猪肌注4%戊巴比妥钠溶液进行麻醉。待麻醉完全后,颈静脉放血处死,再进行屠宰解剖,取出肝脏和脾脏,吸干表面水分后进行称重。器官指数按以下公式计算:
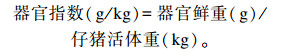
|
试验前9 d,每天早晚各1次由同一个人观察并记录各组仔猪的腹泻程度(0分:正常成形;1分:软粪,能成形;2分:稠状,不成形,粪水无分离;3分:液状,不成形,粪水分离)和腹泻头数,并计算腹泻率及腹泻指数。
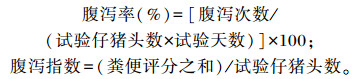
|
待仔猪屠宰后,收集十二指肠近端、空肠中端和回肠后端,用预冷的生理盐水冲洗掉其中的内容物,将其分为2份,其中一份(1~2 cm)用4%的甲醛磷酸盐缓冲液固定,以便在显微镜下观察肠道形态;另一份用于收集黏膜,刮好后的小肠黏膜在液氮中快速冷冻,收集后的黏膜组织样品保存在-80 ℃用于进一步分析。同时,在十二指肠近端、空肠中端、回肠后端、盲肠和结肠区域收集食糜样品,并测量其pH。
1.4.4 肠道形态分析使用梯度酒精对固定后的十二指肠、空肠和回肠组织(约0.5 cm)进行脱水,通过二甲苯处理使其透明,随后用石蜡进行包埋,最后将样品切成5 μm厚度的切片,用乙醇脱蜡处理后用苏木精-伊红(HE)染色。使用图像处理和分析系统(Version 1; Leica Imaging Systems Ltd., Cambridge, UK)在显微镜下以40倍的放大倍数测量染色切片上的绒毛高度和隐窝深度,并计算绒毛高度/隐窝深度。在完整的肠绒毛上计数100个肠上皮细胞中上皮内淋巴细胞(IEL)和杯状细胞(GC)的数目,每个切片重复计数5次。
1.4.5 抗氧化能力分析采用多功能酶标仪(TECAN公司)检测肠黏膜组织中超氧化物歧化酶(SOD)的活性及谷胱甘肽(GSH)的含量,试剂盒购自南京建成生物工程研究所。
1.4.6 细胞因子RT-PCR分析称取0.1 g左右小肠黏膜组织样品,使用Trizol提取组织中的总RNA,然后用紫外分光光度计测定RNA浓度。取1 ng上述RNA作为模板,然后用逆转录试剂盒(TaKaRa,大连)合成第1链cDNA。根据GenBank中猪的白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、白细胞介素-12(IL-12)及肿瘤坏死因子-α(TNF-α)基因及内参基因3-磷酸甘油醛脱氢酶(GAPDH)序列,依据引物设计原则,采用Primer 5.0软件设计引物,见表 2。设计完成后将引物序列交由生工生物工程(上海)股份有限公司进行引物的合成。然后以cDNA作为模板,采用试剂盒TB GreenTM Premix Ex TaqTM II (TliRNaseH Plus),使用ABI7900HT-PCR仪器(ABI Biotechnology,美国)对样品进行扩增,并运用配套软件(Applied Biosystem,SDS2.3)进行数据分析。以GAPDH为内参基因,对获得的信号、数据进行处理,采用2-ΔΔCt法对定量结果进行计算分析。
|
|
表 2 用于RT-PCR分析的引物序列 Table 2 Primer sequences for real-time PCR analysis |
所有数据均采用SPSS 24.0统计软件进行单因素方差分析(one-way ANOVA),并用Duncan氏法进行多重比较检验,结果以平均值和均值标准误(SEM)表示。P < 0.05表示差异显著,0.05≤P < 0.10表示有显著差异趋势。
2 结果 2.1 酵母多糖对断奶仔猪生长性能、器官指数、腹泻指数和肠道pH的影响由表 3可知,各组断奶仔猪的肝脏指数和脾脏指数无显著差异(P>0.05)。与对照组相比,饲粮中添加0.1%酵母多糖和抗生素可显著增加断奶仔猪的平均日增重(P < 0.05),0.1%、0.2%酵母多糖和抗生素组显著降低料重比(P < 0.05);与其他3组相比,饲粮中添加0.1%酵母多糖可显著增加平均日采食量(P < 0.05)。与对照组相比,0.1%、0.2%酵母多糖和抗生素组可降低断奶仔猪的腹泻率和腹泻指数,但无显著差异(P>0.05)。与对照组相比,饲粮中添加0.1%酵母多糖可显著降低断奶仔猪的盲肠内容物pH(P < 0.05);各组的十二指肠、空肠和结肠内容物pH之间无显著差异(P>0.05)。
|
|
表 3 酵母多糖对断奶仔猪生长性能、器官指数、腹泻指数和肠道pH的影响 Table 3 Effects of yeast polysaccharide on growth performance, organ indexes, diarrhea index and intestinal pH of weaned piglets (n=8) |
由表 4可知,与对照组相比,饲粮中添加0.1%和0.2%酵母多糖有增加断奶仔猪空肠绒毛高度的趋势(0.05 < P < 0.10)。各组断奶仔猪的十二指肠、空肠和回肠隐窝深度无显著差异(P>0.05)。与其他3组相比,饲粮中添加0.1%酵母多糖有增加断奶仔猪十二指肠绒毛高度/隐窝深度的趋势(0.05 < P < 0.10)。与抗生素组相比,饲粮中添加0.2%酵母多糖有增加断奶仔猪十二指肠上皮内淋巴细胞数量的趋势(0.05 < P < 0.10)。与对照组相比,饲粮中添加0.2%酵母多糖和抗生素有增加断奶仔猪空肠上皮内淋巴细胞数量的趋势(0.05 < P < 0.10),饲粮中添加0.1%酵母多糖和抗生素可显著增加回肠上皮内淋巴细胞数量(P < 0.05)。
|
|
表 4 酵母多糖对断奶仔猪肠道形态的影响 Table 4 Effects of yeast polysaccharide on intestinal morphology of weaned piglets (n=8) |
由表 5可知,与对照组相比,饲粮中添加0.2%酵母多糖和抗生素可显著降低断奶仔猪的十二指肠黏膜SOD活性(P < 0.05);饲粮中添加0.1%、0.2%酵母多糖和抗生素可显著降低空肠黏膜SOD活性(P < 0.05);饲粮中添加0.1%酵母多糖和抗生素有降低回肠黏膜SOD活性的趋势(0.05 < P < 0.10)。各组断奶仔猪的小肠黏膜GSH含量无显著差异(P>0.05)。
|
|
表 5 酵母多糖对断奶仔猪肠道黏膜抗氧化指标的影响 Table 5 Effects of yeast polysaccharide on intestinal mucosal antioxidative indexes of weaned piglets (n=8) |
由表 6可知,与对照组相比,0.2%酵母多糖组断奶仔猪的十二指肠黏膜IL-6的mRNA表达量显著降低(P < 0.05)。与抗生素组相比,0.1%和0.2%酵母多糖组断奶仔猪的十二指肠黏膜IL-12的mRNA表达量显著降低(P < 0.05)。与对照组相比,0.1%、0.2%酵母多糖和抗生素组断奶仔猪的空肠黏膜TNF-α的mRNA表达量有降低趋势(0.05 < P < 0.10)。与对照组和抗生素组相比,饲粮中添加0.2%酵母多糖可显著提高断奶仔猪的回肠黏膜IL-10的mRNA表达量(P < 0.05)。
|
|
表 6 酵母多糖对断奶仔猪肠道黏膜IL-6、TNF-α、IL-12和IL-10的mRNA表达量的影响 Table 6 Effects of yeast polysaccharide on IL-6, TNF-α, IL-12和IL-10 mRNA expression levels in intestinal mucosa of weaned piglets (n=8) |
断奶应激是猪整个生产周期中最大的应激之一,因为仔猪不仅遭受营养供给从富含蛋白质、脂肪和乳糖的高效率母乳转变为消化率较低的以淀粉为基础的固体饲粮的转变,而且必须迅速适应心理和社会环境的急剧变化[10],断奶极易导致仔猪的早期断奶综合征[11]。而源自于酵母细胞壁的甘露寡糖和葡聚糖被视为改善动物生长性能和健康状况的益生元[12]。已有研究表明,饲粮中添加酵母多糖可减少仔猪腹泻,改善断奶后仔猪的生长性能[13]。而徐杰等[14]研究表明,饲粮中添加酵母细胞壁多糖不能改善断奶仔猪的生长性能。本试验中,与对照组相比,饲喂添加0.1%酵母多糖的饲粮可显著提高断奶仔猪的平均日增重和平均日采食量;饲粮中添加0.1%和0.2%酵母多糖可降低腹泻率和腹泻指数,但无显著差异;饲粮中添加0.1%、0.2%酵母多糖和抗生素改善了料重比。这些结果的差异可能与酵母多糖的浓度、纯度、分子质量、添加水平、构像、化学结构以及活化程度有关。本试验结果表明,酵母多糖可通过提高采食量来改善断奶仔猪的生长性能。
仔猪的肠道酸度是影响消化吸收功能的重要因素,也是调节内环境pH平衡和电解质平衡的基本条件[15]。本试验中,饲喂含0.1%酵母多糖饲粮的断奶仔猪,其盲肠内容物pH较对照组低。盲肠是微生物发酵的主要区域,益生菌会通过非消化性多糖的发酵产生短链脂肪酸,降低盲肠pH。酵母多糖会抑制肠道中某些致病菌(如大肠杆菌和沙门氏菌)的定植,同时促进益生菌(如乳酸杆菌和双歧杆菌)的定植。本试验中,饲喂含0.1%酵母多糖饲粮的断奶仔猪盲肠内容物pH低于对照组,这可能是因为酵母多糖在大肠中通过微生物发酵产生大量的挥发性脂肪酸。0.1%酵母多糖组生长性能的改善可能有部分原因是由于盲肠中pH的降低。
绒毛是小肠的特殊结构,其高度和密度直接影响小肠的吸收面积。绒毛高度和密度的增加会扩大小肠的吸收区域,有利于营养物质的吸收。绒毛高度/隐窝深度是衡量仔猪小肠功能和健康的重要指标[16]。报道认为,饲粮中添加酵母甘露寡糖可显著提高猪的空肠绒毛高度[17]。本试验中,饲粮中添加0.1%酵母多糖有增加空肠绒毛高度和十二指肠绒毛高度/隐窝深度的趋势,这与添加0.1%酵母多糖改善仔猪生长性能的结果相一致。由杯状细胞和肠上皮内淋巴细胞等组成的肠上皮细胞是仔猪抵御毒素和外源病原体的第1道屏障,杯状细胞可通过分泌黏蛋白来抵御肠腔内的有害成分[18]。上皮内淋巴细胞构成肠道中第1个防御性免疫细胞系,并在调节上皮细胞的完整性、黏膜免疫和外源抗原的免疫反应中发挥关键作用。本试验中,与对照组相比,饲粮中添加0.2%酵母多糖可增加断奶仔猪的空肠上皮内淋巴细胞数量;添加0.1%酵母多糖可显著增加回肠上皮内淋巴细胞数量。这些结果表明酵母多糖可维持断奶仔猪的肠道完整性。
氧化应激是指细胞中氧化和抗氧化作用失衡,并抑制抗氧化酶的活性,其中GSH和SOD是氧自由基的清除剂。研究表明,在母猪饲粮中添加酵母甘露寡糖可显著增加后代仔猪的SOD和过氧化氢酶活性[19]。本试验中,与对照组相比,饲粮中添加0.1%和0.2%酵母多糖可显著降低断奶仔猪的空肠黏膜SOD活性。这可能是因为酵母多糖的免疫刺激活性和病原体的有效清除力减少了自由基的产生[20],并因此减少了GSH和SOD的产生。
细胞因子是由免疫细胞和某些非免疫细胞合成和分泌的一类具有广泛生物活性的蛋白质,在细胞间充当信号分子,主要调节免疫反应,参与免疫细胞分化,介导炎症反应[21]。单核吞噬细胞、淋巴细胞和Th1细胞可产生IL-6、TNF-α和IL-12等促炎细胞因子,参与炎症反应,以防御如细菌和病毒在内的病原微生物[22]。然而,促炎因子的过度表达可能对动物体造成病理损害,抑制动物的生长性能并降低生产效率[23]。IL-10是限制免疫反应中组织损伤的关键调节因子,具有很强的免疫抑制和抗炎作用[24]。甘露寡糖和β-葡聚糖都可作为免疫调节剂,调节炎症介质的产生并增强机体的免疫功能。报道认为,饲粮中添加酵母甘露寡糖可能促进抗炎因子(如IL-10)的分泌,从而减轻过度性免疫反应和免疫应激[25]。Li等[26]研究也发现,饲粮中添加β-葡聚糖可显著降低仔猪的血清IL-6和TNF-α含量,增加血清IL-10含量。本试验中,与对照组相比,饲粮中添加0.2%酵母多糖可显著降低断奶仔猪的十二指肠黏膜促炎因子IL-6的mRNA表达量,显著提高回肠黏膜抗炎因子IL-10的mRNA表达量。这些结果表明,酵母多糖可能通过调节肠道黏膜细胞因子的产生来影响断奶仔猪的肠道免疫功能。
4 结论综上所述,饲粮中添加0.1%和0.2%酵母多糖可提高断奶仔猪的生长性能,降低盲肠pH,改善肠道形态并降低肠道炎症。在本试验条件下,仔猪饲粮中酵母多糖的适宜添加水平为0.1%。
| [1] |
CROMWELL G L. Why and how antibiotics are used in swine production[J]. Animal Biotechnology, 2002, 13(1): 7-27. DOI:10.1081/ABIO-120005767 |
| [2] |
陈红英, 王月颖, 傅思武. 抗生素在养殖业中的应用现状[J]. 现代畜牧科技, 2019(5): 1-3. CHEN H Y, WANG Y Y, FU S W. Application status of antibiotics in aquaculture[J]. Modern Animal Husbandry Science & Technology, 2019(5): 1-3 (in Chinese). |
| [3] |
王学东, 刘立鹤, 戴晋军, 等. 酵母细胞壁多糖在养猪中的应用[J]. 养猪, 2009(6): 9-10. WANG X D, LIU L H, DAI J J, et al. Application of yeast cell wall polysaccharides in piglet[J]. Swine Production, 2009(6): 9-10 (in Chinese). |
| [4] |
许飞龙, 褚青坡, 李会智, 等. 酵母细胞壁多糖对断奶仔猪生产性能和免疫性能的影响[J]. 畜牧与兽医, 2016, 48(11): 43-47. XU F L, CHU Q P, LI H Z, et al. Effect of yeast cell wall polysaccharides on growth performance and immune performance of weaned piglets[J]. Animal Husbandry & Veterinary Medicine, 2016, 48(11): 43-47 (in Chinese). |
| [5] |
LIPKE P N, OVALLE R. Cell wall architecture in yeast: new structure and new challenges[J]. Journal of Bacteriology, 1998, 180(15): 3735-3740. DOI:10.1128/JB.180.15.3735-3740.1998 |
| [6] |
VALPOTIĆ H, ŽAJA I Ž, SAMARDZIJA M, et al. Dietary supplementation with mannan oligosaccharide and clinoptilolite modulates innate and adaptive immune parameters of weaned pigs[J]. Polish Journal of Veterinary Sciences, 2018, 21(1): 83-93. |
| [7] |
MANTOVANI M S, BELLINI M F, ANGELI J P F, et al. β-glucans in promoting health: prevention against mutation and cancer[J]. Mutation Research (Reviews in Mutation Research), 2008, 658(3): 154-161. DOI:10.1016/j.mrrev.2007.07.002 |
| [8] |
刘亚娜, 周喆麒, 王芳, 等. 酵母细胞壁多糖提取纯化鉴定技术及其应用研究进展[J]. 中国畜牧兽医, 2019, 46(12): 3607-3616. LIU Y N, ZHOU Z Q, WANG F, et al. Research progress on application, extraction, purification and identification of yeast cell wall polysaccharide[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(12): 3607-3616 (in Chinese). |
| [9] |
徐智鹏, 胡骏鹏, 周小辉. 酵母细胞壁多糖的作用及其成分检测方法[J]. 中国饲料, 2015(11): 40-42. XU Z P, HU J P, ZHOU X H. The Function of yeast cell wall polysaccharide and its component detection method[J]. China Feed, 2015(11): 40-42 (in Chinese). |
| [10] |
赵志贤. 早期断奶应激对仔猪肠道屏障损伤作用的研究[D]. 硕士学位论文. 雅安: 四川农业大学, 2013. ZHAO Z X.Reseach of early weaning diarrhea damage on intestinal barrier of piglets[D].Master's Thesis.Ya'an: Sichuan Agricultural University, 2013.(in Chinese) |
| [11] |
岳增华, 苏成军. 早期断奶仔猪的营养调控[J]. 中国猪业, 2007, 2(6): 26-28. YUE Z H, SU C J. Nutritional regulation of early weaned piglets[J]. China Swine Industry, 2007, 2(6): 26-28 (in Chinese). |
| [12] |
张国辉, 高红梅. 酵母细胞壁及其在水产健康养殖中的应用[J]. 南方水产, 2005, 1(4): 73-76. ZHANG G H, GAO H M. Yeast cell wall and its application in health aquaculture[J]. South China Fisheries Science, 2005, 1(4): 73-76 (in Chinese). |
| [13] |
张金宝, 银花, 舍旺. 酵母多糖对断奶仔猪生长性能、免疫功能和肠道菌群的影响[J]. 中国饲料, 2018(16): 46-50. ZHANG J B, YING H, SHE W. Effect of yeast polysaccharide on growth performance, immune function and intestinal flora of weaned piglets[J]. China Feed, 2018(16): 46-50 (in Chinese). |
| [14] |
徐杰, 陈晖, 陈中平, 等. 日粮中添加酵母细胞壁多糖对断奶仔猪生产性能和免疫性能的影响[J]. 中国饲料, 2018(7): 83-86. XUE J, CHEN H, CHEN Z P, et al. Effect of yeast cell wall polysaccharide added to diet on performance and Immunity of weaned piglets[J]. China Feed, 2018(7): 83-86 (in Chinese). |
| [15] |
饶辉. 影响断奶仔猪胃肠道pH值及胃蛋白酶活性的因素[J]. 猪业科学, 2008(6): 58-60. RAO H. Factors of affecting the pH and pepsin activity of the gastrointestinal tract of weaned piglets[J]. Swine Industry Science, 2008(6): 58-60 (in Chinese). |
| [16] |
MONTAGNE L, PLUSKE J R, HAMPSON D J. A review of interactions between dietary fibre and the intestinal mucosa, and their consequences on digestive health in young non-ruminant animals[J]. Animal Feed Science and Technology, 2003, 108(1/2/3/4): 95-117. |
| [17] |
CONEJOS J R V, ACDA S P, CAPITAN S S, et al. Mannan oligosaccharides from yeast (Saccharomyces cerevisiae) cell wall improves nutrient digestibility and intestinal morphology of growing pigs[Sus domesticus (Erxleben)][J]. The Philippine Agricultural Scientist, 2012, 95(3): 305-311. |
| [18] |
MONCADA D M, KAMMANADIMINTI S J, CHADEE K. Mucin and Toll-like receptors in host defense against intestinal parasites[J]. Trends in Parasitology, 2003, 19(7): 305-311. DOI:10.1016/S1471-4922(03)00122-3 |
| [19] |
CZECH A, MOKRZYCKA A, GRELA E R, et al. Influence of mannanoligosaccharides additive to sows diets on blood parameters of sows and their piglets[J]. Bull Vet Inst Pulawy, 2009, 53: 89-95. |
| [20] |
OGNIK K, KRAUZE M. Dietary supplementation of mannanoligosaccharides to turkey hens on their growth performance and antioxidant status in the blood[J]. South African Journal of Animal Science, 2012, 42(4): 379-388. |
| [21] |
BELARDELLI F. Role of interferons and other cytokines in the regulation of the immune response[J]. APMIS, 2010, 103(1/2/3/4/5/6): 161-179. |
| [22] |
ROGLER G, ANDUS T. Cytokines in inflammatory bowel disease[J]. World Journal of Surgery, 1998, 22(4): 382-389. DOI:10.1007/s002689900401 |
| [23] |
SI Y B, ZHANG Y L, CHEN Z J, et al.Posttranslational modification control of inflammatory signaling[M]//XU D.Regulation of inflammatory signaling in health and disease.Springer: Singapore, 2017: 37-61.
|
| [24] |
SANJABI S, ZENEWICZ L A, KAMANAKA M, et al. Anti-inflammatory and pro-inflammatory roles of TGF-β, IL-10, and IL-22 in immunity and autoimmunity[J]. Current Opinion in Pharmacology, 2009, 9(4): 447-453. DOI:10.1016/j.coph.2009.04.008 |
| [25] |
CHE T M, SONG M, LIU Y, et al. Mannan oligosaccharide increases serum concentrations of antibodies and inflammatory mediators in weanling pigs experimentally infected with porcine reproductive and respiratory syndrome virus[J]. Journal of Animal Science, 2012, 90(8): 2784-2793. DOI:10.2527/jas.2011-4518 |
| [26] |
LI J, XING J J, LI D, et al. Effects of β-glucan extracted from Saccharomyces cerevisiae on humoral and cellular immunity in weaned piglets[J]. Archives of Animal Nutrition, 2005, 59(5): 303-312. DOI:10.1080/17450390500247832 |




