2. 青岛农业大学科技处, 青岛 266109;
3. 江苏农林职业技术学院畜牧兽医学院, 句容 212400
2. Science and Technology Office, Qingdao Agricultural University, Qingdao 266109, China;
3. Institute of Animal Husbandry and Veterinary Medicine, Jiangsu Vocational College of Agriculture and Forestry, Jurong 212400, China
由于畜禽类饲粮全面禁抗政策的实施,化学合成抗氧化剂对人类健康亦有潜在威胁,人们将视角转向可饲用天然产物饲料添加剂的开发[1]。目前,将银杏-杜仲叶复合发酵物(GEL)作为饲料添加剂,研究其对肉鸡生长性能和抗氧化等方面的研究报道在国内外都比较少[2]。在畜牧生产中,微生物发酵是一种从植物产品中去除抗营养因子的有效手段,同时是能够产生具有生物活性物质的有效途径,可以促进动物的生长和健康。大量研究发现,功能性植物资源作为饲料添加剂能够增强动物机体的抗氧化能力[3-4],改善肉品风味,显著提高肉品质。近年来大量研究表明,以植物资源如杜仲、银杏、辣木、黄芪等为原料生产功能性添加剂,添加到动物饲粮中,可以有效改善动物的生产性能,减少氧化损伤[5-8],并提高肉品质[9-11]。本课题组前期研究发现,发酵银杏叶可以提高肉鸡的抗氧化能力,改善肌肉系水力和肉品质[12-14]。
发酵过程中,微生物将银杏-杜仲叶复合原料中不易消化吸收的大分子物质转化变成小分子,容易被肠黏膜吸收,加速血液中的有效成分达到有效浓度,从而提高动物的生产性能和肉品质。本试验选用爱拔益加(AA)肉鸡作为研究对象,研究饲粮中添加不同水平的GEL对肉鸡抗氧化功能和肉品质的影响,并设未发酵物[未发酵银杏-杜仲叶(NGEL)]组作为对照,为银杏-杜仲叶生物饲料添加剂用于肉鸡生产提供基础数据。
1 材料与方法 1.1 GEL的制备1) 10月份于南京林业大学银杏园采摘的银杏叶,自然晾晒,备用;12月份于河南理工大学杜仲园收集的杜仲落叶,自然晾晒,备用;
2) 分别将银杏叶和杜仲叶60 ℃烘干,磨粉过40目筛,装入自封袋密封保存;
3) 接种2.0%黑曲霉菌和1.0%产朊假丝酵母混合发酵银杏叶和杜仲叶配比为2 ∶ 1的复合物,添加麸皮20%(g/g总干料),含3.0%(NH4)2SO4、2.0%葡萄糖、2.0% KH2PO4、0.5% MgSO4·7H2O,物料初始pH为5,湿度为60%,发酵温度为28 ℃,发酵时间为96 h。
通过黑曲霉和产阮假丝酵母生物转化后的GEL,营养丰富,总黄酮和绿原酸含量达到最优,分别由发酵前的1.67%和0.42%提高至2.13%和0.50%,提高幅度为27.55%和19.48%。代谢能为13.15 MJ/kg,粗蛋白质含量为25.23%。
1.2 试验动物选取1日龄健康AA肉仔鸡360只(由山东烟台苏佳丽禽业有限公司提供),平均体重为(49.24±3.89) g,差异不显著(P>0.05)。
1.3 试验设计与饲粮选取360只1日龄的健康AA肉鸡,随机分成6组,即对照组、NGEL组[在基础饲粮中添加NGEL,前期(1~21日龄)添加0.3%,后期(22~24日龄)添加0.6%]及4个GEL组(GEL1、GEL2、GEL3、GEL4组,即在基础饲粮中添加GEL,前期GEL分别添加0.2%、0.3%、0.4%和0.5%,后期分别添加0.4%、0.6%、0.8%和1.0%),每组6个重复,每个重复10只鸡。试验期42 d。采用玉米-豆粕型基础饲粮,其组成及营养水平见表 1。试验采用重量替代法,用麸皮在不同的饲粮中补齐试验添加物的量。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
分别于21、42日龄08:00开始进行采样。前1天19:00开始断粮,保持饮水供应。每组中每个重复取1只鸡,每组共6只,先进行称重,后采用5 mL离心管进行颈静脉采血,并于低温3 500 r/min离心15 min制备血清,置-20 ℃冰箱保存,待测。在每只鸡的大体一致的相应部位采集胸肌样品,去除脂肪和结缔组织,每只鸡各取4块,分别用于测定24和48 h的滴水损失(10 g)、45 min和24 h的pH(50 g)、肉色(15 g)、烹饪损失和嫩度(剪切力)(30 g)。
1.5 抗氧化指标的测定 1.5.1 血清中α-生育酚(α-TOH)含量的测定采用Kayden等[15]的方法测定血清α-TOH的含量。取100 μL血清样品与2.0%连苯三酚充分混匀,置70 ℃的恒温振荡水浴中2 min;加入3.6 mmol/L KOH 0.25 mL,再置70 ℃恒温振荡水浴中30 min。冰水浴冷却后,加入正己烷2 mL和蒸馏水0.5 mL,2 min剧烈振荡,将1 mL最上层的正己烷α-TOH抽提液转移至4 mL玻璃试管中,制备1、2、4、6、8和10 μg/mL的α-TOH标准品,分别加2.0%菲罗啉200 μL到样品管和标准品管中,充分混匀,再加1 mmol/L FeCl3 200 μL,1 min涡旋混匀,再加H3PO4 200 μL,涡旋混匀,在534 nm处比色法读取吸光值。由标准曲线计算各样品中的α-TOH含量。
1.5.2 血清和组织中抗氧化与脂质过氧化指标的测定采用硫代巴比妥酸(TBA)法测定血清、肝脏和胸肌中丙二醛(MDA)含量;按Noguchi等[16]的方法测定血清和肝脏中还原型谷胱甘肽(GSH)含量及胸肌中谷胱甘肽过氧化物酶(GSH-Px)活性;根据铁离子(Fe3+)还原法测定胸肌总抗氧化能力(T-AOC);使用黄嘌呤氧化法测定胸肌总超氧化物歧化酶(T-SOD)活性。试剂盒均购自南京建成生物工程研究所。
1.6 胸腿肌肉品质的测定 1.6.1 pH的测定分别于45 min和24 h时,用嫩度仪取样器在备存肉样上钻1个小孔,将用便携式数显pH计的电极直接插入小孔中,使电极头完全被包埋在肉样中,读取pH(pH45 min和pH24 h)。每测1个样品后,均用蒸馏水充分冲洗电极,并注意校正。
1.6.2 系水力的测定烹饪损失:每个样取胸肌约10 g(M),用锡箔纸包住,置75 ℃水中煮15 min,称重(m)。
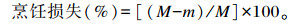
|
滴水损失:分别取胸肌约10 g,称重(W1),置于充气的塑料袋中,封口,避免肌肉块贴壁,吊挂于4 ℃冰箱内,24 h后取出胸肌,拭去肌肉表面水分,称重(W2)。
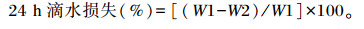
|
称量后的肉样重新放入充气的塑料袋中,封口,挂回4 ℃冰箱,经24 h再取出肉样,擦干肉样表层水分,称重(W3)。
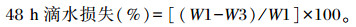
|
将沿左侧胸肌取的样品,去除肉样表面附着的脂肪及多余的结缔组织,于塑料袋中密封,在温度15~16 ℃下进行尸僵前处理24 h。4 ℃下再熟化24 h。取出熟化充分的肉样,室温放置1 h,解除塑料袋包装,将温度计插入肌肉中心部,然后包扎好,袋口朝上,置于80 ℃水浴锅中,进行加热,当肌肉中心温度达到70 ℃时,取出肉样,冷却至室温。将每块肌肉沿肌纤维方向修成1 cm×1 cm×3 cm的长条,3~5块,测定剪切力3次(Salter剪切力仪,G2R Elec. Mf g. Co.),取平均值。
1.6.4 肉色评定分别取出肉样,沿肌纤维方向,切取2 cm×2 cm的胸肌样品,用色差仪(CHROMA METER CR-400, KONZCAminOLTA SENSING, INC, 日本)测定亮度(L*)、红度(a*)和黄度(b*)值。
1.6.5 胸肌脂肪酸含量的测定分别称取0.2 g经过冻干处理的样品,放入试管中;加内标1 mL,加NaHCO3/甲醇溶液4 mL,混匀,50 ℃放20 min后,加盐酸/甲醇溶液2 mL,80 ℃下孵育1 h;充分振荡;冷至室温,先后加入水2 mL和正己烷6 mL,充分振荡,离心分层;取200 μL上层溶液,加600 μL正己烷,用气相色谱仪进行分析。
GC-14C气相色谱仪:附带N-2000双通道色谱工作站软件(浙江大学智能信息工程有限公司);色谱柱:长30 m,内径0.22 mm,柱温195 ℃;载气:氢气流速22.5 mL/min,空气流速80 mL/min,氮气流速9 mL/min;进样器温度:250 ℃;进样量:0.5~1.0 μL;分流比60 ∶ 1。
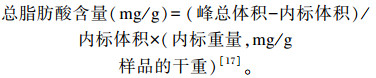
|
数据经Excel 2010整理后,采用SPSS 22.0进行单因素方差分析(one-way ANOVA),差异显著时采用Duncan氏法进行多重比较,最后采用SPSS 22.0软件做线性回归分析,差异显著性水平设为P < 0.05。
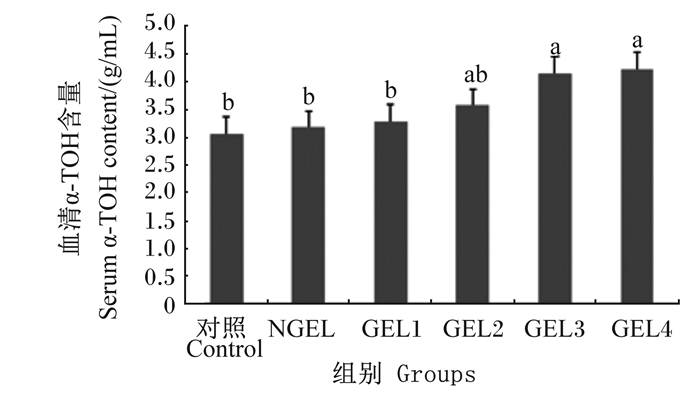
2 结果与分析 2.1 GEL对肉鸡血清α-TOH含量的影响由图 1可知,GEL1、GEL2、GEL3和GEL4组血清α-TOH含量分别比对照组提高了9.43%、20.54%、35.02%和57.24%,这4组分别比NGEL组提高了7.62%、18.54%、32.78%和54.64%;且GEL3和GEL4组均显著高于对照组和NGEL组(P < 0.05);线性回归分析结果表明,随着饲粮GEL添加水平的提高,血清α-TOH含量呈显著线性增加(P < 0.05)。
|
数据柱标注不同小写字母表示差异显著(P < 0.05)。下图同。 Value columns with different small letters mean significant difference (P < 0.05). The same as below. 图 1 饲粮添加GEL对肉鸡血清α-TOH含量的影响 Fig. 1 Effects of dietary GEL on serum α-TOH content of broilers |
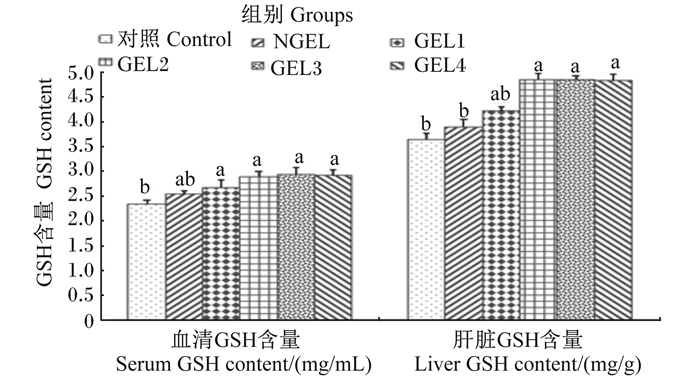
由图 2可知,与对照组相比,4个GEL组的血清GSH含量分别显著提高了14.10%、23.50%、25.21%和24.35%(P < 0.05),而各GEL组间均无显著差异(P>0.05);GEL2、GEL3和GEL4组的肝脏GSH含量最高,分别比对照组和NGEL组提高了33.24%、32.97%、32.42%和24.68%、24.42%、23.92%(P < 0.05)。
|
图 2 饲粮添加GEL对肉鸡血清和肝脏GSH含量的影响 Fig. 2 Effects of dietary GEL on serum and hepatic GSH contents of broilers |
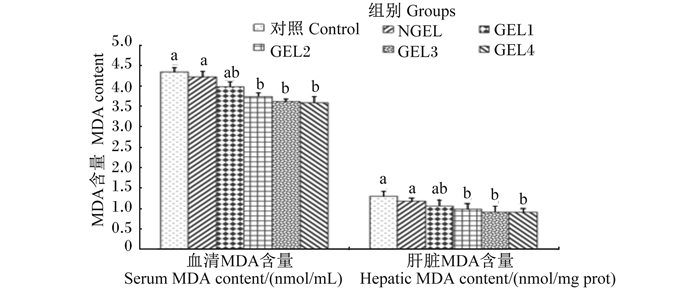
由图 3所示,饲粮添加GEL对血清和肝脏MDA含量的影响趋势是一致的。与对照组和NGEL组相比,GEL2、GEL3、GEL4组的血清或肝脏的MDA含量均显著降低(P < 0.05)。
|
图 3 饲粮添加GEL对肉鸡血清和肝脏MDA含量的影响 Fig. 3 Effects of dietary GEL on serum and hepatic MDA content of broilers |
由表 2可知,随着饲粮中GEL添加水平的增加,胸肌中T-SOD的活性和T-AOC呈线性增加,而MDA含量呈线性降低;GEL2、GEL3和GEL4组胸肌中T-SOD活性显著高于对照组和NGEL组(P < 0.05),而各组间的胸肌GSH-Px活性无显著差异(P>0.05);就胸肌中T-AOC而言,GEL2、GEL3和GEL4组显著高于对照组(P < 0.05);与对照组相比,不同的饲粮处理均对胸肌MDA含量产生显著影响(P < 0.05),GEL3组的胸肌MDA含量显著低于NGEL组和GEL1组(P < 0.05)。
|
|
表 2 饲粮添加GEL对肉鸡胸肌抗氧化和脂质过氧化指标的影响 Table 2 Effects of dietary GEL on antioxidant and lipid peroxidation indexes in breast muscle of broilers |
由表 3可知,饲粮中添加GEL对胸肌的pH24 h、24和48 h的滴水损失、48 h的烹饪损失和剪切力均产生显著影响(P < 0.05)。同时,随饲粮GEL添加水平的增加,24 h滴水损失、48 h滴水损失和剪切力呈显著线性降低(P=0.021和P=0.039、P=0.016);同时,GEL2、GEL3和GEL4组的剪切力、24 h滴水损失和48 h滴水损失显著低于对照组(P < 0.05)。GEL2和GEL3组的烹饪损失显著低于对照组(P < 0.05)。
|
|
表 3 饲粮添加GEL对肉鸡胸肌肉品质的影响 Table 3 Effects of dietary GEL on breast muscle quality of broilers |
如表 4可见,饲粮处理对C16 ∶ 0(P=0.033)、C18 ∶ 0(P=0.001)、C18 ∶ 2(P=0.001)、C18 ∶ 3(P=0.001)、C20 ∶ 4(P=0.001)和总多不饱和脂肪酸(PUFA)(P=0.001)含量产生了显著影响。与对照组或NGEL组相比,GEL2、GEL3和GEL4组的胸肌C16 ∶ 0和C18 ∶ 0含量显著降低(P < 0.05),就总PUFA、C18 ∶ 2、C18 ∶ 3和C20 ∶ 4含量而言,4个GEL组均比对照组和NGEL组有显著升高(P < 0.05),同时,GEL3、GEL4组与GEL1组间的总PUFA、C18 ∶ 2、C18 ∶ 3和C20 ∶ 4含量均有显著差异(P < 0.05);随着饲粮中GEL添加水平的增加,C16 ∶ 0(P=0.033)、C18 ∶ 0(P=0.001)和总饱和脂肪酸(P=0.041)含量呈显著线性降低(P < 0.05),而总PUFA、C18 ∶ 2、C18 ∶ 3和C20 ∶ 4含量呈显著线性增加(P < 0.05)。
|
|
表 4 饲粮添加GEL对肉鸡胸肌脂肪酸组成的影响 Table 4 Effects of dietary GEL on fatty acid composition in breast muscle of broilers |
发酵是饲粮生产中常用的一种处理工艺,通过微生物可产生具有促进健康作用的生物活性物质。经过微生物发酵处理的植物资源,含有丰富的酶、维生素和生长因子[18],银杏黄酮甙元在发酵后更容易被动物肠道消化吸收[19]。本试验已发表数据揭示了饲粮中添加GEL能够显著提高肉鸡饲料效率,且有效改善肠道结构,提高消化酶的活性,进而增强肠道消化吸收功能,从而提高了肉鸡的生长性能[20]。
抗氧化酶防御主要包括SOD、CAT和GSH-Px,它们在预防脂质过氧化的有害影响方面起着重要作用[21]。MDA含量用于评估脂质过氧化程度[22-23]。SOD是动物机体抗氧化损伤系统中的重要成员之一,在生物体内它是一种以自由基为底物的酶,可以平衡氧化和抗氧化过程,通过SOD活性能够间接反映机体清除自由基的能力。T-AOC能够反映机体清除自由基的能力。就氧化还原而言,本试验结果显示,肉鸡饲粮中添加不同水平的GEL能提高胸肌T-SOD活性和T-AOC,降低血清、肝脏及胸肌MDA的含量,这和GEL中的总黄酮、绿原酸对细胞自由基和抗氧化平衡的调控相关。黄酮类化合物是具有多种酚类结构的一类天然物质,酚类物质具有很高的抗氧化活性,能够通过稳定细胞内产生的自由基,起到抗氧化的作用[24-25]。
多不饱和脂肪酸的提高通常增加脂质过氧化的水平。GSH参与细胞防御体系,是天然活性氧(ROS)在细胞内的清除剂,可以保护组织不受氧化损伤,能够有效防止脂肪酸过氧化[26-27]。作为一种免疫调节分子,脂肪酸能够介导细胞通讯、膜流动性、第二信使传递[28]。血清α-TOH和GSH含量随着GEL添加水平的提高有显著提高,原因可能是在发酵过程中产生的微生物酶类,作用于植物细胞壁,使具有抗氧化功能的酚类物质释放出来[29-30]。酚酐被β-葡萄糖苷酶分解成苷元,苷元具有亲油性,有利于通过细胞膜磷脂双层膜,所以很容易被上皮细胞吸收[29, 31]。
3.2 GEL对肉鸡肉品质的影响众所周知,肌肉pH能够影响多种肉质特性,如肉色、嫩度、系水力(滴水损失和蒸煮损失)及其他肌肉性状,是最重要的宰后因素之一。此外,屠宰后肉的pH迅速下降能够导致蛋白质变性,进而导致肉色苍白和系水力降低[24]。在本试验中,屠宰后胸肌肉pH24 h随着饲粮GEL添加水平的增加呈线性增加。该结果提示饲粮GEL能够将肉的pH维持在相对较低的范围内。肉的系水力是直接与肌内脂肪和水分含量相关的。较低的系水力说明通过渗出损失的营养成分较多,最终导致肉较干较硬。降低的pH能够影响系水力。嫩度(剪切力)可能是决定消费者对肉的可接受性的最重要的食用品质指标[32]。本试验数据表明,系水力和剪切力的变化趋势与pH是吻合的。杜仲叶中的绿原酸可以使细胞膜的脂质层避免过氧化自由基的干扰,进而减少细胞膜上的载体通道,减缓脂质的过氧化,抑制亚铁离子(Fe2+)诱导MDA的形成[33],阻止肌肉过快氧化,降低肌肉渗水性和肌肉反光,维持胴体性状及肉品质的相对稳定。饲粮中添加杜仲提取物能不同程度地降低肉产品的滴水损失,改善肉色和嫩度,增添肉的多汁性和风味;此外,杜仲叶中含有苏氨酸和蛋氨酸,它们能够加快脂肪代谢、改善肉质性状[33]。
本试验结果发现,饲粮中添加GEL能够有效改变脂肪酸的组成,表现在增加或保护不饱和脂肪酸(UFA)的氧化,或降低胸肌总饱和脂肪酸(SFA)的含量。SFA含量的降低是由于C16 ∶ 0和C18 ∶ 0含量显著降低所致,这可能与饲粮GEL的添加对血清胆固醇(TC)含量的降低作用有关[12]。由于胸肌中C18 ∶ 2、C18 ∶ 3和C20 ∶ 4含量的增加,胸肌中总PUFA含量显著增加。这可能是由于过氧化物酶能够降低总UFA氧化,它的活性增强,总PUFA含量就增加了。临床数据显示,冠状心脏疾病(CHD)与饲粮TC和SFA的摄取呈显著相关[26]。本试验中,肉鸡饲粮添加GEL后42 d,与对照组相比,其胸肌总SFA含量较低,且本试验中,脂肪酸组成的结果与增强的T-AOC和增加的SOD活性的结果相互支持。
4 结论饲粮中添加GEL(前期添加0.2%~0.5%,后期添加0.4%~1.0%)可提高42日龄肉鸡血清的抗氧化能力,降低脂质过氧化水平,改善胸肌品质和脂肪酸组成。
| [1] |
徐永平. 中国畜产品生产的出路在于提高安全性[J]. 中国动物保健, 2002(1): 2-3. XU Y P. Livestock production way out is to improve security in China[J]. China Animal Health, 2002(1): 2-3 (in Chinese). |
| [2] |
FENG J, LIU X, XU Z R, et al. Effects of fermented soybean meal on digestive enzyme activities and intestinal morphology in broilers[J]. Poultry Science, 2007, 86(6): 1149-1154. DOI:10.1093/ps/86.6.1149 |
| [3] |
廖石勇, 邹坪珈, 李琦, 等. 银杏叶-辣木叶发酵物对异育银鲫生长发育、消化酶活性以及抗氧化能力的影响[J]. 黑龙江畜牧兽医, 2018(14): 176-179. LIAO S Y, ZOU P J, LI Q, et al. Effects of fermentation Ginkgo biloba-Moringa leaves on growth, digestive enzyme activity and antioxidant capacity of Carassius auratus gibelio[J]. Heilongjiang Animal Science and Veterinary Medicine, 2018(14): 176-179 (in Chinese). |
| [4] |
任小杰, 李祥明, 杨在宾, 等. 银杏叶及其提取物对肉鸡生长性能、抗氧化及血清生化指标的影响[J]. 中国粮油学报, 2018, 33(4): 73-79. REN X J, LI X M, YANG Z B, et al. Effects of Ginkgo biloba leaf and its extracts on growth performance, antioxidant and serum biochemical indexes of broilers[J]. Journal of the Chinese Cereals and Oils Association, 2018, 33(4): 73-79 (in Chinese). |
| [5] |
朱永毅, 李潇蒙, 石强. 日粮添加发酵银杏叶对1-42 d黄羽肉仔鸡生长性能、血清生化指标和抗氧化性能的影响[J]. 中国饲料, 2018(2): 13-18. ZHU Y Y, LI X M, SHI Q. Effects of dietary supplementation with fermented Ginkgo biloba leaf on growth performance serum biochemical indexes and antioxidant properties of 1 to 42 d yellow-feathered broilers[J]. China Feed, 2018(2): 13-18 (in Chinese). |
| [6] |
彭密军, 张命龙, 王志宏, 等. 饲粮中添加杜仲叶对断奶仔猪生长性能、抗氧化力和免疫功能的影响[J]. 天然产物研究与开发, 2019, 31(4): 675-681. PENG M J, ZHANG M L, WANG Z H, et al. Effects of dietary addition of Eucommia leaves for antibiotic on growth performance, blood biochemical parameters and immune organs of weaning piglets[J]. Natural Product Research and Development, 2019, 31(4): 675-681 (in Chinese). |
| [7] |
刘娇, 常文环, 陈志敏, 等. 日粮中添加辣木提取物对AA肉鸡生产性能、屠宰性能、肉品质及血清生化指标的影响[J]. 中国畜牧兽医, 2019, 46(2): 414-423. LIU J, CHANG W H, CHEN Z M, et al. Effects of Moringa oleifera Lam. extract on production performance, slaughter performance, meat quality and serum biochemical indexes in AA broilers[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(2): 414-423 (in Chinese). |
| [8] |
ZHANG X H, SUN Z Y, CAI J F, et al. Dietary supplementation with fermented Moringa oleifera leaves inhibits the lipogenesis in the liver of meat ducks[J]. Animal Feed Science and Technology, 2020, 260: 114336. DOI:10.1016/j.anifeedsci.2019.114336 |
| [9] |
胡忠泽, 金光明, 刘海, 等. 茶多酚对肉鸡脂肪代谢的影响及作用机制[J]. 南京农业大学学报, 2006, 29(2): 85-88. HU Z Z, JIN G M, LIU H, et al. Effects of tea polyphenols on fat metabolism of broilers and its mechanism[J]. Journal of Nanjing Agricultural University, 2006, 29(2): 85-88 (in Chinese). |
| [10] |
张梅芳. 杜仲叶粉对三黄鸡生产性能和胴体品质的影响[J]. 中国家禽, 2007, 29(11): 37-38. ZHANG M F. Effects of Eucommia ulmoides leaf powder on production performance and carcass quality of Sanhuang broiler[J]. China Poultry, 2007, 29(11): 37-38 (in Chinese). |
| [11] |
郝艳霜, 李树鹏, 陈福星. 中药黄芪在家禽生产中的应用研究[J]. 中国家禽, 2006, 28(20): 93-95. HAO Y S, LI S P, CHEN F X. Application of Astragalus menbranaceus in poultry production[J]. China Poultry, 2006, 28(20): 93-95 (in Chinese). |
| [12] |
CAO F L, ZHANG X H, YU W W, et al. Effect of feeding fermented Ginkgo biloba leaves on growth performance, meat quality, and lipid metabolism in broilers[J]. Poultry Science, 2012, 91(5): 1210-1221. DOI:10.3382/ps.2011-01886 |
| [13] |
高树峰. 发酵银杏叶制备新型生物饲料添加剂的研究[D]. 硕士学位论文. 南京: 南京林业大学, 2014. GAO S F.Study on preparation of new biological feed additive from fermented Ginkgo biloba leaves[D].Master's Thesis.Nanjing: Nanjing Forestry University, 2014.(in Chinese) |
| [14] |
NIU Y, WAN X L, ZHANG L L, et al. Effect of different doses of fermented Ginkgo biloba leaves on serum biochemistry, antioxidant capacity hepatic gene expression in broilers[J]. Animal Feed Science and Technology, 2019, 248: 132-140. DOI:10.1016/j.anifeedsci.2019.01.003 |
| [15] |
KAYDEN H J, CHOW C K, BJORNSON L K. Spectrophotometric method for determination of tocopherol in red blood cells[J]. Journal of Lipid Research, 1973, 14(5): 533-540. DOI:10.1016/S0022-2275(20)36858-9 |
| [16] |
NOGICHI K, CANTOR A H, SCOTT M L. Mode of action of selenium and vitamin E in prevention of exudative diathesis in chicks[J]. The Journal of Nutrition, 1973, 103(10): 1502-1511. DOI:10.1093/jn/103.10.1502 |
| [17] |
KENNEDY S R, CAMPBELL P J, PORTER A, et al. Influence of dietary conjugated linoleic acid (CLA) on lipid and fatty acid composition in liver and flesh of Atlantic salmon (Salmo salar)[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2005, 141(2): 168-178. DOI:10.1016/j.cbpc.2005.02.010 |
| [18] |
窦茂鑫, 吴涛. 饲用微生态制剂的发展现状与应用性研究[J]. 饲料研究, 2013(1): 13-17. SHI M X, WU T. Development status and application of forage microecological preparations[J]. Feed Research, 2013(1): 13-17 (in Chinese). |
| [19] |
CHEN Y S, LIOU H C, CHAN C F. Tyrosinase inhibitory effect and antioxidative activities of fermented and ethanol extracts of Rhodiola rosea and Lonicera japonica[J]. The Scientific World Journal, 2013, 2013: 612739. |
| [20] |
曹银娣, 张旭晖, 孙智远, 等. 银杏-杜仲叶复合发酵工艺优化及发酵物对肉鸡肠道功能的影响[J]. 畜牧与兽医, 2020, 52(6): 27-34. CAO Y D, ZHANG X H, SUN Z Y, et al. Optimization of compound fermentation technology of Ginkgo biloba-Eucommia leaves and the effect of fermentation substance on intestinal function of broilers[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(6): 27-34 (in Chinese). |
| [21] |
RAY G, HUSAIN S A. Oxidants, antioxidants and carcinogenesis[J]. Indian Journal of Experimental Biology, 2002, 40(11): 1213-1232. |
| [22] |
HASHEMIPOUR H, KERMANSHAHI H, GOLIAN A, et al. Effect of thymol and carvacrol feed supplementation on performance, antioxidant enzyme activities, fatty acid composition, digestive enzyme activities, and immune response in broiler chickens[J]. Poultry Science, 2013, 92(8): 2059-2069. DOI:10.3382/ps.2012-02685 |
| [23] |
WAN X L, SONG Z H, NIU Y, et al. Evaluation of enzymatically treated Artemisia annua L. on growth performance, meat quality, and oxidative stability of breast and thigh muscles in broilers[J]. Poultry Science, 2017, 94(4): 844-850. |
| [24] |
NIU Y, WAN X L, ZHANG X H, et al. Effect of supplemental fermented Ginkgo biloba leaves at different levels on growth performance, meat quality, and antioxidant status of breast and thigh muscles in broiler chickens[J]. Poultry Science, 2017, 96(4): 869-877. DOI:10.3382/ps/pew313 |
| [25] |
TOPPO R, ROY B K, GORA R H, et al. Hepatoprotective activity of Moringa oleifera against cadmium toxicity in rats[J]. Veterinary World, 2015, 8(4): 537-540. DOI:10.14202/vetworld.2015.537-540 |
| [26] |
ZHOU T X, CHEN Y J, YOO J S, et al. Effects of chitooligosaccharide supplementation on performance, blood characteristics, relative organ weight, and meat quality in broiler chickens[J]. Poultry Science, 2009, 88(3): 593-600. DOI:10.3382/ps.2008-00285 |
| [27] |
ZHOU Y Q, LIANG M, LI W Z, et al. Protective effects of Eucommia ulmoides Oliv. bark and leaf on amyloid β-induced cytotoxicity[J]. Environmental Toxicology and Pharmacology, 2009, 28(3): 342-349. DOI:10.1016/j.etap.2009.05.012 |
| [28] |
CALFEE-MASON K G, SPER B T, GLAUERT H P. Effects of vitamin E on the NF-κB pathway in rats treated with the peroxisome proliferator, ciprofibrate[J]. Toxicology and Applied Pharmacology, 2004, 199(1): 1-9. DOI:10.1016/j.taap.2004.03.006 |
| [29] |
HUR S J, LEE S Y, KIM Y C, et al. Effect of fermentation on the antioxidant activity in plant-based foods[J]. Food Chemistry, 2014, 160: 346-356. DOI:10.1016/j.foodchem.2014.03.112 |
| [30] |
KATINA K, LAITILA A, JUVONEN R, et al. Bran fermentation as a means to enhance technological properties and bioactivity of rye[J]. Food Microbiology, 2007, 24(2): 175-186. DOI:10.1016/j.fm.2006.07.012 |
| [31] |
MUROTA K, TERAO J. Antioxidative flavonoid quercetin: implication of its intestinal absorption and metabolism[J]. Archives of Biochemistry and Biophysics, 2003, 417(1): 12-17. DOI:10.1016/S0003-9861(03)00284-4 |
| [32] |
KARADEMIR-CATALGOL B, OZDEN S, ALPERTUNGA B. Effects of trichlorfon on malondialdehyde and antioxidant system in human erythrocytes[J]. Toxicology in Vitro, 2007, 21(8): 1538-1544. DOI:10.1016/j.tiv.2007.06.002 |
| [33] |
WANG M Q, DU Y J, YE S S, et al. Effects of Duzhong (Eucommia ulmoides Oliv.) on growth performance and meat quality in broiler chicks[J]. Journal of Animal and Veterinary Advances, 2012, 11(9): 1385-1389. DOI:10.3923/javaa.2012.1385.1389 |




