玉米是我国最主要的饲料原料,同时也是主要的储备粮食品种之一,在保障粮食供应方面发挥着重要作用。临储玉米储存的平均年限通常为3年[1],轮换后作为工业或饲料原料出售。近年来,随着我国临储玉米库存量的持续增加,部分玉米的储存年限超过3年,称为陈化玉米[2]。基于我国国情,陈化玉米今后将长期存在,因此,在饲料中合理利用陈化玉米尤为重要。研究发现,随着储存期的延长,玉米常规概略养分含量变化不明显[3],但玉米中脂质易发生水解而使脂肪酸值增高,不饱和脂肪酸易氧化而产生大量自由基和脂质过氧化产物丙二醛(MDA)[4]。MDA可与蛋白质发生交联导致蛋白质变性,使过氧化氢酶(CAT)和过氧化物酶(POD)活性降低[5];自由基可引起蛋白质发生氧化[6-8],导致蛋白质消化率降低[8-9]。研究表明,饲喂陈化玉米可导致仔猪生长性能和抗氧化功能下降[10],并引发黄膘肉现象[11]。Liu等[12]研究发现,饲喂陈化玉米会导致肉鸡采食量降低和小肠形态受损。Qamar等[13]报道,饲喂陈化玉米对肉鸭的抗氧化功能和胸肌肉品质有负面影响。近年来,我国蛋鸡存栏数保持在12亿~15亿只,饲料需求量大。玉米在蛋鸡饲粮中通常占50%以上,陈化玉米在蛋鸡饲粮中的合理利用十分重要,但有关陈化玉米对蛋鸡的影响则鲜见报道,特别是对蛋鸡消化与抗氧化功能及蛋品质的影响尚不清楚。因此,本研究选取储藏4年的陈化玉米以不同比例等量替代饲粮中的正常玉米,探究陈化玉米对蛋鸡生产性能、消化与抗氧化功能及蛋品质的影响,以期为陈化玉米在蛋鸡饲粮中的合理利用提供参考依据。
1 材料与方法 1.1 试验材料试验所用正常玉米和陈化玉米从安徽省黄山粮食储备库选取,储存时间分别为1和4年,储存条件符合国家标准GB/T 7415—2008规定的要求。
1.2 试验设计与饲养管理将288只60周龄的海兰褐蛋鸡随机分为4组,每组6个重复,每个重复12只蛋鸡。采用不同比例陈化玉米等量替代基础饲粮中的正常玉米,分别为以下4种饲粮处理。1)对照组:基础饲粮(正常玉米);2)25%陈化玉米组:25%陈化玉米等量替代基础饲粮中的正常玉米;3)50%陈化玉米组:50%陈化玉米等量替代基础饲粮中的正常玉米;4)100%陈化玉米组:100%陈化玉米等量替代基础饲粮中的正常玉米。基础饲粮参考NRC(1994)标准配制,其组成及营养水平见表 1。试验在南京市康欣禽业有限公司进行,蛋鸡采用3层阶梯笼饲养。预试期1周,正试期8周。试验期间蛋鸡自由采食和饮水,每天16 h连续光照,每天上、下午分别喂料1次,室温保持在18~23 ℃。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
于试验第28天和第56天从每重复随机选取3个鸡蛋用于鸡蛋品质测定。试验结束时,于每个重复中随机选取1只健康状况良好的蛋鸡,共24只,禁饲12 h(不禁水)。蛋鸡称重后,采用颈静脉采血法用注射器刺入颈静脉处采集5 mL左右血液于洁净离心管中,待血清析出后于4 ℃条件下3 500 r/min离心15 min分离血清,并将血清置于-20 ℃条件下保存待测。血液采集完毕后,从颈椎脱臼处死蛋鸡。待鸡死亡后,立即剖开腹腔,分离肝脏、胰腺、前肠,取肝脏和胰腺放于自封袋中,-20 ℃保存待测。收集前肠食糜于离心管中,-20 ℃保存待测。
1.4 测定指标与方法 1.4.1 正常玉米和陈化玉米的生化特性正常玉米和陈化玉米常规概略养分含量按照张丽英[14]的方法测定,玉米脂肪酸值按照国家标准GB/T 20570—2015的方法进行测定。玉米MDA含量及CAT、POD活性采用试剂盒(南京建成生物工程研究所)按照说明书进行测定。玉米脂肪酸含量采用气相色谱分析仪(GC-2010,日本岛津公司)进行测定,玉米氨基酸含量按照Yin等[15]的方法采用全自动氨基酸分析仪(L-8900,日本日立公司)进行测定。玉米蛋白质羰基(PC)、总巯基(T-SH)和游离巯基(SH)含量按照Zhang等[16]的方法进行测定。
1.4.2 生产性能试验期间,每天记录每个重复蛋鸡的产蛋数、蛋重和死淘数,统计每周耗料量,计算产蛋率、平均日采食量、料蛋比和平均蛋重。
1.4.3 血清生化指标血清中葡萄糖(GLU)、甘油三酯(TG)、总胆固醇(TC)、总蛋白(TP)、白蛋白(ALB)和球蛋白(GLB)含量采用试剂盒(南京建成生物工程研究所)进行测定,测定方法按照说明书进行。
1.4.4 消化酶活性称取0.3 g胰腺和前肠食糜样品,将样品与4 ℃预冷的生理盐水按1 ∶ 9(质量体积比)比例匀浆后于4 ℃、4 000 r/min离心10 min,取上清液于-20 ℃条件下保存待测。采用试剂盒(南京建成生物工程研究所)方法测定胰腺和前肠食糜中的胰蛋白酶、脂肪酶和淀粉酶活性,操作过程严格按照说明书进行。
1.4.5 抗氧化指标采用试剂盒(南京建成生物工程研究所)测定血清和肝脏的总抗氧化能力(T-AOC)、总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)和CAT活性以及还原型谷胱甘肽(GSH)、MDA、PC和T-SH含量,操作过程严格按说明书进行。
1.4.6 蛋品质于试验第28天和第56天从每重复中随机选取3个鸡蛋,测定蛋壳强度、蛋壳厚度、蛋白高度、哈夫单位、蛋黄颜色和蛋黄比例。采用蛋壳强度分析仪(Egg Force Reader,Orka,以色列)测定蛋壳强度;利用螺旋测微器分别测量蛋的中间、锐端以及钝端3个位置的蛋壳厚度,取其平均值,精确到0.01 mm;采用多功能蛋品测定仪(EMT-5200,Robotmation,日本)测定蛋白高度、哈夫单位和蛋黄颜色;用鸡蛋分离器将蛋黄与蛋清分离,采用电子天平进行称重,计算蛋黄比例:
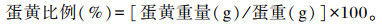
|
试验数据采用Excel 2013进行初步处理后,用SPSS 25.0软件进行单因素方差分析(one-way ANOVA),各组间差异用Duncan氏法进行多重比较分析,P<0.05为差异显著,结果以平均值±标准误(SE)表示。
2 结果与分析 2.1 正常玉米和陈化玉米的生化特性由表 2可知,正常玉米和陈化玉米的水分、粗蛋白质、粗脂肪和粗灰分含量均无明显差异。与正常玉米相比,陈化玉米的不饱和脂肪酸含量降低,脂肪酸值及MDA、PC含量升高,CAT和POD活性及T-SH、SH含量降低。
|
|
表 2 正常玉米与陈化玉米的生化特性(风干基础) Table 2 Biochemical properties of normal corn and aging corn (air-dry basis) |
由表 3可知,与正常玉米相比,陈化玉米中蛋氨酸、甘氨酸、赖氨酸和精氨酸含量下降。
|
|
表 3 正常玉米与陈化玉米氨基酸含量分析 Table 3 Analysis of amino acids contents in normal corn and aging corn |
由表 4可知,与对照组相比,100%陈化玉米组蛋鸡产蛋率显著降低(P<0.05)。各组之间蛋鸡的平均日采食量、料蛋比和平均蛋重均无显著差异(P>0.05)。
|
|
表 4 陈化玉米对蛋鸡生产性能的影响 Table 4 Effects of aging corn on performance of laying hens. |
由表 5可知,与对照组相比,100%陈化玉米组蛋鸡血清GLU和ALB含量显著下降(P<0.05)。各组之间蛋鸡的血清TC、TG、TP、GLB含量无显著差异(P>0.05)。
|
|
表 5 陈化玉米对蛋鸡血清生化指标的影响 Table 5 Effects of aging corn on serum biochemical parameters of laying hens |
由表 6可知,与对照组相比,50%和100%陈化玉米组蛋鸡的前肠食糜中胰蛋白酶活性显著降低(P<0.05)。各组之间蛋鸡的胰腺中胰蛋白酶活性以及胰腺和前肠食糜中脂肪酶、淀粉酶活性无显著差异(P>0.05)。
|
|
表 6 陈化玉米对蛋鸡胰腺和前肠食糜消化酶活性的影响 Table 6 Effects of aging corn on activities of digestive enzyme in pancreas and anterior intestinal chyme of laying hens |
由表 7可知,与对照组相比,100%陈化玉米组蛋鸡的血清MDA含量显著升高(P<0.05),25%、50%、100%陈化玉米组蛋鸡的血清GSH-Px活性均显著下降(P<0.05)。各组之间蛋鸡的血清T-SH、PC和GSH含量以及T-AOC、T-SOD和CAT活性无显著差异(P>0.05)。
|
|
表 7 陈化玉米对蛋鸡血清抗氧化指标的影响 Table 7 Effects of aging corn on serum antioxidant parameters of laying hens |
由表 8可知,与对照组相比,50%和100%陈化玉米组蛋鸡的肝脏MDA含量显著升高(P<0.05),100%陈化玉米组的蛋鸡肝脏PC含量显著升高(P<0.05),50%和100%陈化玉米组的蛋鸡肝脏GSH-Px活性显著下降(P<0.05),100%陈化玉米组蛋鸡的肝脏CAT活性显著下降(P<0.05)。各组之间蛋鸡的肝脏T-SH和GSH含量以及T-AOC和T-SOD活性无显著差异(P>0.05)。
|
|
表 8 陈化玉米对蛋鸡肝脏抗氧化指标的影响 Table 8 Effects of aging corn on liver antioxidant parameters of laying hens |
由表 9可知,与对照组相比,试验第56天100%陈化玉米组鸡蛋的蛋黄颜色显著降低(P<0.05)。各组之间试验第28天和第56天鸡蛋的蛋壳强度、蛋壳厚度、蛋白高度、哈夫单位和蛋黄比例均无显著差异(P>0.05)。
|
|
表 9 陈化玉米对蛋鸡蛋品质的影响 Table 9 Effects of aging corn on egg quality of laying hens |
玉米在储存过程中不可避免的会发生一系列生理和化学变化。研究表明,玉米经过长时间储存后,其脂质易发生水解而使脂肪酸值升高,不饱和脂肪酸易氧化而产生脂质过氧化产物MDA[4]。本研究中,陈化玉米脂肪酸值高达109.18 mg KOH/100 g,属重度不宜储存,且陈化玉米中MDA含量升高,CAT和POD活性以及不饱和脂肪酸含量下降,表明陈化玉米已经发生了脂质氧化,而脂质过氧化会产生羟自由基等自由基,这些自由基能引起蛋白质发生氧化,从而导致蛋白质结构和功能性质变化,降低可消化性。研究发现,蛋白质在氧化过程中,羟自由基攻击蛋白质侧链的α碳原子或活性氧导致肽链断裂会形成PC,SH也会被氧化成二硫键[6-8]。因此,PC、T-SH和SH含量是衡量蛋白质氧化程度的重要指标[17]。权萌萌等[6]报道,稻谷中PC含量随着储藏时间延长而增多。吴大伟等[18]发现,随着储存时间延长,豆粕中PC含量升高,而T-SH含量下降。尹阳阳等[19]报道,随着储藏时间延长,稻谷中T-SH含量减少,二硫键含量上升。本研究结果表明,与正常玉米相比,陈化玉米中PC含量升高,且T-SH含量降低,提示在储存过程中部分蛋白质发生了氧化。
3.2 陈化玉米对蛋鸡生产性能的影响长期储存导致陈化玉米脂质过氧化与蛋白质氧化程度加深,引起蛋白质结构改变,降低陈化玉米的营养价值,进而影响摄食陈化玉米动物的生产性能[10-11]。朱正鹏等[20]研究发现,饲喂30%陈化玉米饲粮使肉鸭的平均日增重显著降低。Liu等[12]报道,饲喂100%陈化玉米饲粮显著降低了肉鸡的平均日采食量和料重比。本研究结果表明,陈化玉米对蛋鸡的平均日采食量、料蛋比和平均蛋重没有显著影响,但100%陈化玉米组蛋鸡的产蛋率显著下降,表明陈化玉米对蛋鸡的生产性能产生了负面影响。研究表明,普通玉米与陈化玉米的代谢能值无显著差异,二者常规概略养分含量差异亦较小,但陈化玉米的粗蛋白质消化率有所下降[13, 21-23]。因此,蛋鸡摄食陈化玉米后产蛋率下降的主要原因可能是玉米长期储存后发生了脂质过氧化与蛋白质氧化,降低了不饱和脂肪酸和氨基酸含量以及蛋白质可消化性,导致其营养价值降低,并可能对蛋鸡造成氧化损伤,影响其健康和生产性能,且与陈化玉米在饲粮中的使用比例有关。
3.3 陈化玉米对蛋鸡消化功能的影响血清生化指标可以反映机体健康和营养状况。GLU含量与机体糖代谢密切相关,血清ALB含量可间接反映机体蛋白质代谢能力。本研究发现,100%陈化玉米组蛋鸡的血清GLU含量显著降低。刘洋等[24]报道,饲喂储存3年的玉米使肉鸡血清GLU含量显著降低。陈化玉米可导致仔猪空肠黏膜中葡萄糖转运蛋白2的mRNA表达量下降[25]。但也有研究报道,陈化玉米显著提高了仔猪空肠黏膜中钠-葡萄糖协同转运蛋白1的mRNA表达量[26]。尽管试验动物不同,但陈化玉米在蛋鸡上可能也存在相似的作用机制,从而导致蛋鸡的血清GLU含量降低。此外,100%陈化玉米组蛋鸡的血清ALB含量显著减少,提示陈化玉米造成蛋鸡蛋白质合成和利用率减少,这可能与陈化玉米中蛋白质氧化和氨基酸含量变化有关。
动物对各种营养物质的消化均需要酶参与。Rideau等[27]指出,鸡的消化酶主要在小肠中发挥作用,其活力可以反映机体消化功能和代谢状况。本研究中,50%和100%陈化玉米组蛋鸡的前肠食糜中胰蛋白酶活性均显著降低,提示陈化玉米影响了蛋鸡对蛋白质的消化利用。王坤等[28]报道,常温储存可引起豆粕蛋白质氧化,蛋鸡摄入蛋白质氧化豆粕后降低了其回肠食糜中胰蛋白酶活性。赵同芳[9]指出,谷物长期储存后其蛋白质的胃蛋白酶和胰蛋白酶消化率下降。蛋白质发生氧化时,酪氨酸会发生交联生成双聚酪氨酸,双聚酪氨酸具有抵抗酸水解和抑制蛋白酶活性作用[29]。此外,蛋白质氧化使氨基酸残基生成PC化合物、SH形成二硫键等都会影响蛋白质的理化性质,从而导致酶对其的化学和物理作用位点发生变化,降低蛋白质水解能力,进而降低其可消化性[30]。本试验中,蛋鸡摄食陈化玉米后前肠食糜中胰蛋白酶活性下降可能与储存过程中陈化玉米蛋白质发生氧化有关。
3.4 陈化玉米对蛋鸡抗氧化功能的影响脂质过氧化会产生活性氧(ROS),当ROS含量超过细胞的抗氧化保护水平时会导致DNA、蛋白质和内源性脂质破坏[31]。MDA是脂质过氧化的主要产物,PC和T-SH是反映蛋白质氧化水平的重要指标[17],这些化合物含量间接表明机体氧化损伤程度。抗氧化防御系统控制着机体的氧化还原平衡,包括酶和非酶体系[32]。抗氧化酶系统是抵抗ROS损伤机体的防御系统,包括T-SOD、GSH-Px和CAT。GSH是非酶类抗氧化剂之一,在GSH-Px的作用下清除自由基。李锦英等[10]报道,饲喂储存期为4年的陈化玉米显著降低了仔猪血清GSH-Px活性和T-AOC。Qamar等[13]亦发现,饲喂陈化玉米饲粮肉鸭血清T-AOC及T-SOD、CAT活性显著降低。本研究中,各陈化玉米组蛋鸡血清中GSH-Px活性显著降低,50%和100%陈化玉米组蛋鸡肝脏中GSH-Px活性显著降低,100%陈化玉米组蛋鸡肝脏中CAT活性显著降低,提示陈化玉米引起蛋鸡产生过多的ROS,造成机体抗氧化能力下降,且与陈化玉米的替代比例有关。ROS可以诱导脂质过氧化,也可以直接攻击蛋白质,使其发生氧化[33],脂质过氧化产物也可与蛋白质分子发生交联,引起蛋白质氧化。Chen等[34]研究发现,在给肉鸡腹腔注射过氧化氢建立的氧化应激模型中,随着胸肌中ROS和MDA含量升高,PC含量也显著提高。Zhang等[16]报道,饲喂热氧化大豆分离蛋白的肉鸡血清MDA和PC含量上升。Liu等[12]报道,饲喂100%陈化玉米饲粮的肉鸡血清MDA含量显著升高。本研究中,50%陈化玉米组蛋鸡的肝脏MDA含量显著上升,100%陈化玉米组蛋鸡的血清和肝脏MDA含量显著升高,肝脏PC含量显著上升,提示蛋鸡摄入陈化玉米后发生了脂质氧化,并引起蛋白质氧化,且存在剂量效应。这可能是因为陈化玉米中MDA含量显著升高,ROS蓄积[35],导致蛋鸡摄入外源性ROS含量增加,过量的ROS超过了机体的可调节范围,降低了蛋鸡的抗氧化能力,使机体遭受氧化损伤。
3.5 陈化玉米对蛋鸡蛋品质的影响蛋品质受许多因素影响,如品系、年龄和营养等[36]。尽管蛋黄颜色与营养价值、新鲜度或烹饪特性无关,但蛋黄颜色是消费者衡量鸡蛋品质的主要指标之一。蛋黄颜色由蛋鸡饲粮中的黄色和红色类胡萝卜素或叶黄素沉积到蛋黄中而形成[37]。蛋鸡自身不能合成这些类胡萝卜素和叶黄素,必须从饲粮中获取[38],饲粮组成以及各成分之间的比例对色素沉积具有重要影响。玉米作为蛋鸡饲料的主要原料,是类胡萝卜素和叶黄素的重要来源。本研究中,100%陈化玉米组蛋鸡的蛋黄颜色显著降低,提示蛋鸡摄食陈化玉米后蛋黄中色素沉积减少,这可能与陈化玉米中叶黄素和玉米黄质含量有关。在储存过程中玉米中的叶黄素和玉米黄质易被氧化而发生降解[39],且饲粮中的多不饱和脂肪酸被氧化后可加速叶黄素和玉米黄质的氧化而减少色素沉积[40]。因此,本研究中可能是由于储存导致陈化玉米中叶黄素和玉米黄质含量下降,进而使摄入陈化玉米的蛋鸡体内类胡萝卜素和叶黄素的吸收和在鸡蛋中的沉积减少,从而影响了蛋黄颜色。
4 结论① 不同替代比例陈化玉米均使蛋鸡的产蛋率有所降低,尤其是100%陈化玉米替代正常玉米显著降低了蛋鸡的产蛋率,但陈化玉米对蛋鸡的平均日采食量、料蛋比和平均蛋重无显著影响。
② 不同替代比例陈化玉米使蛋鸡血清GLU和ALB含量降低,前肠消化功能下降;蛋鸡血清和肝脏抗氧化功能均有不同程度下降,且100%陈化玉米替代正常玉米使蛋鸡上述指标显著下降。
③ 不同替代比例陈化玉米不影响鸡蛋的蛋壳强度、蛋壳厚度、蛋白高度、哈夫单位和蛋黄比例,但100%陈化玉米替代正常玉米对蛋黄颜色造成一定负面影响。
| [1] |
胡元森, 段永康, 王改利, 等. 不同储藏年限玉米主要品质变化研究[J]. 农业机械, 2011(6): 64-67. HU Y S, DUAN Y K, WANG G L, et al. Study on main quality changes of maize in different storage years[J]. Farm Machinery, 2011(6): 64-67 (in Chinese). |
| [2] |
杨露, 赵江涛, 谭会泽, 等. 储藏玉米陈化机制及品质判定进展[J]. 饲料研究, 2016(24): 49-53. YANG L, ZHAO J T, TAN H Z, et al. Advances in aging mechanism and quality judgment of stored corn[J]. Feed Research, 2016(24): 49-53 (in Chinese). |
| [3] |
王改利. 玉米储藏期霉菌活动、品质变化及挥发性物质成分分析[D]. 硕士学位论文. 郑州: 河南工业大学, 2010: 8-13. WANG G L.Fungal activity, quality changes and analysis of volatile compounds in stored corn[D].Master's Thesis.Zhengzhou: Henan University of Technology, 2010: 8-13.(in Chinese) |
| [4] |
周显青, 张玉荣, 张勇. 储藏玉米陈化机理及挥发物与品质变化的关系[J]. 农业工程学报, 2008, 24(7): 242-246. ZHOU X Q, ZHANG Y R, ZHANG Y, et al. Ageing mechanism of stored maize and the relationship between its volatile components and quality[J]. Transactions of the Chinese Society of Agricultural Engineering, 2008, 24(7): 242-246 (in Chinese). |
| [5] |
张玉荣, 周显青, 张勇. 储存玉米膜脂过氧化与生理指标的研究[J]. 中国农业科学, 2008, 41(10): 3410-3414. ZHANG Y R, ZHOU X Q, ZHANG Y, et al. Research on membrane lipid peroxidation and physiological parameters of storage maize[J]. Scientia Agricultura Sinica, 2008, 41(10): 3410-3414 (in Chinese). |
| [6] |
权萌萌, 鞠兴荣, 石嘉怿. 稻谷蛋白质氧化及其对稻谷陈化品质的影响[J]. 粮食与饲料工业, 2015(8): 9-13. QUAN M M, JU X R, SHI J Y, et al. Effects of protein oxidation on aging quality of rice[J]. Cereal & Feed Industry, 2015(8): 9-13 (in Chinese). |
| [7] |
黄友如, 华欲飞, 裘爱泳. 脂质氧化诱导的大豆蛋白质聚集机理的研究[J]. 中国粮油学报, 2006, 21(1): 80-87. HUANG Y R, HUA Y F, QIU A Y. Mechanism of aggregation of soybean proteins induced by lipid oxidation[J]. Journal of the Chinese Cereals and Oils Association, 2006, 21(1): 80-87 (in Chinese). |
| [8] |
郭玉宝. 大米储藏陈化中蛋白质对其糊化特性的影响及其相关陈化机制研究[D]. 博士学位论文. 南京: 南京农业大学, 2012: 103-117. GUO Y B.The effects of protein on pasting properties of rice during storage ageing and its related ageing mechanism[D].Ph.D.Thesis.Nanjing: Nanjing Agricultural University, 2012: 103-117.(in Chinese) |
| [9] |
赵同芳. 粮食品质研究概述[J]. 粮食储藏, 1983(6): 24-29. ZHAO T F. Overview of food quality research[J]. Grain Storage, 1983(6): 24-29 (in Chinese). |
| [10] |
李锦英, 陈代文, 郑萍, 等. 饲粮添加陈化玉米和复合抗氧化剂对仔猪生长性能、抗氧化功能及肝脏损伤的影响[J]. 四川农业大学学报, 2019, 37(1): 83-91. LI J Y, CHEN D W, ZHENG P, et al. Effects of aging corn and antioxidant blend supplementation on growth performance, antioxidant capacity and liver injure of weaning piglets[J]. Journal of Sichuan Agricultural University, 2019, 37(1): 83-91 (in Chinese). |
| [11] |
孙得发. 2016—2017年中国饲料企业使用陈化玉米导致的黄膘肉问题及思考[J]. 中国畜牧杂志, 2017, 53(7): 147-151, 166. SUN D F. The yellow fat problem caused by the use of aged corn in Chinese feed enterprises from 2016 to 2017 and its thinking[J]. Chinese Journal of Animal Science, 2017, 53(7): 147-151, 166 (in Chinese). |
| [12] |
LIU J B, YAN H L, ZHANG Y, et al. Effects of stale maize on growth performance, immunity, intestinal morphology and antioxidant capacity in broilers[J]. Asian-Australasian Journal of Animal Sciences, 2020, 33(4): 605-614. DOI:10.5713/ajas.19.0224 |
| [13] |
QAMAR S H. Effect and mechanism of aging corn and rice bran oil on performance, antioxidative status, intestinal physiology and meat quality of meat duck[D]. 博士学位论文. 雅安: 四川农业大学, 2019: 58-92. QAMAR S H.Effect and mechanism of aging corn and rice bran oil on performance, antioxidative status, intestinal physiology and meat quality of meat duck[D].Ph.D.Thesis.Ya'an: Sichuan Agricultural University, 2019: 58-92. |
| [14] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业大学出版社, 2007: 49-79. ZHANG L Y. Analysis of feed and feed quality detection technology[M]. 3rd ed. Beijing: China Agricultural University Press, 2007: 49-79 (in Chinese). |
| [15] |
YIN F G, LIU Y L, YIN Y L, et al. Dietary supplementation with Astragalus polysaccharide enhances ileal digestibilities and serum concentrations of amino acids in early weaned piglets[J]. Amino Acids, 2009, 37(2): 263-270. DOI:10.1007/s00726-008-0142-6 |
| [16] |
ZHANG X L, LU P, XUE W Y, et al. An evaluation of heat on protein oxidation of soy protein isolate or soy protein isolate mixed with soybean oil in vitro and its consequences on redox status of broilers at early age[J]. Asian-Australasian Journal of Animal Sciences, 2017, 30(8): 1135-1142. DOI:10.5713/ajas.16.0683 |
| [17] |
LEVINE R L, GARLAND D, OLIVER C N, et al. Determination of carbonyl content in oxidatively modified proteins[J]. Methods in Enzymology, 1990, 186: 464-478. |
| [18] |
吴大伟, 陈星, 洑琴, 等. 常温储存和干热处理对豆粕蛋白质氧化的影响[J]. 中国粮油学报, 2014, 29(5): 90-94. WU D W, CHEN X, FU Q, et al. Effects of storing and heating on protein oxidation of soybean meal[J]. Journal of the Chinese Cereals and Oils Association, 2014, 29(5): 90-94 (in Chinese). |
| [19] |
尹阳阳, 卞科, 魏红艳. 稻谷储藏过程中巯基与质构特性的关系[J]. 农产品加工, 2010(6): 71-73. YIN Y Y, BIAN K, WEI H Y. The relationship between sulfhydryl groups and texture characteristics in rice storage[J]. Farm Products Processing, 2010(6): 71-73 (in Chinese). |
| [20] |
朱正鹏, 王瑜铭, 丁莹, 等. 陈化玉米对肉鸭生长性能、抗氧化功能及免疫器官指数的影响[J]. 中国畜牧杂志, 2018, 54(11): 71-74. ZHU Z P, WANG Y M, DING Y, et al. Effects of aged corn on growth performance, serum antioxidant activity and immune organ indexes of meat ducks[J]. Chinese Journal of Animal Science, 2018, 54(11): 71-74 (in Chinese). |
| [21] |
YIN D F, YUAN J M, GUO Y M, et al. Effect of storage time on the characteristics of corn and efficiency of its utilization in broiler chickens[J]. Animal Nutrition, 2017, 3(3): 252-257. DOI:10.1016/j.aninu.2017.04.007 |
| [22] |
CABELL C A, ELLIS N R. Feeding value of stored corn[J]. Journal of Animal Science, 1955, 14(4): 1167-1173. DOI:10.2527/jas1955.1441167x |
| [23] |
BARTOV I. Effect of storage duration on the nutritional value of corn kernels for broiler chicks[J]. Poultry Science, 1996, 75(12): 1524-1527. DOI:10.3382/ps.0751524 |
| [24] |
刘洋, 刘比一, 尹达菲, 等. 不同储存时间的玉米对肉鸡血清生化和组织学的影响[J]. 中国家禽, 2015, 37(13): 22-26. LIU Y, LIU B Y, YIN D F, et al. Effect of corns at different storage periods on serum biochemical parameters and organ histology of broilers[J]. China Poultry, 2015, 37(13): 22-26 (in Chinese). |
| [25] |
LUO B, CHEN D W, TIAN G, et al. Effects of dietary aged maize with oxidized fish oil on growth performance, antioxidant capacity and intestinal health in weaned piglets[J]. Animals, 2019, 9(9): 624. DOI:10.3390/ani9090624 |
| [26] |
李锦英, 陈代文, 郑萍, 等. 饲粮添加陈化玉米和复合抗氧化剂对仔猪空肠屏障及后肠微生物和代谢产物的影响[J]. 中国兽医学报, 2019, 39(9): 1840-1849. LI J Y, CHEN D W, ZHENG P, et al. Effects of aging corn and complex antioxidant supplementation on the jejunal barrier and hindgut microbes and metabolities of piglets[J]. Chinese Journal of Veterinary Science, 2019, 39(9): 1840-1849 (in Chinese). |
| [27] |
RIDEAU N, NITZAN Z, MONGIN P. Activities of amylase, trypsin and lipase in the pancreas and small intestine of the laying hen during egg formation[J]. British Poultry Science, 1983, 24(1): 1-9. DOI:10.1080/00071668308416707 |
| [28] |
王坤, 何青芬, 程业飞, 等. 维生素E缓解蛋白质氧化豆粕对蛋鸡生产性能、消化功能和鸡蛋品质的影响[J]. 南京农业大学学报, 2020, 43(2): 318-325. WANG K, HE Q F, CHENG Y F, et al. The protective effects of vitamin E on laying performance, digestive function and egg quality in laying hens fed with protein-oxidized soybean meal[J]. Journal of Nanjing Agricultural University, 2020, 43(2): 318-325 (in Chinese). |
| [29] |
ABDELRAHIM M, MORRIS E, CARVER J, et al. Liquid chromatographic assay of dityrosine in human cerebrospinal fluid[J]. Journal of Chromatography B: Biomedical Sciences and Applications, 1997, 696(2): 175-182. DOI:10.1016/S0378-4347(97)00248-X |
| [30] |
GRUNE T, JUNG T, MERKER K, et al. Decreased proteolysis caused by protein aggregates, inclusion bodies, plaques, lipofuscin, ceroid, and 'aggresomes' during oxidative stress, aging, and disease[J]. The International Journal of Biochemistry & Cell Biology, 2004, 36(12): 2519-2530. |
| [31] |
YU B P. Cellular defenses against damage from reactive oxygen species[J]. Physiological Reviews, 1994, 74(1): 139-162. DOI:10.1152/physrev.1994.74.1.139 |
| [32] |
MICHIELS C, RAES M, TOUSSAINT O, et al. Importance of Se-glutathione peroxidase, catalase, and Cu/Zn-SOD for cell survival against oxidative stress[J]. Free Radical Biology and Medicine, 1994, 17(3): 235-248. DOI:10.1016/0891-5849(94)90079-5 |
| [33] |
DRÖGE W. Free radicals in the physiological control of cell function[J]. Physiological Reviews, 2002, 82(1): 47-95. DOI:10.1152/physrev.00018.2001 |
| [34] |
CHEN X X, ZHANG L, LI J L, et al. Hydrogen peroxide-induced change in meat quality of the breast muscle of broilers is mediated by ROS generation, apoptosis, and autophagy in the NF-κB signal pathway[J]. Journal of Agricultural and Food Chemistry, 2017, 65(19): 3986-3994. DOI:10.1021/acs.jafc.7b01267 |
| [35] |
周显青, 张玉荣, 张勇. 储存玉米生理指标的研究[J]. 玉米科学, 2007, 15(4): 96-99. ZHOU X Q, ZHANG Y R, ZHANG Y. Studies on the physi1ological indexes of stored-maize[J]. Journal of Maize Sciences, 2007, 15(4): 96-99 (in Chinese). |
| [36] |
SILVERSIDES F G, SCOTT T A. Effect of storage and layer age on quality of eggs from two lines of hens[J]. Poultry Science, 2001, 80(8): 1240-1245. DOI:10.1093/ps/80.8.1240 |
| [37] |
沈曼曼, 王莹. 影响蛋黄颜色沉积因素分析[J]. 广东饲料, 2014, 23(6): 43-45. SHEN M M, WANG Y. Analysis of factors affecting egg yolk color deposition[J]. Guangdong Feed, 2014, 23(06): 43-45 (in Chinese). |
| [38] |
BLOUNT J D, HOUSTON D C, MOLLER A P. Why egg yolk is yellow[J]. Trends in Ecology & Evolution, 2000, 15(2): 47-49. |
| [39] |
UYGUN-SARIBAY M, ERGUN E, KÖSEOǦLU T. Effect of gamma irradiation and storage on lutein and zeaxanthin in liquid, frozen and dried egg yolk samples[J]. Journal of Radioanalytical and Nuclear Chemistry, 2014, 301(2): 597-605. DOI:10.1007/s10967-014-3171-5 |
| [40] |
VAN HET HOF K H, WEST C E, WESTSTRATE J A, et al. Dietary factors that affect the bioavailability of carotenoids[J]. The Journal of Nutrition, 2000, 130(3): 503-506. DOI:10.1093/jn/130.3.503 |




