意大利蜜蜂(Apis mellifera ligustica,简称意蜂)是我国饲养的主要蜜蜂品种。它繁殖力强、产量高,不仅可以为农作物授粉,提高农作物产量,而且可以提供价值高、用途广的蜂产品,对自然生态环境的保护具有重要的作用。意蜂为变温动物,对气温的变化极为敏感,以强群越冬,在较高纬度地区,越冬困难。并且,在早春育虫时,工蜂往往因受冻损失,春季群势发展迟缓。山梨醇、海藻糖为蜜蜂体内重要的小分子抗寒性物质,因此探究添加外源山梨醇和海藻糖对意蜂个体抗寒生理机制的影响对提高早春和越冬期蜂群的饲养管理水平和蜜蜂抗寒新品系的选育具有重要的作用。海藻糖是生物体内一种重要的双糖。作为昆虫体内重要血糖,海藻糖存在于昆虫几乎所有的组织和器官中[1-3]。海藻糖可以通过降低昆虫体液的过冷却点,提高昆虫的抗寒性,从而使昆虫躲避低温冻害。在维持蛋白质的稳定方面,研究发现海藻糖可在高温、高寒、高渗透压及干燥失水等恶劣环境条件下在细胞表面形成独特的保护膜,有效地保护蛋白质分子使之不变性失活,从而维持生命体的生命过程和生物特征[4]。海藻糖酶(THL)是一种葡萄糖苷酶,可专一地催化1分子海藻糖水解为2分子葡萄糖,用于维持机体正常的生理及生命活动[5-6]。海藻糖和THL与昆虫的抗性有着密切的关系,其含量或活性的变化在一定程度上可以反映昆虫抗性的强度及其对环境的适应性,在昆虫的抗逆境能力中扮演着重要的角色[7-8]。另外,生物体内多羟基化合物的积累对提高昆虫抗逆性也十分重要,主要包括山梨醇、甘油和丙二醇等。研究发现,山梨醇能够明显提高蚜虫和粉虱耐高温能力[9]。除此之外,蚕卵内山梨醇含量与滞育开始、持续和解除的过程具有密切的平行关系[10]。对麦红吸浆虫而言, 山梨醇能够降低体液的冰点, 增强虫体的抗寒性, 体液内山梨醇也可以提高渗透压, 有利于保持体内水分的平衡, 提高不同滞育期间麦红吸浆虫的抗寒能力[11]。山梨醇脱氢酶(SDH)是调控生物体内山梨醇含量的关键酶之一,可将山梨醇氧化为糖原, 为机体提供能量[12]。昆虫耐寒性研究至今已成为昆虫生物学及生态学研究的热门领域。国内外针对昆虫抗寒性研究主要包括抗寒性的类型、测定方法及影响因素等。在昆虫抗寒性相关指标的探索方面,前人做了大量的研究,李志勇等[13]研究表明,越冬性能更强的东方蜜蜂其过冷却点显著低于抗寒力较弱的西方蜜蜂。Danks[14]研究表明,昆虫会在越冬期降低体内的游离水含量,提高结合水含量,进而可以避免体内液体的结冰现象。常志光等[15]研究发现,昆虫抗寒性与体内脂肪含量呈正相关。李浩[16]研究发现,昆虫体内游离水和葡萄糖含量的增加使过冷却点升高;脂肪、山梨醇含量的增加使过冷却点降低, 从而影响昆虫抗寒性。相关研究表明,欧桦小蠹(Scolytus ratzeburgi)幼虫的抗寒系统为:甘油-山梨醇-葡萄糖-海藻糖[17]。综上所述,山梨醇和海藻糖在提高昆虫抗寒性能方面发挥了重要的作用,鉴于此,本研究通过外源添加海藻糖和山梨醇,比较意蜂过冷却点、抗寒性物质含量、关键酶活性以及抗寒相关基因表达的变化,来探讨山梨醇和海藻糖在提高意蜂抗寒性能方面的生理生化机制。
1 材料与方法 1.1 试验设计本试验于2019年3月底至2019年10月底在山东农业大学试验蜂场和山东农业大学本部2号楼进行。从意蜂姊妹蜂群中随机选取900只刚出房的幼蜂,随机分成6组,每组3个重复,每个重复50只蜜蜂。6组均于实验室内饲养,于常温(30 ℃)和冷处理(4 ℃冷驯化2 h)条件下,分别饲喂蔗糖溶液(对照,由蔗糖和去离子水配制成的蔗糖水平为50%的糖溶液)、海藻糖溶液(由蔗糖、去离子水和海藻糖配制成的海藻糖水平为5%的糖溶液)及山梨醇溶液(由蔗糖、去离子水和山梨醇配制成的山梨醇水平为10%的糖溶液)。
各组蜜蜂饲养于饲喂盒中(每盒50只蜜蜂),并将饲喂盒放置于恒温恒湿培养箱中,调节恒温恒湿培养箱的温度为30 ℃,相对湿度为50%~60%,各组分别饲喂12 d,冷处理条件下的3个组在饲喂12 d后放置于4 ℃低温培养箱中冷驯化2 h。蜜蜂冷冻于-80 ℃冰箱中储存。另取900只意蜂,按照以上分组饲养,用于取血淋巴。蜜蜂抗寒性能指标包括游离水、结合水、脂肪、糖原和蛋白质含量,THL、SDH活性以及血淋巴中山梨醇、海藻糖、果糖含量。并采用实时荧光定量PCR(qRT-PCR)方法检测蜂体海藻糖-6-磷酸合成酶(TPS)、SDH的mRNA相对表达量差异。
1.2 蜂体过冷却点、冰点测定过冷却点、冰点的测定参考秦玉川等[18]的热电偶方法,使用低温恒温槽和数据采集器等组成的过冷却点测定系统,将温度探头置于蜜蜂腹部,并进行固定。温度探头与计算机系统相连置于低温恒温槽中,蜂体温度随着恒温箱温度以2 ℃/min持续下降,直至蜂体开始结冰,蜂体在小分子抗冻保护剂的作用下释放潜热,体温开始回升,体内刚开始回升时的温度为过冷却点。蜂体温度上升到最高点后开始下降,蜜蜂开始结冰,此转折点记录的温度即冰点。每个组各取48只意蜂(每个重复16只)分别进行测定。
1.3 蜂体游离水含量测定每个重复取意蜂10只,放入已知重量的称量瓶中,用电子天平(精度0.01 mg)称量鲜重(FW),然后将蜜蜂样本放入电热恒温鼓风干燥箱中65 ℃、48 h,测定干重(DW),计算蜂体的游离水含量。
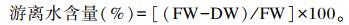
|
测完含水量的蜂体采用氯仿甲醇法测定脂肪含量: 将氯仿和甲醇按体积比2 ∶ 1配制20 mL氯仿-甲醇(2∶1)溶液待用。取上述配好的溶液2 mL,与测完含水量的蜂体充分匀浆,再离心10 min(5 000 r/min),取上清,残余固体用2 mL氯仿-甲醇(2∶1)溶液离心10 min(5 000 r/min),取上清,上清中加入1.2 mL 1.6% CaCl2,盖紧摇晃后静置1 h,离心10 min(5 000 r/min),弃上清。用2% CaCl2-氯仿-甲醇(3∶8∶4)混合液的下层液1 mL加入上清中,离心10 min,使用移液枪将上述溶液离心10 min后的上清液吸取,并取1 mL 2% CaCl2-氯仿-甲醇(3∶8∶4)混合液的上层液轻轻置于离心管下层液。离心10 min,继续使用移液枪吸取上清液后,将剩下的下层液全部导入称量瓶中,在70 ℃干燥24 h,称重即为脂肪含量。
1.5 蜂体糖原含量测定每个重复取3只。准确称取蜂体0.1~0.2 g样品,加入0.75 mL提取液充分匀浆;转移至10 mL试管中;将试管放入恒温水浴锅中95 ℃水浴20 min(盖紧,防止水分散失),隔5 min振摇试管1次,使充分混匀;待组织全部溶解后,将试管冷却至室温,用蒸馏水定容到5 mL,振荡混匀,8 000 r/min、25 ℃离心10 min,取上清液测定糖原含量。
1.6 血淋巴中小分子糖醇含量测定每个重复取50只蜜蜂,用毛细管取意蜂血淋巴100 μL于离心管中,采用试剂盒(苏州科铭生物技术有限公司)测定血淋巴中海藻糖、山梨醇、果糖含量,采用日立7020型全自动生化分析仪测定血淋巴中葡萄糖含量。
1.7 蜂体THL活性测定每个重复取3只蜜蜂,采用THL试剂盒(苏州科铭生物技术有限公司)测定: 按照蜂体组织质量(g) ∶提取液体积(mL)为1 ∶ 10比例,冰浴中充分匀浆。匀浆液于4 ℃低温离心机中8 000 r/min离心10 min,取上清用EL80S超级酶标仪在505 nm处测定吸光度。余下蜂体上清,用EL80S超级酶标仪在562 nm处测定吸光度,计算蛋白质浓度。
1.8 蜂体SDH活性测定每个重复取3只蜜蜂,采用SDH试剂盒(苏州科铭生物技术有限公司)测定。按照蜂体组织质量(g) ∶提取液体积(mL)为1 ∶ 10的比例,进行冰浴匀浆。4 ℃低温离心机中8 000 r/min离心10 min,取上清,用紫外分光光度计在340 nm处测定吸光度,计算酶活性。剩余上清液用于测定相应蜂体的蛋白质浓度。
1.9 总RNA提取与qRT-PCR采用qRT-PCR法检测TPS、SDH mRNA相对表达量。每个重复选取5只蜜蜂液氮研磨,Trizol法提取总mRNA,然后使用反转录试剂盒(TaKaRa:DRR037A)将总RNA立即反转录为cDNA,反转录操作步骤如下: 20 μL体系混匀后,25 ℃反应10 min,55 ℃反应30 min,85 ℃灭活5 min,4 ℃终止反应,共1个循环,调节样品cDNA浓度于相同水平后,-20 ℃保存待用。取1 000 ng cDNA加入到20 μL荧光定量体系中,按照荧光定量试剂盒(TaKaRa)操作指南,用7500 Real-Time PCR仪(ABI 7500,美国)检测目的基因相对表达量。目的基因引物设计参考序列来自于NCBI数据库,以β-肌动蛋白(β-action)为内参,采用Primer 5.0进行引物设计,委托生工生物科技有限公司合成引物,引物序列见表 1。
|
|
表 1 试验中PCR引物 Table 1 PCR primers in this study |
数据采用SAS 9.2统计软件进行单因素方差分析(one-way ANOVA),多重比较采用Duncan氏法,结果用平均值±标准误来表示,P < 0.05表示差异显著。
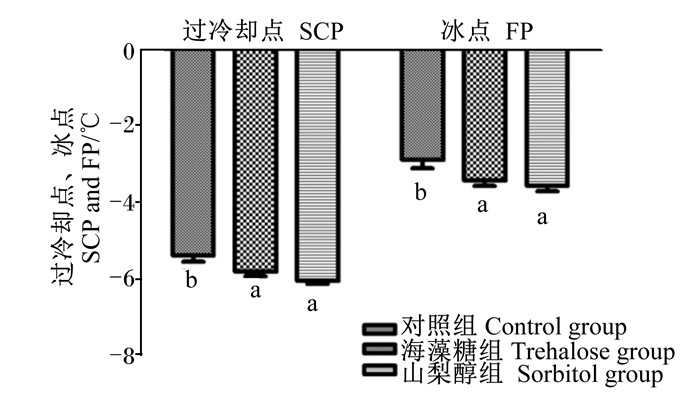
2 结果与分析 2.1 意蜂过冷却点及冰点由图 1可知,对照组、海藻糖组和山梨醇组意蜂的过冷却点分别为(-5.38±0.15) ℃、(-5.79±0.13) ℃、(-6.03±0.10) ℃。与对照组相比,山梨醇组和海藻糖组意蜂的过冷却点显著降低(P < 0.05)。对照组、海藻糖组和山梨醇组意蜂的冰点分别为(-2.88±0.21) ℃、(-3.41±0.15) ℃、(-3.55±0.15) ℃。与对照组相比,山梨醇组和海藻糖组意蜂的冰点显著降低(P < 0.05)。
|
数据柱标注不同字母表示差异显著(P < 0.05)。 Data column with different letters mean significant difference (P < 0.05). 图 1 不同处理对意蜂过冷却点、冰点的影响 Fig. 1 Effects of different treatments on SCP and FP of Apis mellifera ligustica |
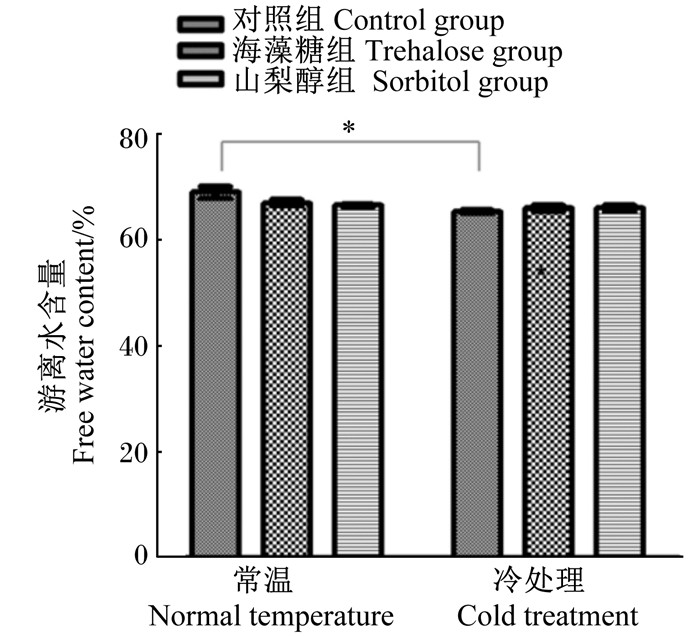
由图 2可知,常温条件下,对照组、海藻糖组、山梨醇组蜂体游离水含量分别为(76.33±0.88)%、(75.33±0.88)%、(74.00±1.15)%。冷处理条件下,对照组、海藻糖组、山梨醇组蜂体游离水含量分别为(72.67±0.88)%、(74.00±0.58)%、(73.00±0.58)%。结果显示,经冷处理后的对照组蜂体游离水含量显著降低(P < 0.05)。意蜂通过降低体内的游离水含量来提高其抗寒性,添加外源山梨醇和海藻糖后,意蜂冷处理以及常温条件下蜂体游离水含量无显著差异(P>0.05),这说明山梨醇和海藻糖并不是通过降低蜂体游离水含量来提高其抗寒性。
|
*表示常温条件下的对照组与冷处理条件下的对照组间差异显著(P < 0.05)。下图同。 * showed significant difference between the control group under normal temperature condition and the control group under cold treatment condition (P < 0.05). The same as below. 图 2 不同处理对意蜂蜂体游离水含量的影响 Fig. 2 Effects of different treatments on free water content of body of Apis mellifera ligustica |
由表 2可知,对照组蜂体脂肪含量在冷处理后显著增加(P < 0.05),常温与冷处理条件下,与对照组相比,山梨醇组和海藻糖组蜂体脂肪含量变化不显著(P>0.05)。对照组冷处理后蜂体糖原含量显著提升(P < 0.05),并且糖浆中添加外源山梨醇、海藻糖后无论是常温还是冷处理条件下,蜂体糖原含量都有显著提升(P < 0.05)。
|
|
表 2 不同处理对意蜂蜂体脂肪和糖原含量的影响 Table 2 Effects of different treatments on body fat and glycogen contents of Apis mellifera ligustica |
由表 3可知,对照组血淋巴中山梨醇、海藻糖、葡萄糖、果糖含量在经过低温处理后显著上升(P < 0.05)。常温条件下,山梨醇组血淋巴中山梨醇含量显著提高(P < 0.05),冷处理条件下,血淋巴中山梨醇含量变化不显著(P>0.05)。不管是常温和冷处理条件下,海藻糖组血淋巴中海藻糖含量无显著变化(P>0.05)。山梨醇组和海藻糖组在2种处理下血淋巴中葡萄糖含量显著增加(P < 0.05)。常温条件下,山梨醇组血淋巴中果糖含量显著增加(P < 0.05),海藻糖组血淋巴中果糖含量变化不显著(P>0.05),但是经冷处理后显著下降(P < 0.05)。
|
|
表 3 不同处理对意蜂血淋巴中小分子糖醇含量的影响 Table 3 Effects of different treatments on contents of small molecule sugar and alcohol in hemolymph of Apis mellifera ligustica |
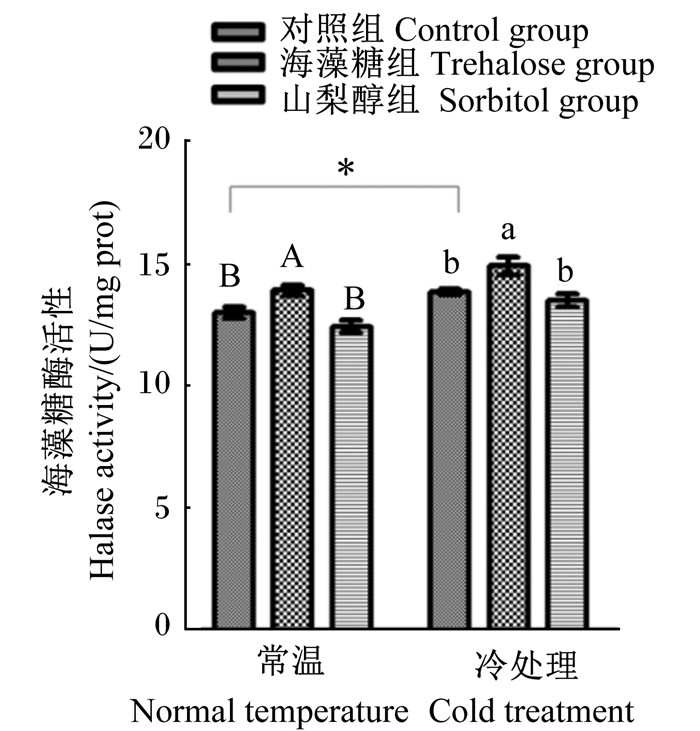
由图 3可知,与对照组相比,无论是否经过冷处理,糖浆中添加外源海藻糖后,蜂体THL的活性均显著提高(P < 0.05)。该结果表明糖浆中添加外源海藻糖后,蜂体THL活性提高,进而促进了蜂体内海藻糖的分解。常温和冷处理条件下,山梨醇组意蜂蜂体THL活性与其对照组相比差异均不显著(P>0.05)。
|
常温条件下,数据柱标注不同大写字母表示差异显著(P < 0.05);冷处理条件下,数据柱标注不同小写字母表示差异显著(P < 0.05)。下图同。 Under normal temperature condition, the data column with different capital letters indicated significant difference (P < 0.05); under cold treatment condition, the data column with different small letters indicated significant difference (P < 0.05). The same as below. 图 3 不同处理对意蜂蜂体THL活性的影响 Fig. 3 Effects of different treatments on activity of THL in body of Apis mellifera ligustica |
由图 4可知,常温条件下,山梨醇组蜂体SDH活性显著高于对照组(P < 0.05)。冷处理条件下,山梨醇组蜂体SDH活性显著高于对照组(P < 0.05)。结果表明,外源山梨醇的添加使蜂体SDH的活性提高,从而促进了山梨醇的分解。在常温和冷处理条件下,海藻糖组蜂体SDH活性与各自的对照组相比差异均不显著(P>0.05)。
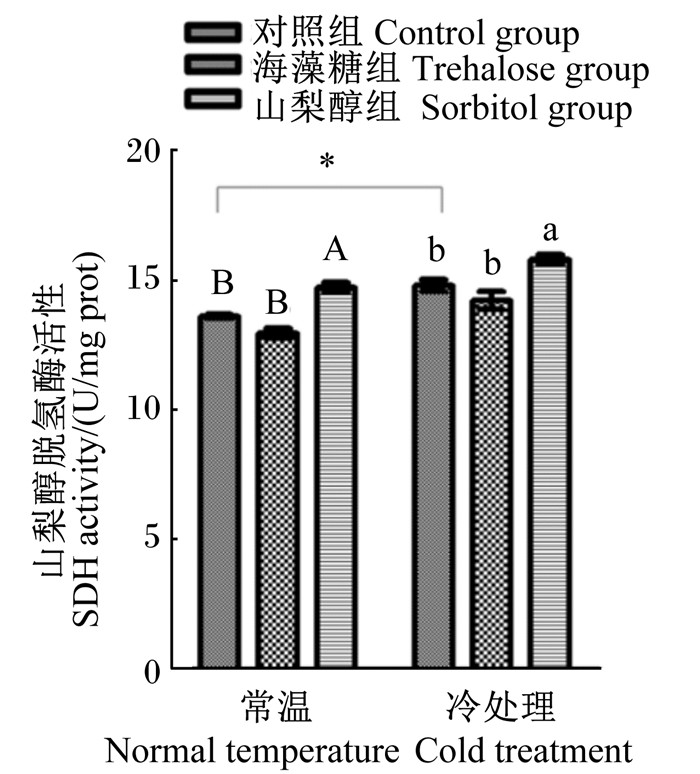
|
图 4 不同处理对意蜂蜂体SDH活性的影响 Fig. 4 Effects of different treatments on activity of SDH in body of Apis mellifera ligustica |
在常温和冷处理条件下山梨醇组意蜂SDH mRNA相对表达量均呈现上调趋势,并且显著高于各自对照组(P < 0.05)(图 5)。常温条件下,海藻糖组意蜂的TPS mRNA相对表达量显著下调(P < 0.05),海藻糖组经冷处理后TPS mRNA相对表达量有下调的趋势,但是与其对照组相比差异不显著(P>0.05)(图 6)。
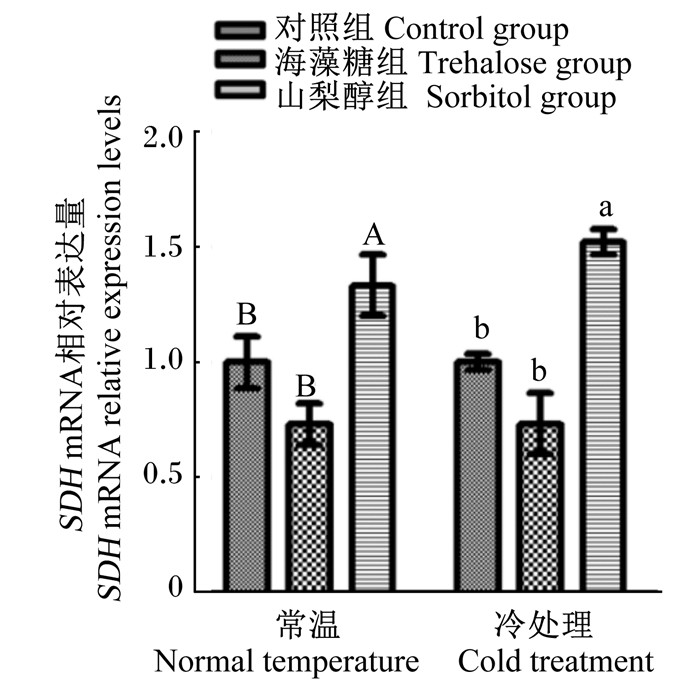
|
图 5 不同处理对意蜂SDH mRNA相对表达量的影响 Fig. 5 Effects of different treatments on relative expression levels of SDH mRNA of Apis mellifera ligustica |
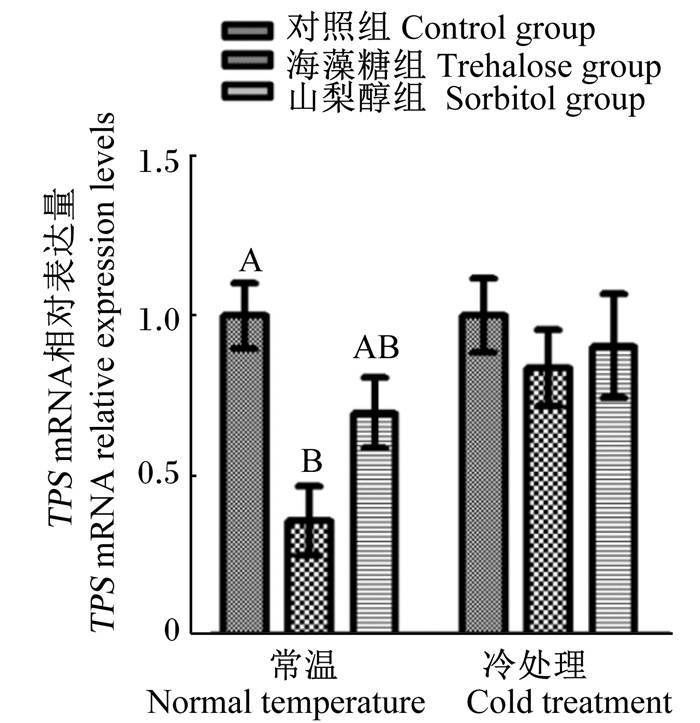
|
图 6 不同处理对意蜂TPS mRNA相对表达量的影响 Fig. 6 Effects of different treatments on relative expression levels of TPS mRNA of Apis mellifera ligustica |
蜜蜂可以通过降低自身过冷却点来增强自身的抗寒性。当蜜蜂蜂体温度低于过冷却点时,体液开始结成冰晶,蜜蜂开始释放热量。通过对热量的测定,可以灵敏探测出蜜蜂的过冷却点,过冷却点可以作为蜜蜂抗寒性的主要指标之一。本研究通过测定外源添加山梨醇、海藻糖后意蜂过冷却点的变化,结果显示意蜂过冷却点分别下降了0.65、0.41 ℃。试验结果表明,外源添加山梨醇、海藻糖显著降低了蜜蜂的过冷却点,进而提高了蜜蜂的抗寒性。本研究与罗立平等[19]研究外源添加海藻糖对花绒寄甲成虫存活和抗寒性的影响结果一致:不管是否经低温处理,取食含9%海藻糖的半人工饲料的花绒寄甲成虫与对照组成虫相比,其过冷却点显著降低。
昆虫在越冬过程中通过降低体内游离水含量,使虫体内溶质的浓度提高,进而降低昆虫过冷却点,以此来提高其抗寒性。本试验中,冷处理后意蜂的游离水含量显著降低,与上述研究结果一致。无论低温处理与否,试验组与对照组相比蜂体含水量无显著差异,这与罗立平等[19]对取食外源海藻糖的花绒寄甲的研究结果一致,推测可能是其体内积累了足够的海藻糖、山梨醇,无需通过排出水分增加溶质浓度的方式来降低其过冷却点。
脂肪在昆虫抗寒性中发挥重要作用,是生物体进行贮能和保温的基础物质[20-22]。昆虫体内总脂肪的含量与其过冷却点呈负相关,体内脂肪含量越高,其过冷却点越低[23-25]。本试验结果表明,冷处理后意蜂的蜂体脂肪含量显著提高,这与以上的研究结果一致,但是外源添加山梨醇、海藻糖后蜂体脂肪含量无显著变化,这可能是因为添加山梨醇、海藻糖后所积累的能量已经足够抵御当时低温环境,不需要通过提高蜂体脂肪含量为蜜蜂提供能量。这与先前报道的鳞翅目等飞行昆虫抗寒机制相符。例如飞蝗体内血淋巴中海藻糖的含量下降到一定程度时,就会激活负责释放储存脂肪进入血淋巴的促脂激素,以便释放为飞行提供能量的脂类[26]。
TPS的作用是催化尿苷二磷酸-葡萄糖(UDP-G)生成海藻糖。在本试验中,常温条件下,海藻糖组意蜂TPS mRNA相对表达量显著下调,这可能是因为外源添加海藻糖的增加使其体内海藻糖的合成通路受到抑制。冷处理条件下,外源添加海藻糖后TPS mRNA相对表达量下调但不显著,可能因为意蜂在冷应激后需要大量积累海藻糖来提高其抗寒性,从而使TPS mRNA相对表达量下调不明显。相关研究表明,在海藻糖的分解途径中,滞育激素通过一系列反应导致卵巢THL活性提高,使血液中的海藻糖分解成葡萄糖,葡萄糖进入卵母细胞进一步合成糖原诱导卵滞育,因此THL是滞育激素调控代谢过程中的关键酶,并且滞育激素是通过促进THL的mRNA的转录,从而提高酶活性,最终改变代谢途径诱导卵滞育[27]。以上研究结果和本试验中海藻糖的代谢反应结果一致,外源添加海藻糖使蜂体THL的活性显著提高,从而将蜂体内的海藻糖分解成葡萄糖,引起葡萄糖含量的显著增加。糖原是由多个葡萄糖组成的一种生物大分子,分子质量约为107 ku,是动物体内储存葡萄糖的一种形式。血液中的葡萄糖含量通过糖原分解来维持,为机体新陈代谢提供能量[28]。本试验结果显示,外源添加海藻糖后蜂体糖原含量在常温以及冷处理条件下都有显著的上升。Crowe等[29]研究结果显示,海藻糖能在THL的水解作用下转化成葡萄糖,而葡萄糖在昆虫体内糖类代谢过程中可与糖原互相转化,参与能量代谢。综上所述,我们推测意蜂可能通过以下通路来提高机体抗寒性:UDP-G在TPS的作用下转化成海藻糖,海藻糖在THL的作用下转化为葡萄糖,机体内过多的葡萄糖以能量代谢途径转化为糖原,作为能量储存在蜜蜂体内,在环境胁迫下维持其机体正常的生命活动。
昆虫在滞育期积累低分子质量的多元醇和糖。山梨醇是滞育昆虫最常见积累的多元醇之一,SDH是调节山梨醇代谢的关键酶,它催化山梨醇脱氢转化为糖原。SDH在滞育期间表达水平存在明显变化,在山梨醇利用和滞育解除中发挥着重要作用。Niimi等[30]查明了伴随滞育卵的解除过程,SDH活性逐步提高,SDH是滞育解除过程中的一个关键酶。对SDH转录研究表明,滞育卵用5 ℃冷藏解除滞育后SDH mRNA相对表达量达到峰值,显示出解除滞育的卵内出现由山梨醇向糖原转化[31]。本试验结果表明,无论是常温还是冷处理条件下,外源添加山梨醇均使意蜂蜂体糖原含量显著提高、SDH的活性显著提高、SDH mRNA相对表达量显著上升,这与上述研究结果一致。在冷应激期间变化明显的糖类物质还有互为同分异构体的小分子糖——葡萄糖、果糖,它们均为活细胞的能量来源,研究表明,阿松扁叶蜂体内葡萄糖、果糖含量在滞育初期较高,并且随着越冬期环境温度的变化葡萄糖含量持续上升,而果糖含量则呈现先升高后降低的趋势变化[32]。在本试验中,通过对蜂体血淋巴中葡萄糖含量的检测结果得出,低温处理后意蜂血淋巴中的葡萄糖含量相比于常温饲养显著升高。另外,山梨醇组的意蜂血淋巴中的葡萄糖和果糖含量同样显著升高。杜晓云[12]研究得出,柞蚕蛹在长时间的滞育过程中,脂肪体中的糖原逐渐在糖原磷酸化酶的作用下转化为山梨醇和甘油,山梨醇在SDH的作用下转化为果糖,果糖进一步转化为糖原。此时幼虫及蛹中有足够的能量,使得昆虫可以打破滞育,重新发育。综合以上试验结果推测,蜜蜂体内的山梨醇通过以下代谢通路来提高抗寒性:山梨醇在SDH的作用下转化成果糖,果糖再通过能量代谢转化成葡萄糖,部分葡萄糖合成糖原作为储能物质储存在体内,或直接用于供能。这也充分说明意蜂体内山梨醇、海藻糖等小分子物质的积累和分解存在一定的平衡机制,在其面对外界低温胁迫时共同发挥作用。
4 结论外源添加山梨醇和海藻糖组意蜂过冷却点和冰点显著低于对照组,二者通过增加意蜂血淋巴中小分子糖醇含量进而提高机体抗寒性。TPS、LDH的表达特征证实了山梨醇和海藻糖在意蜂遭受低温胁迫过程中具有重要作用。
| [1] |
ELBEIN A D, MITCHELL M. Levels of glycogen and trehalose in Mycobacterium smegmatis and the purification and properties of the glycogen synthetase[J]. Journal of Bacteriology, 1973, 113(2): 863-873. DOI:10.1128/JB.113.2.863-873.1973 |
| [2] |
WYATT G R, COOK K E, FIRKO H, et al. Juvenile hormone action on locust fat body[J]. Insect Biochemistry, 1987, 17(7): 1071-1073. DOI:10.1016/0020-1790(87)90122-3 |
| [3] |
THOMPSON S N. Trehalose-the insect 'blood' sugar[J]. Advances in Insect Physiology, 2003, 31: 205-285. |
| [4] |
聂凌鸿, 宁正祥. 海藻糖的生物保护作用[J]. 生命的化学, 2001, 21(3): 206-209. NIE L H, NING Z X. Biological protection of trehalose[J]. Chemistry of Life, 2001, 21(3): 206-209 (in Chinese). |
| [5] |
刘晓健, 崔淼, 李大琪, 等. 飞蝗几丁质合成酶2基因的表达特性、功能及调控[J]. 中国农业科学, 2014, 47(7): 1330-1340. LIU X J, CUI M, LI D Q, et al. Expression characteristics, function and regulation of chitinase 2 gene in migratory locust[J]. Chinese Agricultural Science, 2014, 47(7): 1330-1340 (in Chinese). |
| [6] |
褚亚平. 氟铃脲对斜纹夜蛾海藻糖酶活性及基因表达的影响[D]. 硕士学位论文. 泰安: 山东农业大学, 2013. ZHU Y P.Effects of fluoroflurea on trehalase activity and gene expression in C.terrai[D].Master's Thesis.Tai'an: Shandong Agricultural University, 2013.(in Chinese) |
| [7] |
李正杨. 高温对抗性和敏感小菜蛾海藻糖及其酶活性的影响[D]. 硕士学位论文. 福州: 福建农林大学, 2013. LI Z Y.Effects of high temperature on the activity of trehalose and its enzyme in resistant and sensitive Plutella xylosa[D].Master's Thesis.Fuzhou: Fujian Agriculture and Forestry University, 2013.(in Chinese) |
| [8] |
明照岳. 高温胁迫对二点委夜蛾海藻糖代谢的影响与其卵黄蛋白特性的研究[D]. 硕士学位论文. 泰安: 山东农业大学, 2014. MING Z Y.Effects of high temperature stress on trehalose metabolism and its yolk protein characteristics in C.japonicus[D].Master's Thesis.Tai'an: Shandong Agricultural University, 2014.(in Chinese) |
| [9] |
CHILDERS C C, ACHOR D S.Thrips feeding and oviposition injuries to economic plants, subsequent damage and host responses to infestation[M]//PARKER B L, SKINNER M, LEWIS T.Thrips biology and management.Boston: Springer, 1995: 31-51.
|
| [10] |
陈田飞, 乐波灵. 家蚕滞育机理研究概况[J]. 广西蚕业, 2004, 41(3): 12-16. CHEN T F, LE B L. Study on diapause mechanism of silkworm[J]. Guangxi Sericulture, 2004, 41(3): 12-16 (in Chinese). |
| [11] |
王洪亮, 仵均祥, 王丙丽. 麦红吸浆虫滞育期间海藻糖酶和山梨醇脱氢酶活性的变化[J]. 西北农林科技大学学报(自然科学版), 2006, 34(8): 139-142. WANG H L, WU J X, WANG B L. Changes of trehalase and sorbitol dehydrogenase activities during diapause in wheat red plasmids[J]. Journal of Northwest A&F University (Natural Science), 2006, 34(8): 139-142 (in Chinese). |
| [12] |
杜晓云. 山梨醇脱氢酶抑制剂的筛选、合成与活性研究[D]. 硕士学位论文. 大连: 大连理工大学, 2018. DU X Y.Screening, synthesis and activity of sorbitol dehydrogenase inhibitors[D].Master's Thesis.Dalian: Dalian University of Technology, 2018.(in Chinese) |
| [13] |
李志勇, 薛运波, 王志, 等. 东西方蜜蜂越冬期过冷却点的测试及过冷却点与越冬性能的关系[J]. 蜜蜂杂志, 2006, 26(11): 12-13. LI Z Y, XUE Y B, WANG Z, et al. The test of overcooling point and the relationship between overcooling point and overwintering performance of eastern and Western honeybees[J]. Journal of Honeybees, 2006, 26(11): 12-13 (in Chinese). |
| [14] |
DANKS H V. Life history and biology of Einfeldia synchrona (Diptera: Chironomidae)[J]. The Canadian Entomologist, 1971, 103(11): 1597-1606. DOI:10.4039/Ent1031597-11 |
| [15] |
常志光, 李志勇, 高寿增, 等. 卡尼鄂拉蜂越冬期体内水分、蛋白质、脂肪的变化与抗寒性的关系研究[J]. 蜜蜂杂志, 2008, 28(1): 6-7. CHANG Z G, LI Z Y, GAO S Z, et al. Study on the relationship between the changes of water, protein and fat and cold resistance of the Kaneorrah bee during its overwintering period[J]. Journal of Bee, 2008, 28(1): 6-7 (in Chinese). |
| [16] |
李浩. 沙葱萤叶甲耐寒性及其机理的研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2014. LI H.Study on cold tolerance and mechanism of Firefly armour[D].Master's Thesis.Hohhot: Inner Mongolia Agricultural University, 2014.(in Chinese) |
| [17] |
韩召军, 王荫长, 尤子平. 陆生昆虫的抗寒性机制[J]. 昆虫知识, 1989(1): 39-42. HAN Z J, WANG Y C, YOU Z P. Mechanism of cold resistance of terrestrial insects[J]. Insect Knowledge, 1989(1): 39-42 (in Chinese). |
| [18] |
秦玉川, 杨建才. 一种便携式测定昆虫过冷却点的方法[J]. 应用昆虫学报, 2000, 37(4): 236-238. QIN Y C, YANG J C. A new simple method to test insect super-cooling point[J]. Chinese Bulletin of Entomology, 2000, 37(4): 236-238 (in Chinese). |
| [19] |
罗立平, 王小艺, 唐艳龙, 等. 外源海藻糖对花绒寄甲成虫存活和耐寒性的影响[J]. 昆虫学报, 2019, 62(5): 586-593. LUO L P, WANG X Y, TANG Y L, et al. Effects of exogenous trehalose on survival and cold tolerance of adult Phyllostachys grandiflori[J]. Acta Entomologica Sinica, 2019, 62(5): 586-593 (in Chinese). |
| [20] |
BEMANI M, IZADI H, MAHDIAN K, et al. Study on the physiology of diapause, cold hardiness and supercooling point of overwintering pupae of the pistachio fruit hull borer, Arimania comaroffi[J]. Journal of Insect Physiology, 2012, 58(7): 897-902. DOI:10.1016/j.jinsphys.2012.04.003 |
| [21] |
BEHROOZI E, IZADI H, SAMIH M A, et al. Physiological strategy in overwintering larvae of pistachio white leaf borer, Ocneria terebinthina Strg.(Lepidoptera: Lymantriidae) in Rafsanjan, Iran[J]. Italian Journal of Zoology, 2012, 79(1): 44-49. DOI:10.1080/11250003.2011.592152 |
| [22] |
LEHMANN P, LYYTINEN A, SINISALO T, et al. Population dependent effects of photoperiod on diapause related physiological traits in an invasive beetle (Leptinotarsa decemlineata)[J]. Journal of Insect Physiology, 2012, 58(8): 1146-1158. DOI:10.1016/j.jinsphys.2012.06.003 |
| [23] |
马延龙, 候凤, 马纪. 荒漠昆虫光滑鳖甲的耐寒性季节变化及其生理机制[J]. 昆虫学报, 2009, 52(4): 372-379. MA Y L, HOU F, MA J. Seasonal variation of cold tolerance and its physiological mechanism in smooth turtle armour of desert insect[J]. Acta Entomologica Sinica, 2009, 52(4): 372-379 (in Chinese). |
| [24] |
郭海波, 许永玉, 鞠珍, 等. 中华通草蛉成虫抗寒能力季节性变化[J]. 生态学报, 2006, 26(10): 3238-3244. GUO H B, XU Y Y, JU Z, et al. Seasonal variation of cold resistance of adult Lacewing beetle[J]. Acta Ecologica Sinica, 2006, 26(10): 3238-3244 (in Chinese). |
| [25] |
蒋智林, 文礼章, 李有志, 等. 甘薯天蛾过冷却点变化与生化成分的关系[J]. 昆虫知识, 2009, 46(2): 294-297. JIANG Z L, WEN L Z, LI Y Z, et al. Relationship between the changes of supercooling point and biochemical components of the sweet potato moth[J]. Insect Knowledge, 2009, 46(2): 294-297 (in Chinese). |
| [26] |
李冰祥, 陈永林, 蔡惠罗. 飞蝗不同地理种群抗寒性研究(英文)[J]. 生态学报, 1999, 21(12): 2023-2030. LI B X, CHEN Y L, CAI H L. Study on cold resistance of migratory locust populations in different geographical populations (English)[J]. Acta Ecologica Sinica, 1999, 21(12): 2023-2030 (in Chinese). |
| [27] |
SU Z H, SATO Y, YAMASHITA O. Purification, cDNA cloning and Northern blot analysis of trehalase of pupal midgut of the silkworm, Bombyx mori[J]. Biochimica et Biophysica Acta: Gene Structure and Expression, 1993, 1173(2): 217-224. DOI:10.1016/0167-4781(93)90184-F |
| [28] |
张江伟. PHKA2基因突变致11例糖原累积症Ⅸa型的临床表型与遗传学特征分析及两种单基因病的报道[D]. 硕士学位论文. 北京: 北京协和医学院, 2014. ZHANG J W.Clinical phenotypic and genetic characteristics analysis of 11 cases of glycogen accumulation syndrome TYPE ⅨA caused by PHKA2 mutation and two monogenic diseases reported[D].Master's Thesis.Beijing: Peking Union Medical College, 2014.(in Chinese) |
| [29] |
CROWE J H, CROWE L M, CHAPMAN D. Preservation of membranes in anhydrobiotic organisms: the role of trehalose[J]. Science, 1984, 223(4637): 701-703. DOI:10.1126/science.223.4637.701 |
| [30] |
NⅡMI T, YAGINUMA T. Biosynthesis of NAD-sorbitol dehydrogenase is induced by acclimation at 5℃ in diapause eggs of the silkworm, Bombyx mori[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1992, 102(1): 169-173. DOI:10.1016/0305-0491(92)90291-X |
| [31] |
NⅡMI T, YAMASHITA O. A cold-inducible Bombyx gene encoding a protein similar to mammalian sorbitol dehydrogenase[J]. European Journal of Biochemistry, 1993, 213(3): 1125-1131. DOI:10.1111/j.1432-1033.1993.tb17862.x |
| [32] |
梁中贵, 张卫光, 刘学辉, 等. 松阿扁叶蜂越冬幼虫体内抗寒物质分析[J]. 昆虫知识, 2005, 42(6): 695-699. LIANG Z G, ZHANG W G, LIU X H, et al. Analysis of cold resistant substances in the overwintering larvae of Parasitophus sonata[J]. Insect Knowledge, 2005, 42(6): 695-699 (in Chinese). |




